«Вся правда о прививках» или чего на самом деле стоит бояться родителям, отказывающимся от вакцинации? (+видео!)
— Начиная читать «Откровения о прививках от педиатра-невролога, которая работала врачом педиатром в детском саду и прививала детей», я ожидал увидеть трагические истории с детьми, которых прививал сам автор – доктор Емельянова, и у которых развились тяжелые последствия. Ничего похожего я не прочел – ни одного конкретного случая автор не приводит, разве что случай ребенка, умершего через 3 дня после прививки. Как врач, она должна была бы рассказать, к какому заключению о причинах смерти в конце концов пришла комиссия. Ведь все случаи побочных явлений после прививок тщательно рассматриваются комиссионно, так что ни один из них не остается не расследованным – особенно в наше время, когда противники вакцинации ищут любого повода очернить прививки.
Так вот, внезапная смерть младенцев – это устоявшийся диагноз. В возрасте 2-4 месяцев жизни внезапно умирают дети, как получившие, так, чаще не получившие прививку. Педиатр, тем более со стажем, должен знать, что внезапная смерть младенцев – это вторая по частоте причина постнеонатальной младенческой смертности. А также и то, что из известных причин на первом месте стоят курение родителей, сон младенца на животе, сон в одной постели с матерью. Вот об этом стоит предупредить родителей.
Педиатр, тем более со стажем, должен знать, что внезапная смерть младенцев – это вторая по частоте причина постнеонатальной младенческой смертности. А также и то, что из известных причин на первом месте стоят курение родителей, сон младенца на животе, сон в одной постели с матерью. Вот об этом стоит предупредить родителей.
— Помимо голословности заявлений, отсутствия фактов, какие особенности материала Вы бы еще отметили?
Это некомпетентность. Автор не пишет, где и сколько она училась на невропатолога, после того как прекратила работать в детском саду. Не думаю, что подготовка была серьезной. Она, например, указывает: «Известно, что скрытая или явная патология нервной системы после вакцинации может манифестировать в виде судорожной готовности. То есть, вакцинация может провоцировать эпилепсию (описанное осложнение на вакцинацию)».
Я напомню, что эпилептический припадок у больного эпилепсией гораздо чаще вызывает мелькание экрана телевизора, чем болевые ощущения, связанные с прививкой. Может запретить телевизор? Да, у небольшой части детей повышение температуры после введения вакцины может вызвать фебрильные судороги. Но ведь и они у 99 детей из 100 бывают при развитии инфекции. К тому же, врач-невропатолог должен не распалять родителей по этому поводу, а объяснить, что фебрильные судороги доброкачественные и ничем ребенку не грозят.
Также автор указывает: «Однажды на консультации был особенно тяжелый ребенок, угрожаемый по ДЦП (на самом деле-то уже с ДЦП, но такой диагноз ему поставят после года), я запретила делать ему вакцинацию, потому что на ее фоне ДЦП резко прогрессирует».
Это ее утверждение выглядит совсем дико — ДЦП – врожденное заболевание, ребенок рождается с теми или иными повреждениями, которые могут позже проявиться двигательными или иными расстройствами по мере роста ребенка (например, неспособность сидеть до 6-8 месяцев выявить нельзя, как и неспособность ходить до возраста 1 года), но никак не прогрессировать.
Противники вакцинации чаще всего связывают с прививкой поражения нервной системы. Я хотел бы предложить автору покопаться в книгах по неврологии и найти там – среди причин нервных болезней – прививки, и рассказать родителям, какие это болезни. Да, еще 10 лет назад у детей с врожденным иммунодефицитом живая полиомиелитная вакцина вызывала параличи (5-8 детей в год на всю Россию) – но сейчас прививают инактивированной вакциной, так что эти осложнения исчезли.
Что касается причитаний о том, что прививка «является серьезной иммунобиологической операцией», это говорилось задолго до г. Онищенко; думаю, доктор Емельянова согласится со мной, что, например, употребление в пищу многих продуктов, вызывающих аллергию, — гораздо более частая, чем прививки и более «серьезная иммунобиологическая операция», поскольку вызывает подчас тяжелые поражения, вплоть до анафилактического шока, с летальным исходом. Вот бы ей разъяснить родителям, какие виды пищи лучше не давать маленькому ребенку.
— А как Вы могли бы прокомментировать такое утверждение: «все современные вакцинирующие препараты получают методами биотехнологии с использованием сывороток и клеток животных. У животных, как становится известно нам чем дальше, тем больше, есть чрезвычайно опасные для человека инфекции типа прионных и ретровирусных. Очистить вакцину от примесей, потенциально содержащих эти инфекции, принципиально невозможно?
Действительно, есть опасения передачи ретровирусов и прионов через вакцины – это, конечно проблема, но с ней пока что успешно справляются изготовители вакцин. Фактов подобных заболеваний не могут привести даже ярые противники вакцинации.
— Действительно ли вакцины могут спровоцировать серьезные аутоиммунные заболевания?
Причина их вообще не совсем ясна, так что их легко нарочно привязать к теме прививок. Но и это не получается – в ряде стран подсчитана частота этих болезней до проведения прививок (например, против папилломавирусной инфекции) и после – цифры сходятся, указывая на непричастность вакцин к их развитию.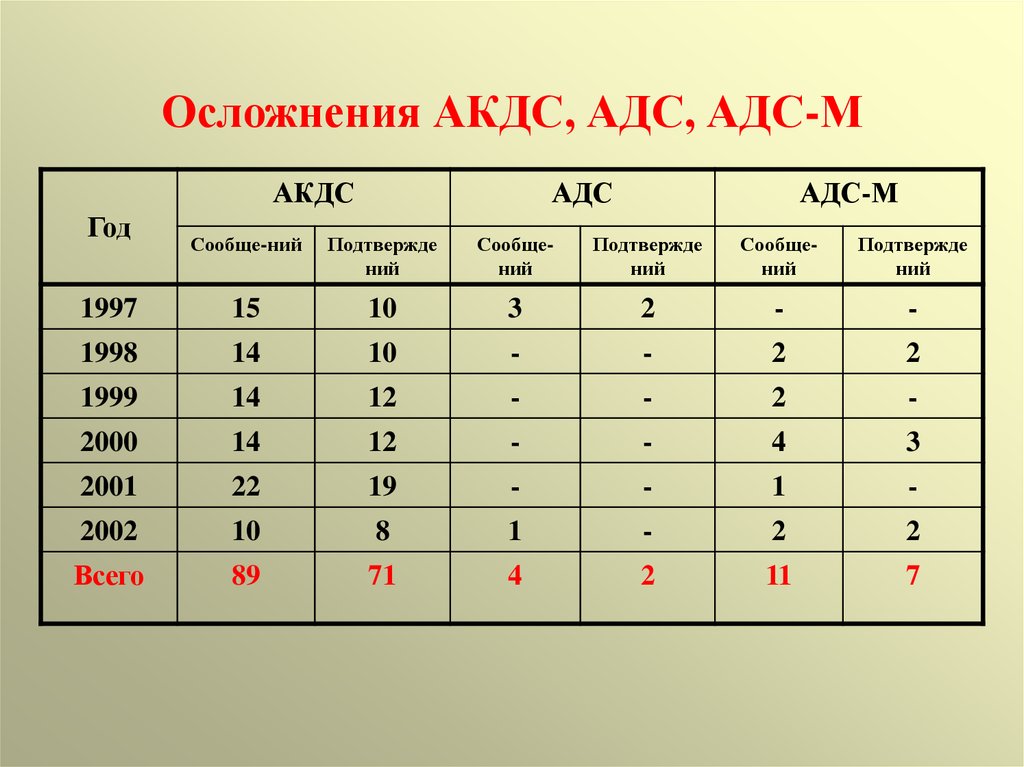 Вообще, противники вакцинации любят ссылаться на отдельные случаи, обычно недостаточно обследованные, и не приводят цифры. А они интересны.
Вообще, противники вакцинации любят ссылаться на отдельные случаи, обычно недостаточно обследованные, и не приводят цифры. А они интересны.
Так, в 80-е годы пошел вниз охват прививками АКДС – и с 90-х годов в странах бывшего СССР разразилась эпидемия дифтерии – 120 000 случаев при 6000 умерших. Плюс к этому рост коклюша и кори. Тогда Минздрав спросил инфекционистов – что делать? Единственный выход – массовые прививки – и привиты были все 150 000 000 россиян, некоторые повторно. И, знаете, каких-то особых неприятностей это не принесло. И после 1995 г. массовые прививки детей от полиомиелита погасили вспышку, привили всех, так что при заносе этой инфекции в 2010 г. из Таджикистана в России заболели полиомиелитом всего 8 детей – и все не привитые (6 из них с фиктивными справками о прививках).
А кто болеет корью в наше время? Дети, чьи родители слушают «всю правду о прививках». И с коклюшем мы пока справиться как следует не можем из-за большого числа отказавшихся от прививок. Зайдите в нашу клинику, поговорите с родителями не привитого ребенка с коклюшем – а это 15-20 приступов кашля в день со рвотой, и так в течение 3-4 недель. Из-за низкого охвата заражаются дети первых месяцев, еще не привитые – они болеют очень тяжело, и нередко дело кончается летальным исходом.
Зайдите в нашу клинику, поговорите с родителями не привитого ребенка с коклюшем – а это 15-20 приступов кашля в день со рвотой, и так в течение 3-4 недель. Из-за низкого охвата заражаются дети первых месяцев, еще не привитые – они болеют очень тяжело, и нередко дело кончается летальным исходом.
Мой совет докторам, устроившим антипрививочную пропаганду, повернитесь лицом к действительным проблемам и не дурите голову 20 миллионам родителей в России, прививающих детей от всех инфекций. Ведь предсказывали люди вашего круга в конце 18 века, что прививки Дженнера против оспы приведут к появлению рогов и вымени у привитых. Сейчас эти страсти Вы заменили на аутоиммунные болезни, диабет, рак. Уже много поколений человечества выросло с прививками (уверен, и авторы статей против прививок), прививки не только не мешали, но и способствовали, как никакие другие меры медицинского характера, улучшению показателей физического развития человека, его способностей, снижению смертности и увеличению продолжительности жизни – и в дальнейшем они будут способствовать укреплению здоровья, нравится это противникам прививок или нет.
Я, например, сделал всем своим детям, внукам и правнукам все необходимые прививки, и сам ежегодно прививаюсь от гриппа.
Подготовлено по материалам портала:
Использованы иллюстрации комикса Maki Naro.
Переводчик: irvitzer.
Вакцинация у детей, фебрильные судороги и эпилепсия
Вакцинация детей, несомненно, является эффективным методом предотвращения многих заболеваний. Но как только болезни, профилактируемые вакцинацией, стали редкими сразу возник вопрос о ее побочных эффектах. Наряду с острыми аллергическими реакциями родителей волнует возможность неврологических осложнений, например фебрильных судорог (ФС) и эпилепсии [1]. Не только многие родители, но и врачи боятся усугубления неврологических проблем в результате вакцинации, а развитие эпилепсии, совпадающее с ней по времени, только увеличивает эти опасения. В результате родители либо откладывают сроки вакцинации своих детей, либо вообще от нее отказываются, что приводит к вспышкам таких серьезных заболеваний, как корь.
Конечно, невролог не должен решать вопросы: проводить или не проводить вакцинацию, чем конкретно вакцинировать ребенка. Согласно Приказу Минздрава России № 125н от 21.03.14 (ред. от 13.04.17) «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям», «вакцинацию осуществляют медицинские работники, прошедшие обучение по вопросам применения иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней, организации проведения вакцинации, техники проведения вакцинации, а также по вопросам оказания медицинской помощи в экстренной или неотложной форме»1.
Однако никто из неврологов не проходил подобного обучения, и решение проблемы вакцинации целиком ложится на плечи педиатра. Задача невролога — точно сформулировать неврологический диагноз. Но в сложившейся клинической практике педиатры очень часто просят заключение невролога по поводу возможности вакцинации.
В настоящей работе источники литературы, посвященной этой проблеме, сгруппированы по трем тематическим направлениям: вакцино-индуцированные судороги, вакцинация ребенка с ФС, вакцинация ребенка с эпилепсией.
Вакцино-индуцированные судороги. В инструкциях ко многим вакцинам описан такой побочный эффект, как судороги: например, к вакцинам против кори, паротита и краснухи (КПК), гепатита А, полиомиелита, менингококковой инфекции, гриппа типа В, адсорбированной коклюшно-дифтерийно-столбнячной вакцине (АКДС), вакцине против тифа и болезни Лайма [2]. Как правило, судороги ассоциированы с повышением температуры, т. е. являются фебрильными.
Вакцино-индуцированные ФС, как правило, развиваются в течение 72 ч после вакцинации. Причем некоторые вакцины более, чем другие, ассоциированы с ФС: АКДС (особенно неинактивированная) и КПК (особенно в совокупности с вакциной против ветряной оспы) [3]. Вакцина против ветряной оспы производится только за рубежом, но довольно часто применяется и в Российской Федерации. В вакцине АКДС наиболее реактогенным считается коклюшный компонент [4]. После введении комбинированной вакцины КПК ФС развиваются не в течение 3 сут, а между 7-ми и 14-ми сутками [3]. Реже упоминается, что вакцины против гриппа и пневмококка также могут сопровождаться повышенным риском ФС [4, 5].
Вакцина против ветряной оспы производится только за рубежом, но довольно часто применяется и в Российской Федерации. В вакцине АКДС наиболее реактогенным считается коклюшный компонент [4]. После введении комбинированной вакцины КПК ФС развиваются не в течение 3 сут, а между 7-ми и 14-ми сутками [3]. Реже упоминается, что вакцины против гриппа и пневмококка также могут сопровождаться повышенным риском ФС [4, 5].
Точные эпидемиологические данные по частоте развития ФС после вакцинаций не известны. Эксперты ВОЗ приводят величину 0,08 на 1000 прививок АКДС2, что в 70 раз ниже частоты ФС, вызванных осложнениями инфекций, против которых направлена вакцина, и в 500 раз меньше частоты обычных ФС. S. David и соавт. [6] провели анкетирование родителей 15 069 детей первого года жизни, получавших неинактивированную вакцину АКДС, и 13 069 детей, получавших инактивированную вакцину АКДС. При этом ФС отмечались редко и только после 4-й иммунизации (0,06% при неинактивированной вакцине и 0,02% при инактивированной). Частота развития ФС была одинаковой у детей с ФС в анамнезе и без них [3]. Оценка частоты и риска развития ФС при вакцинации против гриппа затруднена наличием большого количества типов и партий противогриппозных вакцин, по всей видимости, обладающих различной реактогенностью [4].
Частота развития ФС была одинаковой у детей с ФС в анамнезе и без них [3]. Оценка частоты и риска развития ФС при вакцинации против гриппа затруднена наличием большого количества типов и партий противогриппозных вакцин, по всей видимости, обладающих различной реактогенностью [4].
Следует помнить, что при развитии осложнений наличие временно́й связи не обязательно свидетельствует о связи причинно-следственной, что, в частности, подтверждается результатами двойного слепого исследования [7], в котором частота ФС при введении комбинированной вакцины КПК сравнивалась с плацебо. По данным исследования, у 6% детей лихорадка развилась при применении плацебо, а у 88% детей с лихорадкой из группы вакцинированных она не была связана с вакцинацией. Таким образом, возможно, риск возникновения вакцино-индуцированных ФС сильно преувеличен.
Точные механизмы развития ФС при вакцинации пока не известны [4]. Однако установлено, что ФС любой этиологии в значительной мере обусловлены генетическими факторами. Так, результаты исследования B. Feenstra и соавт. [8] показали, что у детей с вакцино-индуцированными ФС есть генетическая склонность к иммунологическим нарушениям и к лихорадке, а не к судорогам. У 929 пациентов с ФС после вакцинации были описаны частые хромосомные варианты в генах IFI44L (ген, индуцированный интерфероном) и в генах рецепторов к вирусу кори CD46. В то же время в группах 1070 детей с ФС, не связанных с вакцинацией, были обнаружены другие частые хромосомные варианты с локусами, ассоциированными с судорогами (SCN1A, SCN2A, TMEM16), и локусом, который ассоциирован с уровнем магния.
Так, результаты исследования B. Feenstra и соавт. [8] показали, что у детей с вакцино-индуцированными ФС есть генетическая склонность к иммунологическим нарушениям и к лихорадке, а не к судорогам. У 929 пациентов с ФС после вакцинации были описаны частые хромосомные варианты в генах IFI44L (ген, индуцированный интерфероном) и в генах рецепторов к вирусу кори CD46. В то же время в группах 1070 детей с ФС, не связанных с вакцинацией, были обнаружены другие частые хромосомные варианты с локусами, ассоциированными с судорогами (SCN1A, SCN2A, TMEM16), и локусом, который ассоциирован с уровнем магния.
Интересно также исследование S. Auvin и соавт. [9], продемонстрировавшее четкий провоспалительный профиль моноцитов с увеличением IL-1β, IL-6, TNF-α у пациентов с синдромом Драве после вакцинации по сравнению с контрольной группой.
Считается, что одновременное введение нескольких вакцин может увеличивать риск развития ФС. В международной практике вакцину КПК иногда совмещают с вакцинированием против ветряной оспы. Такое совмещение в 2 раза повышает частоту вакцино-индуцированных ФС [4]. Ранний детский возраст (до 2 лет) ранее относили к фактору риска развития Ф.С. Но попытка отложить вакцинацию до более старшего возраста с целью уменьшения риска не увенчалась успехом. Более того, результаты исследования M. Daley и соавт. [10] выявили, что если отложить срок вакцинации против кори, паротита и краснухи до возраста ребенка старше 15 мес, то это увеличит риск развития Ф.С. Таким образом, откладывание срока вакцинации до более старшего возраста ребенка не снижает риск развития ФС, т. е. нецелесообразно [10, 11].
В международной практике вакцину КПК иногда совмещают с вакцинированием против ветряной оспы. Такое совмещение в 2 раза повышает частоту вакцино-индуцированных ФС [4]. Ранний детский возраст (до 2 лет) ранее относили к фактору риска развития Ф.С. Но попытка отложить вакцинацию до более старшего возраста с целью уменьшения риска не увенчалась успехом. Более того, результаты исследования M. Daley и соавт. [10] выявили, что если отложить срок вакцинации против кори, паротита и краснухи до возраста ребенка старше 15 мес, то это увеличит риск развития Ф.С. Таким образом, откладывание срока вакцинации до более старшего возраста ребенка не снижает риск развития ФС, т. е. нецелесообразно [10, 11].
Вакцинация и эпилепсия. Считается, что вакцинация увеличивает риск ФС, но не увеличивает риск развития афебрильных эпилептических приступов [3, 4, 11]. Так, M. Griffin и соавт. [12] провели анализ 38 171 вакцинации АКДС и статистически достоверно показали увеличение числа ФС, но не нашли связи с афебрильными приступами. По данным S. Shorvon и A. Berg [13], риск развития афебрильного приступа после вакцинации составляет 1 на 76 133. Результаты исследования S. Håberg и соавт. [14] выявили, что противогриппозная вакцина не увеличивает риск развития эпилепсии: были обследованы более 500 тыс. детей, у которых вакцинация не привела к увеличению числа новых случаев эпилепсии. По данным ВОЗ, вероятность развития афебрильных эпилептических приступов, осложняющих прививку АКДС, составляет 0,06 на 1000 детей, что в 333 раз меньше, чем вероятность развития афебрильных приступов в результате осложнениях этих инфекций. Таким образом, причинная связь вакцинации с развитием эпилепсии не доказана [4].
По данным S. Shorvon и A. Berg [13], риск развития афебрильного приступа после вакцинации составляет 1 на 76 133. Результаты исследования S. Håberg и соавт. [14] выявили, что противогриппозная вакцина не увеличивает риск развития эпилепсии: были обследованы более 500 тыс. детей, у которых вакцинация не привела к увеличению числа новых случаев эпилепсии. По данным ВОЗ, вероятность развития афебрильных эпилептических приступов, осложняющих прививку АКДС, составляет 0,06 на 1000 детей, что в 333 раз меньше, чем вероятность развития афебрильных приступов в результате осложнениях этих инфекций. Таким образом, причинная связь вакцинации с развитием эпилепсии не доказана [4].
Не обнаружено корреляций между вакцинацией и развитием специфического эпилептического синдрома, кроме того, считается, что не увеличивается и риск развития эпилептических энцефалопатий [3]. Существует временно́е совпадение сроков активной ревакцинации ребенка первого года жизни и пика дебюта синдрома Веста (около 5—7 мес жизни), но причинно-следственная связь не подтверждается. В отдельных странах специально сдвигались сроки вакцинации, но это не изменило частоту синдрома Веста [3].
В отдельных странах специально сдвигались сроки вакцинации, но это не изменило частоту синдрома Веста [3].
Однако синдром Драве (синоним — тяжелая миоклоническая эпилепсия младенчества) и связь с вакцинацией заслуживают отдельного обсуждения. Синдром Драве — это ранняя эпилептическая энцефалопатия, при которой самыми частыми клиническими проявлениями являются фебрильный статус и/или пролонгированные Ф.С. Впервые о связи введения АКДС и приступов сообщили S. Bercovic и соавт. [15] в 2006 г. — у 11 из 14 пациентов с аллергической вакцинной энцефалопатией была обнаружена мутация в гене SCN1A. Из обследованных пациентов только 8 имели четко очерченный клинико-генетический синдром Драве, у остальных были диагностированы «пограничный» (borderline) синдрома Драве и синдром Леннокса—Гасто. Публикация вызвала бурное обсуждение. В сообщениях имеются данные о тесной временно́й связи между прививкой и эпилепсией — от 1 до 14 сут, хотя эпидемиологические исследования пока не подтверждают эту связь. Возможно, что вакцинация вызывает лихорадку, которая провоцирует клинические проявления, но в этом случае вакцина сама по себе не может являться причиной [3].
Возможно, что вакцинация вызывает лихорадку, которая провоцирует клинические проявления, но в этом случае вакцина сама по себе не может являться причиной [3].
N. Zamponi и соавт. [16] провели сравнение частоты вакцино-ассоциированных судорог (в том числе после АКДС) у 72 пациентов с мутациями в гене SCN1A (с фенотипом синдрома Драве и генерализованной эпилепсии/ФС плюс) и у 11 пациентов с аналогичными фенотипами, но без мутаций. Вакцино-индуцированные судороги отмечались у 25% пациентов с мутацией и у 18% пациентов без нее (статистическая разница не была получена). При наличии мутаций судороги далеко не всегда были фебрильными (только в 1/3 случаев). Было показано, что у пациентов, у которых приступы начинались в первые 48 ч после вакцинации, в дальнейшем наблюдались более раннее начало афебрильных приступов и более высокая частота эпилептического статуса (по сравнению с началом приступов после 48 ч). Другой разницы между группами не было, в том числе, что очень важно, по когнитивным функциям. Авторы [16] пришли к выводу, что вакцинация не оказывает существенного эффекта на течение синдрома Драве и генерализованной эпилепсии/ФС плюс, обусловленных мутациями в гене SCN1A.
Авторы [16] пришли к выводу, что вакцинация не оказывает существенного эффекта на течение синдрома Драве и генерализованной эпилепсии/ФС плюс, обусловленных мутациями в гене SCN1A.
Вакцинация ребенка с ФС. Согласно Федеральному закону и Методическим указаниям 2002 г.3, а также более новому документу (Письмо Минздрава России от 23.08.17 № 15−2/10/2−58964), абсолютным противопоказанием к вакцинации является сильная реакция или поствакцинальное осложнение на ее предыдущее введение. К сильным реакциям на прививку со стороны ЦНС относится развитие вакцино-ассоциированных энцефалита и полиомиелита; поражения ЦНС с генерализованными или фокальными остаточными проявлениями, приводящими к инвалидности (энцефалопатия, серозный менингит, неврит, полиневрит), а «также афебрильные судороги» (цит. по Письму Минздрава России, 2017), т. е. имеются в виду доказанные случаи развития вакцино-индуцированной эпилепсии, вероятность которой чрезвычайно мала. Все исследователи едины в том, что прививать ребенка с ФС необходимо. К сожалению, эта рекомендация имеет средний, а не высокий класс доказательности (III), т. е. данные были получены в результате хорошо спланированных нерандомизированных исследований), но, скорее всего, будущие исследования ничего в ней не изменят (уровень рекомендации высокий — А) [3]. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями, особенно в раннем детском возрасте. Японские неврологи считают, что вакцинацию лучше провести через некоторый временно́й интервал после ФС (через 3 мес), но такая тактика носит эмпирический характер [17]. Согласно Приказу Минздрава России № 125н от 21.03.14 наличие ФС, развившихся при предыдущем вакцинировании АКДС, не является противопоказанием к следующему введению дозы АКДС. Однако после ее применения целесообразно назначение парацетамола (10—15 мг/кг 3—4 раза в сутки) в течение 1—2 сут (пункт 7.3).
Все исследователи едины в том, что прививать ребенка с ФС необходимо. К сожалению, эта рекомендация имеет средний, а не высокий класс доказательности (III), т. е. данные были получены в результате хорошо спланированных нерандомизированных исследований), но, скорее всего, будущие исследования ничего в ней не изменят (уровень рекомендации высокий — А) [3]. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями, особенно в раннем детском возрасте. Японские неврологи считают, что вакцинацию лучше провести через некоторый временно́й интервал после ФС (через 3 мес), но такая тактика носит эмпирический характер [17]. Согласно Приказу Минздрава России № 125н от 21.03.14 наличие ФС, развившихся при предыдущем вакцинировании АКДС, не является противопоказанием к следующему введению дозы АКДС. Однако после ее применения целесообразно назначение парацетамола (10—15 мг/кг 3—4 раза в сутки) в течение 1—2 сут (пункт 7.3).
Вакцинация ребенка с эпилепсией. Проводить вакцинацию у пациента с эпилепсией также необходимо. Итальянские детские неврологи [3] считают, что не существует повышенного риска развития побочных эффектов после вакцинации у детей с идиопатической или симптоматической эпилепсией. Тем не менее у этой рекомендации также средняя степень доказательности на фоне ее высокого класса (уровень доказательности III, класс рекомендаций А). Те же авторы пишут, что вакцинация не противопоказана детям с эпилептическими энцефалопатиями, синдромами Драве и Веста (уровень доказательности III, класс рекомендаций А), и вероятный риск эпилептической энцефалопатии не должен заставлять родителей отказываться от вакцинации (уровень доказательности III, класс рекомендаций А). При этом родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов. Пациентам с мутацией в гене SCN1A показана ранняя и более агрессивная терапия (антипиретики и/или бензодиазепины на короткий период до и после вакцинации) в сочетании с ранней противосудорожной терапией, которая может предотвратить последующие вакцино-индуцированные приступы (уровень доказательности III, класс рекомендаций D, т.
Проводить вакцинацию у пациента с эпилепсией также необходимо. Итальянские детские неврологи [3] считают, что не существует повышенного риска развития побочных эффектов после вакцинации у детей с идиопатической или симптоматической эпилепсией. Тем не менее у этой рекомендации также средняя степень доказательности на фоне ее высокого класса (уровень доказательности III, класс рекомендаций А). Те же авторы пишут, что вакцинация не противопоказана детям с эпилептическими энцефалопатиями, синдромами Драве и Веста (уровень доказательности III, класс рекомендаций А), и вероятный риск эпилептической энцефалопатии не должен заставлять родителей отказываться от вакцинации (уровень доказательности III, класс рекомендаций А). При этом родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов. Пациентам с мутацией в гене SCN1A показана ранняя и более агрессивная терапия (антипиретики и/или бензодиазепины на короткий период до и после вакцинации) в сочетании с ранней противосудорожной терапией, которая может предотвратить последующие вакцино-индуцированные приступы (уровень доказательности III, класс рекомендаций D, т. е. слабая степень рекомендации) [3].
е. слабая степень рекомендации) [3].
В отечественной медицине традиционно считается, что коклюшный компонент противопоказан пациентам с эпилепсией (т.е. вакцина АКДС). Вакцины АДС, АДС-м и АД-м постоянных противопоказаний не имеют, при эпидемиологической необходимости их можно применять даже на фоне обострения заболевания. В случае сильной реакции на предыдущую дозу этих вакцин рекомендуется проводить повторную вакцинацию на фоне применения стероидов (преднизолон внутрь 1—1,5 мг/кг в сутки за сутки до и сразу после прививки). Американские рекомендации по применению АКДС (2018) [18] менее жесткие. Они относят прогрессирующие и нестабильные неврологические нарушения, включая инфантильные спазмы, неконтролируемые судороги или прогрессирующую энцефалопатию к разделу состояний, при которых необходима предосторожность при вакцинации АКДС, т. е. выгода для пациента от вакцинации должна превышать возможные риски, и это соотношение выгоды и рисков оценивается индивидуально в каждом конкретном случае.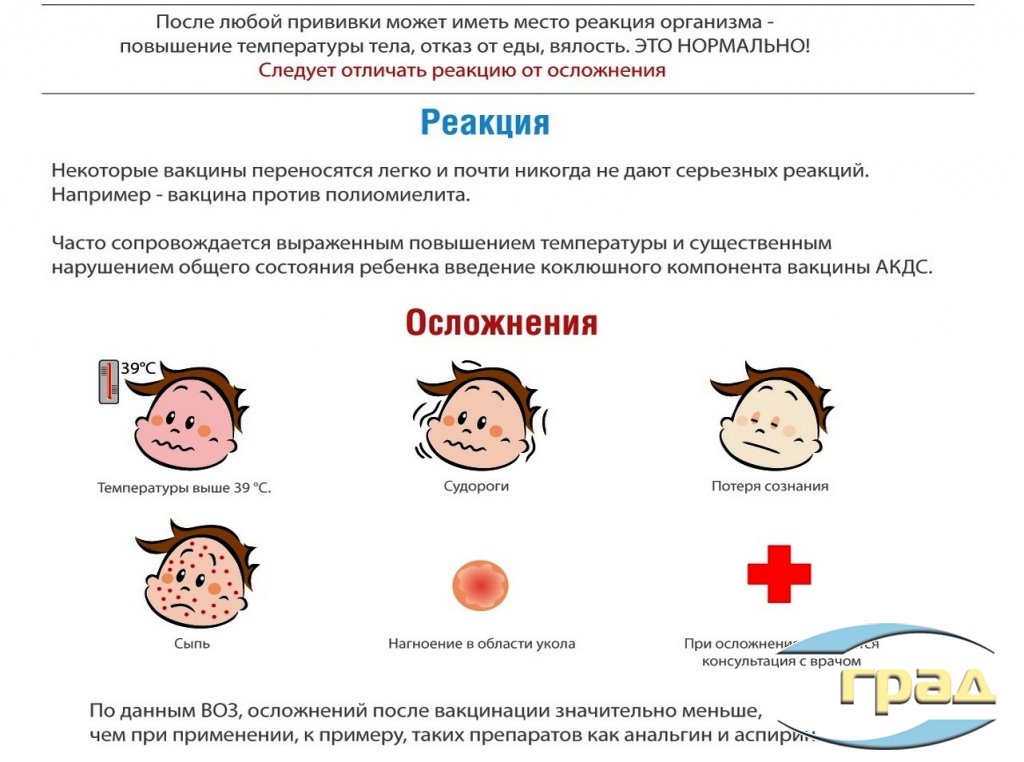 Выходом могло бы быть введение инактивированной коклюшной вакцины, но пока отсутствуют отечественные рекомендации по возможности ее применения у пациентов с эпилепсией.
Выходом могло бы быть введение инактивированной коклюшной вакцины, но пока отсутствуют отечественные рекомендации по возможности ее применения у пациентов с эпилепсией.
Существуют противоречия по вопросам вакцинации детей и ее возможных осложнений между врачами и родителями пациентов. Существует так называемое «антивакцинное» лобби, которое сеет страх и сомнения в умах родителей, доказывая, что причинной развития тяжелых неврологических заболеваний, в том числе эпилепсии, является вакцинация. Часто родители, имея ребенка с тяжелой эпилепсией, убеждены, что именно вакцина вызвала у него судороги. Наличие мифов в отношении вакцинации приводит к росту прослойки невакцинированных детей и к вспышкам инфекций (например, кори) даже в развитых странах [19].
Однако, как видно из приведенного обзора, риск развития вакцино-индуцированных ФС невысок, а их прогноз абсолютно благоприятен, а опасения родителей, а иногда и врачей, в отношении неврологических осложнений вакцинации сильно преувеличены. Риск развития ФС и возможность развития эпилепсии значительно выше при самих инфекционных заболеваниях, чем при прививках от них. Кроме того, следует помнить об успехах совершенствования вакцинации и появлении большого числа инактивированных вакцин, что также снижает риск неврологических осложнений после вакцинации. Для того чтобы предотвратить потенциально возможное развитие энцефалопатии у пациентов с определенными генными мутациями, необходимо более ясное представление о взаимодействии вакцины и генной мутации. Это не значит, что данная группа пациентов не должна прививаться — прививки им показаны, но врачам следует подходить к вакцинации индивидуально и выбирать вакцины, которые ассоциированы с наименьшим риском развития судорог.
Риск развития ФС и возможность развития эпилепсии значительно выше при самих инфекционных заболеваниях, чем при прививках от них. Кроме того, следует помнить об успехах совершенствования вакцинации и появлении большого числа инактивированных вакцин, что также снижает риск неврологических осложнений после вакцинации. Для того чтобы предотвратить потенциально возможное развитие энцефалопатии у пациентов с определенными генными мутациями, необходимо более ясное представление о взаимодействии вакцины и генной мутации. Это не значит, что данная группа пациентов не должна прививаться — прививки им показаны, но врачам следует подходить к вакцинации индивидуально и выбирать вакцины, которые ассоциированы с наименьшим риском развития судорог.
1. Некоторые вакцины (АКДС и ассоциированная вакцина КПК) обладают риском развития Ф.С. Они, вероятно, могут провоцировать ФС, но не являются их причиной. Откладывание срока вакцинации до более старшего возраста ребенка не снижает риск развития ФС, т. е. нецелесообразно.
е. нецелесообразно.
2. Вакцины не увеличивают риск развития эпилепсии и синдрома Веста. Вакцинация АКДС, вероятно, может способствовать более раннему развитию приступов при синдроме Драве, но не оказывает существенного эффекта на его течение.
3. Наличие Ф.С. в анамнезе не является противопоказанием для вакцинации. Родители ребенка с ФС должны быть информированы о том, что некоторые вакцины ассоциированы с температурными реакциями.
4. Наличие эпилепсии не является противопоказанием к вакцинации в целом. Согласно отечественному законодательству, из вакцинации должен быть исключен коклюшный компонент.
5. Для пациентов с эпилептическими энцефалопатиями существуют международные рекомендации по необходимости прививок (согласно отечественному законодательству, из вакцинации должен быть также исключен коклюшный компонент). Родители пациентов с синдромом Драве должны быть информированы о рисках вакцинации и о возможной их профилактике с помощью противоэпилептических препаратов.
Авторы заявляют об отсутствии конфликта интересов.
e-mail: [email protected]
1http://legalacts.ru/doc/prikaz-minzdrava-rossii-ot-21032014-n-125n/#100005
2WHO Global Vaccine Safety Essential Medicines & Health Products 20, Avenue Appia, CH-1211, Geneva 27, Switzerland. INFORMATION SHEET OBSERVED RATE OF VACCINE REACTIONS DIPHTHERIA, PERTUSSIS, TETANUS, 2014 VACCINES http://www.who.int/vaccine_safety/initiative/tools/DTP_vaccine_rates_information_sheet.pdf
3Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок. Методические указания МУ 3.3.1.1095—02 Минздрав России, 2002.
4Письмо Минздрава России от 23.08.17 № 15−2/10/2−5896 Методические рекомендации «Противопоказания к вакцинации». http://www.consultant.ru/document/cons_doc_LAW_222956/
Вакцинация АКДС и выживаемость детей в обсервационных исследованиях с неполными данными о вакцинации
Обзор
. 2007 Январь; 12 (1): 15-24.
2007 Январь; 12 (1): 15-24.
doi: 10.1111/j.1365-3156.2006.01774.x.
Питер Ааби 1 , Кристин Стабелл Бенн, Йенс Нильсен, Ида Мария Лиссе, Амабелия Родригес, Хенрик Йенсен
принадлежность
- 1 Bandim Health Project, Датский научный центр эпидемиологии и Statens Serum Institut, Бисау, Гвинея-Бисау, Дания. [email protected]
- PMID: 17207144
- DOI: 10.1111/j.1365-3156.2006.01774.x
Бесплатная статья
Обзор
Peter Aaby et al. Троп Мед Int Health.
2007 Январь
Троп Мед Int Health.
2007 Январь
Бесплатная статья
. 2007 Январь; 12 (1): 15-24.
doi: 10.1111/j.1365-3156.2006.01774.x.
Авторы
Питер Оби 1 , Кристин Стабелл Бенн, Йенс Нильсен, Ида Мария Лиссе, Амабелия Родригес, Хенрик Йенсен
принадлежность
- 1 Bandim Health Project, Датский научный центр эпидемиологии и Statens Serum Institut, Бисау, Гвинея-Бисау, Дания. [email protected]
- PMID: 17207144
- DOI:
10.
 1111/j.1365-3156.2006.01774.x
1111/j.1365-3156.2006.01774.x
Абстрактный
Фон: Обсервационные исследования вакцины против дифтерии, столбняка и коклюша (АКДС) в центрах лонгитюдных исследований показали разное влияние на выживаемость детей, варьирующееся от 10-кратного снижения до трехкратного увеличения смертности. Ни в одном из этих исследований не было полной информации о прививках АКДС как у выживших, так и у умерших детей. Мы рассмотрели методологию анализа данных, чтобы оценить, могут ли методологические различия объяснить расходящиеся результаты.
Дизайн: В исследованиях использовался дизайн случай-контроль, анализ выживаемости с фиксированным интервалом прививочного статуса (ориентировочный подход) и анализ выживаемости с ретроспективным обновлением вакцинационного статуса.
Полученные результаты: Семь исследований с использованием схемы «случай-контроль» или ориентировочного подхода выявили негативное влияние АКДС на выживаемость детей. Восемь из девяти анализов выживаемости с ретроспективным обновлением статуса вакцинации сообщили о положительном эффекте. Положительный эффект АКДС увеличивался с увеличением интервала между визитами для сбора данных. Исследования с длительным интервалом между посещениями показали очень высокие показатели смертности среди невакцинированных детей, низкие коэффициенты смертности для вакцинированных детей по сравнению с невакцинированными детьми и сильно благоприятные оценки АКДС.
Вывод: Расходящиеся результаты обсервационных исследований влияния АКДС на выживаемость детей отчасти объясняются методологическими различиями. Для оценки влияния плановых вакцинаций на смертность необходимы обсервационные исследования, минимизирующие влияние систематической ошибки. Следует рассмотреть рандомизированные испытания.
Следует рассмотреть рандомизированные испытания.
Похожие статьи
Внедрение вакцины против дифтерии, столбняка и коклюша и детская смертность в сельских районах Гвинеи-Бисау: обсервационное исследование.
Ааби П., Дженсен Х., Гомеш Дж., Фернандес М., Лиссе И.М. Ааби П. и др. Int J Эпидемиол. 2004 Апрель; 33 (2): 374-80. doi: 10.1093/ije/dyh005. Int J Эпидемиол. 2004. PMID: 15082643
Влияние плановой иммунизации на выживаемость детей в сельских районах Малави с учетом пола.
Ааби П., Вессари Х., Нильсен Дж., Малета К., Бенн К.С., Дженсен Х., Эшорн П. Ааби П. и др. Pediatr Infect Dis J. 25 августа 2006 г.; 25 (8): 721-7. doi: 10.1097/01.inf.0000227829.64686.ae. Pediatr Infect Dis J.
 2006.
PMID: 16874172
2006.
PMID: 16874172Неспецифические эффекты вакцинации против столбняка и коклюша на детскую смертность в Себу, Филиппины.
Чан Г.Дж., Моултон Л.Х., Беккер С., Муньос А., Блэк Р.Э. Чан Г.Дж. и соавт. Int J Эпидемиол. 2007 Октябрь; 36 (5): 1022-9. doi: 10.1093/ije/dym142. Epub 2007 23 июля. Int J Эпидемиол. 2007. PMID: 17646186
Должны ли девочки грудного возраста получать добавки микроэлементов?
Бенн К.С., Лунд С., Фискер А., Йоргенсен М.Дж., Ааби П. Бенн С.С. и соавт. Int J Эпидемиол. 2009 Апрель; 38 (2): 586-90. doi: 10.1093/ije/dyn364. Epub 2009 15 января. Int J Эпидемиол. 2009. PMID: 19147706 Обзор.
Ассоциация вакцин, содержащих БЦЖ, АКДС и корь, с детской смертностью: систематический обзор.

Хиггинс Дж.П., Соарес-Вайзер К., Лопес-Лопес Дж.А., Какуру А., Чаплин К., Кристенсен Х., Мартин Н.К., Стерн Дж.А., Рейнгольд А.Л. Хиггинс Дж. П. и соавт. БМЖ. 2016 13 октября; 355:i5170. дои: 10.1136/bmj.i5170. БМЖ. 2016. PMID: 27737834 Бесплатная статья ЧВК. Обзор.
Посмотреть все похожие статьи
Цитируется
Профиль когорты: Сельская система медицинского и демографического наблюдения (HDSS) проекта Bandim Health Project (BHP) — национально репрезентативная HDSS в Гвинее-Бисау.
Тайсен С.М., Фернандес М., Бенн К.С., Ааби П., Фискер А.Б. Тайсен С.М. и соавт. Открытый БМЖ. 11 июня 2019 г .; 9 (6): e028775. doi: 10.1136/bmjopen-2018-028775. Открытый БМЖ. 2019. PMID: 31189684 Бесплатная статья ЧВК.
Связана ли дифтерия-столбняк-коклюш (АКДС) с повышенной женской смертностью? Метаанализ, проверяющий гипотезы о неспецифических эффектах вакцины АКДС в зависимости от пола.

Ааби П., Равн Х., Фискер А.Б., Родригес А., Бенн К.С. Ааби П. и др. Trans R Soc Trop Med Hyg. 2016 декабрь; 110 (10): 570-581. дои: 10.1093/trstmh/trw073. Epub 2016 17 ноября. Trans R Soc Trop Med Hyg. 2016. PMID: 27856947 Бесплатная статья ЧВК.
Влияние оральной вакцины против полиомиелита при рождении на младенческую смертность: рандомизированное исследование.
Лунд Н., Андерсен А., Хансен А.С., Джепсен Ф.С., Барбоза А., Биринг-Соренсен С., Родригес А., Равн Х., Ааби П., Бенн К.С. Лунд Н. и др. Клин Инфекция Дис. 2015 15 ноября; 61 (10): 1504-11. дои: 10.1093/cid/civ617. Epub 2015 28 июля. Клин Инфекция Дис. 2015. PMID: 26219694 Бесплатная статья ЧВК. Клиническое испытание.
Взаимодействие между добавлением витамина А новорожденным и сроками вакцинации против кори: ретроспективный анализ трех рандомизированных исследований в Гвинее-Бисау.

Бенн К.С., Мартинс К.Л., Фискер А.Б., Динесс Б.Р., Гарли М.Л., Бальде И., Родригес А., Уиттл Х., Ааби П. Бенн С.С. и соавт. вакцина. 2014 22 сентября; 32 (42): 5468-74. doi: 10.1016/j.vaccine.2014.07.090. Epub 2014 13 августа. вакцина. 2014. PMID: 25131735 Бесплатная статья ЧВК. Клиническое испытание.
Проверка гипотезы о том, что вакцина против дифтерии, столбняка и коклюша оказывает негативное неспецифическое и дифференцированное по полу влияние на выживаемость детей в странах с высокой смертностью.
Ааби П., Бенн С., Нильсен Дж., Лиссе И.М., Родригес А., Равн Х. Ааби П. и др. Открытый БМЖ. 2012 г., 22 мая; 2(3):e000707. doi: 10.1136/bmjopen-2011-000707. Печать 2012. Открытый БМЖ. 2012. PMID: 22619263 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Характер и частота побочных реакций, связанных с иммунизацией АКДС и АКДС у младенцев и детей
Клинические испытания
. 1981 ноябрь; 68 (5): 650-60.
1981 ноябрь; 68 (5): 650-60.
С. Л. Коди, Л. Дж. Барафф, Дж. Д. Черри, С. М. Марси, С. Р. Манкларк
- PMID: 7031583
Клинические испытания
C L Cody et al. Педиатрия. 1981 ноябрь
. 1981 ноябрь; 68 (5): 650-60.
Авторы
С. Л. Коди, Л. Дж. Барафф, Дж. Д. Черри, С. М. Марси, С. Р. Манкларк
- PMID: 7031583
Абстрактный
В 784 прививках DT и 15 752 прививках DTP, проведенных детям в возрасте от 0 до 6 лет, которые были проспективно изучены на предмет реакций, возникающих в течение 48 часов после иммунизации, незначительные реакции были значительно более частыми после вакцины DTP. Соотношение скорости реакции, связанной с иммунизацией DTP и DT (DTP/DT) для выбранных местных и системных реакций, было следующим: локальное покраснение 37,4%/7,6%; местный отек, 40,7%/7,6%; боль, 50,9%/9,9%; лихорадка, 31,5%/14,9%; сонливость 31,5%/14,9%; раздражительность — 53,4%/22,6%; рвота, 6,2%/2,6%; анорексия, 20,9%/7,0% и постоянный плач, 3,1%/0,7%. После иммунизации АКДС у девяти детей развились судороги, а у девяти развились гипотонические гипореактивные эпизоды. Никаких последствий после этих реакций обнаружено не было.
Соотношение скорости реакции, связанной с иммунизацией DTP и DT (DTP/DT) для выбранных местных и системных реакций, было следующим: локальное покраснение 37,4%/7,6%; местный отек, 40,7%/7,6%; боль, 50,9%/9,9%; лихорадка, 31,5%/14,9%; сонливость 31,5%/14,9%; раздражительность — 53,4%/22,6%; рвота, 6,2%/2,6%; анорексия, 20,9%/7,0% и постоянный плач, 3,1%/0,7%. После иммунизации АКДС у девяти детей развились судороги, а у девяти развились гипотонические гипореактивные эпизоды. Никаких последствий после этих реакций обнаружено не было.
Похожие статьи
Реакции на вакцину АКДС: влияние предшествующих реакций на частоту последующих реакций.
Барафф Л.Дж., Черри Д.Д., Коди К.Л., Марси С.М., Манкларк К.Р. Барафф Л.Дж. и соавт. Стенд Дев Биол. 1985;61:423-8. Стенд Дев Биол. 1985. PMID: 3879687
Младенцы и дети с судорогами и эпизодами гипотонии-гипореактивности после иммунизации против дифтерии-столбняка-коклюша: последующая оценка.

Барафф Л.Дж., Шилдс В.Д., Беквит Л., Строум Г., Марси С.М., Черри Д.Д., Манкларк К.Р. Барафф Л.Дж. и соавт. Педиатрия. 1988 июня; 81 (6): 789-94. Педиатрия. 1988 год. PMID: 3259305
Незначительные нежелательные явления в сравнительном испытании эффективности в Германии у детей грудного возраста, получавших бесклеточную вакцину против коклюша АКДС (АКДС) Ледерле/Такеда, цельноклеточную компонентную вакцину АКДС (АКДС) Ледерле или вакцину АКДС Ледерле. Группа по изучению коклюшной вакцины.
Шмитт-Гроэ С., Штер К., Черри Д.Д., Хайнингер У., Убералл М.А., Лауссук С., Экхардт Т. Шмитт-Гроэ С. и др. Стенд Дев Биол. 1997;89:113-8. Стенд Дев Биол. 1997. PMID: 9272341 Клиническое испытание.
Иммунологические основы введения АКДС-полиовакцины.

Коэн Х. Коэн Х. Верх К Академ Генескд Белг. 2000;62(4):245-67. Верх К Академ Генескд Белг. 2000. PMID: 11004905 Обзор. Голландский.
Ацетаминофен и ибупрофен для предотвращения побочных реакций, связанных с иммунизацией детей.
Мэнли Дж., Таддио А. Мэнли Дж. и др. Энн Фармакотер. 2007 г., июль; 41 (7): 1227-32. doi: 10.1345/аф.1Н647. Epub 2007 22 мая. Энн Фармакотер. 2007. PMID: 17519301 Обзор.
Посмотреть все похожие статьи
Цитируется
Условный дефект роста мутантов Bordetella pertussis и Bordetella bronchiseptica, регулирующих поглощение железа (мех).
де Йонге Э.Ф., Томмассен Дж. де Йонге Э.
 Ф. и др.
FEMS Microbiol Lett. 2022 1 июля; 369 (1): fnac047. doi: 10.1093/femsle/fnac047.
FEMS Microbiol Lett. 2022.
PMID: 35700015
Бесплатная статья ЧВК.
Ф. и др.
FEMS Microbiol Lett. 2022 1 июля; 369 (1): fnac047. doi: 10.1093/femsle/fnac047.
FEMS Microbiol Lett. 2022.
PMID: 35700015
Бесплатная статья ЧВК.Тепловой шок усиливает высвобождение пузырьков внешней мембраны у Bordetella spp.
де Йонге Э.Ф., Балхуйзен М.Д., ван Бокстель Р., Ву Дж., Хаагсман Х.П., Томмассен Дж. де Йонге Э.Ф. и др. Curr Res Microb Sci. 2020 17 сен;2:100009. doi: 10.1016/j.crmicr.2020.100009. электронная коллекция 2021 дек. Curr Res Microb Sci. 2020. PMID: 34841303 Бесплатная статья ЧВК.
Пертактин способствует выделению и передаче Bordetella bronchiseptica.
Ма Л., Деван К.К., Тейлор-Малнейкс Д.Л., Вагнер С.М., Линц Б., Ривера И., Су Ю., Колфилд А.Д., Блас-Мачадо У.
 , Харвилл И.Т.
Ма Л и др.
PLoS Патог. 2021 4 августа; 17 (8): e1009735. doi: 10.1371/journal.ppat.1009735. Электронная коллекция 2021 авг.
PLoS Патог. 2021.
PMID: 34347835
Бесплатная статья ЧВК.
, Харвилл И.Т.
Ма Л и др.
PLoS Патог. 2021 4 августа; 17 (8): e1009735. doi: 10.1371/journal.ppat.1009735. Электронная коллекция 2021 авг.
PLoS Патог. 2021.
PMID: 34347835
Бесплатная статья ЧВК.Коклюшные вакцины следующего поколения, основанные на индукции защитных Т-клеток в дыхательных путях.
Chasaide CN, Mills KHG. Chasaide CN и соавт. Вакцины (Базель). 2020 21 октября; 8 (4): 621. doi: 10.3390/vaccines8040621. Вакцины (Базель). 2020. PMID: 33096737 Бесплатная статья ЧВК. Обзор.
Влияние FHA и Prn на колонизацию мышей Bordetella pertussis зависит от типа вакцины и анатомической локализации.
Зеддеман А., ван Шуппен Э., Кок К.Е., ван Гент М., Хойвельман К.Дж., Барт М.Дж., ван дер Хейде Х.

 1111/j.1365-3156.2006.01774.x
1111/j.1365-3156.2006.01774.x 2006.
PMID: 16874172
2006.
PMID: 16874172



 Ф. и др.
FEMS Microbiol Lett. 2022 1 июля; 369 (1): fnac047. doi: 10.1093/femsle/fnac047.
FEMS Microbiol Lett. 2022.
PMID: 35700015
Бесплатная статья ЧВК.
Ф. и др.
FEMS Microbiol Lett. 2022 1 июля; 369 (1): fnac047. doi: 10.1093/femsle/fnac047.
FEMS Microbiol Lett. 2022.
PMID: 35700015
Бесплатная статья ЧВК. , Харвилл И.Т.
Ма Л и др.
PLoS Патог. 2021 4 августа; 17 (8): e1009735. doi: 10.1371/journal.ppat.1009735. Электронная коллекция 2021 авг.
PLoS Патог. 2021.
PMID: 34347835
Бесплатная статья ЧВК.
, Харвилл И.Т.
Ма Л и др.
PLoS Патог. 2021 4 августа; 17 (8): e1009735. doi: 10.1371/journal.ppat.1009735. Электронная коллекция 2021 авг.
PLoS Патог. 2021.
PMID: 34347835
Бесплатная статья ЧВК.