Лечебные препараты из живых микроорганизмов
Статья на конкурс «био/мол/текст»: Существуют ли лекарственные средства, не вызывающие побочных эффектов и осложнений, высокоэффективные и безопасные? Ближе всего к этим идеальным характеристикам подобрались пробиотические препараты (из живых микроорганизмов — симбионтов человека) и бактериофаги (вирусы бактерий). При введении в организм человека они вступают в борьбу за существование с возбудителями инфекционных заболеваний или, в случае бактериофагов, по-партизански разлагают их изнутри. Пробиотики и фаги с разной специфичностью влияют на патогенные бактерии, все процессы развиваются в пределах микробиоценоза определенной области человеческого тела и направлены на сохранение среды обитания, иначе говоря, на подержание гомеостаза. Пробиотики и фаги обычно применяют по отдельности, но перспективным может оказаться их совместное использование.
Обратите внимание!
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Клин клином выбивают.
Народная мудрость
Биотехнология — медицине
В современной медицинской практике используется большое количество средств, получаемых благодаря жизнедеятельности микроорганизмов. Сюда относятся витамины, ферменты, генно-инженерные гормоны и интерфероны, заменители крови и, конечно же, антибиотики. Собственно, даже медицинский спирт — этот универсальный антисептик, народный анальгетик и антидепрессант — является продуктом бродильного метаболизма дрожжевых грибков. Традиционные и новые высокоэффективные, различные по структуре и механизму действия природные и химически модифицированные лекарственные препараты, в создании которых участвовали микроорганизмы, применяются для лечения различных заболеваний.
Когда лекарство опаснее болезни
В практике применения лекарственных средств врачу приходится встречаться с так называемыми побочными явлениями, которые могут развиваться наряду с основным действием лекарства и ограничивать возможности его применения. Побочные реакции особенно часто возникают в случаях применения лекарств, обладающих многосторонним фармакологическим эффектом (вспомним тот же этиловый спирт), тогда как цель лечения достигается благодаря использованию лишь некоторых сторон фармакодинамики данного лекарства.
Особенного внимания заслуживают в этом смысле антибиотики, поскольку они являются препаратами выбора при лечении большинства инфекционных заболеваний, а назначению антибиотиков далеко не всегда предшествует проведение необходимых микробиологических исследований. Нередки случаи нерационального применения антибиотиков широкого спектра действия, нарушения пациентами схем приема препаратов, а то и вовсе бесконтрольного самолечения. И даже при правильном использовании антибактериальное действие антибиотиков распространяется не только на патогенную, но и на нормальную микробную флору организма. Под действием антибиотиков гибнут бифидобактерии, лактобациллы, симбиотические штаммы кишечной палочки и другие полезные микробы. Освободившиеся экологические ниши тут же заселяют условно-патогенные бактерии и грибки (как правило, обладающие резистентностью к антибиотикам), которые до этого присутствовали на коже и в нестерильных полостях организма в незначительном количестве — их размножение сдерживалось нормальной микрофлорой. Антибиотикотерапия, например, может способствовать превращению мирных сапрофитных дрожжеподобных грибков

Рисунок 1. Дрожжеподобные грибки Candida albicans и последствия их активного размножения. а — Клетки Candida albicans под электронным микроскопом. б — Проявления кандидоза. Рисунки с сайтов velvet.by и www.medical-enc.ru.
В основе других побочных эффектов могут лежать индивидуальные особенности взаимодействия организма с антибиотиком: непереносимость препарата может иметь аллергическую или псевдоаллергическую природу, быть следствием ферментопатий или попадать в загадочную категорию идиосинкразий (до выяснения механизма непереносимости).
Пробиотики вместо антибиотиков?
В настоящее время перед медицинской наукой и органами охраны здоровья всего мира стоит ответственная задача — создание эффективных антибактериальных препаратов, вызывающих как можно менее выраженные побочные реакции.
Одним из возможных решений проблемы является разработка и широкое фармакотерапевтическое использование препаратов на основе живых культур представителей нормальной микрофлоры (пробиотиков) для коррекции микробиоценозов человека и для лечения патологических состояний. Применение бактериальных препаратов основано на понимании роли нормальной микрофлоры организма в процессах, обеспечивающих неспецифическую резистентность к инфекциям, в формировании иммунного ответа, а также на установлении антагонистической роли нормофлоры и ее участия в регуляции метаболических процессов [1].
Основоположником теории пробиотиков считают И.И. Мечникова. Он полагал, что сохранение здоровья человека и продление молодости во многом зависит от обитающих в кишечнике молочнокислых бактерий, способных подавлять процессы гниения и образования токсичных продуктов. Еще в 1903 году Мечников предложил практическое использование микробных культур—антагонистов для борьбы с болезнетворными бактериями.
По некоторым данным, термин «пробиотики» был введен Вернером Коллатом в 1953 году, затем его неоднократно и по-разному толковали как ученые, так и регулирующие организации. Коллат назвал пробиотиками вещества, необходимые для развития здорового организма, своего рода «промоторы жизни» — в противоположность антибиотикам. С концовкой этого утверждения соглашались также Лилли и Стилвелл, которым часто приписывают изобретение термина, однако они уточняли, что пробиотики представляют собой вещества, вырабатываемые одними микроорганизмами и стимулирующие рост других. Подавляющее же большинство определений вращалось вокруг принятия жизнеспособных микробов с целью модуляции кишечной микрофлоры. Согласно консенсусной трактовке экспертного совета ВОЗ и ФАО, пробиотики представляют собой живые микроорганизмы, которые при принятии в достаточном количестве приносят пользу здоровью. Существенный вклад в развитие современной концепции пробиотиков внес известный биохимик, специалист по питанию животных Марсель Ванбелле [2]. Т.П. Лайонс и Р.Дж. Фэллон в 1992 году назвали наше время «наступающей эпохой пробиотиков» (и не ошиблись, судя по невероятному росту их продаж —
По сравнению с традиционными антибактериальными препаратами пробиотики имеют ряд преимуществ: безвредность (однако не при всех диагнозах и не для всех пациентов — Ред.), отсутствие побочных реакций, аллергизации и отрицательного воздействия на нормальную микрофлору. В то же время авторы ряда исследований связывают прием этих биопрепаратов с выраженным клиническим эффектом при лечении (долечивании) острых кишечных инфекций. Важной особенностью пробиотиков, по некоторым данным, является их способность модулировать иммунные реакции, оказывать в ряде случаев противоаллергическое действие, регулировать пищеварение.
В настоящее время в медицине широко используют ряд подобных бактериальных препаратов. Одни из них содержат бактерии, постоянно обитающие в организме человека («Лактобактерин», «Бифидумбактерин», «Колибактерин», «Бификол»), другие состоят из микроорганизмов, не являющихся «резидентами» человеческого тела, но способных на определенное время колонизировать слизистые оболочки или раневые поверхности, создавая на них защитную биопленку (рис. 2) и вырабатывая вещества, губительные для патогенных бактерий. К таким препаратам относятся, в частности, «Биоспорин» на основе сапрофитной бактерии Bacillus subtilis и «А-бактерин», состоящий из живых клеток зеленящего аэрококка — Aerococcus viridans [1].

Рисунок 2. Биопленка. а — Формирование биопленки. б — Биопленка под электронным микроскопом. Рисунки с сайтов www.lymebaysolutions.co.uk и phys.org.
Полезный микроб — аэрококк
Некоторых аэрококков (рис. 3) относят к условно-патогенным микробам, поскольку они способны вызывать заболевания у животных (например, гаффкемию у омаров) и людей с иммунодефицитами. Аэрококки часто обнаруживаются в воздухе больничных палат и на предметах медицинского назначения, выделяются от больных со стрептококковыми и стафилококковыми инфекциями и к тому же имеют определенное морфологическое сходство с этими опасными бактериями.

Рисунок 3. Клетки и колонии аэрококков. а — Бактерии под обычным световым микроскопом. б — Бактерии под электронным микроскопом. Видны округлые клетки, расположенные парами и тетрадами. в — Колонии аэрококков на питательной среде с добавлением крови. Зеленое окрашивание вокруг колоний — результат частичного разрушения гемоглобина. Фото (а) с сайта codeofconduc.com, (б) и (в) — сделаны авторами статьи.

Рисунок 4. Подавление аэрококками роста патогенных бактерий. Зоны значительной задержки роста зарегистрированы при культивировании вибрионов, стафилококков, дифтерийной палочки, провиденции. Синегнойная палочка (Pseudomonas aeruginosa) к антагонистическому действию аэрококков устойчива. Фото авторов статьи.
Но коллективу кафедры микробиологии Днепропетровской медицинской академии удалось выявить среди аэрококков штамм не просто безвредный для человека, но и проявляющий выраженную антагонистическую активность в отношении широкого спектра возбудителей инфекционных болезней. Так был разработан и внедрен препарат, не имеющий аналогов в мировой практике, — пробиотик «А-бактерин» для наружного и перорального применения, который не уступает по своему воздействию на микрофлору человека дорогостоящим препаратам антибиотического направления (рис. 4).
Антагонистические свойства аэрококков связаны с продукцией перекиси водорода (вещества, широко применяемого в медицине в качестве антисептика) — стабильным признаком производственного штамма А. viridans, из которого готовится «А-бактерин». Другим бактерицидным веществом, продуктом метаболизма аэрококков, является супероксидный радикал (рис. 5), образуемый этими бактериями при окислении молочной кислоты. Причем способность аэрококков окислять молочную кислоту очень важна в случае применения препарата в стоматологии, так как одной из причин кариеса является молочная кислота, образуемая стрептококками.

Рисунок 5. Бактерицидные вещества, образуемые аэрококками: перекись водорода (а) и супероксидный радикал (б). Рисунок с сайта tofeelwell.ru.
В культуральной жидкости аэрококков был выявлен низкомолекулярный кислотоустойчивый и термостабильный пептид виридоцин, обладающий широким спектром антагонистической активности в отношении тех микроорганизмов, которые чаще всего вызывают госпитальные инфекции и участвуют в формировании физиологического и патологического микробиоценоза кишечника человека [3]. Кроме того, А. viridans продуцирует во внешнюю среду пептид аэроцин*, способный убивать дрожжеподобные грибки. Использование «А-бактерина» с йодидом калия и этонием эффективно при урогенитальных кандидозах, так как обеспечивает направленное повреждение мембран кандид [4, 5]. Тот же эффект достигается в случае применения препарата как средства профилактики кандидозов, возникающих, например, вследствие угнетения иммунитета при ВИЧ-инфекции [1, 6, 7].
Кроме способности подавлять размножение патогенных бактерий, «А-бактерин» способствует регенерации поврежденной ткани, проявляет адъювантное действие, стимулирует фагоцитоз и может быть рекомендован больным, сенсибилизированным к антибиотикам и химиотерапевтическим средствам. Сегодня «А-бактерин» успешно применяется для лечения ожоговых и хирургических ран, для профилактики и лечения диареи, а также в стоматологической, урологической и гинекологической практике. Перорально «А-бактерин» используется для коррекции микрофлоры кишечника, профилактики и лечения кишечных инфекций, коррекции отдельных биохимических показателей (холестеринового профиля и уровня молочной кислоты) и активации иммунитета [1]. Другие пробиотики тоже широко применяются для лечения и профилактики кишечных инфекций, особенно у детей раннего возраста, находящихся на искусственном вскармливании [9]. Пользуются популярностью и пищевые продукты, содержащие живые пробиотические культуры.
Лечебные вирусы
Как оказалось, в терапевтических целях может быть использовано не только явление микробного антагонизма, но и паразитизма. Патогенные бактерии паразитируют в организме человека, но и они, в свою очередь, являются хозяевами для еще более мелких паразитов — бактериофагов. Применение фагов в медицине основано на их высокой специфичности. Каждый вид фагов способен размножаться только в клетках определенной группы бактерий (рис. 6). Бактериофаги принципиально не способны повреждать человеческие клетки, и кроме того, бактерии-симбионты человека и патогенные бактерии обычно восприимчивы к разным фагам.

Рисунок 6. Паразитизм во благо. а — Специфичность фагов зависит от их способности адсорбироваться на определенных структурах бактериальной клетки. б — Прикрепившись к поверхности бактерии, фаги могут перемещаться вместе с ней. в — Выход фагового потомства из пораженной бактерии. В одной клетке может образоваться более 1000 новых бактериофагов. Рисунки с сайтов epochtimes.ru, epochtimes.ru и www.biocuantica.es.
При лечении инфекций важно создать высокую концентрацию антимикробного препарата именно в месте локализации возбудителя. Применяя антибиотики в виде таблеток или инъекций, добиться этого довольно трудно. Но в случае фаготерапии достаточно, если в инфекционный очаг доберутся хотя бы одиночные бактериофаги. Обнаружив патогенные бактерии и проникнув в них, фаги начинают очень быстро размножаться. С каждым циклом размножения, который длится около получаса, количество фагов возрастает в десятки, а то и сотни раз. После разрушения всех клеток возбудителя фаги более не способны размножаться и, благодаря своим мелким размерам, беспрепятственно выводятся из организма вместе с другими продуктами распада.
Пробиотики и фаги вместе

Рисунок 7. Транслокация бактерий из кишечника в кровяное русло. Рисунок с сайта darwinian-medicine.com.
Бактериофаги хорошо зарекомендовали себя в профилактике и лечении кишечных инфекций и гнойно-воспалительных процессов. Возбудители этих заболеваний часто приобретают устойчивость к антибиотикам, но остаются чувствительными к фагам [10]. В последнее время ученых заинтересовала перспектива совместного использования бактериофагов и пробиотиков. Предполагается, что при назначении такого комплексного препарата сначала фаг уничтожает патогенные бактерии, а потом освободившуюся экологическую нишу заселяют полезные микроорганизмы, формируя стабильный микробиоценоз с высокими защитными свойствами. Такой подход уже был опробован на сельскохозяйственных животных [11]. Вероятно, он войдет и в медицинскую практику.
Возможно и более тесное взаимодействие в системе «бактериофаг + пробиотик». Известно, что бактерии — представители нормальной микрофлоры человека — способны адсорбировать на своей поверхности различные вирусы, не позволяя им проникнуть в клетки человека [9]. Оказалось, что таким же образом могут адсорбироваться и бактериофаги: они не способны внедриться в клетку устойчивой к ним бактерии, но используют ее как «транспортное средство» для перемещения в организме человека. Такое явление получило название транслокации бактериофагов.
Внутренняя среда организма, его ткани и кровь считаются стерильными. На самом деле через микроскопические повреждения слизистых оболочек бактерии-симбионты периодически проникают в кровяное русло (рис. 7), хотя и быстро там уничтожаются клетками иммунной системы и бактерицидными веществами [12]. При наличии инфекционного очага барьерные свойства окружающих тканей часто нарушены, их проницаемость возрастает. Это повышает вероятность проникновения туда циркулирующих пробиотических бактерий вместе с прикрепившимися к ним фагами [13, 14]. В частности, у людей с инфекциями мочевыводящих путей, принимающих «А-бактерин» перорально, аэрококки обнаруживались в моче, причем их количество было стабильно низким, что говорило именно о переносе аэрококков, а не об их размножении в этих органах [15]. Аэрококки и наиболее распространенные возбудители урологических инфекций относятся к совершенно разным группам бактерий, а значит, чувствительны к разным бактериофагам. Это открывает интересные перспективы для создания комплексного препарата, например, на основе А. viridans и фагов, поражающих кишечные бактерии [16]. Такие разработки ведутся на кафедре микробиологии Днепропетровской медицинской академии, однако они пока не вышли за стадию лабораторного исследования.
Статья написана при участии Юргель Л.Г. и Кременчуцкого Г.Н.
От редакции
Редакция «Биомолекулы» обращает внимание читателей на то, что авторы статей из номинации «Своя работа» делятся важными и интересными деталями своих исследований, приводят собственный взгляд на ситуацию в своей отрасли. Коллектив же «Биомолекулы» не считает, что вопрос о целесообразности применения пробиотиков уже решен.
Результаты исследований подобных веществ, какими бы потрясающими они ни были, должны подтверждаться соответствующим образом: препарат должен пройти необходимые фазы клинических испытаний, чтобы медицинское сообщество могло признать его безопасным и эффективным лекарственным средством, и лишь после этого рекомендовать пациентам. Естественно, речь идет об испытаниях по международным нормам, а не так, как это иногда у нас бывает — на 12 пациентах сельского лазарета, заявивших, что им ну-просто-жуть-как-помогло. Неплохим ориентиром для врачей и пациентов было бы одобрение каких-либо пробиотических препаратов, например, американским FDA, но увы…
Пока же принимаемые внутрь пробиотики следует рассматривать не как лекарства, а как пищевые добавки. Причем заявленные производителем свойства препарата нельзя переносить на другие пробиотики: критичны штамм (не род и даже не вид) и количество колониеобразующих единиц. А еще нужно иметь в виду, что на такую продукцию влияет множество факторов, связанных с производством, условиями и сроками хранения, употреблением и пищеварением.
Крупнейшие контролирующие питание и лечение организации мира считают: пока не достаточно доказательств для утверждения, что пробиотики положительно влияют на здоровье (тем более всех поголовно, вне зависимости от исходного состояния этого самого здоровья). И не то чтобы контролеры были убеждены в неэффективности этих препаратов — просто, как правило, в проведенных медисследованиях они не усматривают достоверной причинно-следственной связи приема пробиотиков с позитивными изменениями. А еще стоит помнить о тех исследованиях, где какой-то пробиотик оказывался неэффективным или даже влиял отрицательно.
Так или иначе, потенциал у пробиотического направления есть — как минимум в профилактике и лечении разных энтеритов (если речь идет о пероральном приеме). Просто не всё так просто. Не так просто, как хотелось бы производителю, врачу и пациенту. Наверное, пробиотики на полках наших магазинов и аптек просто «родились немного недоношенными». Так что ждем от ученых-разработчиков и производителей убойных доказательств. А авторам статьи пожелаем успехов на этом нелегком поприще и, конечно, в поиске новых интересных свойств микроорганизмов.
- Кременчуцкий Г.Н., Рыженко С.А., Волянский А.Ю., Молчанов Р.Н., Чуйко В.И. А-бактерин в лечении и профилактике гнойно—воспалительных процессов. Днепропетровск: Пороги, 2000. — 150 с.;
- Vanbelle M., Teller E., Focant M. (1990). Probiotics in animal nutrition: a review. Arch. Tierernahr. 40 (7), 543–567;
- Риженко С.А., Кременчуцький Г.М., Бредихіна М.О. (2008). Вплив рідкого пробіотику «А-бактерину» на мікробіоту кишечника. Медичні перспективи. 2, 47–50;
- Акилов О.А. (2000). Современные методы лечения кандидоза. Сайт «Русский Медицинский Сервер».;
- Edwards J.E. Jr., Bodey G.P., Bowden R.A., Büchner T., de Pauw B.E., Filler S.G. et al. (1997). International conference for development of consensus on the management and prevention of severe candidal infections. Clin. lnfect. Dis. 25, 43–59;
- Antoniskis D., Larsen R.A., Akil B., Rarick M.U., Leedom J.M. (1990). Seronegative disseminated Coccidioidomycosis in patients with HIV infection. AIDS. 4, 691–693;
- Jones J.L., Fleming P.L., Ciesielski C.A., Hu D.J., Kaplan J.E., Ward J.W. (1995). Coccidioidomycosis among persons with AIDS in the United States. J. Infect. Dis. 171, 961–966;
- Степанский Д.А., Рыженко С.А., Кременчуцкий Г.Н., Шарун О.В., Юргель Л.Г., Крушинская Т.Ю., Кошевая И.П. (2012). Неоксидные компоненты антагонистической активности аэрококков (НКА). Аннали Мечниковського інституту. 4, 9–10;
- Ардатская М.Д. (2011). Пре- и пробиотики в коррекции микроэкологических нарушений кишечника. Фарматека. 12, 62–68;
- Бехтерева М.К., Иванова В.В. (2014). Место бактериофагов в терапии инфекционных заболеваний желудочно-кишечного тракта. Педиатрия. 2, 24–29;
- Григорьева Г.И., Гордеева И.В., Кульчицкая М.А., Аникина Т.А. (2006). Эффективное применение биологических препаратов (пробиотики и бактериофаги) при лечении коров с острым течением эндометрита. Ветеринарная патология. 1, 52–56;
- Бондаренко В.М. (2013). Механизмы транслокации бактериальной аутофлоры в развитии эндогенной инфекции. Бюллетень оренбургского научного центра УРО РАН (электронный журнал). 3;
- Кременчуцкий Г.Н., Рыженко С.А., Юргель Л.Г. (2008). Явление транслокации E.coli (Hem+, Strr). Труды XVI Международной конференции «Новые информационные технологии в медицине, биологии, фармакологии, экологии». 250–251;
- Кутовий А.Б., Василишин Р.Й., Мешалов В.Д., Кременчуцкий Г.Н. (2002). Ентерально органа транслокація бактерій і генералізація інфекційного процесу в експерименті. Вісник наукових досліджень. 2, 121–123;
- Шарун А.В., Нікуліна О.О., Кременчуцький Г.М. (2005). Порівняльний аналіз біологічних властивостей аерококів, виділених із різних екологічних ніш організму людини. Медичні перспективи. 3, 72–78;
- Зимин А.А., Васильева Е.А., Васильева Е.Л., Фишман К.С., Скобликов Н.Э., Кременчуцкий Г.Н., Мурашев А.Н. (2009). Биобезопасность в фаговой и пробиотической терапии: проблемы и решения. Вестник новых медицинских технологий. 1, 200–202..
Лекарственные средства на основе бактериальных лизатов // Фармакология
Преферанская Нина Германовна
Доцент кафедры фармакологии фармацевтического факультета Первого МГМУ им. И.М. Сеченова, к.фарм.н.
При неблагоприятных условиях «входные ворота» макроорганизма начинают пропускать различные патогены. Патогенные микроорганизмы попадают в организм и сталкиваются с различными физическими и механическими препятствиями. Макроорганизм в ответ на проникновение микроорганизмов и их болезнетворное воздействие мобилизует все присущие ему первоначально неспецифические, а затем и специфические факторы защиты.
В связи с ростом резистентности микрофлоры, новым подходом в фармакотерапии при наиболее часто возникающих инфекционных заболеваниях является применение нового класса препаратов на основе бактериальных лизатов. Бактериальные лизаты обладают высокой эффективностью и безопасностью. В большинстве случаев при местном применении этих препаратов наступаетполное освобождение от опасных для организма микроорганизмов. Действие препаратов на основе бактериальных лизатов направлено не только на уничтожение микроорганизмов и токсичных продуктов их жизнедеятельности, но и на восстановление и активацию мощного иммунного ответа. Действие лизатов бактерий осуществляется через полиморфноядерные лимфоциты, обладающие ценной способностью распознавать чужеродный материал; через В–лимфоциты, участвующие в выработке антител; через дендритные клетки, продуцирующие преимущественно цитокины и выполняющие важные иммунорегуляторные функции, а также естественные киллеры и мононуклеарные фагоциты, уничтожающие большую часть попавших в организм патогенных агентов.
Препараты бактериальных лизатов чаще всего относят к иммунокорректорам микробного происхождения, которые представляют собой патоген–ассоциированный молекулярный агент, приводящий к каскаду местных иммунных реакций и стимулирующий иммунный ответ через распознающие рецепторы. Лизаты бактерий содержат раздробленные убитые бактерии. При их применении в организме больного суммируется продукция иммуномодуляторов, формируется качественно новый стойкий иммунитет. Спустя две недели применения на лизаты основных штаммов возбудителей иммунологическая память закрепляется до полугода, поэтому препараты применяют курсами 2 раза в год. Бактериальные лизаты чаще всего классифицируют по фармакотерапевтическому признаку на препараты, применяемые:
- в отоларингологии и стоматологии — ИРС19, Имудон, Исмижен;
- в пульмонологии — Бронхо–мунал, Бронхо–ваксом, Рибомунил;
- в урологии — Уро–ваксом;
- в гинекологии — Флорагин;
- в проктологии — Пастеризан, Пастеризан форте;
- в дерматологии — Актинолизат.
БАКТЕРИАЛЬНЫЕ ЛИЗАТЫ ПРИ ИНФЕКЦИЯХ В ОТОРИНОЛАРИНГОЛОГИИ И СТОМАТОЛОГИИ
ИРС 19 — иммуностимулирующий респираторный спрей на основе 19 бактериальных лизатов (Streptococcus pneumoniae type I, Streptococcus pneumoniae type II, Streptococcus pneumoniae type III, Streptococcus pneumoniae type V, Streptococcus pneumoniae type VIII, Streptococcus pneumoniae type XII, Haemophilus influenzae type B, Klebsiella pneumoniae ss pneumoniae, Staphylococcus aureus ss aureus, Acinetobacter calcoaceticus, Moraxella catarrhalis, Neisseria subflava, Neisseria perflava, Streptococcus pyogenes group A, Streptococcus dysgalactiae group C, Streptococcus group G, Enterococcus faecium, Enterococcus faecalis).
При применении различных типов стрептококка, стафилококка, энтерококка, клебсиеллы, моракселлы, гемофильной палочки, содержащихся в ИРС 19, повышается неспецифический и специфический иммунитет. Неспецифическая иммунозащита проявляется в повышении фагоцитарной активности макрофагов, увеличении содержания лизоцима. Протеолитический фермент лизоцим синтезируется макрофагами, нейтрофилами и другими фагоцитирующими клетками и постоянно поступает в жидкости и ткани организма (кровь, лимфу, слизистые). Лизоцим разрушает гликопротеиды (мурамилдипептид) клеточной стенки бактерий, это приводит к лизису и активируется фагоцитоз поврежденных клеток. Специфическая защита обусловлена локально образующимися антителами класса иммуноглобулинов типа А (IgA). Образование антител активирует лизоцим.
Около 60% всех IgA содержится в секретах слизистых и существует в двух формах — в сывороточной и секреторной. Сывороточный IgA обладает высокой аффинностью, обеспечивает нейтрализацию, опсонизацию и маркирование антигена, осуществляет запуск антителозависимой клеточно–опосредованной цитотоксичности. Сывороточный IgA не связывает комплемент.
Секреторная форма IgA в сыворотке крови не обнаруживается и является основным фактором местного специфического гуморального иммунитета. Секреторный IgA препятствует адгезии (прилипанию) микроорганизмов на эпителиальных клетках, их размножению и генерализации (распространение по всему макроорганизму) инфекции в пределах слизистой.
ИРС 19 содержит штаммы возбудителей наиболее часто возникающих заболеваний в отоларингологии и стоматологии. Применение препарата увеличивает локально образующиеся секретируемые антитела класса А (IgA), стимулирует фагоцитарную активность макрофагов, повышает выделение лизоцима, увеличивает уровень опсонинов, пропердина и активирует индукцию эндогенного интерферона. На поверхности слизистой оболочки образуется защитная пленка.
Применяется ИРС 19 для лечения и профилактики острых и хронических заболеваний верхних дыхательных путей и бронхов, таких как ринит, синусит, ларингит, фарингит, тонзиллит, трахеит, бронхит и др.; для восстановления местного иммунитета после перенесенного гриппа или других вирусных инфекций; при подготовке к плановому оперативному вмешательству на ЛОР–органах и в послеоперационный период.
Для лечения острых и хронических заболеваний верхних дыхательных путей и бронхов применяют взрослым и детям старше 3 лет — по 1 дозе препарата в каждый носовой ход 2–5 раз в день; детям в возрасте от 3 месяцев до 3 лет (после предварительного освобождения от слизистого отделяемого) — по 1 дозе препарата в каждый носовой ход 2 раза в день. Лечение проводят до исчезновения симптомов инфекции. Для профилактики взрослым и детям с 3–месячного возраста за 2–3 недели до ожидаемого подъема заболеваемости — по 1 дозе препарата в каждый носовой ход 2 раза в день в течение 2 недель.
Применяют препарат исключительно местно, вводят интраназально, путем аэрозольного введения 1 дозы (1 доза = 1 короткое нажатие пульверизатора). При распылении нужно держать флакон в вертикальном положении и не запрокидывать голову. При распылении ИРС 19 образуется мелкодисперсный аэрозоль, который покрывает слизистую оболочку носа, что приводит к быстрому развитию местного иммунного ответа.
Фармакологический эффект наступает через час после распыления препарата, длительность действия 3–4 месяца. Использование препарата ИРС 19 позволяет снизить частоту заболеваемости до пяти раз, возникновение обострений и рецидивов болезни, ее хронизацию, что приводит к нормальной жизнедеятельности, повышает работоспособность и значительно улучшает качество жизни больных. Хороший профилактический эффект наступает при использовании препарата несколько раз в год, в зависимости от частоты возникновения эпидемии [греч. epidemia — повальная болезнь / epi — на, среди; demos — народ].
Важно! В начале лечения могут иметь место такие реакции, как чиханье и усиление выделений из носа. Как правило, они носят кратковременный характер. Если эти реакции примут тяжелое течение, следует уменьшить кратность введения препарата или отменить его.
При применении могут возникать аллергические реакции: редко — крапивница, ангионевротический отек, в начале лечения — ринофарингит, синусит, ларингит, бронхит, тошнота, рвота, боль в животе, диарея, редко — приступы астмы и кашель, повышение температуры тела (> 39°С) без видимых причин. В случае появления клинических симптомов бактериальной инфекции следует рассмотреть целесообразность назначения системных антибиотиков.
В случае если интраназальный спрей не использовался длительное время, то может возникнуть закупорка насадки препарата. В этом случае необходимо сделать несколько нажатий подряд, чтобы жидкость смогла пройти под действием избыточного давления, а при отсутствии эффекта следует опустить насадку на несколько минут в теплую воду.
Имудон — иммуностимулирующий препарат бактериального происхождения, таблетки для рассасывания местного применения в оториноларингологии, стоматологии.
Представляет собой поливалентный антигенный комплекс, в состав которого входят лизаты бактерий, наиболее часто вызывающих воспалительные процессы в полости рта и глотки. Смесь лизатов бактерий – Lactobacillus acidophilus, Lactobacillus delbrueckii ss lactis, Lactobacillus helveticus, Lactobacillus fermentum, Streptococcus pyogenes groupe A, Streptococcus sangius groupe H, Staphylococcus aureus, Enterococcus faecium, Enterococcus faecalis, Klebsiella pneumoniae ss pneumoniae, Fusobacterium nucleatum ss fusiforme, Corynebacterium pseudodiphtheriticum, Candida albicans + вспомогательные вещества.
Препарат активирует фагоцитоз, способствует увеличению количества иммунокомпетентных клеток, повышает выработку лизоцима и интерферона, иммуноглобулина А в слюне.
Применяется для лечения и профилактики поверхностного и глубокого пародонтоза, пародонтита, стоматита, афтозного стоматита, глоссита, эритематозного и язвенного гингивита, инфекции после удаления зубов, имплантации искусственных зубных корней, изъязвления, вызванного зубными протезами, а также при воспалительных и инфекционных заболеваниях ротовой полости и глотки, фарингита, ангины, хронического тонзиллита, предоперационной подготовки и в послеоперационный период после тонзиллэктомии, дисбактериоза полости рта.
При острых воспалительных заболеваниях полости рта и глотки, в случае обострения хронических заболеваний — по 8 таблеток в день. Таблетки рассасывают (не разжевывая) в ротовой полости с интервалом в 1–2 часа. Средняя продолжительность курса лечения — 10 дней. Для профилактики хронических воспалительных заболеваний полости рта и глотки – по 6 таблеток в день. Продолжительность курса — 20 дней.
Детям в возрасте от 3 до 14 лет при лечении острых и обострении хронических воспалительных заболеваний полости рта и глотки препарат назначают в дозе 6 таблеток в сутки. Дети в возрасте от 3 до 6 лет должны рассасывать таблетки под наблюдением взрослых. Рекомендуется проводить профилактические курсы 3–4 раза в год. Не следует принимать пищу и воду, а также полоскать рот в течение 1 часа после применения Имудона, чтобы не снижать терапевтическую эффективность препарата.
Важно! При применении могут возникать аллергические реакции: кожная сыпь крапивница, ангионевротический отек; диспептические расстройства: тошнота, рвота, боли в животе; редко — обострение бронхиальной астмы, кашель, геморрагический васкулит, повышение температуры тела.
Исмижен — лиофилизированный бактериальный лизат — Streptococcus viridans, Streptococcus pneumoniae, Streptococcus pyogenes, Staphylococcus aureus, Klebsiella ozaenae, Klebsiella pneumoniae, Neisseria catarrhalis, Haemophilus influenzae. Препарат выпускают в виде таблеток для рассасывания. Лекарство представляет собой иммуностимулятор, который повышает сопротивляемость организма к специфическим и неспецифическим инфекциям, повышая количество секреторных и сывороточных антител. Препарат стимулирует активность гуморального и клеточного иммунитета; а также выработку нейтрофилов, макрофагов, Т–лимфоцитов, В-лимфоцитов, специфических сывороточных IgM, IgG, IgA, адгезию макрофагов на бактериях. В итоге риск заболеть респираторными инфекциями значительно снижается, облегчается течение болезни. У больных, принимающих Исмижен, реже развиваются осложнения. При сочетании с химиотерапией снижается потребность в антибиотиках. Действующее вещество хорошо всасывается в ротовой полости. Назначают для лечения гриппа, ринита, фарингита, ларингита, бронхита и других заболеваний дыхательных путей.
Таблетку необходимо держать в ротовой полости до полного рассасывания. Нельзя в течение получаса после приема таблетки пить, полоскать рот и горло. Для лечения и профилактики принимают по 1 таблетке раз в сутки. Курсовая дозировка устанавливается врачом, как правило, до исчезновения всех симптомов, но не более 10 дней.
Важно! Препарат противопоказан к применению детям до года.
Преферанская Н.Г.
Антибактериальные препараты – 8 групп антибиотиков, список лучших
Антибактериальные препараты – особая группа лекарственных средств. Основная их цель – уничтожение бактериальной инфекции в организме. В соответствии с типом возбудителя подбирается и антибиотик. Многообразие патогенных агентов обуславливает большое количество видов этой группы препаратов.
Группы антибиотиков – классификация
Антибактериальные препараты – это продукты жизнедеятельности (натурального происхождения или синтетические аналоги) живых бактериальных микроорганизмов, которые призваны избирательно подавлять развитие клеток других организмов. Впервые термин «антибиоз» (жизнь против жизни) предложил Пастер, а вещества, реализующие этот процесс, начали именовать антибиотиками. Эта группа включает сотни препаратов, различных по химическому составу и структуре.
Они отличаются также по спектру и механизму работы, однако действие антибиотиков всегда направлено против патогенных микроорганизмов. В соответствии с химическим составом их и объединяют в следующие группы:
- b-лактамы: пенициллины, цефалоспорины, карбопенемы, монолактамы;
- макролиды и группа линкомицина;
- тетрациклины;
- хлорамфениколы;
- аминогликозиды;
- полиены;
- прочие (антибиотики различного химического строения).
Антибактериальные препараты – список
Постоянное изменение патогенных микроорганизмов, устойчивость их к воздействию препаратов требует постоянного совершенствования лекарственных средств. Ученые непрерывно работают над созданием новых антибактериальных средств. В связи с этим список антибиотиков постоянно расширяется. Однако существуют лекарственные средства, которые лучше других зарекомендовали себя в процессе лечения, чаще используются во врачебной практике – лучшие антибиотики по мнению врачей. При этом схожее название антибиотиков совсем не означает их аналогичность.
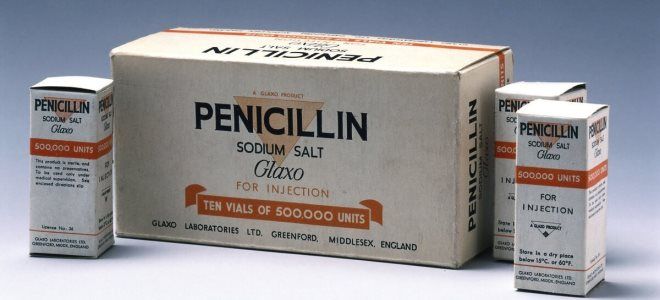
Препараты пенициллины
Пенициллиновая группа антибиотиков – одна из старейших. Входящие в состав препаратов вещества продуцируются многими видами плесени из рода Penicillium. Они обладают эффективностью в отношении большинства грамположительных и некоторых грамотрицательных микроорганизмов. По своему строению это бета-лактамы. Главной особенностью этих соединений является наличие в составе молекулы четырехчленного бета-лактамного кольца.
Такая структура обуславливает уникальные терапевтические свойства пенициллинов, среди которых:
- низкая токсичность;
- редкие побочные эффекты;
- большой диапазон дозировок.
По своему химическому строению современные пенициллины весьма разнообразны. С учетом данной особенности выделяют 6 основных групп пенициллинов:
- Естественные пенициллины: бензилпенициллины, бициллины, феноксиметилпенициллин.
- Изоксазолпенициллины: клоксациллин, оксациллин.
- Амидинопенициллины: амдиноциллин, ацидоциллин.
- Аминопенициллины: ампициллин, амоксициллин.
- Карбоксипенициллины: тикарциллин, карбенициллин.
- Уреидопенициллины: азлоциллин, мезлоциллин.
Препараты макролиды
Антибиотики макролиды – большой класс антибактериальных препаратов. В основе их химической структуры находится макроциклическое лактонное кольцо. Оно и обуславливает частично антибактериальный эффект макролидов: нарушение синтеза белка на рибосомах клетки патогенных микроорганизмов. В результате таких изменений наблюдается выраженный бактериостатический эффект – торможение развития бактерий.
Некоторые из этих лекарств именуются антибактериальными препаратами обладающими антихеликобактерной активностью (Омепразол). Кроме антибактериального действия, макролиды обладают:
- иммуномодулирующей активностью;
- противовоспалительным действием.
Макролиды относятся к группе малотоксичных антибиотиков, поэтому часто применяются в клинической практике. Они показывают высокую эффективность в отношении грамположительных кокков, внутриклеточных форм бактерий:
Для лечения врачами используются различные типы макролидов:
- 14-членные – Эритромицин, Кларитромицин;
- 15-членные – Азитромицин;
- 16-членные – Мидекамицин, Джозамицин.
Антибиотики цефалоспорины

Цефалоспориновая группа является одним из самых обширных классов антибактериальных средств. Высокая их эффективность и низкая токсичность обуславливают частую применяемость. Среди основных свойств цефалоспоринов необходимо выделить:
- выраженное бактерицидное действие;
- широкий терапевтический диапазон;
- синергизм с аминогликозидами;
- разрушаются β-лактамазами расширенного спектра.
Чтобы разграничивать большое количество лекарственных средств этой группы, нередко медики разделяют их на пероральные и парентеральные (по преимущественной активности). Однако большее распространение получила классификация цефалоспоринов по поколениям. Она отражает не только историю совершенствования этой группы лекарственных средств, но и степень их эффективности.
I поколение | II поколение | III поколение | IV поколение |
Парентеральные | |||
Цефалотин Цефазолин | Цефуроксим Цефокситин Цефотетан | Цефотаксим Цефтриаксон Цефоперазон сульбактам | Цефепим Цефпиром |
Пероральные | |||
Цефалексин Цефадроксил | Цефаклор Цефуроксимаксетил | Цефиксим Цефтибутен | |
Антибиотики фторхинолоны
Если проследить историю развития этой группы антибиотиков, то препараты фторхинолоны длительное время использовались исключительно для лечения инфекций мочевыводящих путей. Однако детальное изучение свойств и механизмов действия этой группы позволило сделать выводы относительно возможности широкого применения фторхинолонов в медицине при лечении системных инфекций. В результате они стали одной из самых динамично развивающихся групп антибактериальных средств. Отчасти это обусловлено и широким спектром действия.
Сейчас в медицинской практике используется 4 поколения фторхинолонов. Усовершенствование этой группы антибиотиков охватило широкий спектр патогенных микроорганизмов. В зависимости от типа бактерии, выраженности симптомов заболевания, состояния больного врачи принимают индивидуально решение о назначении того или иного лекарства.
I поколение – нефторированные | II поколение – «грамотрицательные» | III поколение – «респираторные» | IV поколение – «респираторные» + «антианаэробные» |
Налидиксовая кислота Оксолиновая кислота Пипемидовая кислота | Ципрофлоксацин Норфлоксацин Офлоксацин Пефлоксацин Ломефлоксацин | Спарфлоксацин Левофлоксацин | Моксифлоксацин |
Антибиотики аминогликозиды
Аминогликозиды – группа синтетических и полусинтетических, природных антибиотиков, которые схожи по химическому строению, спектру противомикробной активности. Свое название они получили из-за наличия в молекуле аминосахаридов, которые соединены гликозидной связью и имеют агликоновый фрагмент – гексозу. Количество остатков аминосахаров у разных аминогликозидов разное. За счет этого аминогликозиды – антибактериальные препараты широкого спектра действия.
Аминогликозиды принято различать по спектру действия и механизму возникновения резистентности. Согласно этим факторам, выделяют 4 поколения аминогликозидов:
- 1 поколение: Стрептомицин, Канамицин, Мономицин;
- 2 поколение: Гентамицин;
- 3 поколение: Тобрамицин, Амикацин, Нетилмицин;
- 4 поколение: Изепамицин.
Антибиотики амфениколы
Главным антибиотиком из этой группы препаратов является хлорамфеникол. По своей структуре это продукт жизнедеятельности Streptomyces venezuelae. Стереоизомер, присутствующий в составе, обладает выраженными антибактериальными свойствами. Благодаря данному компоненту, амфениколы – антибактериальные препараты широкого спектра. Они проявляют эффективность в отношении большого количества грамположительных и грамотрицательных микроорганизмов, спирохет и даже некоторых вирусных форм (возбудители пситтакоза, трахомы).
Данные антибактериальные препараты нередко становятся препаратами выбора при неэффективной терапии пенициллинами, сульфаниламидами:
- Синтомицин
- Левомицетин.
Монобактамы и карбапенемы
Антибиотики монобактамы отличаются от других антибактериальных средств сверхшироким спектром действия. К помощи этих лекарств врачи прибегают в тех случаях, когда отмечается отсутствие эффекта от применения других антибиотиков. Нередко их именуют резервными и применяют для терапии тяжелых внутри больничных инфекций. Представителем монобактамов является азтреонам. К карбопенемам, антибиотикам со схожими свойствами, относятся:
- Меропенем;
- Эр-тапенем;
- Имипенем-циластатин.
Бактериофаги – препараты антибактериального действия
Когда пациенту показана антибактериальная терапия, препараты врачи подбирают с учетом возбудителя заболевания. Нередко в современной практике используются бактериофаги – антибактериальные препараты природного происхождения. По сути, это микроорганизмы, которые способны точечно уничтожать только болезнетворные бактерии. Существуют и комбинированные фаги:
- коли-протейный;
- клебсиелл поливалентный;
- Секстафаг (поливалентный).
Использование антибактериальных препаратов

Правильное применение антибиотиков позволяет в несколько раз сократить продолжительность лечения. При назначении препарата широкого спектра действия можно наблюдать снижение показателей смертности при угрожающих жизни инфекциях (сепсис, перитонит). Важное значение имеет соблюдение показаний для применения лекарства, правильный подбор препарата, дозировки и кратности приема лекарственного средства.
Показания для приема антибиотиков
При необходимости назначения медицинских препаратов врачи пользуются рекомендациями ВОЗ. При этом антибиотики распределяют по группам согласно необходимости использования. Данная градация разработана с целью снижения растущей угрозы антибиотикорезистентности в мире, для сохранения эффективности антибактериальных препаратов.
Показания к применению антибиотиков регулярно пересматривают. Среди основных можно выделить:
- инфекции бактериальной этиологии: заболевания верхних дыхательных путей, органов ЖКТ, малого таза;
- воспалительные процессы, сопровождающиеся поражением органов бактериями – антибиотики при воспалении используют как дополнительные препараты.
Антибиотики не используются при:
- острых респираторных инфекциях;
- острых кишечных инфекциях с не выявленным возбудителем;
- лихорадках, лейкоцитозах, бактериальная природа которых не доказана.
Чувствительность к антибактериальным препаратам
Перед назначением препаратов врачи устанавливают чувствительность к антибиотикам. Этот метод помогает подобрать эффективный препарат для лечения в конкретном случае. Определение чувствительности бактерий к антибактериальным препаратам возможно 2 методами:
- Диффузионные: с использованием дисков с антибиотиками и с помощью Е-тестов.
- Методы разведения: в жидкой питательной среде, в агаре.
Прием антибиотиков
Лечение антибиотиками должно инициироваться исключительно врачами. Специалисты определяют необходимость применения, тип препарата и подбирают дозировку лекарства. После того, как установлено какие антибиотики использовать врачи придерживаются определенных правил при лечении:
- Правило соответствия – используют в соответствии с типом возбудителя.
- Правило ограничения – дозировка определяется врачом.
- Правило сочетания – комбинировать можно не все антибиотики.
- Правило длительности – при отсутствии эффекта бактерицидный антибиотик заменяют или отменяют через трое суток, бактериостатический – спустя 5 суток.
Бактериальные препараты — с русского на все языки
Бактериальные удобрения — От наличия клубеньковых бактерий в почве зависит исход естественного заражения бобовых растений. При отсутствии в почве соответствующих видов клубеньковых бактерий бобовые растения развиваются без клубеньков и не выполняют функции… … Биологическая энциклопедия
Бактериальные удобрения — Бактериальные удобрения это препараты, относящиеся к микробиологическим инокулянтам, способствующие улучшению питания растений. Питательных веществ они не содержат; препараты, в которых содержатся полезные для сельскохозяйственных растений… … Википедия
Бактериальные удобрения — препараты, в которых содержатся полезные для с. х. растений почвенные микроорганизмы. При внесении Б.у. в почве усиливаются биохимические процессы и улучшается корневое питание растений. В СССР из Б. у. нашли применение нитрагин,… … Большая советская энциклопедия
бактериальные удобрения — почвоудобрительные препараты, содержащие живые микроорганизмы, переводящие молекулярный азот, органические и трудно усвояемые минеральные вещества в доступную для растений форму. Вносятся в почву путем инфицирования семян непосредственно перед… … Словарь микробиологии
БАКТЕРИАЛЬНЫЕ УДОБРЕНИЯ — препараты (нитрагин культура клубеньковых бактерий, и др.), содержащие полезные для с. х. культур почвенные микроорганизмы. Вносят в почву вместе с семенами … Естествознание. Энциклопедический словарь
БАКТЕРИАЛЬНЫЕ УДОБРЕНИЯ — препараты, содержащие полезные для с. х. р ний почвенные микроорганизмы. При внесении в почву усиливают фиксацию азота (напр., нитрагин), минерализацию её органич. в ва и улучшают корневое питание р ний. Б. у. не могут заменить органич. и минер.… … Сельско-хозяйственный энциклопедический словарь
бактериальные удобрения — препараты (нитрагин культура клубеньковых бактерий, и др.), содержащие полезные для сельскохозяйственных культур почвенные микроорганизмы. Вносят в почву вместе с семенами. * * * БАКТЕРИАЛЬНЫЕ УДОБРЕНИЯ БАКТЕРИАЛЬНЫЕ УДОБРЕНИЯ, препарты… … Энциклопедический словарь
БАКТЕРИАЛЬНЫЕ БОЛЕЗНИ ЖИВОТНЫХ — бактериозы, болезни ж ных, вызываемые бактериями. Возбудителями Б. б. ж. могут быть неспорообразующие бактерии кокки (стрептококкозы, стафилококкозы), палочковидные (листериоз, рожа, сальмонеллез), спорообразующие аэробные бактерии бациллы (сиб.… … Сельско-хозяйственный энциклопедический словарь
бактериальные болезни животных — бактериальные болезни животных, бактериозы, болезни животных, вызываемые бактериями. Возбудителями Б. б. ж. могут быть неспорообразующие бактерии кокки (стрептококкозы, стафилококкоэы), палочковидные (листериоз, рожа, сальмонеллёз),… … Сельское хозяйство. Большой энциклопедический словарь
бактериальные удобрения — бактериальные удобрения, препараты, содержащие полезные для сельскохозяйственных растений почвенные микроорганизмы. При внесении в почву усиливают фиксацию азота (например, нитрагин), минерализацию её органического вещества и улучшают корневое… … Сельское хозяйство. Большой энциклопедический словарь
Биологические препараты — Биологические препараты группа медицинских продуктов биологического происхождения, в том числе вакцины, препараты крови, аллергены, соматические клетки, ткани, рекомбинантные белки. В состав биологических препаратов могут входить сахара,… … Википедия
Микробиологические и бактериальные удобрения ⋆ Агрохимия
Уровень потенциального и эффективного плодородия почвы обусловливается интенсивностью и направленностью микробиологических процессов, которые регулируются численностью микроорганизмов.
Микробиологические и бактериальные препараты содержат специфические штаммы микроорганизмов, под действием которых в почве активизируются процессы превращений соединений, содержащие питательные вещества.
Широкое распространение получили препараты, содержащие штаммы азотфиксирующих бактерий. Интерес к микробиологической фиксации атмосферного азота обусловлен ролью этого процесса в азотном балансе и его перспективностью как источника азота для обеспечения растущих нужд сельского хозяйства. При этом аргументами выступают его безвредность для человека и окружающей среды при относительно малых затратах энергии на активизацию азотфиксирующих микроорганизмов.
Согласно полевым исследования отечественных и зарубежных ученых, если сельскохозяйственные культуры 10-20% своей потребности в азоте будут покрывать за счет азотфиксации, то приём инокуляции внесет значительный вклад в азотный баланс.
Препаративные формы микробных удобрений бывают: жидкие, гранулированные, гелеобразные, сыпучие.
Страны производители бактериальных удобрений и объёмы производства:
- США — 20 млн га/порций ежегодно;
- Канада — 2,5 млн га/порций ежегодно;
- Австрия — 6-9 млн га/порций ежегодно;
- Бразилия — 4-6 млн га/порций ежегодно;
- Индия — 2-4 млн га/порций ежегодно;
- Аргентина — 2-3 млн га/порций ежегодно;
- Уругвай — 1-2 млн га/порций ежегодно;
- Россия — 0,3 млн га/порций ежегодно.
Предпосевная обработка семян бактериальными удобрениями может проводиться с применением прилипателя, так и без него. В качестве прилипателя используется 2,0%-й водный раствор NaKМЦ.
Бактериальные удобрения хранят в сухих помещениях, защищенных от осадков и прямых солнечных лучей, температура хранения от 0 до + 4 °С. Срок годности зависит от вида и формы бактериальных удобрений.
В мировой практике внимание уделяется роли почвенной биоты в улучшении фосфорного питания растений.
Биологические препараты — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 сентября 2017; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 сентября 2017; проверки требуют 4 правки.Биологические препараты — группа медицинских продуктов биологического происхождения, в том числе вакцины, препараты крови, аллергены, соматические клетки, ткани, рекомбинантные белки (в том числе антитела).
В состав биологических препаратов могут входить сахара, белки, нуклеиновые кислоты или сложные комбинации этих веществ; биологические препараты могут представлять собой биологические объекты — например, клетки, ткани или фекалии. Биологические препараты получают из различных природных источников — животных, микроорганизмов, также биологические препараты могут быть синтезированы методами биотехнологии. Активно исследуется потенциал медицинского применения клеточных и генных биологических препаратов для лечения многих заболеваний, неизлечимых в настоящий момент[1].
Значение средств биологического и биофармацевтического происхождения[править | править код]
Эту группу выделяют в связи со значительным экономическим и общественным значением входящих в неё препаратов. Так, в 2008 г. оборот денежных средств при производстве и реализации препаратов этой группы достиг суммы 65,2 миллиарда долларов США. Препараты этой группы применяются для лечения и профилактики массовых тяжелых эндокринных и онкологических заболеваний.
Эту группу препаратов изучает биофармакология. Не существует единства в употреблении термина «биологические препараты». Представители прессы и деловые круги содержание этого термина сужают до препаратов, полученных с помощью биологических процессов, вовлекающих рекомбинантную ДНК-технологию. Между тем исторически термин «биологические препараты» также включал вакцины, донорскую кровь и препараты крови, в том числе, иммунные сыворотки, иммуноглобулины, анатоксины, диагностические и лечебные аллергены, соматические клетки, генную терапию, донорские ткани и рекомбинантные лечебные белки.
Средства биологического и биофармацевтического происхождения, применяемые в лечебных и профилактических целях, выделяют из большого числа источников человеческого, животного и микробного происхождения, получают с использованием живых биологических систем, тканей организмов и их производных, с использованием средств биотехнологии. Их применяют для лечения гематологических, эндокринных, онкологических заболеваний, заболеваний мочеполовой, костно-мышечной систем, и противомикробных препаратов. Среди них факторы крови, тромболитические агенты, гормоны, гемопоэтические факторы роста, интерфероны, интерлейкины, вакцины, моноклональные антитела, факторы некроза опухоли, терапевтические ферменты.
Отношение к Анатомо-терапевтическо-химической классификации[править | править код]
Известные в настоящее время биологические и биофармацевтические средства, представляющие интерес биофармакологии, распределены по семи из четырнадцати основных анатомических групп Анатомо-терапевтическо-химической классификации (см. таблицу).
Биологические препараты на основе бактерий и других видов микробов состоят из живых или убитых микроорганизмов, отдельных их компонентов, специфических иммуноглобулинов, сывороток или их фракций; применяются также для профилактики, диагностики и лечения инфекционных болезней и являются объектом изучения иммунологии, микробиологии и эпидемиологии. В интересах этих трех отраслей медицины среди них различают профилактические, лечебные и диагностические препараты.
- К профилактическим препаратам относят вакцины и анатоксины, применяемые для иммунизации и выработки соответственного активного антимикробного или антитоксического иммунитета.
- Лечебные препараты в виде иммуноглобулинов и в прошлом иммунных сывороток используют для создания пассивного антимикробного или антитоксического иммунитета. Важное место занимают препараты, содержащие представителей нормальной микрофлоры организма с усиленными антагонистическими свойствами или (и) повышенной колонизирующей активностью, то есть способностью приживления в организме, что приводит к подавлению развития патогенной и условно-патогенной микрофлоры(колибактерин, бифидумбактерин, препараты лактобацилл).
- Диагностические препараты применяют при оценке иммунного статуса организма: иммунные сыворотки используют для установления класса иммуноглобулинов, определения компонентов комплемента, для постановки аллергических диагностических проб, диагностикумы в виде взвеси убитых бактерий или антигенов, адсорбированных на носителях) используют для проведения серологических исследований и определения антител в сыворотке крови больных. К диагностическим препаратам относятся также бактериофаги и диагностические иммунные сыворотки для идентификации микроорганизмов с помощью различных реакций иммунитета.
| Основная анатомическая группа | Терапевтическо-фармакологическая группа | Группа препарата |
|---|---|---|
| A. Биопрепараты, применяемые при заболеваниях пищеварительного тракта и обмена веществ | Лечение сахарного диабета | Инсулин |
| Ферментные препараты | Панкреатин | |
| Бактериальные препараты | Бифиформ, Лактобактерин, Бифидумбактерин | |
| B. Биопрепараты, применяемые при нарушениях кроветворения и крови | Гемостатические препараты | Фактор свертывания VIII,Фактор свертывания IX |
| Антикоагулянты | Активатор тканевого плазминогена | |
| Стимуляторы эритропоэза | Эритропоэтин | |
| G. Биопрепараты, применяемые в нефрологии и урологии | Гонадотропины | Гонадотропин |
| H. Биопрепараты с гормональной активностью для системного применения | Гормоны, расщепляющие гликоген | Глюкагон |
| Гормоны передней доли гипофиза | Генотропин | |
| J. Противомикробные биопрепараты для системного применения | Вакцины | Вакцины против гепатитов A, В, кори, гриппа, Вакцина против вируса папилломы человека и др |
| Иммуноглобулины | Анти-Д-иммуноглобулин и др. | |
| L. Биопрепараты, применяемые в онкологии и иммунологии | Цитокины и иммуномодуляторы | Колоние-стимулирующие факторы, фактор некроза опухоли |
| Интерфероны | Интерфероны | |
| Интерлейкины | Интерлейкины | |
| Иммунодепрессанты | Моноклональные антитела | |
| M. Биопрепараты, применяемые при заболеваниях костно-мышечной системы | Ревматоидный артрит | — |
- ↑ Center for Biologics Evaluation and Research. What is a biological product? (неопр.) (недоступная ссылка). U.S. Food and Drug Administration (29 октября 2007). Дата обращения 17 декабря 2007. Архивировано 8 ноября 2004 года.
- Brisk Fox Financial «Biopharmaceutical sector sees rising R&D despite credit crunch, finds analysis».
- Бактериальные препараты. Краткая медицинская энциклопедия., М., Совет. Энцикл., 1989.
Самые сильные природные антибиотики | Азбука здоровья


- Рубрики:
- Здоровье и профилактика,
- Лечение травами
Каждый день наш организм встречается с огромным множеством микроорганизмов, многие из них не так уж безобидны. Вирусы и патогенные бактерии способны вызвать серьезные заболевания, в особенности когда иммунитет человека снижен. Организму требуется помощь в борьбе с «незваными гостями», которую окажут природные антибиотики.
У многих лекарственных средств природного происхождения имеются антибиотические свойства, но у кого-то их больше, у кого-то меньше. Как и у синтетических медикаментов, у природных средств есть свой спектр действия. Сегодня мы рассмотрим самые сильные природные антибиотики.
Спектр антибактериального действия лекарственных природных растений и меда
По исследованиям Института охраны материнства и детства г. Хабаровск, руководитель к.м.н. Г.Н. Холодок
- Тысячелистник. Трава тысячелистника бактериостатически действует (то есть подавляет размножение) на белый стафилококк, протей, энтеробактерии. На кишечную палочку действует и бактерицидно (т.е. убивает), и бактериостатически. Слабо действует на гемолитический стрептококк.
- Полынь горькая. Трава полыни горькой действует аналогично тысячелистнику, кроме того подавляет размножение синегнойной палочки. Но в отличие от тысячелистника не действует