Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
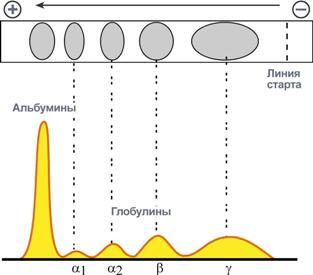
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
Общий белок | взрослые | 65-85 г/л |
дети 1-3 года | 55-85 г/л | |
Белковые фракции | ||
Альбумины | 50-70 % | 30-50 г/л |
α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
β-Глобулины | 8-18 % | 7-11 г/л |
γ-Глобулины | 15-25 % | 8-16 г/л |
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В
течение первых месяцев жизни
концентрация глобулиновых
фракций низка,
что приводит к относительной
гиперальбуминемии до 66-76%. В периоде
между 2-м и 12-м месяцами концентрация
α
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы | Альбумины | Фракции глобулинов | Примеры заболеваний | ||||
| α1 | α2 | β | γ | ||||
Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда | |
Хронические воспаления | ↓ | — | — | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит | ||
Нарушения почечного фильтра | ↓↓ | — | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии | |
Злокачественные опухоли | ↓↓ | ↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли | |
Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы | |
Некроз печени | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов | ||
Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы | |
α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы | |
β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема | |
γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы | |
1. Электрофорезом называют движение заряженных частиц в растворе под действием электрического поля.
Электрофоретический метод в биохимии – это способ пространственного разделения молекул, имеющих разный заряд и размеры, путем помещения их в электрическое поле.
Результатом проведения электрофореза является электрофореграмма — картина, полученная после разделения сложной смеси с помощьюmэлектрофореза и специфического проявления. Электрофореграмма белков биологических жидкостей человека (сыворотка крови, моча, спинномозговая жидкость и др.) позволяет врачам получить значительную диагностическую информацию.
Классификация электрофоретических методов
Основными типами электрофореза являются:
— зональный электрофорез,
— изотахофорез,
— иммуноэлектрофорез.
Зональный электрофорез ведется при постоянном (не изменяющемся) значении рН буферного раствора, заполняющего данный носитель (бумагу, гель, др.). Исследуемый образец наносится пятном или тонким слоем на носитель, по которому и перемещается в электрическом поле. Усложненным вариантом зонального электрофореза является диск-электрофорез (многофазный зональный электрофорез), при котором рН и другие характеристики, постоянные внутри одной “фазы”, при переходе к другой “фазе” скачкообразно изменяются.
При изоэлектрическом фокусировании в среде для электрофореза создается плавный градиент рН. Белок останавливается в зоне, где значение рН равно его изоэлектрической точке (pI). Для создания градиента рН обычно используют раствор полиамино-поликарбоновых кислот, которым насыщают носитель. В отсутствии электрического поля эта смесь обычно имеет рН=6,5. При наложении электрического поля указанные кислоты обеспечивают линейный градиент рН от 3 до 10.
В случае изотахофореза заряженные ионы сначала разделяются в соответствии с величинами их заряда и подвижности, а затем перемещаются в электрическом поле с одинаковыми и постоянными скоростями.
Иммуноэлектрофорез сочетает в себе электрофоретическое разделение белков с иммунопреципитацией, основанной на реакции “антиген – антитело”. Этот тип электрофореза превосходит остальные по чувствительности и разрешающей способности.
По цели различают:
— аналитический (для анализа состава смеси, реже – для получения малых количеств разделяемых веществ) электрофорез,
— препаративный (для получения препаратов — значительных количеств чистых веществ) электрофорез.
По степени денатурации разделяемых белков различают
— нативный электрофорез,
— электрофорез в денатурирующих условиях.
В отличие от нативного электрофореза, электрофорез в денатурирующих условиях предполагает применение химических реагентов, разрушающих пространственную структуру разделяемых белков.
По направлению фракционирования выделяют электрофорез, при котором белки движутся в одном направлении, и двумерный электрофорез, при котором сначала проводят разделение в одном направлении, а затем – в направлении, перпендикулярном первому. Двумерный электрофорез позволяет резко увеличить разрешающую способность при разделении смесей, состоящих
из большого количества разных белков.
В зависимости от ориентации носителя (геля, бумаги, др.) электрофорез может быть вертикальным или горизонтальным.
Большая Энциклопедия Нефти и Газа, статья, страница 4
Электрофореграмма
Cтраница 4
После окраски на электрофореграмме появляются 4 пятна, соответствующие альбумину, а -, р — у-глобулинам. Часто альфа-глобулин можно разделить на, а — и а2 — глобулины; реже на две фракции подразделяются р-глобулины. При рН 8 6 все эти белки в электрическом поле движутся по направлению к аноду, так как они в этих условиях обладают отрицательным зарядом. Быстрее всего движутся альбумины, затем а-глобулины, за ними Р — глобулины и, наконец, у-глобулины. Несмотря на то, что все белки движутся к аноду, после окраски у-глобулины оказываются на месте нанесения капли сыворотки или даже сдвинуты в сторону катода. Это объясняется тем, что во время электрофореза в бумаге происходит непрерывный ток жидкости от анода к катоду, который относит белки в сторону катода. Этот так называемый электроосмотический ток зависит от сорта бумаги, рН буферного раствора и напряжения, при котором производится электрофорез. Можно установить величину этого тока с помощью декстрана ( полисахарид), движение которого при рН барбиталового буфера обуславливается только электроосмотическим током. Его наносят на соседнюю полоску, и для определенных сортов бумаги его движение и движение альбумина находятся в постоянном соотношении. [46]
Большинство элементов на электрофореграмме локализуется при использовании соответствующих реагентов. При проявлении зоны различных элементов выявляются в виде окрашенных пятен или полос. Для количественного определения проводят элюирование определяемого иона или фотометрирование зоны на фореграмме. [47]
Положение олигонуклеотида на двумерной электрофореграмме определяется в основном его составом. [48]
Количество вещества на электрофореграммах определяют так же, как и нйхроматогра ммах: колориметрические помощью ФЭКа или же денситометром с вычислением площади планиметром. [49]
При 120 и 150 электрофореграмма обнаруживает образованй еще одного катиона, который появляется соответственно через 4 и 10 минут после начала нагревания. [50]
При 120 и 150 электрофореграмма обнаруживает образование еще одного катиона, который появляется соответственно через 40 и 10 минут после начала нагревания. [51]
На рисунке 27 приведены электрофореграммы, полученные в аммиачных растворах ОЭДТА и НТА; разделение в растворах ЭДТА и ДЦТА нечеткое. [53]
Восходящая и нисходящая части электрофореграммы не симметричны. Границы обычно острее на восходящей стороне. Не совпадают также и площади под соответствующими пиками. Причина этих явлений понятна из рассмотренного выше примера. Очевидно, что определение состава белковой смеси по электро-фореграмме будет неточным, так как на границах меняется одновременно концентрация всех компонентов, включая концентрацию буферных солей, и каждый из них вносит вклад в изменение показателя преломления на границе. Очевидно также, что точно определить подвижность можно в общем случае только для самого быстрого компонента смеси на нисходящей стороне, подставив в уравнение ( 9) значение электропроводности исходного белкового раствора. Все остальные подвижности можно определить лишь приблизительно, так как электропроводность раствора в областях между границами точно не известна. [54]
В этих приборах передвижение электрофореграммы, регистрация экстинкции и обсчет полученной кривой производятся автоматически. [55]
В аналитическом варианте метода высушенную электрофореграмму погружают в 0 5 % — ный ацетон-нингидриновый или кадмий-нингидриновый раствор ( см. стр. [56]
Последовательность непосредственно читается по электрофореграмме. Длина фрагмента, который может быть расшифрован этим методом, ограничивается разрешающей способностью метода гель-электрофореза. [57]
Число линий преципитации на электрофореграмме зависит от используемой иммунной сыворотки. Например, хорошо себя зарекомендовавшая кроличья антисыворотка к белкам сыворотки человека фирмы Behringwerke ( ФРГ) и аналогичная лошадиная антисыворотка института Human ( Венгерская Народная Республика) позволяют идентифицировать примерно 20 белковых фракций сыворотки. Принципиальная возможность приготовления антисыворотки практически к любому белку значительно увеличивает применимость иммуноэлектрофореза. Кроме того, приготовив антисыворотки, специфичные к какому-либо одному-единственному белку ( или небольшому числу белков), можно в смеси белков исследовать составляющие ее отдельные компоненты. Иммунные сыворотки, предназначенные для иммунохимического анализа отдельных белков плазмы человека, уже имеются в продаже. [58]
Различные методики окрашивания фиксированных нагреванием электрофореграмм позволяют не только выявить, но и количественно измерить различные белковые фракции. Кроме методик окрашивания белка, существуют также способы окрашивания липидных и углеводных компонентов липопротеидов и гликопротеидов. [59]
Страницы: 1 2 3 4
Капиллярный электрофорез — это… Что такое Капиллярный электрофорез?
Капиллярный электрофорез, известный также как капиллярный зональный электрофорез (англ. CZE), используется для разделения ионов по заряду. В случае обычного электрофореза заряженные молекулы перемещаются в проводящей жидкости под действием электрического поля. В 1960х годах была предложена методика капиллярного электрофореза для разделения молекул по заряду и размеру в тонком капилляре, заполненном электролитом.
Оборудование
Для проведения капиллярного электрофореза требуется относительно простое оборудование. Схема эксперимента представлена на рисунке 1. Основные компоненты системы — флакон для нанесения образца, стартовый флакон, конечный флакон, капилляр, электроды, мощный источник питания, детектор и устройство обработки данных. Флакон для нанесения образца, стартовый и конечный флаконы заполнены электролитом, например, водным буферным раствором. Для нанесения образца конец капилляра опускают в флакон с образцом и затем перемещают в стартовый флакон. Перемещение анализируемых веществ осуществляется под действием электрического поля, которые прилагают между стартовым и конечным флаконами. Все ионы передвигаются по капилляру в одном направлении под действием электроосмотического тока. Анализируемые вещества разделяются по электрофоретической мобильности и детектируются около конца капилляра.[1]
Рисунок 1: Система проведения капиллярного электрофореза
Детектирование
Детектирование разделившихся молекул при капиллярном электрофорезе может осуществляться различными устройствами. Наиболее распространенные приборы детектируют изменение поглощения излучения в ультрафиолетовой области или в области видимого света. Обычно в таких системах в качестве ячейки используют участок капилляра. Длина пути проходящего света при капиллярном электрофорезе составляет порядка 50 микрометров, что намного меньше, чем в случае обычных ультрафиолетовых ячеек, в которых длина пути света порядка 1 сантиметра.
В соответствии с законом Бугера -Ламберта-Бера, чувствительность детектора пропорциональна длине пути, по которому свет проходит через ячейку. Для увеличения чувствительности удлиняют путь, по которому проходит свет, однако при увеличении размеров ячейки снижается разрешение. Капиллярная трубка может быть расширена в месте детектирования, такую разновидность называют пузырьковой ячейкой. В другом варианте увеличение пути проходящего света достигается за счёт добавления дополнительного капилляра (см. рисунок 2). Оба этих метода снижают эффективность разделения.[2]
Рисунок 2: Способы увеличения длины капилляра: a) ячейка с пузырьками и б) z-ячейка (дополнительная трубка).[1]Детектирование путем флуоресценции может быть использовано при капиллярном электрофорезе образцов, имеющих естественную флуоресценцию, или химические модификации, которые вводят флуоресцентные метки. Такой способ детектирования обеспечивает высокую чувствительность, однако не может быть использован для определения нефлуоресцирующих образцов. Также используют детектирование флуоресценции, вызванную лазером, такие системы капиллярного электрофореза могут детектировать в пределах 10−18 — 10−21 моль.
Для того, чтобы отличить сходные образцы, системы разделения капиллярным электрофорезом могут быть напрямую свзяаны с масс-спектрометрами. В большинстве таких систем конец капилляра помещают в прибор для электроаэрозольной ионизации. Ионизированные частицы далее анализируют масс-спектрометрией.[2]
Способы разделения
Молекулы разделяют капиллярным электрофорезом из-за отличий в подвижности в приложенном электрическом поле. Скорость движения () разделяемых молекул в приложенном поле относительно электрода с противоположным зарядом:
где это электрофоретическая подвижность и E — сила электрического поля. Электрофоретическая подвижность пропорциональна заряду иона. В случае, когда образец состоит из двух типов молекул, отличающихся зарядом, в результате электрофореза происходит разделение. Электрофоретическая подвижность вещества при данных значениях рН составляет:
где это удельный заряд молекулы и это радиус Стокса молекулы:
где это постоянная Больцмана, и температура, а D — коэффициент диффузии. Данные уравнения показывают, что электрофоретическая подвижность молекулы пропорциональна заряду и обратно пропорциональна ее радиусу. Электрофоретическая подвижность может быть определена экспериментально по времени движения молекулы в электрическом поле заданной силы:
где это расстояние от точки старта до места детекции, это время, затраченное анализируемой молекулой на достижение точки детекции, напряжение электрического поля, и это общая длина капилляра.[2] Так как электрическое поле действует лишь на заряженные молекулы, незаряженные молекулы слабо разделяются капиллярным электрофорезом.
Скорость перемещения анализируемых молекул при капиллярном электрофорезе зависит от величины электроосмотическго потока в буфере. В общем случае электроосмотический поток направлен по направлению к отрицательно заряженному катоду. Отличающиеся электрофоретическими подвижностями, молекулы двигаются к противоположно заряженному электроду.[1] Отрицательно заряженные частицы двигаются к положительно заряженному аноду, положительно заряженные — к катоду в направлении электроосмотического потока (см. рисунок 3).
Рисунок 3: Разделение заряженных и незаряженных молекул (А) в соответствии с их электрофоретической и электроосмотической подвижностью
Скорость электроосмотического потока может быть представлена в виде:
где это электроосмотическая подвижность, равная:
где это потенциал стенки капилляра, а относительная диэлектрическая проницаемость буферного раствора. Электроосмотическая подвижность может быть определена путем измерения времени задержки нейтрально заряженных молекул.[2] Скорость движения () анализируемой молекулы в электрическом поле может быть представлено в виде:
Ввиду того, что электроосмотический поток буферного раствора обычно больше, чем электрофоретический поток анализируемых веществ, все анализируемые молекулы перемещаются с буферным раствором к катоду. Отрицательно заряженные молекулы дольше задерживаются в капилляре, ввиду противоречий в их электрофоретических подвижностях.[1] Порядок перемещения заряженных молекул представлен на рисунке 3: небольшие катионы перемещаются быстро, малые многократно заряженые анионы сильно задерживаются.[2]
Рисунок 4: Схема внутренней организации капилляра, заполненного силикагелем в присутствии буферного раствора
Эффективность и разрешение
Количество теоретических тарелок, или эффективность разделения в случае капиллярного электрофореза определяется уравнением:
где это количество теоретических тарелок, это кажущаяся подвижность в среде разделения и это коэффициент диффузии разделяемого вещества. В соответствии с этим уравнением эффективность разделения ограничивается только диффузией и является величиной, пропорциональной силе электрического поля. Эффективность разделения путем капиллярного электрофореза, как правило, значительно выше, чем эффективность других методов разделения, например, жидкостная хроматография высокого давления. В отличие от ЖХВД, в случае капиллярного электрофореза не происходит перенос масс между фазами.[2] Профиль потока в случае систем электроосмотического потока является плоским, в отличие от ламинарного профиля хроматографических колонок, в которых разделение происходит под давлением (см. рисунок 5). В результате этого при электроосмотическом разделении не происходит расширения полос, как при хроматографии. Разделение капиллярным электрофорезом может иметь несколько сотен теоретических тарелок.[3]
Рисунок 5: Профили ламинарного и электроосмотического потока
Разрешение () разделения капиллярного электрофореза может быть записано как :
В соответствии с данным уравнением, максимальное разрешение достигается при сходных значениях электрофоретических и электроосмотических подвижностей, но с противоположным знаком. Кроме того, высокое разрешение требует низкой скорости и, соответственно, требует большего времени на разделение.[2]
Родственные методы
Разделение при помощи капиллярного электрофореза основано на различиях в электрофоретических подвижностях разделяемых молекул. Однако, некоторые классы молекул не могут быть разделены, так как являются незаряженными или незначительно отличаются по электрофоретической подвижности. Добавление поверхностно-активных веществ облегчает разделение незаряженных молекул. Заряженные полимеры, например, ДНК, могут быть разделены в капиллярах, заполненных гелем; гель сильнее замедляет более длинные молекулы, чем более короткие. Такой вариант капиллярного электрофореза называют капиллярным гель-электрофорезом. Некоторые системы капиллярного электрофореза могут быть использованы для микромасштабной хроматографии. Также системы капиллярного электрофореза могут быть использованы для изотахофореза, изоэлектрического фокусирования и аффинного электрофореза.
Примечания
- ↑ 1 2 3 4 Skoog, D.A.; Holler, F.J.; Crouch, S.R «Principles of Instrumental Analysis» 6th ed. Thomson Brooks/Cole Publishing: Belmont, CA 2007.
- ↑ 1 2 3 4 5 6 7 Skoog, D.A.; Holler, F.J.; Crouch, S.R «Principles of Instrumental Analysis» 6th ed. Chapter 30 Thomson Brooks/Cole Publishing: Belmont, CA 2007.
- ↑ Skoog, D.A.; Holler, F.J.; Nieman, T.A. «Principles of Instrumental Analysis, 5th ed.» Saunders college Publishing: Philadelphia, 1998.
Литература
- Terabe, S.; Otsuka, K.; Ichikawa, K.; Tsuchiya, A.; Ando, T. Anal. Chem. 1984, 56, 111.
- Terabe, S.; Otsuka, K.; Ichikawa, K.; Tsuchiya, A.; Ando, T. Anal. Chem. 1984, 56, 113.
- Foley, J.P. Anal. Chem. 1990, 62, 1302.
- Carretero, A.S.; Cruces-Blanco, C.; Ramirez, S.C.; Pancorbo, A.C.; Gutierrez, A.F. J. Agric. Food. Chem. 2004, 52, 5791.
- Cavazza, A.; Corradini, C.; Lauria, A.; Nicoletti, I. J. Agric. Food Chem. 2000, 48, 3324.
- Rodrigues, M.R.A.; Caramao, E.B.; Arce, L.; Rios, A.; Valcarcel, M. J. Agric. Food Chem. 2002, 50, 4215.
Ссылки
Электрофорез — это… Что такое Электрофорез?
направленное движение коллоидных частиц или макроионов под действием внешнего электрического поля. Э. был открыт Ф. Ф. Рейссом в 1807 и считается важнейшей разновидностью электрокинетических явлений (См. Электрокинетические явления). Скорость υ движущихся частиц приближённо связана с напряжённостью электрического поля Е уравнением Смолуховского: где η — вязкость среды, D — диэлектрическая проницаемость, ξ — Электрокинетический потенциал. Э. используют в электрохимии для изучения двойного электрического слоя (См. Двойной электрический слой), адсорбции ионов на поверхности, в медицине (см. Электрофорез лекарственный). В промышленности Э. используют для выделения каучука из латекса, очистки воды, отделения каолина от песка и др. В биохимии Э. служит для анализа, разделения и очистки биополимеров (главным образом белков), бактериальных клеток, вирусов, а также аминокислот, витаминов и др. Практическое применение Э. началось после создания шведским учёным А. Тиселиусом специального аппарата для фронтального (или свободного) Э. белков в растворе (1937). Наиболее широкое распространение нашли электрофоретические методы с использованием инертных носителей (бумаги, гелей и др.), получившие общее название зонального Э., т. к. фракции разделяемых веществ образуют в толще носителя отдельные, несмешивающиеся зоны. Э. часто сочетают с другими методами разделения биоорганических соединений (например, с хроматографией). Разработана техника концентрирования электрофоретических зон биополимеров в гелях, значительно повышающая разрешающую способность метода (диск-Э.). Применение реакции антиген-антитело в сочетании с Э. послужило основой для создания метода иммуно-Э. Электрофоретический анализ биологических жидкостей, например сыворотки крови для исследования главным образом белков, широко используют в диагностике многих заболеваний.Лит.: Ларский Э. Г., Методы зонального электрофореза, М., 1971; Духин С. С., Дерягин Б. В., Электрофорез, М., 1976.
Н. Н. Чернов.
ЭЛЕКТРОФОРЕЗ — это… Что такое ЭЛЕКТРОФОРЕЗ?
электрофоре́з (от электричество и греч. Phóorēsis несение, перенесение), передвижение заряженных частиц под действием внешнего электрического поля к электроду, знак которого противоположен заряду частиц; метод анализа и препаративного разделения аминокислот, пептидов, белков, нуклеотидов, нуклеиновых кислот и других веществ. Для Э. необходимы источник постоянного тока и камеры с электродами. Различают фронтальный, или свободный, и зональный Э. Фронтальный Э. проводят в буферных растворах. Метод требует больших количеств веществ, сложной регистрирующей аппаратуры, трудоёмок. Зональный Э. проводят на инертных носителях (на бумаге; в крахмальном, агаровом, агарозном и полиакриламидном гелях). С помощью Э. на бумаге разделяют сложные смеси органических веществ белков, гликопротеидов и липопротеидов плазмы или сыворотки крови, спинномозговой жидкости, экссудатов, транссудатов, жидкого гноя, синовиальной жидкости, мочи, экстрактов печени, мышц и других тканей животных, а также аминокислот, гидролизатов белков и азотсодержащих витаминов и других веществ. При Э. в полиакриламидном геле (диск-Э.) разделение частиц сочетается с эффектами концентрирования и молекулярного сита. Этот метод используют при исследовании белков, гликопротеидов и липопротеидрв сывороток крови и лимфы, при изучении фармакодинамики лекарств, веществ и др. Э. в крахмальном геле применяют при изучении изоферментов, полиморфизма сывороточных белков. Современными, с высокой разрешающей способностью методами Э. являются изоэлектрическое фокусирование и изотахофорез. В основе электрофокусирования лежит способность коллоидных частиц изменять заряд в зависимости от pH среды. При изотахофорезе разделение смесей осуществляется с использованием прерывистой буферной системы на основе различий электрофоретической подвижности разделяющихся ионов. См. также Иммуноэлектрофорез.
Электрофорез лекарственный (гальваноионотерапия) электролечебная процедура, в процессе которой в ткани организма через неповрежденную кожу или слизистую оболочку вводят лекарств, вещества с помощью постоянного тока. Метод основан на перемещении ионов и ионизированных молекул растворов лекарственных веществ под действием постоянного тока и проникновении их в ткани на месте наложения электродов. При этом методе на ткани организма воздействует также постоянный ток. Действие лекарственных веществ при Э. л. обусловлено созданием их значительной концентрации непосредственно в патологическом очаге. Для Э. л. используют аппарат для гальванизации с его электродами и гидрофильными прокладками, но одну из гидрофильных прокладок пропитывают раствором вводимого лекарственного вещества. Эту прокладку надевают на электрод, имеющий одноимённый заряд с вводимым ионом лекарственные вещества. Так, ионы иода вводят из раствора йодистого калия, которым смачивают гидрофильную прокладку отрицательного электрода (К+, I-). Ионы кальция, наоборот, вводят с гидрофильной прокладки положит, полюса (Са+, Cl-). Для соблюдения правильной полюсности, особенно при введении веществ со сложной молекулой, пользуются специальными таблицами, в которых указаны полярность вводимого иона и концентрация раствора. В зависимости от характера болезни путём Э. л. вводят различные вещества новокаин (при болезнях периферической нервной системы), салициловые препараты при ревматизме), антибиотики, сульфаниламиды (при хронических воспалительных процессах).
Литература:
Кармолиев Р. Х., Современные биохимические методы исследования в ветеринарии и зоотехнии, М., 1971. См. также лит. при ст. Физиотерапия.
Ветеринарный энциклопедический словарь. — М.: «Советская Энциклопедия». Главный редактор В.П. Шишков. 1981.
Электрофорез в полиакриламидном геле — Википедия
Материал из Википедии — свободной энциклопедии
Электрофорез в полиакриламидном геле (сокр. электрофорез в ПААГ, ПААГ электрофорез; англ. PAGE, Polyacrylamide Gel Electrophoresis) — метод молекулярной биологии и биохимии, используемый для разделения белков и нуклеиновых кислот, основанный на движении заряженных биологических макромолекул в постоянном электрическом поле. Разделение в полиакриламидном геле происходит за счёт различий заряда разделяемых молекул и отличий молекулярных масс, а также от конфигурации молекул. Разделяют т. н. неденатурирующий, или нативный ПААГ-электрофорез (при котором разделяемые биологические макромолекулы в процессе электрофореза остаются в нативном состоянии) и денатурирующий ПААГ-электрофорез (при котором пробы предварительно денатурируют, в случае нуклеиновых кислот используют непродолжительное нагревание пробы с формамидом либо глиоксалем, для денатурации белков обычно используют кипячение пробы в буфере, содержащем сильный ионный детергент (обычно додецилсульфат натрия) и агент, разрушающий четвертичную структуру белка за счёт разрушения дисульфидных мостиков между глобулами белка и внутри полипептидной цепи — бета-меркаптоэтанолом). В процессе денатурирующего ПААГ-электрофореза молекулы сохраняются в денатурированном состоянии за счёт наличия в геле хаотропных агентов (обычно мочевины) в случае ПААГ-электрофореза нуклеиновых кислот и белков и наличия ионных (например додецилсульфата натрия, цетилтриметиламмоний бромида) и неионных (например tween-20) детергентов.
- В случае электрофореза белков в полиакриламидном геле метод обычно используют в модификации Леммли (Laemmli)[1]
- Также электрофорез в полиакриламидном геле применяют для разделения коротких фрагментов нуклеиновых кислот, например, ДНК-электрофорез, например, при секвенировании по Сэнгеру. Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ и ПЦР.
- Различают также т. н. диск-электрофорез (от англ. discontinuous), при котором в геле в процессе электрофоретического разделения белков на границе между концентрирующим и разделяющим гелями создаётся градиент pH, за счёт чего достигается лучшее разделение белковых молекул.