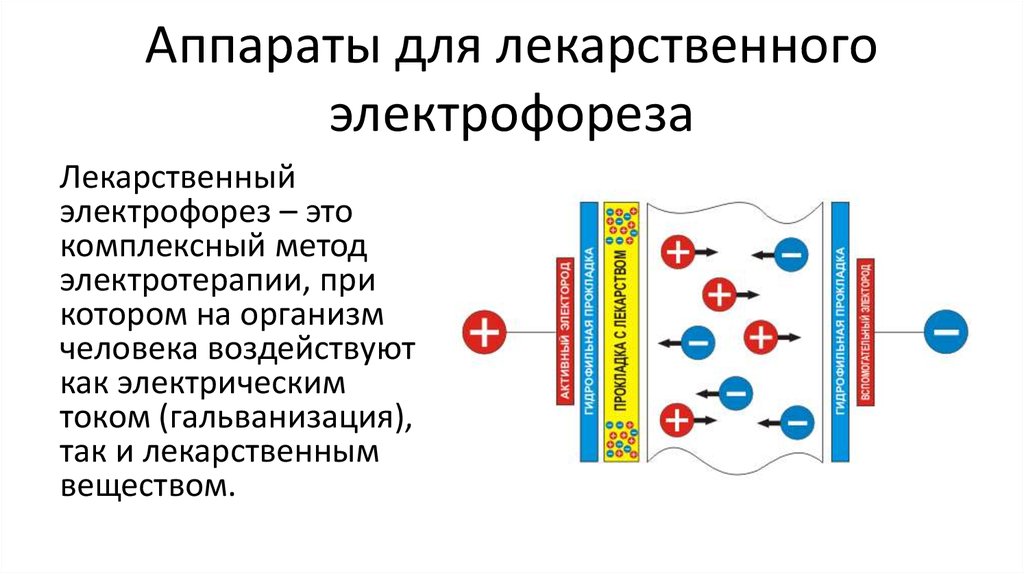
Электрофорез. Способы проведения процедура — Доктор Позвонков
Электрофорез – это явление, заключающееся в перемещении частиц под действие электрического поля. В зоне воздействия на ткани человека усиливаются обмен веществ, ускоряется движение крови и лимфы, повышается регенерация костной, нервной, соединительной ткани. Участки становятся восприимчивыми к введению лекарственных препаратов.
Эффекты от процедуры
- Снижает интенсивность болевого синдрома.
- Улучшает микроциркуляцию.
- Стимулирует выработку гормонально активных веществ.
- Повышает иммунитет.
- Расслабляет спазмированные мышцы.
- Ускоряет репаративные процессы.
Если назначили электрофорез совместно с фармакотерапией, улучшается эффективность последней. Лекарственные вещества поступают прямо в очаг повреждения, минуя желудочно-кишечный тракт. Большая часть дозы остается в подкожно-жировой ткани и постепенно попадает в кровяное русло, поэтому физиопроцедура действует пролонгировано.
Показания
Электрофорез используют для лечения людей с болезнями дыхательной, сердечно-сосудистой, мочеполовой системы. Кроме того, методика применяется у травматологических, офтальмологических, стоматологических пациентов, при патологии ЛОР органов. Показаний к назначению процедуры великое множество, однако, массово процедура не применяется из-за:
- недоверия пациентов к подобному способу лечения;
- необходимости посещений кабинета физиотерапии;
- отсутствия предложения со стороны врача.
Проведение процедуры
Существует несколько способов электрофореза:
- Чрескожный. Используют марлевые прокладки, которые пропитываются лекарственным средством. Их размещают в области патологического очага, создавая поле в котором движется фармакопрепарат.
- Ванночковый. В емкость с электродами помещают лекарство и конечность пациента.
- Полостной. При этом в полые органы вводится необходимое лекарственное средство.
 Один электрод помещается внутрь органа, а другой крепится к коже.
Один электрод помещается внутрь органа, а другой крепится к коже. - Внутритканевый. При этом лекарство принимают внутрь или вводят внутривенно, а над зоной лечения размещаются электроды.
Физиолечение назначают курсом 10-20 процедур. Длительность каждого сеанса 10-15 минут.
Противопоказания и осложнения
Назначение электрофореза противопоказано при:
- выявлении аллергических проявлений на препарат;
- наличии кардиостимулятора, металлических имплантов;
- инфекциях;
- патологии свертывающей системы и недавно перенесенном кровотечении;
- тяжелой сердечной недостаточности;
- злокачественных образованиях;
- травмах участка кожи, на который накладываются электроды.
При соблюдении методики электрофореза побочные явления редки. Возможно появление аллергии на препарат, сопровождающееся локальной отечностью, зудом и покраснением. В этом случае процедуры отменяются и пациенту назначают антигистаминные средства, устраняющие симптомы аллергии.
Другие:
Электрофорез лекарственных препаратов: польза и показания к проведению лечения, методика проведения терапии
Электрофорез лекарственных веществ в числе прочих процедур проводится в физиотерапевтическом отделении нашего центра.
Показания для проведения процедуры
Электрофорез – это перенос различных веществ, в т.ч. и лекарственных, под влиянием электромагнитного поля, создаваемого постоянным током. В основе данного физического явления лежит электролитическая диссоциация. Под действием электромагнитного поля происходит электролиз. Вещество распадается, диссоциирует на положительно и отрицательно заряженные ионы.
По законам электромеханики положительно заряженные ионы (катионы) в водной среде движутся в сторону отрицательного электрода (катода). А отрицательные анионы притягивает положительный анод.
Следовательно, если наложить электроды на участки тела, и смочить их раствором лекарственного средства, то под действием электромагнитного поля произойдет ионизация лекарственного вещества.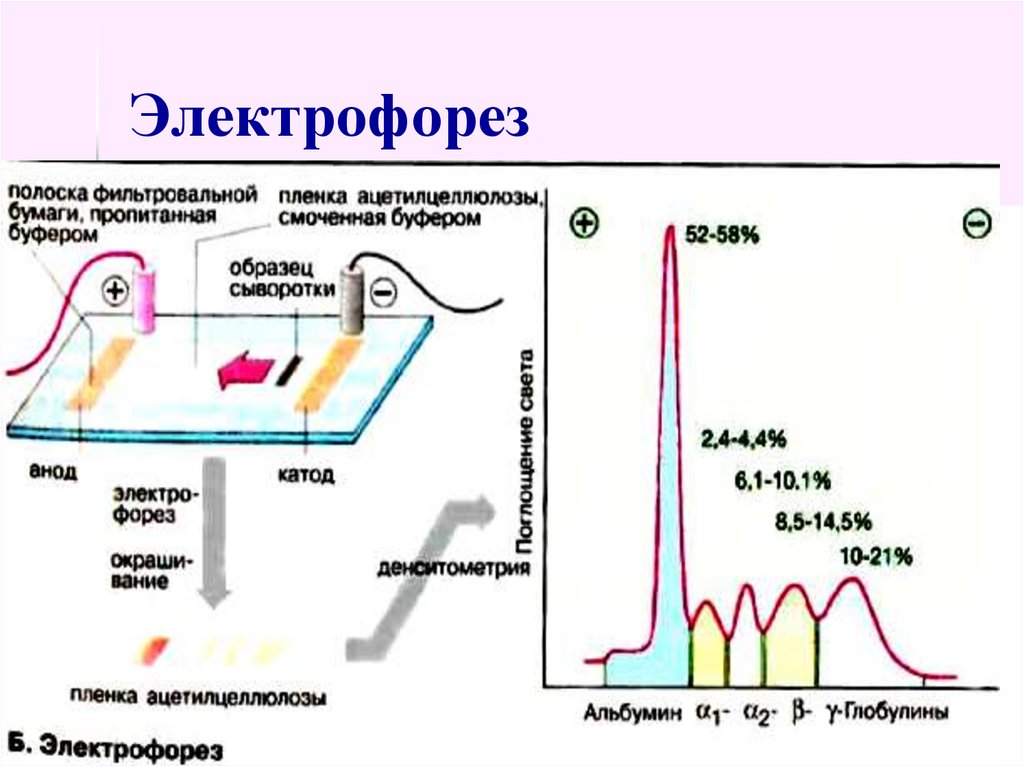 В этой форме оно будет проникать сквозь кожный эпителий, волосяные фолликулы, протоки сальных и потовых желез в толщу тканей, где и будет оказывать свое действие.
В этой форме оно будет проникать сквозь кожный эпителий, волосяные фолликулы, протоки сальных и потовых желез в толщу тканей, где и будет оказывать свое действие.
В сравнении с инъекциями, приемом внутрь такой путь введения лекарств имеет ряд преимуществ. Максимальная концентрация вводимого вещества создается в толще кожи и в подкожном слое. Это т.н. лекарственное депо. Отсюда препарат постепенно диффундирует в глубжележащие ткани, и проникает в кровеносные сосуды. Далее с током крови он разносится по органам и тканям.
Таким образом, электрофорез оказывает местное (в зоне наложения электродов), и общее действие. Благодаря постепенному всасыванию лечебный эффект удлиняется. Само лекарство используется в минимальных дозах.
Уменьшается я его расход (экономическая выгода), снижается риск побочных эффектов и аллергических реакций. Лекарство в ионизированной форме более активно, чем в молекулярной. Лечебный эффект оказывают только ионы лекарства. Нет балластных веществ, токсических примесей.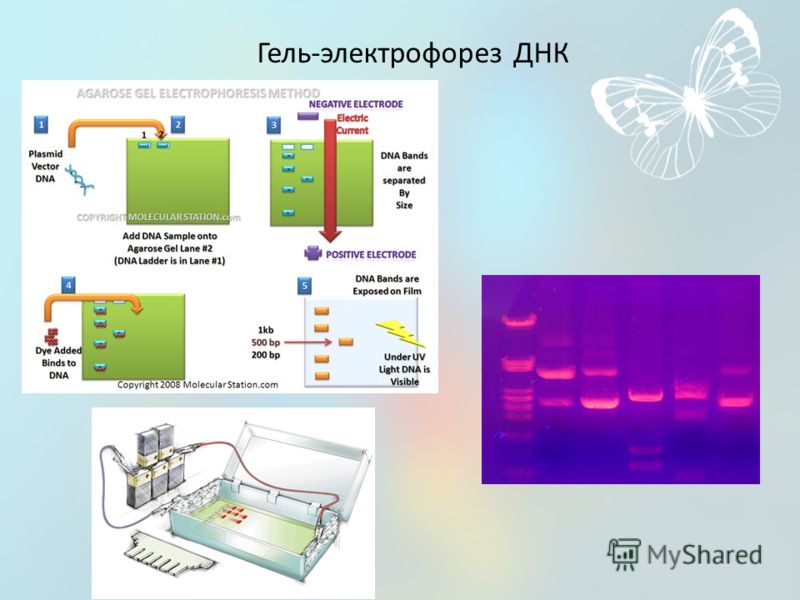 И это тоже повышает безопасность лечения.
И это тоже повышает безопасность лечения.
Особенно результативен электрофорез при местном использовании, когда лекарственное средство, минуя кровь и желудочно-кишечный тракт, поступает непосредственно в патологический очаг. Правда, количество поступившего препарата невелико, не более 10% (в среднем 5-6%) от его содержания в рабочем растворе. Но и этого хватает для полноценного терапевтического действия.
В качестве лекарственных веществ мы используем:
- обезболивающие и противовоспалительные средства
- местные анестетики
- витамины
- минералы
- аминокислоты
- средства, влияющие на тонус сосудов
- средства, влияющие на свертывание крови
- гормональные препараты
- средства с ферментативной активностью
- антибиотики
- антисептики
- препараты растительного происхождения (алоэ)
- препараты животного происхождения (змеиный или пчелиный яд).

- некоторые другие группы лекарств.
Посредством электрофореза можно снизить артериальное давление, восстановить нормальный кровоток, добиться рассасывания воспалительных очагов, тканевой регенерации, обеспечить другие терапевтические эффекты.
Все зависит от используемого препарата. Поэтому круг показаний к электрофорезу довольно широк. Еще один примечательный факт: электрические токи тоже оказывают терапевтическое действие. При сочетании электротоков и лекарств отмечается взаимное усиление их эффектов.
Методика проведения электрофореза
В подавляющем большинстве случаев (80-85%) для электрофореза мы используем постоянный гальванический ток небольшой силы и напряжения. Остальное приходится на диадинамические, синусоидально модулированные, или прямоугольные импульсные токи. Плотность силы тока не должна превышать 0,05-1,0 мА/см2.
Как и при гальванизации, здесь используют металлические пластинки, снабженные гидрофильными прокладками.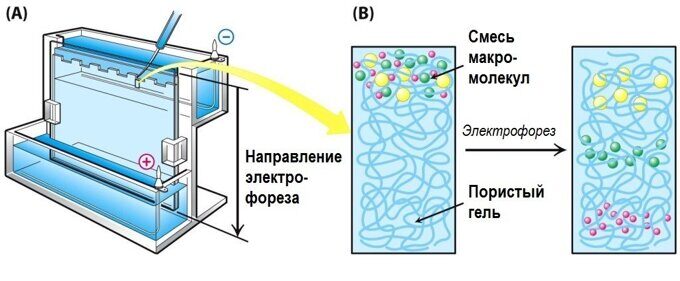 Между электродом и поверхностью кожи располагается лекарственная прокладка. Она представляет собой сложенную в несколько слоев марлевую или бумажную салфетку, смоченную в лекарственном растворе.
Между электродом и поверхностью кожи располагается лекарственная прокладка. Она представляет собой сложенную в несколько слоев марлевую или бумажную салфетку, смоченную в лекарственном растворе.
В качестве лекарственного растворителя, как правило, мы используем воду. Для труднорастворимых в воде средств мы используем спирт, Димексид, буферные растворы. Физраствор здесь недопустим. Будучи солевым раствором, он повергается электролизу, и сводит на нет действие основного лекарственного вещества.
Лекарственная прокладка по площади должна быть больше пластины электрода, и на 1-2 см выступать за его края. Разовые дозы лекарства, оптимальные концентрации растворов определяются по специальным таблицам. При этом учитывается, что расход лекарственного раствора с 10см2 площади электрода составляет 5-10 мл. Для бумажных салфеток этот показатель меньше, и равен 2-3 мл.
Электроды располагают поперечно, реже продольно по отношению к обрабатываемой анатомической зоне, и фиксируют резиновыми бинтами. Еще один важный принцип: полярность. Электрод, с которого ионизированное лекарство проникает в ткани, называют активным. Именно под активный электрод помещают салфетку с раствором.
Еще один важный принцип: полярность. Электрод, с которого ионизированное лекарство проникает в ткани, называют активным. Именно под активный электрод помещают салфетку с раствором.
Положительный заряд имеют ионы металлов, некоторые антибиотики, местные анестетики. Такие вещества располагают под анодом. Под катодом располагают действующие вещества, которые после электролиза приобретают отрицательный заряд, например, хлориды.
Белки, растительные экстракты, и многие другие органические соединения со сложной структурой диссоциируют на положительные и на отрицательные ионы. И те, и другие обладают терапевтической ценностью. Поэтому такие вещества располагают под обоими электродами.
Методика двух электродов (биполярная) может быть применена, когда для электрофореза используются два вещества, одно из которых приобретает положительный заряд, другой – отрицательный. Главное, чтобы взаимодействие этих веществ не привело к ослаблению лечебного действия.
Во время процедуры пациент не должен испытывать жжения, боли – лишь легкое покалывание.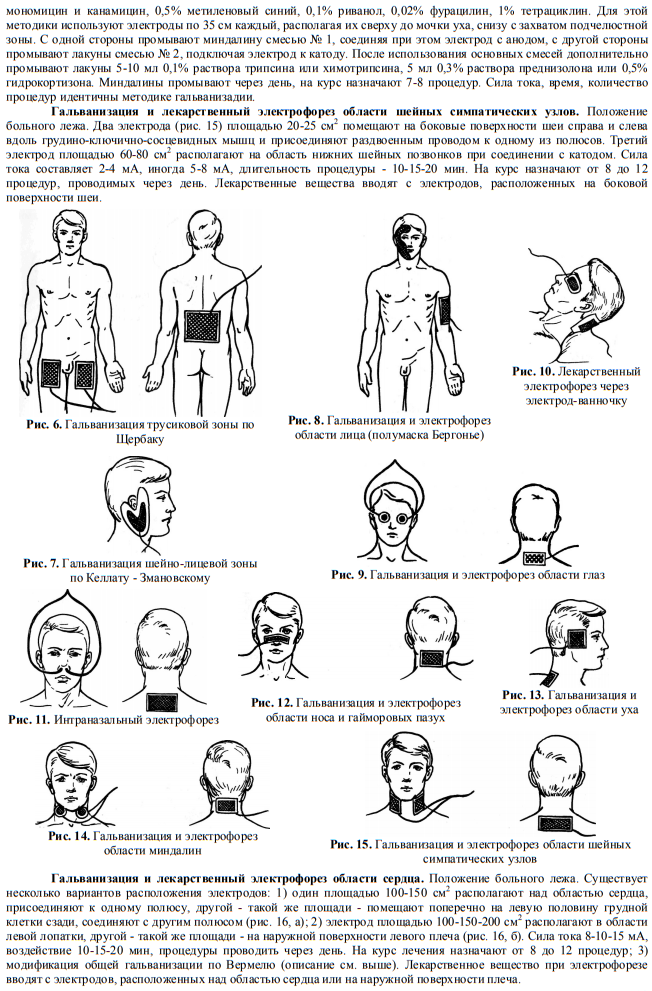 Электрофорез местных анестетиков сопровождается ощущением онемения – это является нормой. Продолжительность процедуры зависит от показаний и от используемого препарата, и колеблется от 15-20 до 30-40 мин.
Электрофорез местных анестетиков сопровождается ощущением онемения – это является нормой. Продолжительность процедуры зависит от показаний и от используемого препарата, и колеблется от 15-20 до 30-40 мин.
При наличии показаний мы прибегаем и к более сложным методикам электрофореза. Электроды в виде ванночек с лекарственным раствором (камерный электрофорез) оправдали себя при лечении суставных заболеваний, артритов и артрозов, а также в офтальмологической практике.
Полостной электрофорез показан при заболеваниях желудочно-кишечного тракта, мочевыводящей системы, женских репродуктивных органов. Активный электрод с лекарственным средством вводится в естественные полости: в желудок, в мочевой пузырь, в матку или в прямую кишку. Второй электрод располагается на поверхности тела в проекции соответствующего органа.
Внутритканевой электрофорез предусматривает внутривенное введение препарата или его прием внутрь. При этом лекарственное средство разносится по органам и тканям. Электроды располагают в проекции патологического очага. Под действием электромагнитного поля лекарственное средство ионизируется и проникает из кровеносного русла в орган или ткань.
Электроды располагают в проекции патологического очага. Под действием электромагнитного поля лекарственное средство ионизируется и проникает из кровеносного русла в орган или ткань.
Противопоказания
Основные противопоказания связаны с непереносимостью лекарственного средства. Среди других ограничений: непереносимость электрического тока, острые гнойные воспалительные процессы, а также повреждения и заболевания кожи в месте накладываемых электродов.
Что такое гель-электрофорез? – Ваш геном
- Гель-электрофорез — метод, обычно используемый в лабораториях для разделения заряженных молекул, таких как ДНК, РНК и белки, в зависимости от их размера.
- Заряженные молекулы движутся сквозь гель при пропускании через него электрического тока.
- Через гель пропускают электрический ток, так что один конец геля имеет положительный заряд, а другой — отрицательный.
- Движение заряженных молекул называется миграцией.
 Молекулы мигрируют к противоположному заряду. Таким образом, молекула с отрицательным зарядом будет притягиваться к положительному концу (противоположности притягиваются!).
Молекулы мигрируют к противоположному заряду. Таким образом, молекула с отрицательным зарядом будет притягиваться к положительному концу (противоположности притягиваются!). - Гель состоит из проницаемой матрицы, немного похожей на сито, через которую могут проходить молекулы при пропускании через нее электрического тока.
- Меньшие молекулы мигрируют через гель быстрее и, следовательно, перемещаются дальше, чем более крупные фрагменты, которые мигрируют медленнее и, следовательно, преодолевают более короткое расстояние. В результате молекулы разделяются по размеру.
Гель-электрофорез и ДНК
- Электрофорез позволяет различать фрагменты ДНК различной длины. ДНК
- заряжена отрицательно, поэтому при подаче на гель электрического тока ДНК будет мигрировать к положительно заряженному электроду.
- Более короткие нити ДНК проходят через гель быстрее, чем более длинные, в результате чего фрагменты располагаются в порядке их размера.

- Использование красителей, флуоресцентных или радиоактивных меток позволяет увидеть ДНК на геле после того, как они были разделены. Они появятся в виде полос на геле.
- Маркер ДНК с фрагментами известной длины обычно пропускают через гель одновременно с образцами.
- Сравнивая полосы образцов ДНК с полосами маркера ДНК, вы можете вычислить приблизительную длину фрагментов ДНК в образцах.
Как проводится гель-электрофорез?
Подготовка геля
- Агарозные гели обычно используются для визуализации фрагментов ДНК. Концентрация агарозы, используемой для приготовления геля, зависит от размера фрагментов ДНК, с которыми вы работаете.
- Чем выше концентрация агарозы, тем плотнее матрица и наоборот. Меньшие фрагменты ДНК разделяются при более высоких концентрациях агарозы, в то время как более крупные молекулы требуют более низких концентраций агарозы.
- Чтобы сделать гель, порошок агарозы смешивают с буфером для электрофореза и нагревают до высокой температуры, пока весь порошок агарозы не расплавится.

- Затем расплавленный гель выливают в лоток для заливки геля и на один конец помещают «гребенку», чтобы сделать лунки для пипетирования образца.
- После того, как гель остынет и затвердеет (теперь он будет непрозрачным, а не прозрачным), расческу снимают.
- Сейчас многие используют готовые гели.
- Затем гель помещают в резервуар для электрофореза и заливают в резервуар буфер для электрофореза до тех пор, пока поверхность геля не будет покрыта. Буфер проводит электрический ток. Тип используемого буфера зависит от приблизительного размера фрагментов ДНК в образце.
Подготовка ДНК к электрофорезу
- Краситель добавляется к образцу ДНК перед электрофорезом, чтобы увеличить вязкость образца, что предотвратит его всплывание из лунок и чтобы миграция образца через гель можно увидеть.
- Маркер ДНК (также известный как стандарт размера или лестница ДНК) загружается в первую лунку геля. Фрагменты в маркере имеют известную длину, поэтому их можно использовать для приблизительного определения размера фрагментов в образцах.

- Подготовленные образцы ДНК затем пипетируют в оставшиеся лунки геля.
- Когда это сделано, крышку помещают на емкость для электрофореза, убедившись, что ориентация геля и положительного и отрицательного электродов правильная (мы хотим, чтобы ДНК мигрировала через гель к положительному концу).
Разделение фрагментов
- Затем включают электрический ток, так что отрицательно заряженная ДНК движется через гель к положительной стороне геля.
- Более короткие фрагменты ДНК движутся быстрее, чем более длинные, поэтому перемещаются дальше во время прохождения тока.
- Расстояние, на которое ДНК мигрировала в геле, можно оценить визуально, наблюдая за миграцией красителя загрузочного буфера.
- Электрический ток остается включенным достаточно долго, чтобы гарантировать, что фрагменты ДНК перемещаются достаточно далеко по гелю, чтобы разделить их, но не настолько долго, чтобы они сбежали с конца геля.
Иллюстрация оборудования для электрофореза ДНК, используемого для разделения фрагментов ДНК по размеру. Гель находится в резервуаре с буфером. Образцы ДНК помещают в лунки на одном конце геля, и через гель пропускают электрический ток. Отрицательно заряженная ДНК движется к положительному электроду.
Гель находится в резервуаре с буфером. Образцы ДНК помещают в лунки на одном конце геля, и через гель пропускают электрический ток. Отрицательно заряженная ДНК движется к положительному электроду.
Изображение предоставлено: Genome Research Limited
Визуализация результатов
- Как только ДНК достаточно далеко мигрировала по гелю, отключается электрический ток и гель удаляется из резервуара для электрофореза.
- Для визуализации ДНК гель окрашивают флуоресцентным красителем, который связывается с ДНК, и помещают на ультрафиолетовый трансиллюминатор, который показывает окрашенную ДНК в виде ярких полос.
- В качестве альтернативы краситель можно смешать с гелем перед его заливкой.
- Если гель работает правильно, будет виден рисунок полос ДНК-маркера/стандарта размера.
- Затем можно судить о размере ДНК в образце, представляя себе горизонтальную линию, пересекающую полосы ДНК-маркера. Затем вы можете оценить размер ДНК в образце, сопоставив их с ближайшей полосой маркера.

Иллюстрация, показывающая полосы ДНК, разделенные на геле. Длину фрагментов ДНК сравнивают с маркером, содержащим фрагменты известной длины.
Изображение предоставлено: Genome Research Limited
Последнее обновление этой страницы 21 июля 2021 г.
Введение в электрофорез — наука о поведении
Электрофорез — это метод разделения молекул в их жидком состоянии на основе их способности двигаться в электрическом поле. Различные формы и виды электрофореза стали ведущими методами анализа биомолекул в биохимии и молекулярной биологии, включая такие генетические материалы, как ДНК или РНК, белки и полисахариды.
Принцип электрофореза
Электрофорез основан на том явлении, что большинство биомолекул существуют в виде электрически заряженных частиц, обладающих ионизируемыми функциональными группами. Биомолекулы в растворе при данном рН будут существовать в виде положительно или отрицательно заряженных ионов.
При воздействии электрического поля ионизированные биомолекулы будут мигрировать с разной скоростью в зависимости от массы и суммарного заряда каждой частицы в растворе — отрицательно заряженные частицы, анионы будут мигрировать к положительно заряженному электроду или катоду , а катионы или положительно заряженные частицы будут притягиваться к отрицательно заряженному электроду, называемому анодом .
Различия в скорости и направлении каждой заряженной частицы приведут к характеру миграции, уникальному для ее индивидуальных свойств, что приведет к выделению компонентов биомолекул, обладающих сходными характеристиками (Эндрюс, 1986, как указано в Westermeier, et al. ., 2005, p. 3).
Теории, связанные с электрофорезом
Электрофоретическое разделение происходит, когда электрическое поле прикладывается между двумя электродами, катодом и анодом, погруженными в буферный раствор. Следующие уравнения описывают явления, происходящие во время электрофореза, то есть факторы, влияющие на электрофоретическое разделение (Westermeier, et al. , 2005; Walker, 2010).
а. Параметр электрофореза определяет скорость и направление разделяемых частиц
При приложении электрического поля возникает v напряжение (В) или разность электрических потенциалов . Он представляет собой разницу в работе , необходимой для перемещения единицы заряженной частицы на определенное расстояние (d) без создания ускорения. Отношения между приложенным электрическим полем (Е) , напряжением (В), и расстоянием (d) при электрофоретическом разделении выражаются как:
Отношения между приложенным электрическим полем (Е) , напряжением (В), и расстоянием (d) при электрофоретическом разделении выражаются как:
| E=V/d | (1) |
суммарный заряд этой частицы в этом конкретном электрическом поле:
| F=qE | (2) |
Во время электрофореза скорость (v) заряженной частицы 90,114 в определенном направлении в электрическом поле, выражается как:
| v=qE/f | (3) |
где f — коэффициент трения, который зависит от формы частиц и зависит от размера частиц и зависит от размера электрофор. размер пор среды и скорость буферного раствора, используемого в электрофорезе.
электрическая подвижность (µ) , которая представляет собой способность заряженной частицы двигаться в ответ на приложенное электрическое поле (E) , можно выразить через скорость (v) заряженных частиц следующим образом: В уравнении (1)-(4) электрическая подвижность (µ) заряженной частицы пропорциональна ее скорости (v) и суммарному заряду частицы (q) , но обратно пропорциональна коэффициент трения (f) . На основе этих уравнений показано, что при любом данном электрофорезе частицы, обладающие разными размерами и зарядами, будут двигаться с разной скоростью и направлением, соответственно, при условии, что приложенное электрическое поле является однородным.
На основе этих уравнений показано, что при любом данном электрофорезе частицы, обладающие разными размерами и зарядами, будут двигаться с разной скоростью и направлением, соответственно, при условии, что приложенное электрическое поле является однородным.
Обратно пропорциональная зависимость между электрической подвижностью (µ) и коэффициентом трения (f) также предполагает, что более мелкие частицы будут мигрировать быстрее, чем более крупные. Таким образом, каждая частица будет разделена на основе ее суммарного заряда, размера и формы.
б. Во время электрофореза выделяется тепло
Помимо интересующей заряженной частицы, ионы в буферном растворе электрофореза также будут ионизированы и заряжены при приложении электрического поля. Эти ионы служат проводниками, переносящими электрические ток (I) между катодом и анодом. The relationship between the voltage (V) and the current (I) is described in Ohm’s law as follows:
| R=V/I | (5) |
where R представляет собой электрическое сопротивление , которое определяется компонентами, используемыми в настройках электрофореза, такими как тип используемого буферного раствора и его общий объем. 92 R
92 R
где P — энергия в единицу времени, преобразованная из электрической в тепловую энергию.
На основании уравнений (1) и (5) расстояние (d) электрофоретического разделения можно уменьшить, если увеличить напряжение (В), что также приведет к увеличению тока (I) и сопротивление (R) . Тем не менее, как указано в уравнении (6), увеличение либо текущего (I) или сопротивление (R) приведет к выработке электроэнергии (P) , которая может быть преобразована из электрической энергии в тепловую.
Чрезмерное выделение тепла во время электрофореза может привести к конвекционным потокам или передаче тепла образцам, испарению буферного раствора, изменению рН буферного раствора и термической нестабильности. Это может привести к смешиванию образцов, изменению настроек электрофореза и повреждению термочувствительных образцов.
Одной из популярных мер противодействия выделению тепла является использование стабилизированного источника питания, который может обеспечивать постоянное напряжение или ток. Тем не менее, согласно закону Ома в уравнениях (5) и (6), приложения постоянного напряжения или тока не могут устранить выделение тепла. Таким образом, идеальная настройка электрофореза должна быть компромиссом между мощностью, , т.е. настройками напряжения и тока, и временем разделения (Walker, 2010).
Тем не менее, согласно закону Ома в уравнениях (5) и (6), приложения постоянного напряжения или тока не могут устранить выделение тепла. Таким образом, идеальная настройка электрофореза должна быть компромиссом между мощностью, , т.е. настройками напряжения и тока, и временем разделения (Walker, 2010).
Формы электрофореза
В зависимости от типа буферного раствора и его влияния на подвижность заряженных частиц электрофорез можно условно разделить на четыре формы следующим образом (Jorgenson, 1986):
1. Электрофорез с подвижной границей
Электрофорез с подвижной границей считается оригинальной формой электрофореза. Пробы для разделения отбираются в свободном растворе, в пробирках или капиллярах, при постоянном значении рН на протяжении всего процесса разделения.
Основным преимуществом электрофореза в свободном растворе является возможность измерения подвижности разделяющихся частиц без других промежуточных факторов, не связанных с разделяющимися частицами. Тем не менее, этот формат электрофореза уязвим для конвекционного тока, а разрешение разделения низкое из-за смешивания образцов в буферном растворе, что может привести к перекрытию компонентов или частиц, обладающих схожими характеристиками (Jorgenson, 19).86).
Тем не менее, этот формат электрофореза уязвим для конвекционного тока, а разрешение разделения низкое из-за смешивания образцов в буферном растворе, что может привести к перекрытию компонентов или частиц, обладающих схожими характеристиками (Jorgenson, 19).86).
2. Зональный электрофорез (ZE)
Зональный электрофорез аналогичен электрофорезу с подвижной границей в том, что электрофоретическое разделение происходит в гомогенной буферной системе (Westermeier, et al. ., 2005). В этом формате часто используется поддерживающая среда или матрица для подавления конвекционного потока и предотвращения неконтролируемой диффузии образца. Матрица в большинстве случаев также обеспечивает дополнительный эффект просеивания , который оказывает влияние на электрофоретическое разделение, как показано в уравнении (3) (Jorgenson, 19).86; Уокер, 2010).
Образцы для ZE-разделения помещают в буферный раствор для электрофореза и разделяют в матрице на определенное время разделения. При подаче электрического тока образцы движутся с разной скоростью, что определяется их массой и зарядом (q) . После завершения процесса разделения компоненты образца, обладающие сходными характеристиками, выделяются в отдельную зону (Becker, 1973) .
При подаче электрического тока образцы движутся с разной скоростью, что определяется их массой и зарядом (q) . После завершения процесса разделения компоненты образца, обладающие сходными характеристиками, выделяются в отдельную зону (Becker, 1973) .
Гель-электрофорез является примером ZE, в котором в качестве опорной среды используется полимерная просеивающая матрица. Этот метод широко используется в исследованиях в области биохимии и молекулярной биологии, а также в рутинной работе благодаря своей простоте и универсальности (Westermeier, 2005). Из-за введения поддерживающей среды ZE не подходит ни для анализа подвижности интересующих заряженных частиц, ни для определения изоэлектрическая точка (pI) пептидов или белков.
3. Изотахоэлектрофорез или изотахофорез (ИТФ)
Изотахофорез или ИТФ представляет собой форму электрофореза, при которой все ионы мигрируют с одинаковой скоростью (v) . В ITP образцы помещают между двумя неоднородными буферными растворами, состоящими из ведущего электролита на одном электроде и завершающего электролита на другом конце (Becker, 1973). Оба электролита обладают тем же видом заряда, что и интересующая частица в образце. При подаче электрического тока наибольшую подвижность будет иметь ведущий электролит, за которым следуют заряженные частицы в образце и концевые электролиты соответственно.
Оба электролита обладают тем же видом заряда, что и интересующая частица в образце. При подаче электрического тока наибольшую подвижность будет иметь ведущий электролит, за которым следуют заряженные частицы в образце и концевые электролиты соответственно.
По мере продолжения ITP заряженные частицы в образце будут смещаться в зависимости от их электрической подвижности (µ) и концентрации в порядке убывания подвижности, в результате чего образуется непрерывная область заряженных частиц с аналогичными характеристиками, окруженная областями, где ведущие и терминирующие ионы заняты (Becker, 1973; Jorgenson, 1986).
Информация изотахофореза передается в виде графиков зависимости напряженности электрического поля от времени, что представляет собой идентичность заряженной частицы, а длина каждой области представляет собой концентрацию заряженной частицы (Jorgenson, 1986).
Рисунок 1: Диаграмма, представляющая изотахофорезное разделение.
Наибольшей подвижностью обладают ионы ведущего электролита (LE), за ними следуют частицы B, A и C образца соответственно. Ионы в терминирующем электролите (ТЭ) обладают наименьшей подвижностью. В ITP идентичность заряженных частиц отражается в напряжении или напряженности электрического поля, изображенных на оси y . Концентрация каждой частицы отражается в продолжительности времени ее обнаружения (L). На этом рисунке частица А имеет наибольшую концентрацию в образце, за ней следуют частицы В и С соответственно.
Ионы в терминирующем электролите (ТЭ) обладают наименьшей подвижностью. В ITP идентичность заряженных частиц отражается в напряжении или напряженности электрического поля, изображенных на оси y . Концентрация каждой частицы отражается в продолжительности времени ее обнаружения (L). На этом рисунке частица А имеет наибольшую концентрацию в образце, за ней следуют частицы В и С соответственно.
Одним из основных недостатков этого формата является то, что в одной настройке можно определить только один вид заряженных частиц, и для получения информации о заряженных частицах другого вида потребуется еще один раунд ITP.
4. Изоэлектрофокусировка (ИЭФ)
Изоэлектрофокусировка или ИЭФ – это электрофорез, который проводится в градиенте рН, который идет от низкого к высокому – от анода к катоду. IEF применим только к амфотерным молекулам, потому что они могут отдавать и получать протоны, действуя как кислота и основание. Примерами амфотерных биомолекул являются пептиды и белки, содержащие аминогруппы и карбоксильные группы (Walker, 2010).
После установления градиента pH и подачи электрического тока амфотерный образец будет мигрировать либо к аноду, либо к катоду, в зависимости от суммарного заряда образца. В изоэлектрической точке (pI) , где суммарный заряд образца равен нулю, скорость (v) и электрическая подвижность (µ) амфотерной молекулы становятся равными нулю, останавливая миграцию (Джоргенсон , 1986).
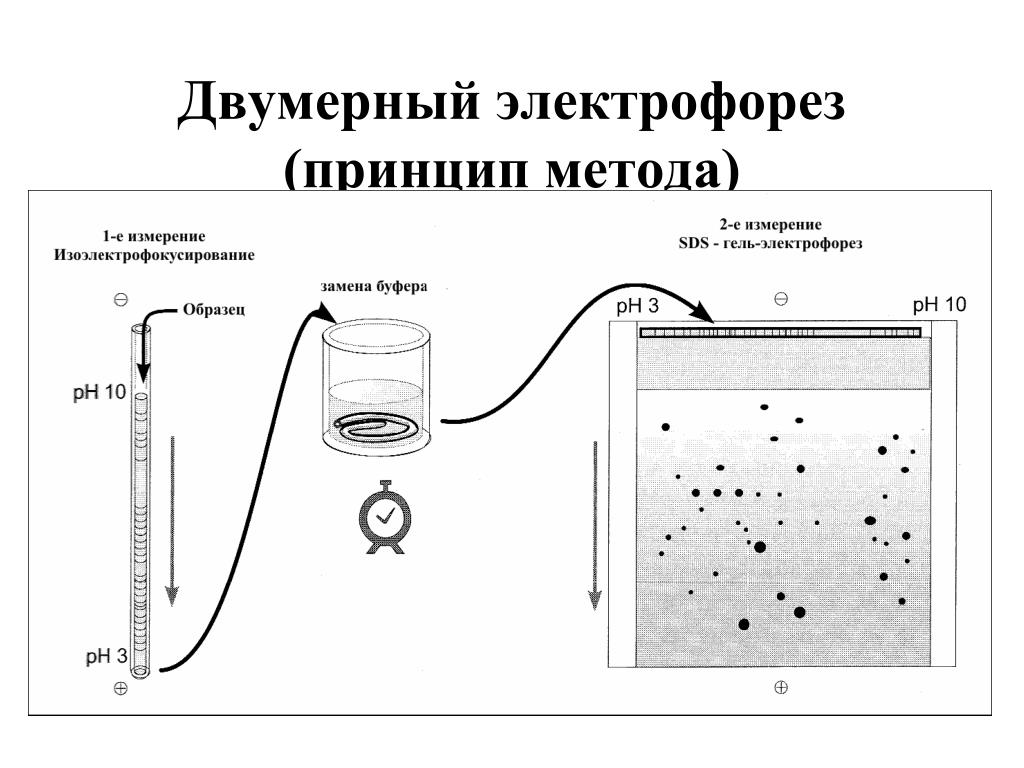
Все четыре формата электрофореза можно проводить как в одномерном, так и в двухмерном (2D) измерениях. Двумерный электрофорез осуществляют путем проведения первого электрофореза с последующим вторым электрофоретическим разделением в направлении, перпендикулярном первому измерению. 2D-электрофорез может дать больше информации и разрешения, что особенно полезно для клинических или полевых образцов, которые часто требуют интенсивного анализа и характеристики, но даются только в ограниченном количестве (Jellum & Thorsurd, 19).82; Сюй, 2008 г.).
Типы электрофореза
Различные формы электрофореза были преобразованы в несколько типов электрофореза, которые используются для разделения различных типов биомолекул, анализа их характеристик и изучения их взаимодействия с интересующей молекулой. Ниже приведены избранные методы электрофореза, основанные на различных форматах электрофореза.
Ниже приведены избранные методы электрофореза, основанные на различных форматах электрофореза.
1. Гель-электрофорез
Гель-электрофорез представляет собой форму ZE, в которой используется гель, нежидкая сшитая полимерная сеть, в качестве поддерживающей среды для поддержания стабильного значения pH в буферном растворе, действующий как антиконвективный стабилизатор . Он также служит разделительной матрицей из-за своей пористой природы, которая фильтрует крупные частицы и препятствует более мелким во время электрофоретического разделения (Jorgenson, 19).86).
Гель отливается в полоски или пластины с прорезями или лунками для образцов . После полной полимеризации гель погружают в буферный раствор для электрофореза и в каждую лунку загружают образцы перед подачей электрического тока для инициирования электрофоретического разделения (Walker, 2010). В конце гель-электрофореза компоненты в образцах будут разделены в зависимости от их массы (Westermeier, 2005).
Как упоминалось ранее, гель-электрофорез является одним из наиболее часто используемых видов электрофореза в исследованиях и рутинной диагностике благодаря простоте использования и универсальности. Его можно адаптировать для разделения различных биомолекул, изменив тип полимеров, используемых для отливки геля, и отрегулировав состав полимера, изменив размер пор геля (Xu, 2008; Chung, 9).0113 и др. , 2014).
Типы гелей
- Полиакриламид — прозрачный и прозрачный гель, полученный сополимеризацией мономеров акриламида в присутствии сшивающего агента, N, N- метилен-бисакриламида, обычно называемого бис-акриламид». Реакция полимеризации катализируется персульфатом аммония (APS) и N, N, N’, N’ -тетраметилендиамином (TEMED). Размер пор полиакриламидных гелей определяется концентрацией акриламида, которая должна быть пропорциональна его сшивающему агенту. Как правило, для разделения ДНК и белков используется небольшой процент акриламидного геля (3-15%).
 Более высокий процент акриламидного геля (10-20%) обычно используется при электрофорезе в полиакриламидном геле с додецилсульфатом натрия (ДСН), при котором белки разделяются в денатурированных условиях в зависимости от их размера (Walker, 2010). ; Чанг, 9 лет0113 и др., 2014).
Более высокий процент акриламидного геля (10-20%) обычно используется при электрофорезе в полиакриламидном геле с додецилсульфатом натрия (ДСН), при котором белки разделяются в денатурированных условиях в зависимости от их размера (Walker, 2010). ; Чанг, 9 лет0113 и др., 2014). - Агароза , природный линейный полисахарид, состоящий из галактозы и цепей 3,6-ангидрогалактозы, экстрагированный из агара, выделенного из красных морских водорослей (Westermeier, et al. ., 2005). Агарозу, как и агар, хранят в виде сухого порошка. Чтобы отлить агарозный гель, порошок агарозы растворяют в соответствующем буферном растворе, нагревают и дают остыть до комнатной температуры. Подобно полиакриламидному гелю, концентрация агарозы в буферном растворе определяет размер пор геля. Агарозный гель обычно используется в концентрации от 0,8% (вес/объем) до 5% (вес/объем) для разделения молекул ДНК и РНК (Walker, 2010). Агарозу можно использовать в сочетании с SDS для разделения высокомолекулярных белков, которые могут быть проблематичными при разделении с помощью SDS-PAGE (Greaser 9).
 0113 и др. , 2012).
0113 и др. , 2012).
2. Гель-электрофорез в импульсном поле (PFGE)
Гель-электрофорез в импульсном поле (PFGE) представляет собой вариант гель-электрофореза, при котором два электрических поля периодически воздействуют по очереди на гель-электрофорез под разными углами. Этот тип электрофореза специально разработан для разделения хромосом, которые представляют собой высокомолекулярные молекулы ДНК размером более 20 тысяч оснований.
В отличие от более мелких молекул ДНК, высокомолекулярные молекулы ДНК находятся в сжатой конформации, что заставляет их двигаться независимо от размера. Во время приложения первого электрического поля свернутые молекулы ДНК растягиваются и будут двигаться через гель. Однако прекращение и изменение направления электрического поля заставляют эти большие молекулы ДНК переориентироваться, прежде чем миграция сможет возобновиться.
Более крупные высокомолекулярные молекулы будут медленнее в процессе переориентации и обновления миграции по сравнению с более мелкими высокомолекулярными молекулами из-за их более длительного времени вязкоупругой релаксации . Повторное приложение двух переменных электрических полей под разными углами в конечном итоге покажет дальнейшее расстояние миграции для более мелких молекул ДНК с высокой молекулярной массой и более короткое расстояние миграции для более крупных молекул ДНК с высокой молекулярной массой (Westermeier, 2005; Westermeier 9).0113 и др., 2005; Уокер, 2010).
Повторное приложение двух переменных электрических полей под разными углами в конечном итоге покажет дальнейшее расстояние миграции для более мелких молекул ДНК с высокой молекулярной массой и более короткое расстояние миграции для более крупных молекул ДНК с высокой молекулярной массой (Westermeier, 2005; Westermeier 9).0113 и др., 2005; Уокер, 2010).
3. Капиллярный электрофорез (КЭ)
Капиллярный электрофорез, также известный как высокоэффективный капиллярный электрофорез (ВКЭ), представляет собой тип электрофореза, проводимый в узком капилляре, погруженном в буферный электролит. Это единственный тип электрофореза, способный выполнять все четыре типа электрофореза (Heiger, 2000). Капилляр обычно имеет длину 20-30 сантиметров и внутренний диаметр 25-75 микрометров.
Электрофоретическое разделение начинается, когда образец вводится в капилляр либо под высоким напряжением, либо под давлением, и к капилляру прикладывают сильные электрические поля (Heiger, 2000; Westermeier, et al. , 2005). Компоненты в образце разделяются по длине капилляра в зависимости от формата проводимого электрофореза. На другом конце капилляра отдельные компоненты обнаруживаются на детекторе , где время обнаружения или время удерживания записывается автоматически.
, 2005). Компоненты в образце разделяются по длине капилляра в зависимости от формата проводимого электрофореза. На другом конце капилляра отдельные компоненты обнаруживаются на детекторе , где время обнаружения или время удерживания записывается автоматически.
Поскольку КЭ выполняется в узком капилляре, для разделения требуется очень небольшой объем образца. Еще одним важным преимуществом CE является автоматизированная система инструментов, позволяющая проводить высокопроизводительный анализ (Heiger, 2000).
4. Иммуноэлектрофорез
Иммуноэлектрофорез представляет собой тип электрофореза, который разделяет антигенов , включая белки и пептиды, на основе их реакции и специфичности к 9антитела 0113 или иммуноглобулины (Ig) . Связывание антигена с соответствующим антителом при определенном соотношении антиген/антитело или эквивалентной точке , , приведет к преципитации комплекса антиген-антитело. Таким образом, антигены в интересующем образце можно разделить на основе их способности связываться с данным антителом (Nowotny, 1979).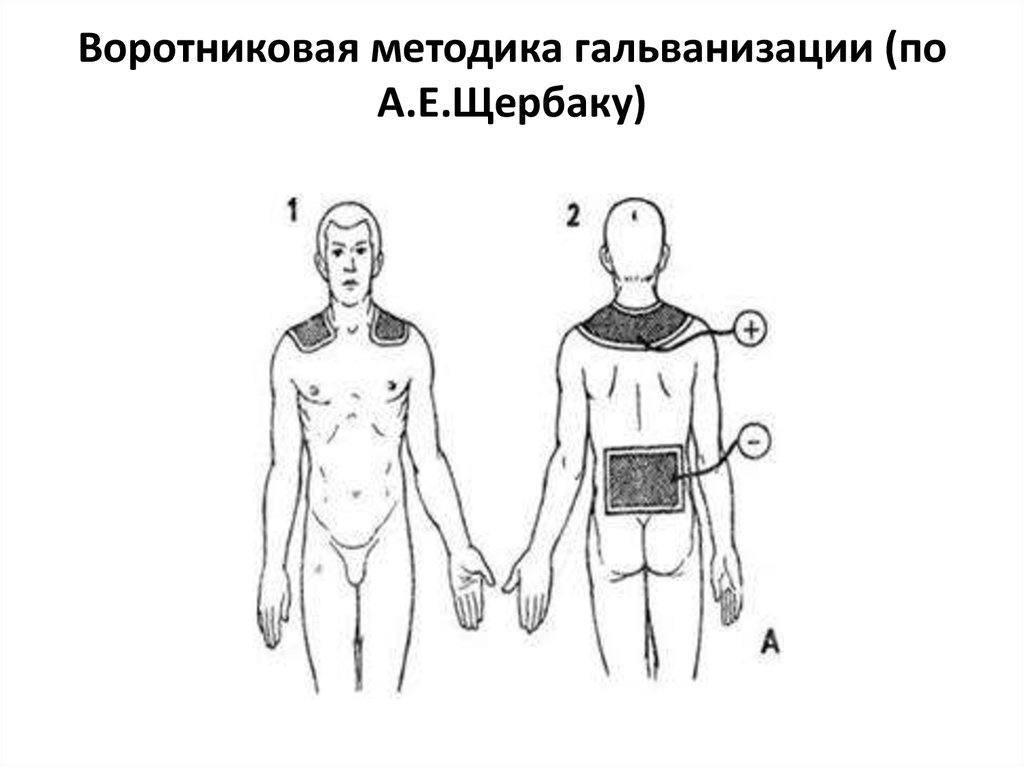
Современные установки для иммуноэлектрофореза основаны на модификациях зонального электрофореза и гель-электрофореза. Иммуноэлектрофорез можно проводить в одномерном или двумерном режиме (Вестермайер и др., 2005; Уокер, 2010).
5. Аффинный электрофорез
Аффинный электрофорез — это тип электрофореза, при котором биомолекула взаимодействует или связывается с другой молекулой, к которой она имеет сродство. Он использует явление, согласно которому электрическая подвижность (µ) изменяется, когда биомолекула, включая нуклеиновые кислоты, белки, пептиды и полисахариды, связывается с другой молекулой, и это изменение электрической подвижности будет отражаться на электрофоретической картине. .
Таким образом, интересующие биомолекулы в образце могут быть выделены на основе их сродства к другой молекуле — независимо от того, склонны ли интересующие биомолекулы связываться с другой молекулой в большей степени, чем другая нежелательная биомолекула. Современные настройки аффинного электрофореза основаны либо на гель-электрофорезе, либо на капиллярном электрофорезе (Kinoshita et al., 2015).
Современные настройки аффинного электрофореза основаны либо на гель-электрофорезе, либо на капиллярном электрофорезе (Kinoshita et al., 2015).
Приборы
Все типы электрофореза разделяют заряженные частицы, пока они погружены в буферный раствор. Для всех форм электрофореза требуется источник питания и устройство для электрофореза, обычно называемое электрофорезом 9.0113 камера . Источник питания подает электрический ток в камеру, которая запускает электрофоретическое разделение. Камера состоит из двух противоположных электродов, катода и анода, и резервуара с буферным раствором, в котором происходит отбор проб и их разделение (Walker, 2010).
Использование источника питания и камеры для электрофореза также требуется для всех видов электрофореза. Однако каждый формат требует специального оборудования для организации процесса разделения. Например, лотки на колесиках, стеклянные пластины и гребни необходимы для гель-электрофореза. Капиллярный электрофорез требует внутренней системы охлаждения, которая эффективно подавляет чрезмерный нагрев и обеспечивает термически стабильные условия во время электрофореза.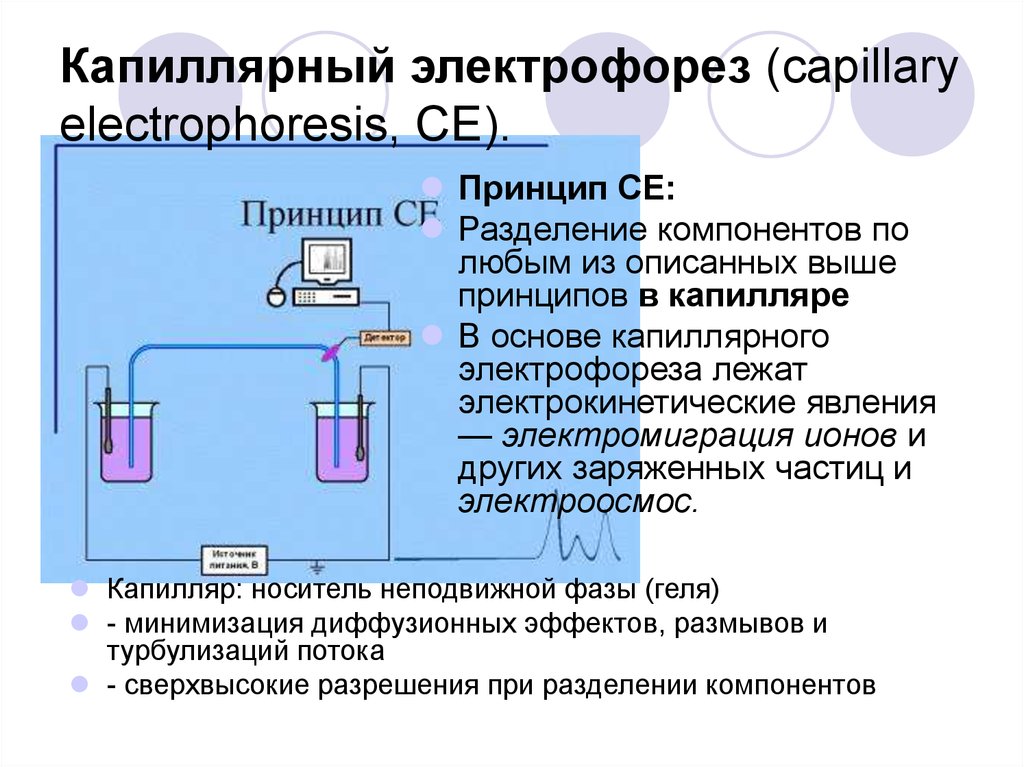
Рисунок 2: Схемы электрофореза блока (A) гель-электрофореза и (B) капиллярного электрофореза
Детектирование электрофоретического разделения
электрофорез — это разделение частиц или компонентов в образце, которые часто невидимы для человеческого глаза. Поэтому для интерпретации результатов, полученных электрофорезом, необходимы дополнительные методы обнаружения и анализа (Jorgenson, 19).86; Уокер, 2010).
Рисунок 3: Пример системы Gel Document System или Gel Doc, оснащенной источником УФ-излучения, подходящего для красителя, который испускает ультрафиолетовую флуоресценцию, когда окрашенные целевые биомолекулы подвергаются воздействию УФ-излучения. Gel Doc можно подключить к компьютерному блоку, что позволяет визуализировать окрашенные гели. (Взято из SynGene)
В случае гель-электрофореза, например, отделенные частицы остаются погруженными в гель, невидимыми при обычном освещении. Чтобы визуализировать характер миграции, гель окрашивают, а затем визуализируют с помощью Gel Documentation System , которая обеспечивает необходимый источник света. Система документации геля часто оснащена камерой, которая может визуализировать визуализацию геля для количественного определения или последующего анализа.
Система документации геля часто оснащена камерой, которая может визуализировать визуализацию геля для количественного определения или последующего анализа.
Методы обнаружения
Существует несколько подходов к обнаружению и визуализации результатов электрофореза, каждый из которых отличается степенью чувствительности и сложности. Общие методы обнаружения следующие (Джоргенсон, 19 лет).86):
- Окрашивание используются различные красители, которые могут связываться с интересующими молекулами. Например, окрашивание кумасси бриллиантовым синим или серебром может связываться с белками. Бромид этидия является примером красителя, который может внедряться между азотистыми основаниями и сильно флуоресцировать в коротковолновом ультрафиолетовом (УФ) свете. Этот подход является распространенным методом обнаружения для гель-электрофореза.
- Авторадиография можно использовать для обнаружения, если интересующие молекулы помечены радиоизотопами.
 По сравнению с окрашиванием авторадиография более чувствительна.
По сравнению с окрашиванием авторадиография более чувствительна. - Онлайн-обнаружение , которое чаще всего является частью автоматизированного оборудования. Для онлайн-обнаружения можно использовать несколько механизмов обнаружения, таких как обнаружение УФ-поглощения, флуоресценции, электрического поля и проводимости. Капиллярный электрофорез и изотахофорез используют этот метод обнаружения.
Помимо авторадиографии, количественное определение разделенных компонентов производится относительно известных стандартов, подвергнутых тому же электрофоретическому разделению. В случае авторадиографии прямой количественный анализ можно провести с помощью денситометра.
Сопутствующие методы
Несколько типов электрофореза могут быть объединены с другими методами либо для исследований, рутинной аналитики, либо для диагностических целей (Walker, 2010).
- Полимеразная цепная реакция (ПЦР) — это метод in vitro , используемый для создания множественных копий определенного участка ДНК.
 ПЦР-амплифицированные продукты в большинстве случаев разделяют гель-электрофорезом или капиллярным электрофорезом. ПЦР в сочетании с разделением и обнаружением с помощью капиллярного электрофореза стала стандартным рутинным методом судебно-медицинского анализа неизвестных образцов ДНК.
ПЦР-амплифицированные продукты в большинстве случаев разделяют гель-электрофорезом или капиллярным электрофорезом. ПЦР в сочетании с разделением и обнаружением с помощью капиллярного электрофореза стала стандартным рутинным методом судебно-медицинского анализа неизвестных образцов ДНК. - Секвенирование по Сэнгеру — это метод секвенирования ДНК, основанный на включении дидезоксинуклеотидов, обрывающих цепь. Традиционно секвенирование по Сэнгеру разрешается с помощью электрофореза в полиакриламидном геле. В настоящее время секвенирование по Сэнгеру разрешается с помощью лазерно-индуцированного капиллярного электрофореза.
- Электроблоттинг относится к методу переноса нуклеиновых кислот (Нозерн-блоттинг для РНК и Саузерн-блоттинг для ДНК) или белков (Вестерн-блоттинг) на мембрану. Обычно его проводят в качестве последующей процедуры после гель-электрофореза, чтобы обеспечить дальнейший анализ разделенных компонентов.
- Профилирование белков с помощью масс-спектрофотометрии (МС) или протеомики — это метод, который пытается определить или идентифицировать белки в данном образце на основе отношения их массы к заряду ионов.
 Перед масс-спектрофотометрией образцы разделяют с помощью определенных форматов или видов электрофореза, обычно в 2D-модели. Затем интересующий компонент подвергается МС для идентификации.
Перед масс-спектрофотометрией образцы разделяют с помощью определенных форматов или видов электрофореза, обычно в 2D-модели. Затем интересующий компонент подвергается МС для идентификации.
В заключение
В целом электрофорез представляет собой метод разделения, который позволяет выделить интересующие биомолекулы или заряженные частицы на основании их подвижности в заданном электрическом поле. Подвижность может быть отражением характеристик интересующих биомолекул или частиц или результатом их взаимодействия с другой молекулой. В сочетании с другими методами электрофорез может стать мощным и универсальным инструментом, применимым для исследований, рутинного анализа и диагностики.
Ссылки
- Беккерс, Дж. Л. (1973). Изотахофорез: некоторые фундаментальные аспекты. (Эйндховен: Technische Hogeschool Eindhoven). https://doi.org/10.6100/IR80190
- Чанг, М., Ким, Д., и Херр, А. Э. (2014). Полимерные просеивающие матрицы в микроаналитическом электрофорезе.

- Гризер, М.Л., и Уоррен, К.М. (2012). Электрофорез белков в агарозных гелях для разделения высокомолекулярных белков. https://doi.org/10.1007/978-1-61779-821-4_10
- Хейгер, Д. (2000). Высокоэффективный капиллярный электрофорез: введение. Технологии Эйджилент.
- Джелум, Э., и Торсруд, А.К. (1982). Клинические применения двумерного электрофореза. Клиническая химия, 28(4), 876–883. https://doi.org/10.1093/clinchem/28.4.876
- Jorgenson, JW (1986). Электрофорез. Аналитическая химия, 58(7), 743A-760A. https://doi.org/10.1021/ac00298a001
- Киношита Э., Киношита-Кикута Э. и Койке Т. (2015). Новейшая технология аффинити-электрофореза. Протеомы, 3(1), 42–55. https://doi.org/10.3390/proteomes3010042
- Новотны, А. (1979). Иммуноэлектрофорез. В «Основных упражнениях по иммунохимии» (стр. 235–237). https://doi.org/10.1007/978-3-642-67356-6_72
- Уокер, Дж. М. (2010). 10 Электрофоретические методы.

 Один электрод помещается внутрь органа, а другой крепится к коже.
Один электрод помещается внутрь органа, а другой крепится к коже.

 Молекулы мигрируют к противоположному заряду. Таким образом, молекула с отрицательным зарядом будет притягиваться к положительному концу (противоположности притягиваются!).
Молекулы мигрируют к противоположному заряду. Таким образом, молекула с отрицательным зарядом будет притягиваться к положительному концу (противоположности притягиваются!).



 Более высокий процент акриламидного геля (10-20%) обычно используется при электрофорезе в полиакриламидном геле с додецилсульфатом натрия (ДСН), при котором белки разделяются в денатурированных условиях в зависимости от их размера (Walker, 2010). ; Чанг, 9 лет0113 и др., 2014).
Более высокий процент акриламидного геля (10-20%) обычно используется при электрофорезе в полиакриламидном геле с додецилсульфатом натрия (ДСН), при котором белки разделяются в денатурированных условиях в зависимости от их размера (Walker, 2010). ; Чанг, 9 лет0113 и др., 2014). 0113 и др. , 2012).
0113 и др. , 2012). По сравнению с окрашиванием авторадиография более чувствительна.
По сравнению с окрашиванием авторадиография более чувствительна. ПЦР-амплифицированные продукты в большинстве случаев разделяют гель-электрофорезом или капиллярным электрофорезом. ПЦР в сочетании с разделением и обнаружением с помощью капиллярного электрофореза стала стандартным рутинным методом судебно-медицинского анализа неизвестных образцов ДНК.
ПЦР-амплифицированные продукты в большинстве случаев разделяют гель-электрофорезом или капиллярным электрофорезом. ПЦР в сочетании с разделением и обнаружением с помощью капиллярного электрофореза стала стандартным рутинным методом судебно-медицинского анализа неизвестных образцов ДНК.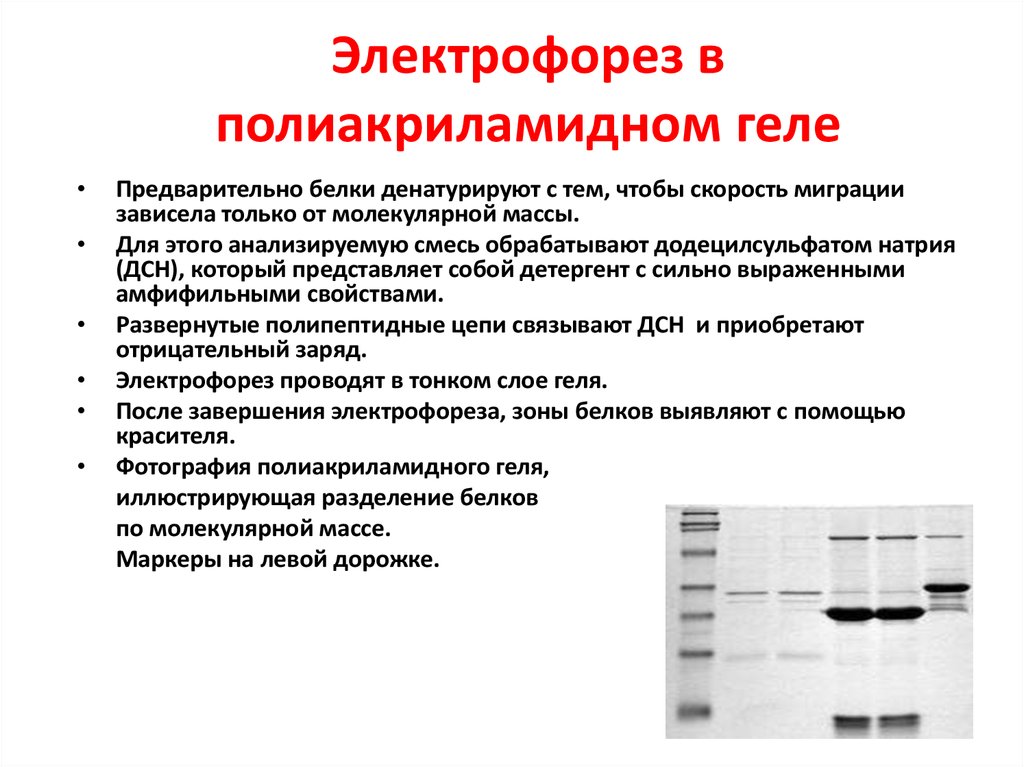 Перед масс-спектрофотометрией образцы разделяют с помощью определенных форматов или видов электрофореза, обычно в 2D-модели. Затем интересующий компонент подвергается МС для идентификации.
Перед масс-спектрофотометрией образцы разделяют с помощью определенных форматов или видов электрофореза, обычно в 2D-модели. Затем интересующий компонент подвергается МС для идентификации.