Клебсиелла в кале у грудничка: опасность, симптомы и лечение
Только при рождении организм малыша начинает заполняться необходимыми микроорганизмами и бактериями, которые в дальнейшем помогают правильно работать всем системам и формируют надежную защиту иммунитета.
Одной из первых заселяется клебсиелла, так как находится практически во всем, что нас окружает. Данная бактерия относится к условно патогенным микроорганизмам, поэтому, когда иммунитет в порядке, то в организме поддерживается оптимальное соотношение полезных и патогенных бактерий.
Однако, любой сбой приводит к тому, что количество патогенных бактерий начинает размножаться и тем самым вызывает определенные нарушения в работе той или иной системы.
Сегодня я предлагаю выяснить, о чем говорит найденная клебсиелла в моче, кишечнике и, соответственно, в кале у грудничка. Давайте разбираться!
Что это такое
Клебсиелла – грамотрицательная палочковидная бактерия.
При этом, действительно данная бактерия может достаточно долго существовать в организме маленького человечка, и вы ничего не будете подозревать. В данном случае ни лечить, ни как-то бороться с ней не требуется.
Однако, если иммунитет грудничка ослабевает или происходят другие явления, которые стимулируют ее рост и размножение, то в этом случае требуется немедленное вмешательство врачей.
Давайте узнаем, что может стать причиной инфицирования и, как следствие, появления повышенного количества бактерий в кале ребенка.
Причины появления клебсиеллы в кале малыша
Начать активный процесс размножения и, соответственно, показывать увеличенные показатели в анализах кала или других забранных биоматериалах клебсиелла может по нескольким причинам.
Внешние причины
- Контакт ребенка со взрослым, который является инфицированным.
- Кормление зараженными продуктами.
- Распространение клебсиеллы через грязные игрушки, посуду, животных. Очень важно соблюдать правила гигиены в уходе за ребенком. Ни в коем случае не разрешается трогать грудничка людям, которые пришли с улицы и не помыли руки, не разрешается также давать грязные продукты питания или не помытые после покупки игрушки. Разумеется, не стоит мыть книги и какие-либо бумажные изделия, а вот пластиковые и мягкие игрушки просто необходимо обрабатывать перед тем, как они попадут в руки или в рот к грудничку.
Внутренние причины
- Ослабленный иммунитет.
- Дисбаланс микрофлоры в кишечнике.
- Нехватка полезных бактерий из-за проведенной антибактериальной терапии.
- Наличие других патогенных микроорганизмов в кишечнике, которые могут нарушать здоровую микрофлору.

- Пищевая аллергия у ребенка.
Малыш рождается с очень слабым иммунитетом, поэтому заражение может произойти как во время родов, так и в первое время после них. Для того, чтобы избежать данной неприятности, необходимо во время беременности максимально защищать себя и плод от заражения различными инфекциями, употреблять достаточное количество витаминов и минералов.
Виды клебсиеллезных поражений
В медицине принято выделять 7 видов этой бактерии, однако наиболее часто встречаемыми в анализах кала и опасными для грудничка являются только два вида:
- клебсиелла окситока;
- пневмония.
Наиболее редкими клебсиеллезными поражениями считаются: сепсис, заболевания мочеполовой системы, инфицирование мозговых оболочек, поражение костей или суставов, клебсиеллезный конъюнктивит.
Симптомы болезни у детей до года
Диагностировать заболевание в домашних условиях достаточно тяжело. Нередко симптомы, которые свидетельствуют о наличии клебсиеллы в кале и в целом – в организме малыша, очень схожи с признаками отравления или дисбактериоза, которые являются частыми заболеваниями в жизни новорожденного. Но все же к симптомам клебсиеллы принято относить:
Но все же к симптомам клебсиеллы принято относить:
Эти симптомы характерны для группы клебсиелла окситока, что же касается клебсиеллы пневмонии, то тут симптомы очень схожи с признаками гриппа или ОРВИ. К ним можно отнести:
- Резкое повышение температуры до 39, а то и выше градусов.
- Затрудненное дыхание и лихорадка.
- Лающий кашель у ребенка в начале недуга.
- На более поздних этапах появляется кашель с выделениями мокроты, в которой могут отмечаться прожилки крови.
Если вы видите у грудничка хотя бы несколько симптомов, то стоит немедленно обратиться к педиатру. Врач сможет назначить необходимые анализы: исследование кала и других биоматериалов, а также другие обследования на наличие патогенных бактерий в организме крохи.
Чем опасна клебиелла в кале для крохи
В случаях, когда иммунитет грудничка в состоянии побороть атаку и размножение клебсиеллы, то тогда возможно появление лишь инфекционного заболевания, которое лечится в очень короткие сроки и проходит без осложнений. Однако, когда лечение затягивается на долгий период и организм крохи не справляется самостоятельно, то в этом случае возможно появление осложнений:
Однако, когда лечение затягивается на долгий период и организм крохи не справляется самостоятельно, то в этом случае возможно появление осложнений:
Кроме того, размножение бактерии может повлечь за собой развитие разных по тяжести заболеваний дыхательной системы, кишечных болезней и сепсиса. Однако, для того, чтобы избежать этих осложнений, необходимо правильно и вовремя диагностировать наличие патогенных микроорганизмов у грудничка.
Диагностика клебсиеллеза
При подозрении у ребенка клебсиеллезной инфекции осмотр проводит врач-гастроэнтеролог или педиатр. Для постановления окончательного диагноза проводится ряд дополнительных исследований. Для этого необходимо сделать забор: кала, мочи, крови, мазка из носовой или ротовой полости, мокроты.
Стоит отметить, что чаще всего врачи диагностируют наличие бактерий клебсиелла пневмония именно в кале, так как она активизируются чаще всего в желудочно-кишечном тракте грудничка.
В очень редких случаях врачи могут обнаружить клебсиеллу в моче.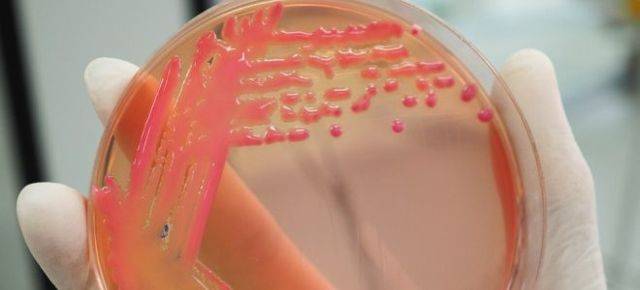
Однако, если в то же время у малыша наблюдается повышенная температура, то это может быть признаком ранней стадии пиелонефрита у крохи. В любом случае лечение может быть назначено только тогда, когда диагноз окончательно подтвержден и болезнь сопровождается несколькими симптомами одновременно.
Как лечить клебсиеллу в кале новорожденного
После того как врачи получили результаты анализов, в которых сказано, что у грудничка обнаружена бактерия клебсиелла в кале или в любом другом биоматериале, а кроме того, болезнь сопровождается рядом симптомов, врач обязан подобрать оптимальное лечение данного заболевания. Есть несколько вариантов развития событий:
- Если заболевание было диагностировано на ранних сроках, то назначаются щадящие средства для лечения: синбиотики, бактериофаги, пребиотики. Их задачей является восстановление микрофлоры в кишечнике и, соответственно, организм потом сам сможет справиться с процессом размножения этих бактерий.

- Если же болезнь находится на более поздней стадии или протекает тяжело, то тут никак не обойтись без антибиотиков. Однако, дозировка назначается врачом, исходя из индивидуального состояния здоровья грудничка. Кроме того, прием лекарственных средств также происходит под чутким наблюдением врача. Дополнительно маленькому пациенту могут быть назначены препараты, которые будут вытеснять лишние микроорганизмы из желудочно-кишечного тракта, а также для поднятия иммунитета и восстановления полноценной работы кишечника. На время лечения и восстановительного периода грудничку может быть назначена щадящая диета, которая будет исключать механические и химические раздражители. Если же малыш находится полностью на грудном вскармливании, то корректировке подлежит рацион молодой мамы.
Реабилитация после лечения
После пройденного курса лечения грудничку могут назначить несколько манипуляций для более быстрого восстановления организма. К ним относятся:
- Продолжение приема пробиотиков для восстановления микрофлоры кишечника и налаживания пищеварения.

- ЛФК, витаминные комплексы, закаливание для повышения иммунитета малыша.
- Травяные сборы, которые направлены на восстановление организма и на поднятие иммунитета.
Как избежать клебсиеллеза у ребенка
Если в результатах анализа забранного кала, мочи или другого биоматериала врач увидел незначительное увеличение показателей данной бактерии, то не стоит паниковать. Во всем и всегда придерживайтесь здравого смысла. Если вы начнете лечить болезнь на этом этапе, то вы не дадите возможности организму и иммунной системе крохи «постоять за себя».
Однако в любом случае наиболее правильным вариантом считается выполнение простых правил и манипуляций, которые помогут избежать данного заболевания. К методам профилактики этого заболевания относят:
- Женщины во время беременности не должны пропускать назначенные приемы врача, кроме того, вы должны регулярно сдавать все анализы, которые показывают наличие патогенных бактерий. В случае, если результаты будут положительными, то вы сможете вовремя принять необходимые меры.

- Питание будущей матери должно включать оптимальное количество витаминов, минералов и микроэлементов. Все мы знаем, что пузожителю достается львиная доля всех этих элементов. Именно они влияют на развитие и формирование основных систем в организме малыша.
- Не стоит отказываться от грудного вскармливания. Дело в том, что грудное молоко помогает сформировать сильный иммунитет крохи.
- Родителям всегда стоит помнить о том, что помещение, в котором находится кроха, необходимо всегда поддерживать в чистоте.
- Всегда следите за состоянием здоровья малыша. Всегда обращайте внимание на любые недомогания крохи и старайтесь как можно скорее поднять его на ноги. Кроме того, следите и за рационом грудничка. Он должен быть богатым на витамины и минералы. Таким образом вы сможете построить крепкий иммунитет ребенка.
- Следите за чистотой посуды и предметов, которые окружают его, особенно за теми, с которыми кроха чаще всего контактирует.
- Уделяйте грудничку достаточное количество внимания и прививайте с самого раннего возраста правила личной гигиены.

Все эти рекомендации помогут вам сформировать крепкий иммунитет у малыша и предотвратить вероятность инфицирования маленького крохи.
Видео
Я предлагаю вам посмотреть небольшой видеосюжет, в котором врач-педиатр рассказывает о возможных кишечных инфекциях у ребенка, а также акцентирует внимание на вопросе появления кебсиеллы в кале грудничка. Кроме того, в данном ролике вы узнаете, как правильно лечить и что делать, если у грудничка обнаружили клебсиеллу пневмонии в кале или в других испражнениях малыша.
Кишечные инфекции – это наверное одно из самых распространенных заболеваний, с которым сталкиваются груднички и их родители. В таком возрасте данные заболевания с трудом поддаются диагностике, однако, только правильное и своевременное постановление диагноза и выполненные все рекомендации врача могут привести к хорошему результату.
Сегодня мы обсудили с вами такое заболевание как клебсиеллез у грудничков. Чаще всего эту бактерию диагностируют именно в кале, так как кишечник – это то место, где активизируется размножение бактерии. Поделитесь теперь вы с нами в х на сайте, находили ли у вашего малыша эту бактерию в кале или других биоматериалах, какое лечение было назначено, и как быстро наступило полное выздоровление.
Поделитесь теперь вы с нами в х на сайте, находили ли у вашего малыша эту бактерию в кале или других биоматериалах, какое лечение было назначено, и как быстро наступило полное выздоровление.
Клебсиелла у грудничка: причины, симптомы, диагностика и лечение клебсиеллеза
Эта разновидность микроорганизмов может “мирно” существовать в организме здорового человека, обитая на слизистых оболочках или коже и не принося человеку абсолютно никакого вреда. Ребенок может активно потреблять возбудителя через пищу, воду и воздух, и до тех пор, пока иммунитет будет в норме, бактерия не сможет себя проявить.
Новорожденные детки не могут похвастаться отменным иммунитетом – сразу после рождения защитные механизмы организма находятся в крайне ослабленном состоянии, поэтому развитие клебсиеллы у грудничков – распространённое явление.
С первых минут жизни все внутренние органы и системы жизнедеятельности грудничка находятся в состоянии дозревания, именно поэтому нет ничего удивительного в том, что малыши могут страдать от бактерий, которых назвать патогенными можно лишь условно. Такими является не только клебсиелла, к примеру, тот же стафилококк – яркий пример патогенного организма мирно живущего в кожных покровах, но в неблагоприятных условиях, приносящий серьезный вред.
Такими является не только клебсиелла, к примеру, тот же стафилококк – яркий пример патогенного организма мирно живущего в кожных покровах, но в неблагоприятных условиях, приносящий серьезный вред.
Представители такой разновидности микроорганизмов как энтеробактерии обитают в кишечнике и представляют собой привычных представителей кишечной микрофлоры.
Так выглядит бактерия клебсиеллы у ребенка под микроскопом
Клебсиелла – один из представителей энтеробактерий, имеет вид палочки, длиной порядка 6,0 мкм и относится к типу анаэробных, то есть организм предпочитает размножаться без кислорода.
Услышав это, многие успокаиваются, так как полагают, что в воздухе этому одноклеточному организму делать нечего, однако данный возбудитель отлично чувствует себя в воздушной среде, воде, пищевых продуктах, почве, потому что обладает прочной капсулой, в которой её жизнедеятельности ничего не угрожает. При кипячении, клебсиелла, естественно гибнет.
Существует 8 видов микробов данного типа, которые имеют разные числа антигенов. Тем не менее, патогенной является бактерия Фриндлера (клебсиелла пневмония) и клебсиелла окситока у грудничка.
Тем не менее, патогенной является бактерия Фриндлера (клебсиелла пневмония) и клебсиелла окситока у грудничка.
Эти бактерии предпочитают обитать в пищеварительной системе, в слизистых оболочках дыхательных путей, а также в кожном покрове.
Иммунная система грудничка находится на начальных стадиях формирования, поэтому слизистые оболочки новорожденных настолько стерильны, что рост возбудителя способен нанести детскому организму крайне серьезный урон.
Бактерия Фриндлера – обитает в дыхательных путях, в то время как клебсиелла в кишечнике у грудничка является признаком заражения окситокой.
Причины клебсиеллеза у детей: пути передачи и факторы риска
Факторы риска и основные причины заболевания бактерией клебсиелла у грудничка, по Комаровскому, можно разделить как внешние и внутренние (экзогенные и эндогенные).
Внешние
- заражение воздушно-капельным путем, то есть когда ребенок заражается от взрослых. Иммунитет взрослого человека при этом спокойно воспринимает клебсиеллу в то время, как для неокрепшего организма это является серьезным испытанием;
- заражение бытовым (контактным) способом.
 Речь о передаче микроба через пустышку, тарелку, погремушку и прочие предметы, на которых может оказаться микроб;
Речь о передаче микроба через пустышку, тарелку, погремушку и прочие предметы, на которых может оказаться микроб; - пищевой способ. Нужно помнить, что организм очень хорошо развивается в кисломолочных и мясных продуктах.
Внутренние
- ослабление защитных механизмов, явное угнетение иммунной системы;
- ослабление микрофлоры. Это, как правило, имеет место после приема антибиотиков или в результате недавно вылеченной кишечной инфекции;
- аллергия. У многих деток, подверженных к различным пищевым аллергиям, есть риск заболеть клебсиеллой.
Очень часто бактерия “сотрудничает” со стафилококком, уничтожая лактобактерии, которые необходимы организму, они снижают микрофлору кишечника, тем самым подготавливая организм к дальнейшему удару.
Первые симптомы
В большинстве случаев, у деток активация клебсиеллы приводит к заболеваниям желудочно-кишечного тракта. Перечислим основные симптомы клебсиеллы у грудничка:
- Дефекация: примесь крови в кале, учащенные позывы, слизь или остатки непереваренной пищи, зеленоватый цвет кала – всё это не окончательные, но характерные симптомы клебсиеллеза;
- сильная боль в области живота;
- тошнота и частые срыгивания;
- повышение температуры до 39°С;
- отсутствие аппетита.

В случае если лечение не начать своевременно, у малыша может начаться обезвоживание. Чтобы этого избежать, применяется препарат Регидрон. Пневмония, вызванная клебсиеллой, у новорожденных сопровождается следующими признаками:
- резкое и острое начало заболевания;
- высокая температура, как правило выше 39°С;
- сильный кашель, в выделяемой мокроте могут содержаться прожилки крови.
Какие заболевания вызывает: виды поражений
Бактерия способна вызвать:
- заболевания желудочно-кишечного тракта, такие как гастрит, а также острые кишечные инфекции;
- пневмонию и прочите заболевания дыхательных путей, таких как гайморит или ринит;
- конъюнктивит и прочие воспалительные процессы слизистых оболочек;
- вагинит у девочек, а также такие заболевания как цистит и пиелонефрит;
- болезни костной системы, воспаления суставов;
Особо часто клебсиеллезу подвержены новорожденные дети, которые пережили родовые травмы
Особо клебсиеллезу подвержены малыши, которые пережили родовые травмы (в т. ч. гематомы на головке), тяжелые заболевания (даже полное излечение приводит к сильному падению иммунитету и большому риску), а также недоношенные детки.
ч. гематомы на головке), тяжелые заболевания (даже полное излечение приводит к сильному падению иммунитету и большому риску), а также недоношенные детки.
Зачастую дети из этой группы заражаются клебсиеллой при больничном режиме, то есть подхватывают ее во время лечения.
Поскольку для крепкого организма бактерия не представляет опасности, то найденная клебсиелла в кале у грудничка – не повод бить тревогу. Переходить к лечению следует лишь тогда, когда у малыша появились явные симптомы болезни.
Диагностика
Основным принципом, которые применяются при диагностике клебсиеллы является в микробиологии выделение и идентификация бактерии.
Для исследования принимается кровь, спинномозговая жидкость, анализ кала и пр. После взятия образцов, их засевают на среду К-2 (которая содержит мочевину, рафинозу). Возбудитель обнаруживается как сочный, блестящий и зеленовато-голубой организм.
Лечение: терапевтическая тактика
В случаях, если клебсиеллой поражен кишечник, то назначают:
- антисептики, такие как Нитроксолин, Фуразолидон, Гентамицин, Амикацин, Сизомицин, Тобрамицин или цефалоспорины 2 и 3 поколений, такие как Цефуроксим, Цефамандол, Цефотаксим, Цефтриаксон;
- бактериофаги – вирусные препараты, уничтожающие клебсиеллу, но не влияющие на организм;
- ферменты, такие как Бифиформ, Линекс, Фестал, Панкреатин;
- растворы, применяемые для регидратации;
Если инфекция приобрела системный характер, то применяют:
- антибиотики, к которым чувствителен возбудитель во время посева;
- стимуляторы иммунной системы.

Лечение клебсиеллы продолжается, как правило, на протяжении от одной до трех недель. Ребенку всё это время необходимо находиться на диете, которая представляет собой продукты, содержащие легкоусвояемые витамины.
В случае, если ребенок питается исключительно грудным молоком, то необходима полная коррекция питания кормящей мамы.
Если заболевание проявляет себя не чрезмерно агрессивно, признаки выражены незначительно, то допускается лечение дома под присмотром лечащего педиатра.
Чем опасны для младенцев: осложнения и последствия
Инфекция может вызывать деструкцию дыхательных путей, сепсис, менингит и энцефалит
Клебсиелла способна приводить к деструкциям тканей дыхательных путей и легких. В воспаленных участках может образоваться абсцесс.
Из внелегочных осложнений следует отметить:
- менингит;
- в случаях попадания бактерий в кровь, клебсиелла способна вызвать сепсис – крайне опасное состояние;
- энцефалит;
- абсцессы в почках;
- поражения зева;
- эндокардиты.

При таких осложнениях возбудителя можно обнаружить в моче. Жизнедеятельность возбудителя сопровождается выделением токсинов, поэтому при сильном заражении у ребенка может возникнуть инфекционный шок. Симптомы такого состояния включают заметное снижение давления и нарушение работы внутренних органов. Зачастую, подобное наблюдается при попытках лечить клебсиеллез народными способами.
Реабилитация после лечения
После того как лечение клебсиеллы у грудничка завершено, ребенку необходимо восстановить микрофлору и наладить работу желудочно-кишечного тракта. Для этого, как правило, назначают:
- прием пробиотиков;
- прием витаминных препаратов;
- лечебно-физические упражнения и оздоровительный массаж
- сборы трав.
Профилактика
Для того чтобы избежать заражения клебсиеллами, нужно соблюдать противоэпидемические правила в:
- роддомах;
- больницах, стационарах, хирургических отделениях;
- отделениях для новорожденных.

Более активно защитить ребенка от клебсиеллы может клебсиеллезная вакцина.
Зачастую после первого курса антибактериальных препаратов, назначают сразу же второй курс. Если существенных изменений после этого нет, должен быть выполнен посев, с целью определить чувствительность организма ребенка к антибиотику. Иначе, получается, что клебсиеллу лечат вслепую.
Также возможно, что клебсиелла была уничтожена, но теперь ребенок страдает от дисбактериоза, симптомы которого очень близки к клебсиеллезу. В таких случаях необходимо сдавать контрольный анализ и решать, что делать далее – пить пребиотики, восстанавливая микрофлору, или далее лечить клебсиеллу.
Всем родителям, которые планируют завести ребенка на заметку: выявленная у будущей матери клебсиелла, не является ни в коем случае показанием к прерыванию беременности. В случаях, когда подобное происходит, необходима консультация специалистов и назначение полного и щадящего для плода лечения, с регулярным наблюдением ребенка.
Многим родителям требуется помнить, что, после рождения, наличие таких организмов как клебсиелла или стафилококк – нормальное явление. Если вы сдали анализы и копрограмма оказалась в норме – это означает, что концентрация клебсиеллы не опасна для здоровья.
Любые проявления сбоев пищеварительной системы при нормальных анализах, означают, что причины расстройств не в клебсиелле. Чрезмерное лечение этого заболевания, в случаях когда его толком нет, но клебсиелла была обнаружена в малом количестве может приводить к дисбактериозам.
Клебсиелла пневмония в кале у грудничка: симптомы, норма в анализе у ребенка
Если у новорожденного или ребенка старшего возраста сильно болит живот, наблюдается усиленный метеоризм или диарея, причиной того может быть клебсиеллезная инфекция.
Клебсиелла (Klebsiella) – это неподвижная энтеробактерия палочковидной формы, относящаяся к классу грамотрицательной флоры. Бактерия может располагаться короткими цепочками или по одной штуке. Палочка покрыта защитной капсулой, что позволяет сохранять ей жизнеспособность в довольно агрессивной среде обитания. Она не боится низких и высоких температур, но при кипячении гибнет.
Палочка покрыта защитной капсулой, что позволяет сохранять ей жизнеспособность в довольно агрессивной среде обитания. Она не боится низких и высоких температур, но при кипячении гибнет.
В организме есть тип микрофлоры, которую называют условно-патогенной. То есть это такие бактерии, которые в состоянии покоя и определенном количестве не приносят вред здоровью.
Но при некоторых условиях они начинают размножаться и паразитировать, вызывая патогенные процессы в организме.
К такому типу бактерий относятся цитробактер, хеликобактер пилори, стрептококк, золотистый стафилококк и клебсиелла, а также почти все семейство энтеробактерий.
Клебсиелла находится в кале у грудничка постоянно, поскольку является неотъемлемой частью его микрофлоры, как и любого другого человека. Тем не менее, заболеванию подвержены больше всего именно новорожденные из-за несформировавшегося полностью желудочно-кишечного тракта.
Разновидности бактерии
Ученые выделают восемь типов палочки, но часто встречающимися и наиболее опасными для новорожденного являются только два:
- клебсиелла пневмония (pneumoniae) или так называемая палочка Фридлендера,
- клебсиелла окситока (oxytoca).

Факторы риска или основные причины болезни
Активизироваться и стать патогенной бактерия в организме у ребенка может по разным причинам, как внешним, так и внутренним:
- от больного взрослого воздушно-капельным путем,
- через бытовой контакт (грязные руки, плохо вымытую посуду, соску, шерсть животных),
- через еду (мясо или кисломолочные продукты).
- в результате снижения иммунитета,
- в результате нарушения баланса бактерий в микрофлоре кишечника (дисбактериоз),
- пищевая аллергия.
Также развитию заболевания у малышей способствует недоношенность, прием антибиотиков, патологические роды, врожденные пороки сердца, респираторные вирусные заболевания.
Клебсиелла в кале как у взрослого, так и ребенка не является опасной до тех пор, пока остается в пределах толстого кишечника и ее количество не увеличивается выше нормы.
Активизация и проникновение в другие органы ведет за собой развитие патогенных процессов.
Формы заболевания и возможные осложнения
Возбудитель может вызывать различные болезни в зависимости от того, какой он орган поражает. Чаще всего у детей развивается кишечная инфекция (клебсиеллезный гастроэнтерит), немного реже – воспаление легких клебсиеллезной природы.
Редко, но все же клебсиеллез может бывать в следующих формах:
- конъюнктивит,
- клебсиеллезный сепсис, поражающий ткани костей и суставов,
- заболевания мочеполовой системы.
При несвоевременном лечении и позднем обнаружении заболевания, оно может вызывать ряд серьезных осложнений, таких как дыхательная недостаточность, менингит, миокардит, токсический гепатит, геморрагический синдром.
Клиническая картина заболевания
Условно симптомы недуга можно поделить на две большие группы, в зависимости от того, какой орган поражает бактерия.
Основные признаки со стороны легких
Клебсиеллезная пневмония очень похожа на обычную, то есть пневмококковой природы.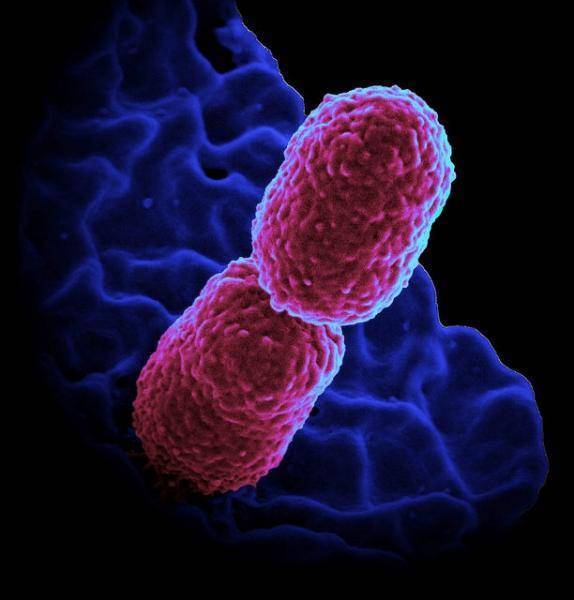 Болезнь развивается остро. Температура тела повышается, может достигать 39 гр. и выше. Начинается сильный кашель, который может сопровождаться вязкой кровянистой мокротой, ознобом. При прослушивании отчетливо ощущаются влажные хрипы и ослабленное дыхание в районе очага инфекции. Клебсиелла «пневмония» в кале существенно превышает норму. На рентгеновском снимке может быть обнаружена мелко- или крупноочаговое, а также долевое воспаление.
Болезнь развивается остро. Температура тела повышается, может достигать 39 гр. и выше. Начинается сильный кашель, который может сопровождаться вязкой кровянистой мокротой, ознобом. При прослушивании отчетливо ощущаются влажные хрипы и ослабленное дыхание в районе очага инфекции. Клебсиелла «пневмония» в кале существенно превышает норму. На рентгеновском снимке может быть обнаружена мелко- или крупноочаговое, а также долевое воспаление.
Патологический процесс развивается альвеолярно, может наблюдаться скапливание жидкости и присоединяться геморрагический компонент (кровоточивость слизистых оболочек). Часто пневмония клебсиеллезного патогенеза имеет склонность к гнойному воспалению тканей (абсцедированию).
Основные проявления со стороны ЖКТ
По симптоматике кишечный клебсиеллез может напоминать энтероколит, энтерит и др. заболевания ЖКТ.
Болезнь характеризуется учащением и разжижением стула, повышением температуры тела, рвотой и срыгиванием (у грудничков).
Испражнения обильные, желто-зеленоватого цвета, имеют непереваренные частицы еды и примеси слизи. В некоторых случаях в каловых массах могут наблюдаться кровянистые сеточки.
В некоторых случаях в каловых массах могут наблюдаться кровянистые сеточки.
Заболевание сопровождается болевыми приступообразными ощущениями в области живота. У малышей и детей старшего возраста наблюдается дискомфорт и беспокойство во время пальпации.
На протяжении всего обострения температура тела держится высокой, может немного снизиться на 5-е сутки. Начало болезни сопровождается частой рвотой, через несколько дней она проходит или случается редко. Обычно на третьи сутки начинается диарея, которая может продолжаться до 10 дней.
Для тяжелых форм заболевания характерны токсикоз (отравление токсинами) и обезвоживание организма в результате сильной рвоты и диареи. Могут фиксироваться такие признаки, как заторможенность, вялость, отсутствие аппетита, отказ от груди, метаболические нарушения.
Изменений в печени, селезенке и других паренхиматозных органах нет. В случае, если клебсиелла в кале у ребенка существенно выше нормы, наблюдается умеренный лейкоцитоз, у новорожденных — гиперлейкоцитоз и анемия, может повышаться СОЭ.
У новорожденных и грудничков болезнь часто протекает в тяжелой форме с потерей веса. Кожа приобретает бледный, немного сероватый оттенок, могут снижаться рефлекторные функции (гипорефлексия) и проявляться синюшность конечностей и слизистых оболочек.
Диагностика и лечение
Основное значение при постановке диагноза имеет анализ кала на клебсиеллу, а также дополнительные бактериологические исследования мочи, крови, рвотных масс, мокроты.Обнаруженная клебсиелла «окситока» или другой штамм в кале еще сама по себе не говорит о заболевании. Ведь ее норма составляет 105 единиц на 1 г каловых масс.
О развитии патогенных процессов стоит говорить при показателях 10 в 6 степени, 7-й, 10 в 8 степени и выше. Очень часто повышенный уровень клебсиеллы обнаруживают вместе с высокой активностью стафилококка.
Также во время диагностики могут использовать динамику титров антител в крови — противоклебсиеллезных агглютининов. Показатели колеблются в районе 1:20- 1:80.
- Поскольку клебсиэлла не имеет специфических симптомов, и ее клиническая картина характерна для многих других болезней, то точный диагноз может быть установлен только после осмотра гастроэнтеролога или инфекциониста и бактериологических исследований на клебсиеллу.

- Новорожденные и дети младшего возраста с признаками дегидратации и токсикоза подлежат немедленной госпитализации.
- В зависимости от формы и тяжести заболевания врач может назначить следующие препараты:
- антибиотики широкого спектра действия,
- бактериофаги – препараты избирательного действия, то есть, направлены на уничтожение конкретной бактерии (могут быть комплексными, поливалентными, направленными на определенный штамм бактерии),
- пробиотики,
- ферменты,
- растворы для восстановления водного баланса,
- в некоторых случаях могут назначаться иммуномодуляторы.
Помимо медикаментозного лечения рекомендуется щадящее диетическое питание.
Восстановление и профилактика
После лечения и купирования симптомов врач обычно назначает комплекс витаминов, массаж и ЛФК, и рекомендует продолжить курс восстановления кишечной микрофлоры и налаживания пищеварения пробиотиками и ферментами.
Профилактика недуга проста, и заключается в выполнении небольшого комплекса правил и рекомендаций:
- соблюдение гигиены на должном уровне, как личной, так и малыша,
- продолжительное грудное вскармливание, введение прикорма согласно возрасту, укрепление иммунитета, адекватное лечение ОРВИ,
- соблюдение санитарно-противоэпидемического режима в роддоме и стационарных отделениях больницы.
Кишечная инфекция или пневмония, вызванная клебсиеллой, — нередкое заболевание, которое может сопровождаться значительной тяжестью протекания, особенно у новорожденных. Но, несмотря на это, имеет благоприятный прогноз на полное выздоровление. Правильное и своевременное лечение проходит без осложнений и не вызывает последствий.
Загрузка…
Клебсиелла у детей — Бактерия клебсиелла в кале у детей, симптомы и лечение
Последнее обновление — 6 ноября 2017 в 21:04
Время на чтение: 4 мин
Нормальная микрофлора состоит из «хороших» и «плохих» бактерий. Для любого родителя диагноз клебсиелла у грудничка звучит грозно. Наш организм постоянно поддерживает равный баланс между всеми бактериями. Бактерии составляют нормальную микрофлору нашей кожи, слизистых и живут внутри нашего кишечника.
Для любого родителя диагноз клебсиелла у грудничка звучит грозно. Наш организм постоянно поддерживает равный баланс между всеми бактериями. Бактерии составляют нормальную микрофлору нашей кожи, слизистых и живут внутри нашего кишечника.
Клебсиелла – одна из таких бактерий. Она также содержится в атмосфере, в которой мы живем: в воде, земле, пыли, и даже нашей еде. Случайная находка клебсиеллы в кале с отсутствием основных симптомов далеко не всегда требует лечения.
Наш иммунитет ежедневно успешно борется с вредоносными бактериями, но иногда иммунитет ослабевает, что и приводит к «победе» клебсиеллы над нормальной «хорошей» микрофлорой.
Существует несколько видов клебсиелл:
- Klebsiella pneumoniae (палочка Фридлендера) – «клебсиелла пневмония» поражает легочную ткань, вызывает всем известное заболевание — пневмонию.
- Klebsiella oxytoca – заселяется в кишечнике, вызывает тяжелое поражение кишечника на фоне общего дисбактериоза.
 Основные симптомы — температура, тошнота со рвотой, слабость и понос.
Основные симптомы — температура, тошнота со рвотой, слабость и понос. - Klebsiella rhinoscleromatis (палочка Фриша-Волковича) – поражает слизистую оболочку носа и дыхательные пути.
- Klebsiella ozaenae (палочка Абеля-Лавенберга) – вызывает хронические болезни носоглотки с характерным зловонным запахом.
Особенности клебсиеллы
Каждая бактерия обладает определенными и характерными свойствами. Клебсиеллы не двигаются, не образуют спор, имеют особое капсульное строение, за счет этого они устойчивы и долго сохраняются в почве, в водах, и в бытовых условиях.
По классификации она относится к классу анаэробов, это обозначает способность размножаться при отсутствии доступа к кислороду. В условиях комнатной температуры, в холодильной камере, они выживают, и отлично размножаются в молоке. При кипячении до 65 градусов Цельсия начинают погибать в течение одного – полутора часов.
Поскольку клебсиелла способна нанести удар только по ослабленному организму, в основной группе риска:
- Ослабленные лица, после перенесенных оперативных вмешательств.

- Новорожденные и грудные дети.
- Беременные женщины.
- Люди пожилого возраста.
Осложнение состояния здоровья на фоне такой бактерии, как клебсиелла у новорожденных детей встречается довольно часто. Поскольку они рождаются с неокрепшей иммунной системой. Симптомы заражения клебсиеллезной инфекцией очень неоднозначны и часто путаются со многими заболеваниями кишечника и желудка.
Именно поэтому лечение порой не помогает, поскольку назначается неверно. В самые первые месяцы после рождения младенец очень уязвим, родители должны беречь его от лишних контактов и внимательно наблюдать за всеми возможными изменениями в поведении и самочувствии малыша.
При малейшем подозрении врача — педиатра на кишечную инфекцию сразу назначается анализ кала. Довольно часто появляется клебсиелла в кале у ребенка. Не всегда нужно сразу бросаться в панику и пытаться это лечить, потому, что данная бактерия в норме должна быть в кишечнике, важна концентрация.
Но есть особые симптомы, когда лечение необходимо.
Симптомы клебсиеллы у детей
Вздутие живота:
- Обильные срыгивания, иногда фонтаном (рвота).
- Повышенное газообразование (метеоризм).
- Капризы и плач на фоне сильной боли в животе.
- Слизь в кале или/и кровяные вкрапления. Неприятный кисломолочный запах.
- Повышенная температура тела.
Лечение клебсиеллезной кишечной инфекции
Клебсиелла у грудничка довольно серьезное состояние, требующее лечения. Обычно назначаются кишечные антисептики, способные снять воспаление, пробиотики для заселения «хорошей» микрофлоры, ферментные препараты для улучшения пищеварения и регидрон (раствор, восстанавливающий баланс потерянной жидкости).
Не менее важно назначение особых растворов для приема внутрь, иногда и в виде клизмы, называемые бактериофагами. Бактериофаги помогают организму справиться с патогенной микрофлорой и полностью уничтожают и останавливают рост бактерии клебсиелла у детей.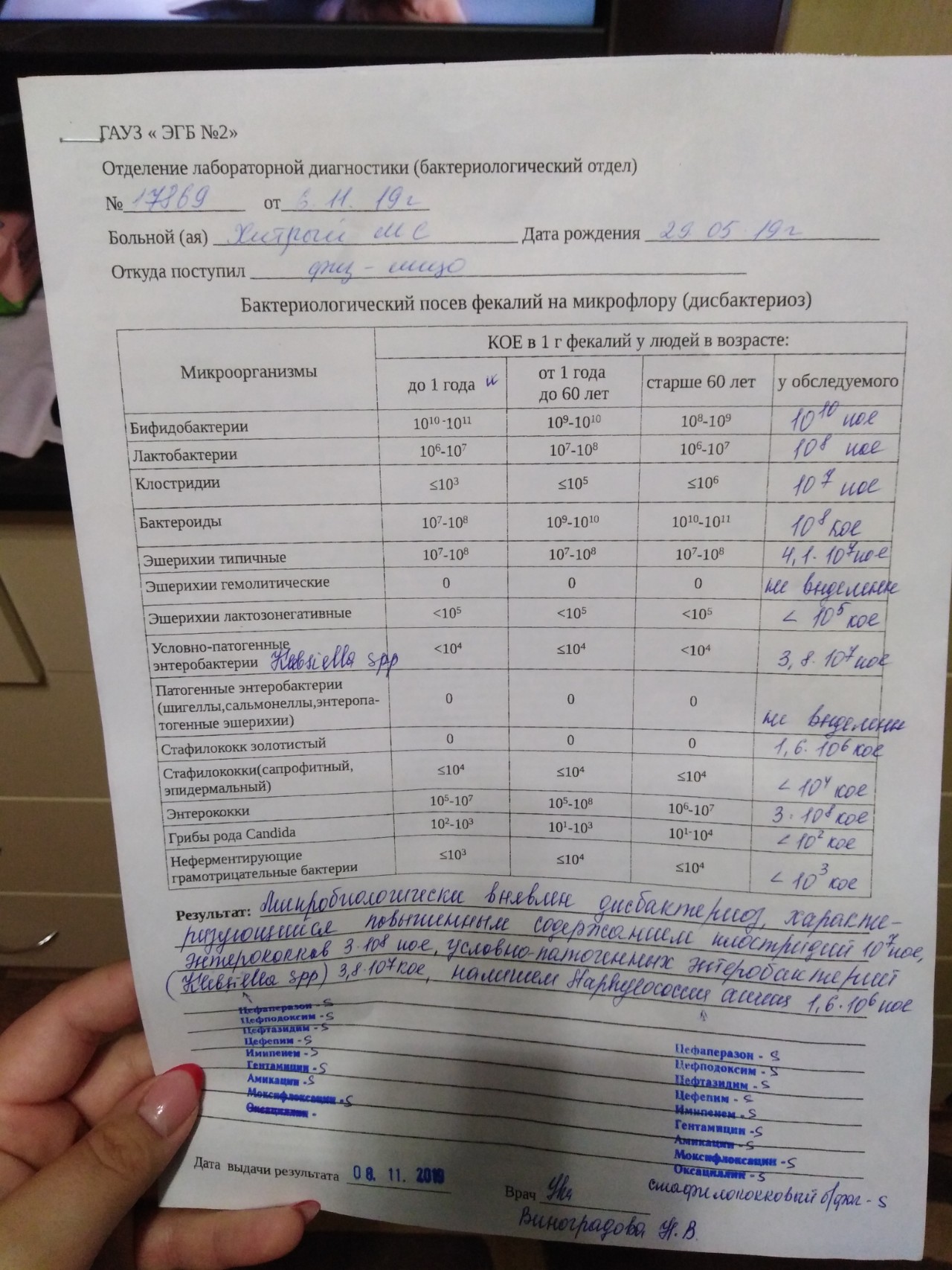
Лекарство необходимо давать в дозировке прописанной врачом — педиатром или врачом — инфекционистом перед кормлением грудного ребенка.
Причины возникновения заболеваний, вызываемых клебсиеллой
В простонародье кишечные инфекции давно называют «болезнью немытых рук». А ведь это не просто так. Чаще всего заражение может произойти из-за несоблюдения элементарных правил санитарной гигиены.
Назовем основные причины:
- Не соблюдение правил личной гигиены при кормлении малыша грудью. Чаще всего встречается клебсиелла окситока у новорожденных. Поинтересуйтесь заранее у вашего педиатра или консультанта по грудному вскармливанию, как правильно ухаживать, как часто мыть грудь.
- Аллергические состояния. Любая аллергия ослабляет организм. Поэтому минимизируйте контакты с аллергенами себя и своего грудного ребенка. Необходимо также подобрать правильное лечение аллергии у малыша и мамы, кормящей грудью.

- Недостаточная развитость иммунитета ребенка. Грудной ребенок появляется на свет как «чистый лист» и очень уязвим. Для развития хорошего иммунитета требуется время. Поэтому минимизируйте контакты с посторонними людьми, когда это возможно. Кормление грудью также способствует становлению хорошего иммунитета, так как материнское молоко содержит природные иммуноглобулины.
- Ослабление иммунных функций организма после лечения от перенесенной болезни. Полное выздоровление от обычного ОРЗ (например) колеблется от двух до трех недель после возобновления хорошего самочувствия. Особенно берегите малыша в это время.
- Недостаток витаминов и питательных веществ. Если вы кормите ребенка грудью, то следите за своим питанием. Питание должно быть разнообразным и полезным. Подробнее об этом вам может рассказать врач — гинеколог в роддоме или консультант по ГВ.
- Лечение малыша антибиотиками. Антибиотики спасли миллиарды жизней людям на всей планете, они помогают от самых различных недугов.
 Но часто они, же приводят к дисбактериозу. Поэтому в обязательном порядке после лечения антибиотиками нужно проводить восстановительную терапию. Прием лакто и бифидо — бактерий для восстановления микрофлоры кишечника.
Но часто они, же приводят к дисбактериозу. Поэтому в обязательном порядке после лечения антибиотиками нужно проводить восстановительную терапию. Прием лакто и бифидо — бактерий для восстановления микрофлоры кишечника.
В мире появилась «кошмарная» супербактерия, борьбу с которой уже обсуждают в ООН
Микроорганизмы, которые представляют угрозу для всего человечества! Так медики в разных странах сейчас говорят о супербактерии, которую врачи еще называют «кошмарной» за свойство противостоять любым антибиотикам. Проблему всерьез обсуждают уже в Организации Объединенных Наций после того, как недавно в США выявили новый опасный штамм. Он стал причиной смерти пожилой американки. Как противостоять супербактерии ученые пока не придумали, но зато найдет ответ на вопрос откуда она взялась.
История начиналась как триллер. Об эпидемии, способной убить человечество. Загадочная пряная Индия. Туристка из США. Смерть по прилету домой. И бактерия. Нет, не таинственная. Давно известная «клебсиелла пневмония». Но, этот штамм оказался неуязвимым.
Давно известная «клебсиелла пневмония». Но, этот штамм оказался неуязвимым.
«Обычная инфекция, которая, в принципе, есть в кишечнике. У нее это стало патогенным. И ни один известный антибиотик, из всех двадцати шести, которые применяются в Соединенных Штатах, не могли помочь», — рассказал специальный представитель ВОЗ в Российской Федерации Гайк Никогосян.
Супербактерию ученые ждали давно. По сути, человек создал ее сам, принимая антибиотики. Не те и не так, как надо. Обычная поликлиника в Ульяновске. Первый попавшийся пациент. «У меня были сопли», — поясняет ребенок. Температура, кашель. Когда дочь заболела, Татьяна решила: к врачам обращаться не станет. Привычно сама выписала девочке антибиотики. Ударную дозу.
«Результат был больше негативный, никакой пользы не было, ребенку легче не стало. И я в первый день поняла, что этот антибиотик, значит, либо нам не подходит, либо я делаю что-то не так», — рассказала мама девочки Татьяна Агеева.
«Назначение антибиотика самопроизвольное, прием антибиотика, было неоправданно. Потому что у ребенка была вирусная инфекция, а при вирусной инфекции антибиотики не помогают», — поясняет участковый педиатр Альфия Мингалимова.
Потому что у ребенка была вирусная инфекция, а при вирусной инфекции антибиотики не помогают», — поясняет участковый педиатр Альфия Мингалимова.
Тем временем бактерии, дремлющие в организме, закалились. Ведь курс до конца не доведен. Выжили! В следующий раз тот же антибиотик их уже не возьмет. Эта стойкость перейдет к следующему поколению. И так раз за разом, до супербактерии. Человечество, правда, в опасности. Только в Европе от стойких к антибиотикам бактерий в год умирают 25 тысяч человек. Проблему обсуждают на уровне Генеральной Ассамблеи ООН.
«Это случалось только при СПИДе, при эболе, при неинфекционных заболеваниях. И, вот, сейчас чувствительность к антибиотикам. Ну, представляете масштаб и глубину проблемы?» — подчеркивает Гайк Никогосян.
Скрытая угроза: мы получаем антибиотики не только когда лечимся. Их добавляют в зубную пасту, в то самое мыло, избавляющее от прыщей. Используют на фермах, птицефабриках. И вот они уже у нас на столе. Наши бактерии вырабатывают стойкость — резистентность. За считанные дни! Фармацевтические компании не успевают создавать новые антибиотики. К тому же это дорого. Выгоднее вложиться в препараты, которые продержатся десятки лет. Для сердца.
За считанные дни! Фармацевтические компании не успевают создавать новые антибиотики. К тому же это дорого. Выгоднее вложиться в препараты, которые продержатся десятки лет. Для сердца.
«Было очень бурное развитие фармакологии в плане разработки новых классов, видов, подтипов и так далее, лекарственных средств, которые так или иначе оказывают влияние на микроорганизмы. С 2008 года этот процесс несколько замедлился», — говорит профессор кафедры клинической фармакологии 1-го Московского медицинского государственного университета им. И.М. Сеченова Марина Журавлева.
А ведь антибиотики не панацея. Например, ученые из новосибирского Академгородка предлагают заменить их бактериофагами. Пожиратели бактерий, созданы еще в советское время.
Как действует антибиотик: пробивает брешь в клеточной стенке, и бактерия гибнет. Либо разрушают ее изнутри, воздействуют на функцию ДНК или на рибосомы, не давая им синтезировать белок. А бактериофаги уничтожают бактерию полностью. Но только одного вида.
«Нельзя взять любой бактериофаг и лечить любую бактерию. Обязательно надо подбирать. Выяснять: как бактериофаг действует для конкретно этого пациента», — поясняет заведующая лабораторией молекулярной микробиологии Института химической биологии и фундаментальной медицины СО РАН Нина Тикунова.
Во всем мире, Россия не исключение, разрабатывают антибактериальные препараты нового поколения. Они блокируют работу генетических конструкций внутри клетки.
«Обмануть клетку, не дать себя разрушить, с одной стороны. Но в то же время распознать и блокировать нужный участок генетической информации и остановить развитие микроорганизма. Это в определенной степени сейчас рассматривается как антибиотики нового поколения», — рассказывает заместитель директора по научной работе Института химической биологии и фундаментальной науки СО РАН Дмитрий Пышный.
Но это пока перспектива. Нужны доработки, клинические испытания. А смерть от супербактерии зафиксирована уже сейчас. Ученые успокаивают: Апокалипсис не сегодня.
«Пока стойких ко всем антибиотикам бактерий мало, но тенденция к росту все же есть, и она очень четкая. Самая серьезная ситуация в странах с неограниченным доступам к антибиотикам», — говорит профессор бактериальной геномики и эволюции Института Сангера и Лондонской школы гигиены и тропической медицины Ник Томсон.
То есть там, где их продают без рецепта. Россия тоже в этом списке. Поэтому врачи, от участковых до профессуры, умоляют: не нужно бежать за антибиотиками каждый раз, когда приболел. Лучше бежать от болезни. Регулярно работать на повышение своего иммунитета. Закалка, спорт, ЗОЖ!
Разработана вакцина от супербактерии клебсиеллы
Светлана МасловаБактерия вызывает тяжелые инфекции и приводит к развитию менингита, сепсиса, пневмонии и других заболеваний. Американские ученые успешно протестировали вакцину, добившись значительного защитного эффекта.
317
Исследователи из Университета Вашингтона в Сент-Луисе разработали и протестировали вакцину от смертельно опасной супербактерии клебсиеллы, которая вызывает многие тяжелые инфекции печени, дыхательных путей, урогенитальные и другие. На фоне роста резистентности бактерии к антибиотикам ученые стремились найти новый способ остановить ее.
На фоне роста резистентности бактерии к антибиотикам ученые стремились найти новый способ остановить ее.
Считается, что половина инфицированных устойчивой клебсиеллой людей умирает. За 70% случаев ответственны штаммы К1 и К2. Новая вакцина направлена именно на эти два распространенных типа.
В основе вакцины — генетически модифицированный штамм кишечной палочки, производящий белки и сахара, а также другие бактериальные ферменты.
Тестирование вакцины проводили на 20 мышах, которым давали три дозы препарата или плацебо с двухнедельным интервалом. Затем грызунов заражали примерно 50 бактериями К1 или К2. Как показали предыдущие исследования, этого числа достаточно, чтобы мышь не справилась с инфекцией без лечения.
После введения плацебо 80% мышей инфицированных К1 и 30% зараженных типом К2 умерли.
Среди вакцинированных мышей выжило 80% из типа К1 и все, зараженные типом К2.
Сейчас команда готовится к проведению клинических исследований на людях. По мнению ученых, в будущем вакцинировать от клебсиеллы нужно будет всех людей. Новая вакцина может стать эффективным инструментом для профилактики инфекции у детей и взрослых, считают авторы.
По мнению ученых, в будущем вакцинировать от клебсиеллы нужно будет всех людей. Новая вакцина может стать эффективным инструментом для профилактики инфекции у детей и взрослых, считают авторы.
В Австралии разработали вакцину от туберкулеза, которую также уже успешно протестировали на мышах. А вакцину от хламидиоза, которая вызывает 100% иммунный ответ, уже проверили на людях.
Facebook31Вконтакте7WhatsAppTelegram
Бактериофаг клебсиелл поливалентный очищенный инструкция по применению: показания, противопоказания, побочное действие – описание Klebsiella polyvalent bacteriophage purified р-р д/приема внутрь, местн. и наружн. прим. 20 мл: фл. 4 шт. (36442)
Препарат используют для приема внутрь (через рот), в виде клизм, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа, а также в дренированные полости: абсцессов, брюшную, плевральную, мочевого пузыря, почечной лоханки.
Внутрь препарат принимают натощак за 0,5-1 час до приема пищи.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием при различных способах введения препарата | |
| внутрь (мл) | в клизме (мл) | |
| 0-6 мес | 5 | 10 |
| 6-12 мес | 10 | 20 |
| от 1 года до 3 лет | 15 | 20-30 |
| от 3 до 8 лет | 20 | 30-40 |
| от 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь.
В случае обработки полости гнойного очага химическими антисептиками перед применением бактериофага она должна быть промыта стерильным 0,9 % раствором натрия хлорида.
При лечении озены и склеромы препарат используют для промывания полости носа и слизистой оболочки верхних дыхательных путей, для введения в полости пазух носа (по клиническим показаниям), а также при поражении глотки, гортани, трахеи в виде ингаляций (без подогрева и использования ультразвука). Доза препарата для обработки слизистых носа и верхних дыхательных путей 10-20 мл. После промывания слизистых в полость носа по очереди в каждый носовой ход вводят турунды, смоченные препаратом, и оставляют на 1 час. Процедуру повторяют 2-3 раза в день в течение 20-40 дней. Поскольку озена и склерома являются хроническими заболеваниями, с целью профилактики обострений рекомендуется 1 раз в год проводить 20-40 дневные курсы лечения по вышеприведенной схеме.
Доза препарата для обработки слизистых носа и верхних дыхательных путей 10-20 мл. После промывания слизистых в полость носа по очереди в каждый носовой ход вводят турунды, смоченные препаратом, и оставляют на 1 час. Процедуру повторяют 2-3 раза в день в течение 20-40 дней. Поскольку озена и склерома являются хроническими заболеваниями, с целью профилактики обострений рекомендуется 1 раз в год проводить 20-40 дневные курсы лечения по вышеприведенной схеме.
При лечении ангин, фарингитов, ларингитов препарат используют для полосканий полости рта и глотки 3 раза в день по 10-20 мл, курс лечения 7-10 дней.
При лечении бронхитов, пневмоний препарат принимают внутрь 3 раза в день по 10-20 мл, а также применяют в виде аэрозолей и ингаляций (без подогрева и использования ультразвука), курс лечения 15-20 дней.
При лечении отитов препарат используют для.промывания и введения в полость среднего уха по 2-5 мл 1-3 раза в день. Курс лечения 7-15 дней.
При лечении воспалений пазух носа препарат используют для промывания полости носа, носоглотки и пазух носа в дозе 5-10 мл и введения в пазухи 2-3 мл. Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди и в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
Процедуру повторяют ежедневно однократно в течение 7-10 дней. Кроме того, препарат вводят в полость носа в виде турунд, смоченных бактериофагом, по очереди и в каждый носовой ход и оставляют в течение 0,5-1 часа. Процедуру повторяют 3 раза в день, курс лечения 7-15 дней.
При лечении стоматитов и хронических пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных бактериофагом клебсиелл, на 5-10 мин, курс лечения 7-10 дней.
При конъюнктивитах и кератоконъюнктивитах препарат применяют по 2-3 капли 4-5 раз в день, курс лечения 5-7 дней; при гнойной язве роговицы — по 4-5 капель в день в течение 7-10 дней; при гнойных иридоциклитах — по 6-8 капель каждые 3 часа в сочетании с приемом внутрь в терапевтических дозировках в течение 7-10 дней.
При абсцессах после вскрытия и удаления гнойного содержимого препарат вводят в количестве меньшем, чем объем удаленного гноя ежедневно однократно, курс лечения 7-10 дней.
При перитонитах и плевритах препарат вводят в дренированные полости брюшную и плевральную через дренажные трубки ежедневно однократно 20-70 мл, курс лечения 10-15 дней.
При остеомиелитах препарат вводят в полость раны через турунды, дренажи в количестве 10-30 мл ежедневно однократно, курс лечения 15-20 дней.
При лечении нагноений ран препарат применяют в виде орошения, аппликаций, повязок, введения в дренаж в дозе 5-50 мл в зависимости от очага поражения не менее одного раза в день, курс лечения 10-15 дней.
При лечении гнойно-воспалительных гинекологических заболеваний (нагноений ран, эндометритов, вульвитов, бартолинитов, кольпитов, сальпингоофоритов) препарат используют для орошений, аппликаций, вводят в полости ран, вагины, матки по 5-20 мл один раз в день в течение 7-10 дней.
При циститах, пиелонефритах, уретритах препарат принимают внутрь в терапевтической дозе 3 раза в день за 1 час до еды в течение 10-20 дней. В том случае, если полость мочевого пузыря или почечной лоханки дренированы, препарат вводят через цистостому, или нефростому 1-3 раза в день по 20-50 мл в мочевой пузырь и 5-7 мл в почечную лоханку, курс лечения 7-15 дней.
При гастоэнтероколитах, панкреатитах, холециститах, а также дисбактериозах кишечника бактериофаг принимают внутрь в возрастных дозировках 3 раза в день за 1 час до еды в течение 7-15 дней (по клиническим показаниям). При неукротимой рвоте препарат применяют в виде высоких клизм 2-3 раза в день по 20-40 мл. При дисбактериозе кишечника препарат может применяться с препаратами нормофлоры.
Для профилактики внутрибольничных хирургических инфекций препарат используют для обработки послеоперационных и свежеинфицированных ран в дозе 5-50 мл в зависимости от очага поражения ежедневно однократно в течение 5-7 дней.
Применение препарата у детей до 1 года (включая недоношенных детей).
При гастоэнтероколите, пневмонии и сепсисе новорожденных препарат применяют, через рот 2-3 раза в сутки по 3-5 мл за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно однократно в дозе 5-10 мл. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата: курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата: курс лечения 7-15 дней (по клиническим показаниям). При рецидивирующем течении заболевания возможно повторное проведение курсов лечения.
С целью профилактики возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют по эпидемическим показаниям внутрь по 3-5 мл 3 раза в день за 30 минут до кормления в течение всего срока пребывания в
стационаре.
При лечении омфалитов, пиодермии, инфицированных ран бактериофаг применяют в виде аппликаций по-5-10 мл 2-3 раза в день (марлевую салфетку смачивают бактериофагом и накладывают на пупошгую ранку или пораженный участок кожи) в течение 7-15 дней.
Применение препарата не исключает использование других антибактериальных и противовоспалительных препаратов.
Инфекция мочевых путей у новорожденных.
Инфекция мочевыводящих путей у маленьких детей встречается не реже, чем вирусные респираторные заболевания. Рвоту и тошноту, рези в области живота родители часто списывают на колики, нарушение питания или кишечные инфекции. Однако при таких симптомах рекомендуется обращаться к врачу. Если это инфекция мочевыводящих путей, то ее несвоевременная диагностика и лечение приведут к неприятным для грудничка последствиям.
Рвоту и тошноту, рези в области живота родители часто списывают на колики, нарушение питания или кишечные инфекции. Однако при таких симптомах рекомендуется обращаться к врачу. Если это инфекция мочевыводящих путей, то ее несвоевременная диагностика и лечение приведут к неприятным для грудничка последствиям.
Инфекция мочевыводящих путей возникает при наличии в организме ребенка бактерий, которые начинают с большой скоростью размножаться в мочевых путях.
Наиболее часто эта патология вызвано такими микробами, как:
— кишечная палочка,
— золотистый стафилококк,
— синегнойная палочка,
— клебсиелла
Часто инфекции у младенцев развиваются на фоне пороков развития мочевыводящих путей.
К таковым относятся:
— пузырно-мочеточниковый рефлюкс;
— сужение мочеточников;
— неправильное расположение органов мочевыделительной системы;
— подковообразная почка и другие
Еще одна причина инфекции – это наличие микробного очага в организме. При инфекционно-воспалительной патологии других органов бактериальная флора может попадать в почки и мочевыводящие пути, вызывая там воспаление. Также бактерия может проникнуть в организм ребенка от матери во время грудного вскармливания.
При инфекционно-воспалительной патологии других органов бактериальная флора может попадать в почки и мочевыводящие пути, вызывая там воспаление. Также бактерия может проникнуть в организм ребенка от матери во время грудного вскармливания.
Мочеполовая инфекция у младенцев проявляется такими же симптомами, как и у взрослых. Проблема состоит в том, что новорожденный ребенок не может предъявлять жалобы.
Чтобы выявить симптомы болезни родителям необходимо пристально следить за ребенком.
Вначале появляются такие признаки как плаксивость, беспокойство, плохой сон и снижение аппетита.
У детей до года инфекция мочевыводящих путей может проявляться уменьшением или увеличением от возрастной нормы выделяемой мочи, изменением цвета и насыщенности мочи (моча ребенка может стать ярко-желтой (при увеличении концентрации мочи, что обычно сопровождается уменьшением ее количества), красной или бурой (примесь крови). При появлении бактерий моча не меняет своего цвета, но становится мутной и теряет прозрачность.
Могут появиться отеки из-за особенностей организма малыша, появление неприятного запаха от подгузника.
Появление беспокойства и плача при мочеиспускании, что говорит о наличии боли и рези у грудничка. Часто мамы отмечают, что ребенок натуживается при мочеиспускании. При этом регистрируется прерывистая струя мочи.
Подъем температуры до высоких цифр, если она не проходит после приема жаропонижающих средств и упорно держится несколько дней – это повод заподозрить инфекцию.
Инфекция мочеполовой системы у грудничка выявляется путем проведения лабораторного исследования мочи, бакпосева мочи, анализа крови, б/х анализа крови.
При воспалении в анализах крови, мочи обнаруживается увеличение количества лейкоцитов. При бакпосеве можно выявить, какая именно бактерия стала причиной инфекции, и определить индивидуальную чувствительность микроба к антибиотику.
Как отмечалось выше, причиной инфекции у грудничков может быть врожденная аномалия развития мочеполовых органов.
При наличии подозрений на данную патологию следует выполняются следующие обследования:
— ультразвуковое исследование органов мочевыделительной системы;
— микционная цистография;
— ретроградная рентгенография почек;
— КТ или МРТ почек.
Основа для лечения инфекции мочевыводящих путей – это антибактериальная терапия. Назначается антибиотик широкого спектра действия либо препарат с учетом чувствительности. Антибиотик принимается внутрь либо вводится внутривенно.
Важно, что при выявлении инфекции младенец должен быть госпитализирован на все время лечения.
Кроме антибиотиков применяются противовоспалительные препараты и жаропонижающие. Причем многие лекарственные средства выпускаются в удобной форме применения, к примеру, в свечах.
Часто назначаются растительные уросептики, которые не имеют токсического эффекта и способствуют выздоровлению ребенка. Ни в коем случае нельзя самостоятельно начинать лечение или отменять лекарства без назначений врача.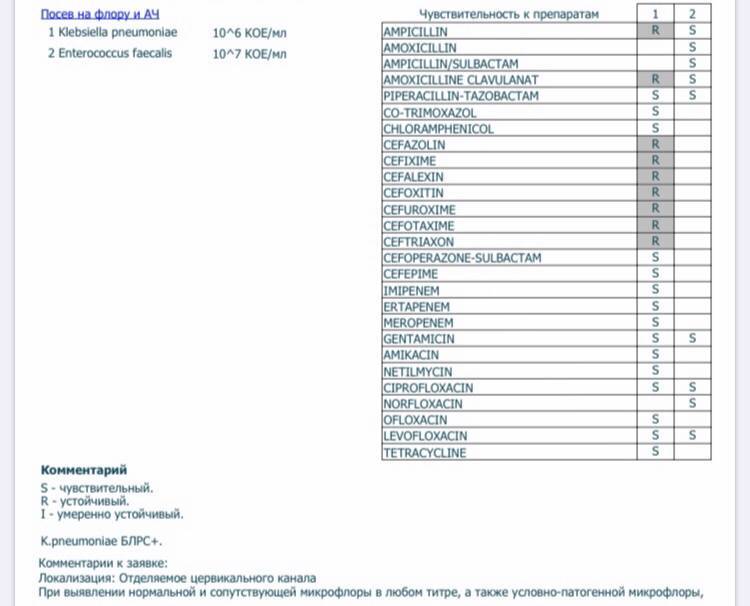 Это приведет к тому, что болезнь перейдет в латентную стадию и будет периодически обостряться, снова и снова вызывая неприятные симптомы. Кроме этого, многие лекарства противопоказаны для детей и бесконтрольное их употребление принесет ребенку непоправимый вред.
Это приведет к тому, что болезнь перейдет в латентную стадию и будет периодически обостряться, снова и снова вызывая неприятные симптомы. Кроме этого, многие лекарства противопоказаны для детей и бесконтрольное их употребление принесет ребенку непоправимый вред.
Инфекция у грудничков с пороками развития будет постоянно рецидивировать, несмотря на качественно проведенное лечение. Поэтому единственный выход – это провести оперативную коррекцию порока. Следует отметить, что операция возможна лишь после того, как острый воспалительный процесс будет устранен.
Профилактика инфекций мочеполовой системы у грудничков.
Для того чтобы исключить болезнь у ребенка, следует выполнять следующие пункты:
-тщательно следить за гигиеной мочеполовых органов ребенка.
— избегать переохлаждения малыша;
— следить за рациональностью питания.
Ежегодно в отделении недоношенных и патологии новорожденных проходят лечение около 1400 детей. Из них с инфекцией мочевых путей 65-70, с различными врожденными пороками почек и мочевой системы 28-30 детей. Всем детям проводится комплекс обследований и лечение согласно разработанным стандартам. Все дети выписываются с улучшением и выздоровлением и в дальнейшем наблюдаются нефрологами и урологами в областной детской поликлинике.
Всем детям проводится комплекс обследований и лечение согласно разработанным стандартам. Все дети выписываются с улучшением и выздоровлением и в дальнейшем наблюдаются нефрологами и урологами в областной детской поликлинике.
Инфекция мочеполовой системы – не такой уж страшный диагноз. При наличии полного обследования и качественной, адекватно подобранной терапии ребенок выздоровеет без каких-либо остаточных явлений.
123103, Россия, Москва г.улица Тухачевского, 26-51
+7 (985) 757-84-48
© Green Mama — натуральная косметика из России./10/10.jpg) ,
2021
,
2021
Klebsiella pneumoniae – представитель возбудителей инфекций, связанных с оказанием медицинской помощи
Одним из основных грамотрицательных возбудителей инфекций, связанных с оказанием медицинской помощи российских стационаров является Klebsiella pneumoniae (третий по частоте возбудитель грамотрицательных нозокомиальных инфекций, доля в структуре грамотрицательных возбудителей – 13,8 %) и наиболее частым представителем семейства Enterobacteriaceae (30,3 % среди нозокомиальных энтеробактерий). Klebsiella pneumoniae в ряде стационаров является преобладающим грамотрицательным возбудителем.
Спектр нозологических форм, вызываемых клебсиеллами, чрезвычайно широк, они являются причиной заболеваний различной локализации.
К частым проявлениям клебсиеллезной инфекции относятся инфекции,
связанные с оказанием медицинской помощи, наблюдаемые среди детей раннего
периода жизни в родовспомогательных учреждениях, больных в палатах интенсивной
терапии, онкологических, геронтологических стационарах, ожоговых центрах,
отделениях хирургического профиля.
Клебсиеллы нередко обнаруживаются в верхних дыхательных путях, в кишечнике у здоровых людей.
ЧТО ТАКОЕ KLEBSIELLA PNEUMONIAE?
Полное «имя» возбудителя:
Семейство Enterobacteriaceae
Род Klebsiella
Вид Klebsiella pneumoniae
К роду Klebsiella относится еще несколько видов. Однако основную роль в патологии человека играет вид Klebsiella pneumoniae, который подразделяется на три подвида: K. pneumoniae subsp. pneumoniaе, K. pneumoniaе subsp. oezenaе, K. pneumoniaе subsp. rhinoscleromatis. Кроме того, известны следующие виды клебсиел: K. oxytoca, K. planticola, K. terrigena.
Клебсиеллы – грамотрицательные эллипсоидные бактерии, имеют форму толстых коротких палочек с закругленными концами, размером 0,3–0,6 ×1,5–6,0 мкм.
ЧЕМ ОПАСНА KLEBSIELLA PNEUMONIAE
Клебсиеллы имеют несколько факторов патогенности,
обусловливающих их способность вызывать патологические реакции в организме
человека. Основными факторами патогенности клебсиелл являются:
Основными факторами патогенности клебсиелл являются:
фимбрии, которые обеспечивают адгезию (прилипание) клебсиеллы к эпителию,
К-антиген, подавляющий фагоцитоз, и
эндотоксин, вызывающий токсические реакции.
Помимо них, K. pneumoniae может продуцировать термолабильный энтеротоксин – белок, по механизму действия подобный токсину энтеротоксигенной кишечной палочки.
Именно благодаря своим факторам патогенности Klebsiella pneumoniaе значительно чаще вызывает манифестные (быстро развивающиеся) формы инфекций, по сравнению с другими микроорганизмами.
В отличие от подавляющего большинства родов семейства Enterobacteriaceae,
Klebsiella обладает способностью образовывать капсулу, что делает ее устойчивой
во внешней среде лечебно-профилактических учреждений. Слизистая капсула
предохраняет возбудителя от высыхания, поэтому клебсиеллы могут сохраняться в
пыли палат, на оборудовании, мебели при комнатной температуре неделями и даже
месяцами.
Возрастающая резистентность Klebsiella pneumoniae к антибиотикам представляет собой наиболее серьезную проблему антибактериальной терапии нозокомиальных инфекций, вызванных данным возбудителем.
Нозокомиальные штаммы Klebsiella pneumoniaе в стационарах России отличаются высоким уровнем резистентности к пенициллинам, ингибиторзащищенным пенициллинам, цефалоспоринам III-IV поколений, аминогликозидам, фторхинолонам.
Госпитальные штаммы Klebsiella pneumoniae в стационарах России характеризуются высокой частотой продукции β(бета)-лактамаз расширенного спектра (81,4 %), которая варьирует от 81,4 % до 100,0 %.
Способность к распространению в стационарах резистентных к антибиотикам Klebsiella pneumoniae в 4 раза выше, чем у чувствительных штаммов.
УСТОЙЧИВОСТЬ KLEBSIELLA PNEUMONIAE К ДЕЗИНФИЦИРУЮЩИМ СРЕДСТВАМ И КОЖНЫМ АНТИСЕПТИКАМ
В ряде исследований была обнаружена резистентность Klebsiella pneumoniae к препаратам, не содержащим спирта или с небольшим содержанием спирта.
Так, в одном из исследований оказалось, что композиционные средства на основе 25,0 % этилового спирта + 25,0 % изопропилового спирта + 0,15 % четвертичных аммониевых соединений, а также на основе 30,0 % изопропилового спирта + 0,1 % полигуанидина были эффективными лишь в 99,1 % случаев.
В другом исследовании была обнаружена низкая эффективность безспиртового кожного антисептика на основе 0,17 % третичного амина + 0,45 % четвертичного аммониевого соединения – в отношении Klebsiella pneumoniae она составляла лишь 96,0%.
В отношении дезинфицирующих средств было обнаружена резистентность Klebsiella pneumoniae к препарату на основе четвертичных аммониевых соединений в 20,0 % и неполная чувствительность в 20,0 % случаев.
КАКИЕ БОЛЕЗНИ KLEBSIELLA PNEUMONIAE ВЫЗЫВАЕТ У ЛЮДЕЙ?
Клебсиеллезы характеризуются тяжелым течением и высокой летальностью, многообразием клинических проявлений.
Бактерии рода Klebsiella вызывают 4,5–44,0 % всех внутрибольничных острых кишечных инфекций, 8,7–56,9 % нозокомиальных пневмоний, 6,0–86,0 % бактериемий, 7,0–42,0 % инфекций мочевыводящей системы, 4,8–12,0 % инфекций в области хирургического вмешательства и ожоговых поверхностей.
Наибольшей тяжестью отличается генерализованное септико-пиемическое течение болезни, приводящее нередко к летальному исходу.
Печально известна роль Klebsiella pneumoniae в возникновении групповых внутрибольничных инфекций в учреждениях родовспоможения. Так, при исследовании 14 вспышек в Свердловской области в период с 1981 по 2004 гг. в 58,3 % случаев возбудителем являлась Klebsiella pneumoniae. Среднее число случаев на одну вспышку было 20,7, а летальность составляла 10,1 %.
При восьми вспышках в отделениях реанимации новорожденных, изученных другими отечественными исследователями, этиология Klebsiella pneumoniae была доказана в 37,8 %, летальность в различные годы достигала 21,7 %.
ИСТОЧНИК ИНФЕКЦИИ И ПУТИ РАСПРОСТРАНЕНИЯ
Источником инфекции служит больной человек и бактерионоситель. Возможно как экзогенное, так и эндогенное заражение. Наиболее частые пути передачи – пищевой, воздушно-капельный и контактно-бытовой.
ПРОФИЛАКТИКА
Коррекция применения антибиотиков в лечебно-профилактической организации, проводимой на основании микробиологического мониторинга и контроля за антибиотикорезистентностью.
Выявление источника возбудителя инфекции и факторов передачи инфекции.
С целью ограничения распространения эпидемически опасных штаммов, необходимо применение изоляционно-ограничительных мероприятий к пациентам, имеющим колонизацию или инфекцию, вызванную ими. Они включают в себя строгое закрепление среднего медицинского персонала, обслуживающего данных пациентов, оборудования для оказания медицинской помощи. Любой контакт с пациентом осуществляется в одноразовых перчатках и фартуках, обязательна обработка рук кожным антисептиком с высоким содержанием спирта после любой манипуляции и контакта с объектами внешней среды, окружающей пациента.
Устранение факторов передачи инфекции.
Мониторинг устойчивости возбудителя к дезинфицирующим средствам.
Проведение адекватной очаговой и заключительной дезинфекции препаратами активными в отношении Klebsiella pneumoniae.
В случае наличия хронического характера развития эпидемического процесса, вызванного госпитальными штаммами Klebsiella pneumoniae – закрытие стационара для проведения заключительной дезинфекции и косметического ремонта, аэрозольная дезинфекция.
Литература:
Брусина Е.Б., Рычагов И.П. Эпидемиология внутрибольничных гнойно-септических инфекций в хирургии. Новосибирск.: Наука, 2006. 171 с.
Зуева Н.Г. Пути улучшения качества антиинфекционной обработки и защиты рук персонала акушерского стационара: автореф. дис. …канд. мед.наук. Пермь, 2012. 25 с.
Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология : учебник для мед. ВУЗов. СПб.: СпецЛит, 2008. 767 с.
Любимова А.В. Эпидемиологический надзор за инфекциями, связанными с оказанием медицинской помощи, в отделении реанимации новорожденных: Автореф. дис. док. мед.наук. СПб, 2011. 46 с.
Основы инфекционного контроля: Практическое руководство/ Американский международный союз здравоохранения [Пер. с англ.] М. : Альпина Паблишер, 2003. 478 с.
Поздеев О.К. Медицинская микробиология. М.: ГЭОТАР-Медиа. 2001. – 778 с.
Рябкова Е.Л. Оптимизация антибиотикотерапии нозокомиальных инфекций, вызванных Klebsiella pneumonia, в стационарах России: Автореф. дис. … канд. мед.наук. Смоленск., 2006. 23 с.
Смирнова С.С., Романенко В.В., Скорюнова Т.В. и др. О причинах и условиях возникновения вспышки внутрибольничных инфекций среди новорожденных в родильном доме г. Краснотуринска / Актуальные проблемы профилактики нозокомиальных инфекций в учреждениях родовспоможения и детства. Материалы I региональной научно-практической конференции. Екатеринбург, 2004. С. 82 – 92.
Страчунский Л.С., Белоусова Ю.Б., Козлова С.Н. Практическое руководство по инфекционной химиотерапии. Смоленск: МАКМАХ, 2007. – 464 с.
Хоулт Д., Криг Н., Снит П. и др. Определитель бактерий Берджи. В 2-х т. Т. 1. М.: Мир, 1997. 432 с.
границ | Факторы вирулентности и устойчивость к антибиотикам штаммов Klebsiella pneumoniae, выделенных от новорожденных с сепсисом
Введение
Klebsiella pneumoniae — одна из ведущих причин неонатального сепсиса (NS) (1, 2). На этот микроорганизм НС приходится 4–9% случаев в развитых странах и 16–28% в развивающихся странах (3–6). Различают «классические» и гипервирулентные штаммы K. pneumoniae (7). «Классический» невирулентный K.pneumoniae (c-KP) обычно вызывают пневмонию, инфекцию мочевыводящих путей, нозокомиальные инфекции и неонатальный сепсис у пациентов с ослабленным иммунитетом (8). C-KP может вызывать вспышки NS в больницах и отделениях интенсивной терапии (9, 10). Штаммы C-KP недавно получили известность из-за их склонности к приобретению устойчивости к противомикробным препаратам. За последние несколько десятилетий во всем мире, особенно в отделениях интенсивной терапии (ОИТ), были обнаружены изоляты K. pneumoniae , положительные по β-лактамазе (БЛРС) (11).Распространенность штаммов K. pneumoniae , продуцирующих БЛРС, составляет 23% в США и до 85–100% в некоторых европейских странах (11). Гипервирулентные штаммы K. pneumoniae (hv-KP) были впервые обнаружены на Тайване в последнем двадцатом веке и вызвали абсцессы печени, менингит и эндофтальмит у ранее здоровых взрослых пациентов (12–14). В настоящее время штаммы hv-KP распространяются в разных частях света (15, 16). Высокая вирулентность hv-KP связана, главным образом, с усилением продукции капсул, которая может быть запущена регулятором гена мукоидного фенотипа ( rmpA ) и гена A, связанного с муковязкостью ( magA ) (7, 17).Помимо c-KP и hv-KP, в последние годы был обнаружен третий тип K. pneumoniae , который характеризуется сочетанием устойчивости к антибиотикам и гипервирулентности (16, 18, 19). Распространенность устойчивости к антибиотикам у изолятов hv-KP редка по сравнению с высокой распространенностью устойчивых к антибиотикам изолятов c-KP (20). Отчет 2016 года показал, что в Китае 12,6% изолятов hv-KP от нескольких инвазивных инфекций вырабатывают БЛРС (21). Роль вирулентных штаммов K.pneumoniae (включая hv-KP) при инфекциях новорожденных неизвестно. Мы предположили, что вирулентные детерминанты K. pneumoniae могут влиять на клинические характеристики и исходы неонатальной инфекции. Мы предполагаем, что вирулентные штаммы K. pneumoniae у новорожденных могут приводить к развитию наиболее тяжелых форм неонатальной инфекции (гнойный менингит и сепсис с одним или несколькими очагами инфекции). C-KP у новорожденных ассоциируется в основном с недоношенностью, незрелостью иммунной системы, длительным пребыванием в отделении интенсивной терапии (ICU), механической вентиляцией легких с использованием внутривенных или мочевых катетеров (1).Следовательно, основными клиническими проявлениями неонатальной инфекции, вызванной c-KP, могут быть пневмония, инфекция мочевыводящих путей и сепсис.
Целью исследования была оценка влияния факторов вирулентности и устойчивости к антибиотикам штаммов K. pneumoniae на клинические особенности и исходы неонатальной инфекции.
Материалы и методы
Субъекты
Это исследование проводилось в течение 18 месяцев с мая 2015 года по октябрь 2016 года.В исследование были включены две группы новорожденных. Первую группу составили 10 новорожденных с подтвержденным посевом сепсиса, вызванным K. pneumoniae . Новорожденные с сепсисом поступили в отделение интенсивной терапии новорожденных (ОИТН) городской детской клинической больницы №1 г. Казани. За это время диагноз «культуральный сепсис» был установлен у 28 новорожденных, поступивших в отделение интенсивной терапии этой больницы. В 14 случаях (50%) неонатальный сепсис был вызван Staphylococcus spp., В 13 случаях (46%) — K.pneumoniae , и один случай был вызван Candida spp. Семь новорожденных умерли. Большинство из них (шесть новорожденных, 86%) были новорожденными с сепсисом, вызванным K. pneumoniae . В соответствии с отчетом совещания экспертов по неонатальному и педиатрическому сепсису (8 июня 2010 г., EMA, Лондон) (22), сепсис определялся как наличие как минимум двух клинических симптомов и как минимум двух лабораторных признаков при наличии или как в результате подозреваемой или доказанной инфекции (положительный посев крови).Клинические симптомы: (1) нестабильность температуры тела; (2) сердечно-сосудистая нестабильность; (3) кожные и подкожные поражения, такие как петехиальная сыпь или склерема; (4) апноэ или повышенная потребность в кислороде, или потребность в поддержке вентиляции; (5) непереносимость кормления или вздутие живота; и (6) раздражительность, вялость или гипотония. Его лабораторные признаки: (1) количество лейкоцитов (WBC) <4 или> 20 × 10 9 клеток / л; (2) отношение незрелых нейтрофилов к общему количеству нейтрофилов (I / T)> 0.2; (3) количество тромбоцитов <100 × 10 9 / л; (4) уровни С-реактивного белка (СРБ)> 15 мг / дл; (5) уровень глюкозы в крови> 180 мг / дл или гипогликемия (<40 мг / дл), подтвержденная как минимум дважды; и (6) метаболический ацидоз, характеризующийся избытком оснований (BE) ≤10 ммоль / л. Культуры крови всех 10 новорожденных, включенных в исследование, дали положительный результат на K. pneumoniae . Вторую группу (группу сравнения) составили 10 новорожденных с инфекцией мочевыводящих путей (ИМП). Критериями включения новорожденных в эту группу были лейкоцитурия (> 10 лейкоцитов / мл) и бактериурия (> 10 5 колониеобразующих единиц / мл).У четырех из десяти младенцев была лихорадка, и они были госпитализированы, еще шесть младенцев были амбулаторными и не имели никаких клинических симптомов. Из мочи всех новорожденных было выделено K. pneumoniae .
Мы изучили чувствительность к антибиотикам K. pneumoniae , его способность продуцировать БЛРС и его факторы вирулентности, включая гены rmpA , аэробактина и колибактина. Отличительной особенностью hv-KP является его гипермуковязкостный фенотип.
Этический комитет городской детской больницы одобрил данное исследование, письменное информированное согласие, полученное от родителей в соответствии с принципами, закрепленными в этом протоколе (Федеральный закон N323-ФЗ от 21.07.2012).11. 2011 «Об охране здоровья граждан в Российской Федерации»).
Анализ CRP
Уровни CRPв сыворотке оценивали с использованием иммунотурбидиметрического анализа Randox Full Range CRP (Randox Laboratories, Крамлин, Северная Ирландия, Великобритания) в соответствии с рекомендациями производителя.
Бактериальные изоляты
Образцы крови: 1 мл крови собирали стерильным шприцем и смешивали с 20 мл бульона для инфузии мозга и сердца (Conda Pronadisa, Испания).Смесь инкубировали при 37 ° C в течение 7 дней, наносили штрихами на поверхность кровяного агара и агара МакКонки (Oxoid, Великобритания) и инкубировали при 37 ° C в течение 24 ч (23). Образцы мочи собирали в стерильные контейнеры. Полную петлю образцов мочи наносили штрихами на поверхность кровяного агара и агара МакКонки (Oxoid, Великобритания) и инкубировали при 37 ° C в течение 24 часов. Все изоляты были идентифицированы в соответствии с морфологическими и биохимическими тестами (окраска по Граму, окраска капсул, тест на подвижность, тест на продукцию индола, тест на продукцию уреазы, тест на метиловый красный, тест Фогеса-Проскауэра) (24) и подтверждены с помощью лазерной десорбции-ионизации с использованием матрицы. времяпролетная масс-спектрометрия (Microflex, Bruker Daltonics, Бремен, Германия).
Тест на чувствительность к антибиотикам
Чувствительность к антибиотикам изолятов K. pneumoniae определяли методом дисковой диффузии Кирби-Бауэра в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) (25). Суспензию каждого изолята K. pneumoniae наносили стерильными стеклянными палочками на поверхность агара Мюллера-Хинтона (Oxoid, UK). Затем диски с антибиотиками (BioRad, Франция) помещали на поверхность засеянной чашки с агаром Мюллера-Хинтона .Затем планшет инкубировали при 35 ° C в течение 18 часов. Чувствительность к противомикробным препаратам определяли путем измерения диаметра зоны ингибирования согласно CLSI (25).
Тест на продукцию β-лактамаз расширенного спектра
Изоляты K. pneumoniae оценивали на БЛРС с использованием метода двойного диска в соответствии с CLSI (25). Диски амоксициллин / клавуланат помещали в центр чашки с агаром Mueller Hinton (Oxoid, UK). Диск цефтазидима и цефотаксима помещали на расстоянии 20 мм от диска амоксициллин / клавулановая кислота.Планшеты инкубировали в аэробных условиях при 35 ° C в течение 18 ч, после чего регистрировали размер зоны. Положительный результат был отмечен, когда зоны ингибирования вокруг любого из дисков цефалоспорина были увеличены в направлении диска, содержащего клавулановую кислоту.
Тестирование гипермуковязкости
Одиночные колонии, культивированные на кровяном агаре и чашках с агаром МакКонки (Oxoid, Великобритания), были получены и исследованы на их способность образовывать вязкие нити. Гипермуковязкозит y определяли по образованию вязких струн длиной> 5 мм (14).Выделение штаммов K. pneumoniae и микробиологические исследования полученных изолятов были выполнены в бактериологической лаборатории Республиканской клинической инфекционной больницы.
Экстракция ДНК
Бактериальные колонии выращивали на поверхности кровяного агара и агара МакКонки, собирали и суспендировали в 50–100 мкл стерильной дистиллированной воды. Тотальную ДНК экстрагировали из взвешенных клеток с помощью набора для экстракции («Литех», Россия) согласно рекомендациям производителя.
Обнаружение генов, ассоциированных с вирулентностью, с помощью полимеразной цепной реакции (ПЦР)
образцов ДНК анализировали с помощью полимеразной цепной реакции (ПЦР). Последовательности праймеров, используемые для амплификации фрагментов генов-мишеней, перечислены в таблице 1. Состав реакционной смеси и программы ПЦР для амплификации могут быть предоставлены по запросу. Ампликоны разделяли в 1,5% агарозном геле и очищали с помощью набора GeneJET Gel Extraction Kit (Thermo Scientific, США) в соответствии с рекомендациями производителя.Секвенирование продуктов ПЦР проводили на анализаторе ДНК 3730 (Life Technologies, США) и сравнивали с K. pneumoniae str. Плазмида II Kp52.145 и последовательности хромосомного генома из GenBank (номера доступа FO834905.1 и FO834906.1 соответственно) для подтверждения целевых генов.
Таблица 1 . Праймеры, используемые для ПЦР.
Результаты
Объекты исследования
Первая группа
Из 10 новорожденных с NS 5 были доношенными, а 5 — недоношенными.Трое недоношенных новорожденных родились раньше 32 недель гестации, еще двое — в срок от 32 до 36 недель (таблица 2). Два новорожденных родились с чрезвычайно низкой массой тела (ELBW). Сепсис развился у пяти новорожденных на первой неделе жизни, у трех на 2-й и 3-й неделях соответственно и у двух новорожденных на 4-й неделе жизни. Сепсис был диагностирован у 5 новорожденных во время пребывания в родильном отделении и у троих (новорожденных с ЭНМТ) — в отделении интенсивной терапии Детской клинической больницы.Дома заболели двое новорожденных.
Таблица 2 . Клиническая характеристика пациентов (Me; межквартильный размах).
NS клинически проявляется гнойным менингитом ( n = 3), энтероколитом ( n = 3) и пневмонией плюс энтероколит ( n = 2). В двух случаях заболевание было связано с сепсисом. У трех матерей новорожденных с сепсисом во время беременности был кольпит. Пациенты получали комплексное лечение, включая антибиотики, инфузионную терапию, ИВЛ, внутривенное введение иммуноглобулинов.Три случая неонатального сепсиса закончились смертельным исходом; у двух новорожденных был гнойный менингит и у одного некротический энтероколит. Остальные семь новорожденных с сепсисом успешно выздоровели.
Вторая группа
Из 10 новорожденных с ИМП восемь родились доношенными и двое — недоношенными. Оба недоношенных новорожденных родились на 35 неделе беременности. ИМП развилась у четырех новорожденных на 3-й неделе жизни, у шести новорожденных на 4-й неделе. Только у четырех из десяти младенцев были клинические проявления, основными из которых были лихорадка и раздражительность.У остальных шести младенцев ИМП протекала бессимптомно. Две матери новорожденных с ИМП во время беременности заболели кольпитом, в одном случае — пиелонефритом. Все новорожденные получали антибактериальную терапию на основании результатов тестов на микробиологическую чувствительность.
Чувствительность к противомикробным препаратам
У новорожденных с NS все изолятов K. pneumoniae были устойчивы к ампициллину, а шесть из них — ко всем аминопенициллинам (включая защищенные), гентамицину и цефалоспоринам третьего поколения.В то же время все изоляты K. pneumoniae были чувствительны к меропенему, амикацину и ципрофлоксацину (табл. 3). Шесть изолятов K. pneumoniae продуцировали БЛРС. У новорожденных с ИМП все изоляты K. pneumoniae также были устойчивы к ампициллинам. Шесть из них были устойчивы к гентамицину, четыре изолята — к защищенным аминопенициллинам и цефалоспоринам третьего поколения. Все изоляты K. pneumoniae были чувствительны к меропенему, амикацину и ципрофлоксацину.Тест на продукцию БЛРС оказался положительным для 4 изолятов K. pneumoniae .
Таблица 3 . Чувствительность к антибиотикам изолятов K.pneumoniae *.
Факторы вирулентности
В группе новорожденных с сепсисом ген rmpA (основной фактор вирулентности K. pneumoniae ) был обнаружен в 4 случаях (40%). Наличие гена rmpA у K. pneumoniae было связано с развитием гнойного менингита (3 случая) и энтероколита (1 случай).Только доношенные дети болели менингитом. Двое из четырех детей с геном rmpA в изолятах K. pneumoniae умерли. «Струнный тест» был положительным, если колония K. pneumoniae показывала присутствие только гена rmpA . Гены аэробактина и колибактина были обнаружены в двух изолятах K. pneumoniae . Оба изолята, продуцирующие аэробактин, были положительными в отношении iro D и iro N . Один из двух изолятов, продуцирующих колибактин, был положительным для clb A и clb B , другой был положительным только для clb B .Гены аэробактина и колибактина были обнаружены только у изолятов K. pneumoniae , взятых у новорожденных с гнойным менингитом с неблагоприятным исходом (таблица 4). Производство аэробактина и колибактина напрямую коррелировало с присутствием гена rmpA . Гены аэробактина и колибактина не были обнаружены в двух rmpA -положительных изолятах K.pneumoniae . В одном случае это был младенец с менингитом с благоприятным исходом, в другом — младенец с энтероколитом.
Таблица 4 . Факторы вирулентности изолята K. pneumoniae у новорожденных с сепсисом и ИМП *.
У новорожденных с ИМП ген rmpA , гены аэробактина и колибактина были обнаружены в 3 (30%) изолятах K. pneumoniae . Все изоляты, продуцирующие аэробактин, были положительными для iro D и iro N . Все изоляты, продуцирующие колибактин, были положительными для clb A и clb B . Гены аэробактина и колибактина не обнаружены в rmpA -отрицательных K.pneumoniae .
Изучение влияния факторов вирулентности изолятов K. pneumoniae на клинические проявления инфекций новорожденных выявило высокую вероятность развития гнойного менингита (OR 9; CI 0,7–113) с неблагоприятным исходом (OR 4,8; ДИ 0,3–65,7), но эти различия не были статистически значимыми (таблица 5).
Таблица 5 . Сравнение клинических и лабораторных данных новорожденных с вирулентными детерминантами и без них.
Обсуждение
Многочисленные исследования показали, что устойчивость к антибиотикам и вирулентность микроорганизмов являются значительными факторами риска развития NS (30, 31). Устойчивость бактерий к антибиотикам — основная причина неэффективной терапии внутрибольничных инфекций и сепсиса. Устойчивость к антибиотикам штаммов K. pneumoniae связана в основном с образованием БЛРС. В 2017 г. Всемирная организация здравоохранения включила в список наиболее опасных супербактерий K. pneumoniae , продуцирующую БЛРС, наряду с Acinetobacter baumani и Pseudomonas aeruguinosa (32).Новорожденные наиболее уязвимы для инфекции. Факторы, предрасполагающие к грамотрицательному сепсису у новорожденных, связаны с недоношенностью и низкой массой тела при рождении, а также с длительным пребыванием в отделении интенсивной терапии (33, 34). В нашем исследовании в группе новорожденных с сепсисом пять новорожденных были недоношенными, а двое из них родились с чрезвычайно низкой массой тела (ELBW). Шесть изолятов крови штаммов K. pneumoniae (60%) продуцировали БЛРС. У новорожденных с ИМП изоляты K. pneumoniae продуцировали БЛРС в 40% случаев.Заражение новорожденных БЛРС, продуцирующим штаммов K. pneumoniae , могло произойти в родильном отделении или во время длительного пребывания в отделении интенсивной терапии. Тестирование на устойчивость к антибиотикам показало, что все изоляты БЛРС K. pneumoniae (из крови и мочи) были устойчивы ко всем аминопициллинам и цефалоспоринам третьего поколения. В то же время все изоляты БЛРС K. pneumoniae были чувствительны к меропенему, амикацину и ципрофлоксацину. Очевидно, что меропенем следует рассматривать в качестве приоритетной антибактериальной терапии в случаях неонатальных инфекций, вызванных штаммами, продуцирующими БЛРС К.пневмония . Вся кровь и моча изолята K. pneumoniae , не продуцирующего БЛРС, были чувствительны к защищенным аминопенициллинам, цефалоспоринам третьего поколения, меропенему, амикацину и ципрофлоксацину. Следовательно, в случаях неонатальных инфекций, вызванных штаммами K. pneumoniae , не продуцирующими ESBL, в качестве первой линии антибиотикотерапии следует использовать защищенные аминопенициллины и цефалоспорины III. Известно, что раннее начало антибактериальной терапии играет решающую роль в эффективности терапии сепсиса, поскольку ее отсрочка увеличивает риск смерти (35).Однако клинические симптомы и лабораторные признаки НП неспецифичны, и его раннее выявление является довольно сложной задачей. Поражение желудочно-кишечного тракта может косвенно указывать на развитие инфекции, вызванной грамотрицательными бактериями, поскольку кишечник является основным местом их колонизации. Среди лабораторных признаков сепсиса, ассоциированного с грамотрицательными бактериями, ряд исследователей выделяют частое развитие тромбоцитопении (36). В нашем исследовании у всех 10 новорожденных с сепсисом была тромбоцитопения, которая была тяжелой (<50 × 10 9 / л) у 8 новорожденных.У пяти младенцев был энтероколит. Наиболее тяжелые формы сепсиса у исследованных младенцев, а также его неблагоприятные исходы были связаны с менингитом. Примечательно, что неонатальный менингит возник только у доношенных детей, двое из них были выписаны домой из родильных домов и заболели на второй неделе жизни. При анализе данной ситуации мы склонны связывать развитие сепсиса у новорожденных с их пребыванием в родильных домах, поскольку большинство изолятов K. pneumoniae были продуцентами БЛРС.Это также может быть подтверждено тем фактом, что сепсис, вызванный K. pneumoniae , произошел у шести новорожденных, которые находились в одной больнице в течение того же периода. К сожалению, ни медперсонал родильных домов, ни матери этих новорожденных не были обследованы на носитель K. pneumoniae , поэтому данное предположение не может быть подтверждено. Несмотря на хорошо известную роль штаммов K. pneumoniae , продуцирующих ESBL, в развитии позднего начала NS, также очевидно, что факторы вирулентности K.pneumoniae играют важную роль в развитии наиболее тяжелых форм NS. Факторы, влияющие на вирулентность штаммов K. pneumoniae , включают капсульные полисахариды, липополисахариды, фимбриальные адгезины и сидерофоры (37, 38). Гипервирулентный фенотип K. pneumoniae связан с наличием гена rmpA (14). Hv-KP вызывает наиболее тяжелые инвазивные формы инфекции у ранее здоровых взрослых (абсцессы печени, менингит и эндофтальмит) (12–14).В отличие от cv-KP, штаммы hv-KP более устойчивы к комплементу и фагоцитозу (38, 39). Механизмы, обеспечивающие такую стабильность, разнообразны и включают защиту от опсонизации и фагоцитоза макрофагами и нейтрофилами из-за наличия толстой капсулы в K. pneumoniae и блокаду TLR, в частности TLR4, который ингибирует экспрессию интерлейкинов. 8 (38). Обычно высокая вирулентность характерна для штаммов K. pneumoniae , вызывающих внебольничные инфекции, и эти микроорганизмы обычно чувствительны к большинству внешних антимикробных факторов.В то же время недавние исследования демонстрируют новую тенденцию: hv-KP приобрели главное свойство внутрибольничных микроорганизмов — антибактериальную устойчивость. Влияние штамма hv-KP на клинические признаки неонатальной инфекции неизвестно. В нашем исследовании ген rmpA был обнаружен в изолятах K. pneumoniae в обеих группах новорожденных с NS и UTI. Обнаружение гена rmpA у штаммов K. pneumoniae , выделенных от новорожденных с сепсисом, в трех из четырех случаев было связано с гнойным менингитом.Обнаружение гена rmpA у новорожденных с ИМП было для нас неожиданным. Очевидно, что другие факторы вирулентности, в частности липополисахарид (ЛПС) и сидерофоры, необходимы для обеспечения вирулентности K. pneumoniae . ЛПС защищает от гуморальной защиты и активирует иммунную систему (20). Липид A LPS является лигандом TLR4 (20). О-антиген ЛПС защищает от комплемента (20). Штаммы K. pneumoniae , которые содержат полноразмерный О-антиген («гладкий ЛПС»), устойчивы к опосредованному комплементом уничтожению, в то время как штаммы с укороченными или отсутствующими О-цепями («грубый ЛПС») чувствительны к комплементу опосредование убийства, даже в присутствии капсулы (40).Отсутствие О-антигена K. pneumoniae менее вирулентен. Обнаружение гена rmpA в изолятах K. pneumoniae у новорожденных с ИМП указывает на то, что распространенность вирулентных штаммов K. pneumoniae может быть выше, чем мы думаем. Распространенность hv-KP в Российской Федерации неизвестна. Распространенность hv-KP очень высока в Азии (до 90%) (41), в других регионах мира она меньше. В Испании и Канаде распространенность hv-KP оценивалась в 5 баллов.4 и 8,2% соответственно (42, 43). В нашем исследовании два случая были вызваны изолятами K. pneumoniae , продуцирующими БЛРС, которые содержали ген rmpA . Это были младенцы с менингитом, и оба случая закончились смертельным исходом. В группе младенцев с ИМП ген rmpA был обнаружен только у изолятов K. pneumoniae , не продуцирующих БЛРС. Несмотря на небольшое количество новорожденных, включенных в это исследование, очевидно, что приобретение множественной лекарственной устойчивости вирулентными штаммами K.pneumoniae может ухудшить течение и прогноз заболевания. Сидерофоры — аэробактин, энтеробактин, иерсиниабактин и колибактин являются наиболее важными вирулентными факторами, которые способствуют росту и выживанию K. pneumoniae у инфицированного хозяина (7, 38). Экспрессия энтеробактина повсеместно распространена среди c-KP и hv-KP (44, 45). Но аэробактин экспрессируется 6% изолятов c-KP и 93–100% изолятов hv-KP (44, 45). Сидерофоры — это небольшие высокоаффинные хелатирующие молекулы железа, секретируемые широким спектром микроорганизмов, которые имеют решающее значение для вирулентности многих грамотрицательных бактерий (7, 20).Известно, что железо необходимо для роста и размножения бактерий (46). Доступ к молекулам железа является важным фактором, обеспечивающим инвазивные свойства K. pneumoniae при инфекции у иммунокомпетентных людей (46). Штаммы Hv-KP продуцируют молекулы сидерофоров в большем количестве и в их более активной форме, чем c-KP (46). Было показано, что развитие инвазивных форм заболевания связано с продукцией нескольких сидерофоров штаммами K. pneumoniae (47).В нашем исследовании штаммов K. pneumoniae , продуцирующих сидерофоры, были обнаружены у двух новорожденных с сепсисом и у трех новорожденных с ИМП. Во всех случаях гены аэробактина и колибактина были обнаружены только в rmpA -положительных изолятах K. pneumoniae . Однако летальные исходы отмечены только в случаях, вызванных вирулентными штаммами КП. Несмотря на связь между развитием гнойного менингита и неблагоприятным исходом у новорожденных, инфицированных в основном вирулентными штаммами КП, нам не удалось подтвердить эту ситуацию статистическими методами.Вероятно, это связано с небольшим количеством новорожденных с гнойным менингитом, который редко встречается в этой возрастной группе. Мы не смогли подтвердить первоначальную гипотезу о том, что развитие только наиболее тяжелых форм неонатальной инфекции (гнойного менингита) связано с вирулентными штаммами КП. ИМП также могут быть вызваны вирулентными штаммами K. pneumoniae . Очевидно, что в будущем роль вирулентных штаммов K. pneumoniae будет возрастать.
Заключение
Распространенность вирулентных штаммов K.pneumoniae среди новорожденных с сепсисом и другими неонатальными инфекциями выше, чем мы думаем. Риск развития тяжелых форм неонатальной инфекции может быть связан с факторами вирулентности. Наиболее тяжелые формы неонатального сепсиса с неблагоприятным исходом в нашем исследовании были вызваны вирулентными штаммами K. pneumoniae .
Авторские взносы
KK, VA и AR: дизайн исследования, написание рукописи. YD: Выделение ДНК штаммов K. pneumoniae с последующим генотипированием методом ПЦР для определения факторов вирулентности.DS: сбор клинических данных. SL: сбор и интерпретация клинических данных. NS: выделение колоний K. pneumoniae , определение их устойчивости к антибиотикам и способности продуцировать β-лактамазу расширенного спектра действия.
Финансирование
Работа поддержана Государственной программой повышения конкурентоспособности Казанского федерального университета. AR поддержана государственным заданием 20.5175.2017 / 6.7 Минобрнауки России.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Работа поддержана Государственной программой повышения конкурентоспособности Казанского федерального университета. AR поддержана государственным заданием 20.5175.2017 / 6.7 Минобрнауки России.
Список литературы
1. Камачо-Гонсалес А., Спирмен П. У., Столл Б. Дж.. Инфекционные болезни новорожденных: оценка неонатального сепсиса. Pediatr Clin North A (2013) 60: 367–89. DOI: 10.1016 / j.pcl.2012.12.003
CrossRef Полный текст | Google Scholar
2. Верма П., Бервал П.К., Нагарадж Н., Свами С., Дживаджи П., Нараян С. Неонатальный сепсис: эпидемиология, клинический спектр, недавние противомикробные препараты и их картина чувствительности к антибиотикам. Int J Contemp Pediatr. (2015) 2: 176–80. DOI: 10.18203 / 2349-3291.ijcp20150523
CrossRef Полный текст | Google Scholar
3. Столл Б.Дж., Хансен Н., Фанаров А.А., Райт Л.Л., Карло В.А., Эренкранц Р.А. и др. Поздний сепсис у новорожденных с очень низкой массой тела при рождении: опыт NICHD Neonatal Research Network. Педиатрия (2002) 110: 285–91. DOI: 10.1542 / педс.110.2.285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Заиди А.К., Тавер Д., Али С.А., Хан Т.А.Патогены, связанные с сепсисом у новорожденных и детей грудного возраста в развивающихся странах. Pediatr Infect Dis J. (2009) 28 (Дополнение 1): S10–8. DOI: 10.1097 / INF.0b013e3181958769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Верньяно С., Менсон Э., Кеннеа Н., Эмблтон Н., Рассел А.Б., Уоттс Т. и др. Инфекции новорожденных в Англии: сеть эпиднадзора NeonIN. Arch Dis Child Fetal Neonatal Ed. (2011) 96: F9–14. DOI: 10.1136 / adc.2009.178798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Podschun R, Ullmann U. Klebsiella spp. как внутрибольничные возбудители: эпидемиология, систематика, методы типирования, факторы патогенности. Clin Microbiol Ред. . (1998) 4: 589–603.
9. Haller S, Eller C, Hermes J, Kaase M, Steglich M, Radonic A, et al. Что вызвало вспышку возбудителя ESBL Klebsiella pneumoniae в отделении интенсивной терапии новорожденных, Германия, с 2009 по 2012 год? Восстановление передачи с помощью эпидемиологического анализа и полногеномного секвенирования. BMJ (2015) 5: e007397. DOI: 10.1136 / bmjopen-2014-007397
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Хаэртынов Х.С., Анохин В.А., Николаева И.В., Семенова Д.Р., Любин С.А., Агапова И.В. Неонатальный сепсис, вызванный клебсиеллой. Новости медицины Северного Кавказа (2016) 11: 82–6. DOI: 10.14300 / mnnc.2016.11004
CrossRef Полный текст | Google Scholar
11. Гелбанд Х, Миллер-Петри М., Пант С., Гандра С., Левинсон Дж., Бартер Д. и др. Состояние антибиотиков в мире . Вашингтон, округ Колумбия: Центр динамики заболеваний, экономики и политики (2015).
12. Лю Ю.С., Ченг Д.Л., Линь К.Л. Klebsiella pneumoniae Абсцесс печени, связанный с септическим эндофтальмитом. Arch Intern Med . (1986) 146: 1913–6.
PubMed Аннотация | Google Scholar
13. Cheng DL, Liu YC, Yen MY, Liu CY, Wang RS. Септические метастатические поражения гнойного абсцесса печени. Их связь с бактериемией Klebsiella pneumoniae у больных сахарным диабетом .Arch Intern Med. (1991) 151: 1557–9. DOI: 10.1001 / archinte.1991.00400080059010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ван Дж. Х., Лю Ю. С., Ли С. С., Йен М. Ю., Чен Ю. С., Ван Дж. Х. и др. Первичный абсцесс печени, вызванный Klebsiella pneumoniae на Тайване. Clin Infect Dis . (1998) 26: 1434–8.
PubMed Аннотация | Google Scholar
15. Декре Д., Верде С., Эмириан А., Ле Гурриерек Т., Пети Дж. К., Оффенштадт Г. и др.Возникающие тяжелые и смертельные инфекции, вызванные Klebsiella pneumoniae , в двух университетских больницах Франции. J Clin Microbiol. (2011) 49: 3012–304. DOI: 10.1128 / JCM.00676-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Bialek-Davenet S, Criscuolo A, Ailloud F, Passet V, Jones L, Delannoy-Vieillard AS, et al. Геномное определение клональных групп Klebsiella pneumoniae с гипервирулентностью и множественной лекарственной устойчивостью. Emerg Infect Dis .(2014) 20: 1812–20. DOI: 10.3201 / eid2011.14020622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Yu WL, Ko WC, Cheng KC, Lee HC, Ke DS, Lee CC, et al. Связь между генами rmpA и magA и клинические синдромы, вызываемые Klebsiella pneumoniae на Тайване. Клин Инект Дис . (2006) 42: 1351–8. DOI: 10.1086 / 503420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Чжан Р., Линь Д., Чан Э. В., Гу Д., Чен Г. X., Чен С.Появление в Китае устойчивых к карбапенемам гипервирулентных штаммов Klebsiella pneumoniae серотипа K1. Противомикробные агенты Chemother . (2015) 60: 709–11. DOI: 10.1128 / AAC.02173-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Surgers L, Boyd A, Girard PM, Arlet G, Decré D. Штамм гипервирулентного возбудителя ESBL Klebsiella pneumoniae K2, Франция. Emerg Infect Dis . (2016) 22: 1687–8. DOI: 10.3201 / eid2209.160681
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21.Чжан И, Чжао Ц., Ван Ц., Ван Х, Чен Х, Ли Х и др. Высокая распространенность гипервирулентной инфекции Klebsiella pneumoniae в Китае: географическое распространение, клинические характеристики и устойчивость к противомикробным препаратам. Противомикробные агенты Chemother . (2016) 60: 6115–20. DOI: 10.1128 / AAC.01127-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Колли Дж. Г., Маки Т. Дж., Маккартни Дж. Э. Практическая медицинская микробиология . Нью-Йорк, Нью-Йорк: Черчилль Ливингстон (1996).
24. MacFaddin JF. Биохимические тесты для идентификации медицинских бактерий. 3-е изд. Балтимор, Мэриленд: Уильямс и Уилкинс (2000).
25. Patel JB, Cockerill FR, Bradford PA, Eliopoulos GM, Hindler JA, Jenkins SG, et al. Стандарты эффективности испытаний на чувствительность к противомикробным препаратам. Уэйн: Институт клинических и лабораторных стандартов (2015).
26. Ло И, Ван И, Йе Л., Ян Дж. Молекулярная эпидемиология и факторы вирулентности гнойного абсцесса печени, вызывающего Klebsiella pneumoniae в Китае. Clin Microbiol Infect. (2014) 20: 818–24. DOI: 10.1111 / 1469-0691.12664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Compain F, Babosan A, Brisse S, Genel N, Audo J, Ailloud F и др. Мультиплексная ПЦР для обнаружения семи факторов вирулентности и капсульных серотипов K1 / K2 Klebsiella pneumoniae . Дж. Клин Микробиол . (2014) 52: 4377–80. DOI: 10.1128 / JCM.02316-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Ю В.Л., Ко В.К., Ченг К.С., Ли С.К., Лай С.К., Чуанг Ю.К. Сравнение распространенности факторов вирулентности для абсцессов печени Klebsiella pneumoniae между изолятами с капсульным серотипом K1 / K2 и не-K1 / K2. Diagn Microbiol Infect Dis. (2008) 62: 1–6. DOI: 10.1016 / j.diagmicrobio.2008.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Центры по контролю и профилактике заболеваний. Жизненно важные признаки: энтеробактерии, устойчивые к карбапенемам. Morb Mortal Wkly Rep. (2013) 62: 165–70.
31. Аль-Хасан М.Н., Хускинс В.С., Лар Б.Д., Экель-Пассов Д.Е., Баддур Л.М. Эпидемиология и исход грамотрицательной инфекции кровотока у детей: популяционное исследование. Эпидемиол. Инфекция. (2011) 139: 791–6. DOI: 10.1017 / S0950268810001640
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Брансуэлл Х. ВОЗ опубликовала список опасных супербактерий в мире. Stat. (27 февраля 2017 г.).
33.Самуэльссон А., Исакссон Б., Ханбергер Х., Ольхагер Э. Поздний неонатальный сепсис, факторы риска и вмешательства: анализ повторяющихся вспышек Serratia marcescens, 2006-2011 гг. J Hosp Infect . (2014) 86: 57–63. DOI: 10.1016 / j.jhin.2013.09.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Кортезе Ф., Сиккитано П., Джезуальдо М., Филанинно А., Де Джорджи Э., Скеттини Ф. и др. Ранние и поздние инфекции у новорожденных: где мы находимся? Обзор. Педиатр неонатол .(2016) 57: 265–73. DOI: 10.1016 / j.pedneo.2015.09.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Родос А., Эванс Л. Е., Альхазани В., Леви М. М., Антонелли М., Феррер Р. и др. Кампания по выживанию после сепсиса: международные рекомендации по ведению сепсиса и септического шока: 2016 г. Intens Care Med. (2017) 43: 304–77. DOI: 10.1007 / s00134-017-4683-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Ли Б., Чжао И, Лю Ц., Чжоу Д.Молекулярный патогенез клебсиеллёзной пневмонии. Микробиол будущего . (2014) 9: 1071–81. DOI: 10.2217 / fmb.14.48
CrossRef Полный текст | Google Scholar
39. Doorduijn DJ, Rooijakkers SH, van Schaik W., Bardoel BW. Механизмы устойчивости к комплементу Klebsiella pneumoniae . Иммунобиология . (2016) 221: 1102–9. DOI: 10.1016 / j.imbio.2016.06.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Мерино С., Кампруби С., Альберти С., Бенеди В.Дж., Томас Дж. М..Механизмы устойчивости Klebsiella pneumoniae к комплемент-опосредованному уничтожению. Инфекция иммунол . (1992) 60: 2529–35.
41. Е М, Ту Дж, Цзян Дж, Би Й, Ю В., Чжан И и др. Клинический и геномный анализ , вызывающего абсцесс печени. Klebsiella pneumoniae идентифицирует новые гены вирулентности, связанные с абсцессом печени. Front Cell Infect Microbiol. (2016) 6: 165. DOI: 10.3389 / fcimb.2016.00165
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42.Куберо М., Грау И., Тубау Ф., Палларес Р., Домингес М.А., Линарес Дж. И др. Гипервирулентный Klebsiella pneumoniae клонов, вызывающих бактериемию у взрослых в клинической больнице в Барселоне, Испания (2007-2013). Clin Microbiol Infect. (2016) 22: 154–60. DOI: 10.1016 / j.cmi.2015.09.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Пейрано Дж., Питоут Дж. Д., Лаупланд КБ, Митеролл Б., Грегсон Д. Б.. Популяционный эпиднадзор на гипермуковязкость Klebsiella pneumoniae , вызывающую внебольничную бактериемию, в Калгари, Альберта. Может ли заразить Dis Med Microbiol . (2013) 24: e61–4. DOI: 10.1155 / 2013/828741
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Подщун Р., Сиверс Д., Фишер А., Ульманн У. Серотипы, гемагглютинины, синтез сидерофоров и сывороточная резистентность изолятов клебсиелл, вызывающих инфекции мочевыводящих путей человека. J Infect Dis. (1993) 168: 1415–21. DOI: 10.1093 / infdis / 168.6.1415
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Эль Фертас-Айсани Р., Мессай Й., Алуаш С., Бакур Р. Профили вирулентности и паттерны чувствительности к антибиотикам штаммов Klebsiella pneumoniae , выделенных из различных клинических образцов. Pathol Biol. (2013) 61: 209–16. DOI: 10.1016 / j.patbio.2012.10.004
CrossRef Полный текст | Google Scholar
46. Холден В.И., Брин П., Хоул С., Дозуа С.М., Бахман М.А. Klebsiella pneumoniae сидерофоров вызывают воспаление, распространение бактерий и стабилизацию HIF-1 во время пневмонии. мБио (2016) 7: 1397–16. DOI: 10.1128 / mBio.01397-16
CrossRef Полный текст | Google Scholar
47. Холт К.Э., Вертхайм Х., Задокс Р.Н., Бейкер С., Уайтхаус, Калифорния, Дэнс Д. и др. Геномный анализ разнообразия, структуры популяции, вирулентности и устойчивости к противомикробным препаратам у Klebsiella pneumoniae , неотложной угрозы общественному здоровью. Proc Natl Acad Sci USA . (2015) E3574–81. DOI: 10.1073 / pnas.1501049112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Выбор и продолжительность антимикробной терапии неонатального сепсиса и менингита
Неонатальный сепсис связан с повышенной смертностью и заболеваемостью, включая нарушения развития нервной системы и длительное пребывание в больнице.Признаки и симптомы сепсиса неспецифичны, и эмпирическая антимикробная терапия начинается сразу после получения соответствующих культур. Однако многие недоношенные новорожденные и дети с низкой массой тела при рождении, у которых нет инфекции, получают противомикробные препараты во время пребывания в больнице. Продолжительное и ненужное использование противомикробных агентов связано с пагубным воздействием на хозяина и окружающую среду. Традиционно выбор противомикробных препаратов основывается на местной политике, а продолжительность терапии определяется лечащим врачом на основе клинических симптомов и результатов посева крови.В этой статье мы кратко обсуждаем возбудителя неонатального сепсиса как в развитых, так и в развивающихся странах. Мы рассматриваем доказательства для правильного выбора эмпирических противомикробных препаратов и оптимальной продолжительности терапии у новорожденных с подозрением на сепсис, сепсис, подтвержденный культурой, и менингит. Более того, существует значительное сходство между возбудителями сепсиса с ранним и поздним началом в развивающихся странах. Выбор антибиотика, описанный в этой статье, может быть более применим в развитых странах.
1. Введение
Неонатальный сепсис — клинический синдром, характеризующийся системными признаками инфекции и сопровождающийся бактериемией в первый месяц жизни [1]. Сепсис, возникающий в первые 72 часа жизни, определяется как сепсис с ранним началом (EOS) [2], а сепсис с поздним началом — как сепсис с поздним началом (LOS). Неонатальный сепсис связан со значительной заболеваемостью и смертностью, что оправдывает быстрое начало соответствующей эмпирической антибактериальной терапии. Знание как общих патогенов, вызывающих сепсис у новорожденных, так и их чувствительности к противомикробным препаратам, имеет важное значение для выбора соответствующего противомикробного лечения.Паттерны восприимчивости патогенов к противомикробным препаратам различаются по географическому признаку и во времени зависят от местных патогенов и характера использования антибиотиков. Целью данной статьи является обзор литературы, касающейся надлежащего выбора и продолжительности антимикробной терапии при подозрении на сепсис, сепсис, подтвержденный культурой, и менингит в неонатальном периоде. В основном мы хотели бы сосредоточиться на лечении бактериальной инфекции.
2. Микробиология неонатального сепсиса
Большинство случаев EOS является результатом вертикальной передачи бактерий от матери новорожденному во время родов.LOS возникает из-за горизонтальной передачи патогенов из окружающей среды или рук лица, осуществляющего уход. Структура бактериального патогена, ответственного за неонатальный сепсис, со временем изменилась и варьируется от места к месту. Существует разница в возбудителях неонатального сепсиса между развитыми и развивающимися странами [2–9]. В развивающихся странах существуют региональные различия в спектре организмов, вызывающих неонатальный сепсис.
В США Национальный институт здоровья и развития детей (NICHD) сообщил, что наиболее распространенными патогенами, вызывающими EOS, являются Streptococcus группы B (GBS) и Escherichia coli [2].GBS остается наиболее частым патогеном у доношенных детей, а E. coli — наиболее значимым патогеном у недоношенных детей с EOS [2]. Аналогичным образом, исследование, проведенное в Соединенном Королевстве, показало, что GBS является наиболее частым патогеном (31%), за ним следуют коагулазонегативные Staphylococcus (CoNS), непиогенные стрептококки и E. coli [3].
В развитых странах грамположительные организмы составляют около 70% всех LOS. Общие патогены, вызывающие ЛОС у младенцев с очень низкой массой тела при рождении (ОНМТ), включают CoNS, за которым следуют Staphylococcus aureus , Enterococcus spp., и ГБС [3–5]. Около 18–20% случаев сепсиса с поздним началом вызвано грамотрицательными микроорганизмами, особенно Enterobacteriaceae spp. и E. coli . Около 12% LOS-сепсиса вызывается грибами, особенно грибами Candida [4].
В развивающихся странах наиболее распространенными возбудителями EOS являются E. coli, Klebsiella видов и S. aureus , а наиболее распространенными возбудителями EOS являются S. aureus , Streptococcus pneumonia и Streptococcus pyogenes . часто сообщаемые организмы в LOS [6, 7].Согласно Национальной перинатальной базе данных новорожденных Индии, Klebsiella pneumonia , Staphylococcus aureus и E. coli являются тремя наиболее распространенными микроорганизмами, вызывающими неонатальный сепсис как в больнице, так и в обществе [8]. Более того, возбудители сепсиса EOS и LOS схожи, особенно в больничных условиях в развивающихся странах [9].
3. Эмпирическая антимикробная терапия неонатального сепсиса
Хотя выделение патогена в культуре является предварительным условием для доказанного бактериального сепсиса, получение результатов посева занимает не менее 48–72 часов.Раннее и надлежащее начало применения противомикробных препаратов у новорожденных из группы высокого риска до того, как появится результат чувствительности посева крови, определяется как «эмпирическая антибиотикотерапия». Большинство младенцев, поступающих в отделения интенсивной терапии новорожденных (ОИТН), получают эмпирические антибиотики, тогда как на самом деле частота подтвержденного посевом EOS составляет от 1 до 4,6 случая на 1000 живорождений [10, 11]. Клинические проявления неонатального сепсиса неспецифичны, и боязнь пропустить диагноз высока из-за повышенной заболеваемости и смертности, связанной с сепсисом.В одном исследовании было отмечено, что соотношение неинфицированных новорожденных с положительными результатами посева крови, получавших антибиотики, составляло от 15: 1 до 28: 1 [12]. Было показано, что ранняя и своевременная эмпирическая антибактериальная терапия, основанная на решении, основанном на факторах риска, при EOS [13, 14] и клинических симптомах при LOS [15], снижает смертность новорожденных. Факторы риска EOS включают клинический хориоамнионит, лихорадку во время родов (> 38,0 ° C), роды в срок <37 недель, разрыв плодных оболочек (ROM)> 18 часов до родов, колонизацию GBS у матери, предыдущий ребенок с инфекцией GBS, бактериурия GBS, и неадекватная антибиотикопрофилактика во время родов [16].Среди младенцев, выписанных домой, появление новой температуры, кашля, учащенного или затрудненного дыхания, плохого кормления, летаргии и судорог являются индикаторами сепсиса и требуют начала соответствующей антибактериальной терапии [17].
3.1. Эмпирическая антимикробная схема лечения сепсиса с ранним началом
Лечение новорожденных с подозрением на сепсис или менингит должно начинаться, как только будут получены соответствующие культуры и внутривенный доступ. Первоначальный выбор противомикробных препаратов для эмпирического лечения зависит от знаний о возможных патогенных микроорганизмах на основе перинатального анамнеза, включая любые материнские симптомы, посевы или инструменты и характер восприимчивости микроорганизмов [18].
Проспективные рандомизированные контролируемые исследования (РКИ) по правильному выбору антимикробной терапии у новорожденных с подозрением на сепсис ограничены [19]. В таблице 1 представлены РКИ по подходящим эмпирическим вариантам лечения антимикробными препаратами при EOS. Кокрановский метаанализ 2 РКИ, проведенный Snelling et al. [19] и Miall-Allen et al. [20], которые сравнивали монотерапию с комбинированной антимикробной терапией, не смогли показать, что один режим превосходит другой [13]. Не было значительных различий в смертности, неэффективности лечения или бактериологической устойчивости.Эти два испытания имели небольшую выборку и проводились до 1990 г., и антибиотики, использованные в исследовании (цефтазидим, тиментин и пиперациллин), больше не используются в эмпирической терапии сегодня. Этот метаанализ исключил 12 испытаний, сравнивающих различные комбинации антибактериальной терапии по двум причинам: в исследуемую популяцию были включены новорожденные старше 48 часов или даже дети более старшего возраста, и различие между EOS и LOS не проводилось.
| ||||||||||||||||||||||||||||||||||||||||||||||
В открытом кластерном рандомизированном исследовании Metsvaht et al.[21] из Эстонии сравнили клиническую эффективность ампициллина и пенициллина G в комбинации с гентамицином при эмпирическом лечении новорожденных (= 283) с риском EOS. В этом исследовании частота подтвержденного EOS составила 4,9%. Частота клинических неудач не различалась между двумя группами (14,1% против 14,2%).
В исследовании сети новорожденных NICHD [2] все изоляты GBS были чувствительны к пенициллину, ампициллину и ванкомицину. Среди изолятов E. coli 96% были чувствительны к гентамицину и цефалоспорину, но до 78% были устойчивы к ампициллину.Данные национального лабораторного надзора из Англии и Уэльса показали, что почти все (94%) изолятов с ранним началом (GBS, CoNS, непиогенные стрептококки , E. coli и т. Д.) Были чувствительны к режиму антибиотикопенициллина. + гентамицин и 100% были чувствительны к комбинации амоксициллин + цефотаксим [3].
Исходя из общей чувствительности к антибиотикам преобладающего организма, вызывающего EOS, рекомендуемая начальная эмпирическая терапия новорожденных с подозрением на бактериальный сепсис и / или менингит включает ампициллин и аминогликозиды [22, 23].Эта комбинация расширяет спектр противомикробных препаратов, а также обеспечивает синергетическое уничтожение бактерий. Другими преимуществами являются низкая стоимость и низкие темпы возникновения бактериальной резистентности [24].
Однако в развивающихся странах, где возбудители EOS отличаются от организмов в развитых странах, указанная выше комбинация ампициллина и гентамицина может быть не лучшим эмпирическим антибиотиком выбора. Недавно Lubell et al. [25] проанализировали литературу, касающуюся моделей чувствительности к антибиотикам внебольничных патогенов, вызывающих неонатальный сепсис в странах Африки к югу от Сахары и в Азии.Два распространенных патогена, S. aureus и Klebsiella spp., Проявляли высокую устойчивость почти ко всем широко используемым антибиотикам (ампициллину, цефтриаксону, хлорамфениколу, котримоксазолу, макролидам и гентамицину). Только Streptococcus pneumoniae продемонстрировали хорошую чувствительность ко всем лекарствам, кроме котримоксазола. Доступные исследования из развивающихся стран сосредоточены в основном на внебольничных инфекциях, и разделение между EOS и LOS часто отсутствует.Более 99% неонатальных смертей происходит в развивающихся странах, и четверть этих смертей связаны с неонатальным сепсисом [26]. Недостаточные знания о правильном выборе антибиотиков и возникающей устойчивости к обычно назначаемым противомикробным препаратам при неонатальном сепсисе будут препятствовать возможности успешного лечения этого состояния в развивающихся странах.
Таким образом, основываясь на имеющихся в настоящее время доказательствах, комбинация ампициллина и гентамицина является подходящим выбором для эмпирической терапии EOS у новорожденных, когда GBS и E.coli продолжают оставаться преобладающими организмами. В развивающихся странах эмпирическая антибиотикотерапия должна быть индивидуализирована для каждой больницы или региона.
3.2. Эмпирическая антимикробная терапия при подозрении на поздний сепсис
Как обсуждалось ранее, CoNS является наиболее частым патогеном при LOS, за ним следуют S. aureus , Enterococcus spp. И GBS; Грамотрицательные организмы составляют 18–20% ЛОС [3–5]. Эмпирическая антимикробная терапия LOS должна охватывать как грамположительные, так и грамотрицательные микроорганизмы.В исследовании, проведенном в Соединенном Королевстве, более 95% организмов, вызывающих LOS, были чувствительны к гентамицину с флуклоксациллином или амоксициллином и амоксициллином с цефотаксимом, но только 79% были восприимчивы к монотерапии цефотаксимом [3].
В развитых странах, где CoNS является преобладающим нозокомиальным патогеном и где устойчивость этих изолятов к пенициллину, полусинтетическому пенициллину и гентамицину, эксперты рекомендуют использовать ванкомицин в качестве эмпирической терапии [24].Из 18 участвовавших в ОИТН австралийской группы исследования неонатальной инфекции девять отделений использовали ванкомицин и аминогликозиды в качестве эмпирического лечения ЛОС первой линии [5]. Их смертность от сепсиса CoNS не отличалась от остальных единиц, которые использовали ампициллин или флуклоксациллин вместе с аминогликозидами. Авторы предполагают, что чрезмерные попытки снизить частоту инфекций CoNS с помощью профилактических антибиотиков нецелесообразны, поскольку большинство этих инфекций относительно доброкачественные.
Чтобы уменьшить рост числа резистентных штаммов из-за необдуманного использования ванкомицина, Karlowicz et al. [27] изучали влияние смены эмпирической антибиотикотерапии LOS с ванкомицина и цефотаксима на оксациллин и гентамицин. Не оказало влияния на частоту молниеносного сепсиса из-за CoNS, хотя 85% изолятов CoNS были устойчивы к оксациллину или гентамицину. Большинство случаев молниеносной LOS были вызваны скорее грамотрицательными организмами, чем CoNS. Аналогичные результаты были получены Stoll et al.[4].
В развивающихся странах ЛОС осложняется более высоким процентом грамотрицательных бактерий и большей устойчивостью к противомикробным препаратам среди организмов. Zaidi et al. [28] сообщили, что частота неонатального сепсиса была в 3–20 раз выше среди госпитализированных младенцев в развивающихся странах по сравнению с развитыми странами. Klebsiella pneumoniae , другие грамотрицательные палочки ( E. coli , Pseudomonas spp. И Acinetobacter spp.) И S.aureus были основными патогенами среди 11471 изолята кровотока. Около 70% этих изолятов могут не подпадать под эмпирический режим приема ампициллина и гентамицина. Около половины изолятов E. coli и Klebsiella были устойчивы к цефотаксиму, широко используемому антибиотику второй линии. Серьезную озабоченность вызывает высокая доля устойчивых к метициллину штаммов S. aureus (MRSA) во многих регионах, особенно в Южной Азии, где, как сообщается, 56% всех изолятов устойчивы к метициллину.
Кокрановский обзор эмпирической антибиотикотерапии при LOS [29] включал одно исследование Miall-Allen et al. [20], которые сравнивали монотерапию тиментином (тикарциллин и клавулановая кислота) с комбинацией флуклоксациллина и гентамицина у 28 новорожденных с подозрением на LOS. Хотя исследование не соответствовало критериям методологического качества, не было разницы в результатах (смертность / неэффективность лечения) между двумя группами.
Эмпирическую противогрибковую терапию следует рассмотреть, если у младенцев есть доступ к центральным сосудам, эндотрахеальная трубка, тромбоцитопения (<100000 / мм 3 ), воздействие цефалоспоринов или карбапенема широкого спектра действия и срок беременности менее 28 недель [30, 31].Амфотерицин B следует выбирать для эмпирической терапии, а флуконазол следует использовать для профилактики.
Таким образом, рандомизированные исследования не имеют достаточных доказательств в пользу какой-либо конкретной антимикробной схемы эмпирического лечения подозреваемой ЛОС. Приемлемым подходом было бы начать с клоксациллина и гентамицина в качестве начальных антибиотиков при ЛОС у стабильного новорожденного. Ванкомицин и цефалоспорин третьего поколения (например, цефотаксим) следует рассматривать для лечения LOS у новорожденных с кардиореспираторной нестабильностью и в регионах, где преобладает MRSA.Опасности начала терапии ванкомицином в качестве начальной терапии у всех младенцев включают риск появления устойчивых к ванкомицину энтерококков и его чрезмерное использование в случаях, когда изоляты CoNS представляют собой простые контаминанты.
4. Продолжительность эмпирической антимикробной терапии
Между центрами существует большая разница в подходящей продолжительности эмпирической терапии антибиотиками при подозрении на EOS при отрицательном посеве крови [32]. Это более уместно для недоношенных детей (гестационный возраст <34 недель и / или <1500 г), поскольку они считаются подверженными высокому риску сепсиса, и обычной практикой является сбор соответствующих культур и начало приема антибиотиков.Рекомендации по лечению младенцев с подозрением на сепсис, но с отрицательными результатами посева, не основаны на убедительных доказательствах. Стандартная практика состоит в том, чтобы прекратить прием антибиотиков сразу после подтверждения отрицательного результата посева крови (48–72 часа) и отсутствия клинических или гематологических признаков инфекции [32–34]. Эта рекомендация изначально основана на исследовании Pichichero [35], в котором сообщалось, что 96% бактериемических культур, взятых до начала антибактериальной терапии, положительны через 48 часов, а 98% - через 72 часа.
С использованием компьютеризированных автоматизированных питательных сред (система культивирования крови ESP) Garcia-Prats et al. [36] сообщили, что 89% посевов крови потенциально септических новорожденных (доношенных и недоношенных) становятся положительными к 36 часам и 94% к 48 часам. На время получения положительного результата посева крови предшествующая антибактериальная терапия не повлияла. Авторы пришли к выводу, что у доношенных бессимптомных младенцев, получавших антибиотики на основании материнских факторов риска, продолжительность может быть сокращена до 24–36 часов, если доступны надежные и более быстрые результаты посева крови.
Отсутствуют хорошо спланированные и достаточно мощные испытания, оценивающие соответствующую продолжительность эмпирической антимикробной терапии при сепсисе с отрицательным посевом крови. Единственное пилотное исследование Saini et al. [37] рандомизировали 52 новорожденных (срок беременности> 30 и вес при рождении> 1000 г) с вероятным сепсисом с отрицательным посевом на короткий курс (48–96 часов) или длительный курс (7 дней) антибактериальной терапии. Рандомизация была проведена через 48–72 часа после включения в исследование. Младенцы с подтвержденным сепсисом и те, у кого сохранялись клинические симптомы, были исключены.Выбор антибактериальной терапии (цефалоспорин, амикацин, клоксациллин) производил лечащий врач. Не было разницы в частоте неудач лечения (определяемой как повторное появление признаков сепсиса в течение 15 дней после прекращения приема антибиотиков, подтвержденное лабораторными данными) между двумя группами. Ограничения этого исследования включают небольшой размер выборки, отсутствие разделения на сепсис с ранним и поздним началом и исключение маленьких детей.
Cordero and Ayers [38] сообщили, что, вероятно, безопасно прекратить прием эмпирических антибиотиков, если посев крови у бессимптомных новорожденных с крайне низкой массой тела при рождении (ELBW) отрицательный.Они отметили, что младенцы с ELBW, получавшие более короткий курс (≤3 дней) по поводу подозрения на сепсис, имели меньшее воздействие третьего противомикробного препарата (ванкомицин, амфотерицин или оксациллин) и меньшее количество дней приема антибиотиков по сравнению с более длинным курсом (≥7 дней).
Хотя количество проспективных исследований ограничено, кажется разумным заключить, что продолжительность эмпирической антимикробной терапии должна составлять 48–72 часа до получения результатов посева при подозрении на неонатальный сепсис. У ребенка с симптомами может быть ложноотрицательный посев крови, если антибиотики вводятся матери внутриутробно или если образец крови взят неправильно.Следовательно, следует продолжать прием антибиотиков у младенцев с симптомами и у детей с положительным посевом крови.
5. Роль С-реактивного белка в определении продолжительности противомикробной терапии
С-реактивный белок (СРБ) является отличным маркером установленных неонатальных бактериальных инфекций. Однако он бесполезен для ранней диагностики, поскольку в начале болезни уровни повышаются только у 35–65% новорожденных [39]. В нескольких исследованиях оценивалась роль серийного измерения уровня СРБ в качестве ориентира для определения продолжительности антибактериальной терапии как в развитых, так и в развивающихся странах [40–44].Серийные значения СРБ, полученные через 24–48 часов после появления симптомов, имеют повышенную чувствительность и специфичность по сравнению с отдельными значениями СРБ при предъявлении диагноза сепсиса. Два последовательных уровня СРБ <10 мг / л с интервалом в 24 часа, через 8–48 часов после обращения, имеют отрицательную прогностическую ценность для сепсиса в 99% [40].
Филип и Миллс [41] предположили, что нормализация уровней CRP может рассматриваться как критерий для прекращения терапии антибиотиками для минимизации воздействия антибиотиков и сокращения срока пребывания в больнице.В проспективном исследовании Ehl et al. [42] отметили, что уровни CRP <10 мг / л, определенные через 24 часа после начала лечения антибиотиками, правильно определили, что 120 из 121 младенца не нуждаются в дополнительных антибиотиках. Jaswal et al. [43] сообщили о 100% отрицательной прогностической ценности без рецидива после прекращения лечения антибиотиками после нормализации уровня СРБ. В отличие от предыдущих исследований, Al-Zwaini et al. [44] сообщили, что CRP является плохим ориентиром для продолжительности лечения неонатальной септицемии, с умеренной чувствительностью и отрицательной прогностической ценностью (78% и 86%, соответственно.) через 48 часов после начала приема антибиотиков.
Врачи находятся в постоянной дилемме относительно продолжительности антибактериальной терапии новорожденных с вероятной инфекцией, у которых есть неспецифические клинические симптомы и отрицательные посевы крови, или тех младенцев, которые проходят неполное обследование на сепсис. В таких случаях Squire et al. [45] предположили, что, дополнив оценку сепсиса отрицательным СРБ, общее использование антибиотиков может быть сокращено до 20% для всего питомника. Однако предыдущие исследования, которые показали, что СРБ является хорошим ориентиром, исключали младенцев из группы высокого риска с центральными линиями, ИВЛ, послеоперационными заболеваниями, менингитом, асфиксией при рождении [42] и новорожденных с положительным исходным СРБ [40].Следовательно, полезность CRP при принятии решений относительно продолжительности приема антибиотиков может быть обоснована только в выбранной подгруппе новорожденных.
6. Опасности длительной эмпирической антимикробной терапии
Оптимальная продолжительность эмпирического применения противомикробных препаратов снижает развитие устойчивости к противомикробным препаратам, предотвращает нежелательные изменения флоры, обнаруженные в отделении интенсивной терапии, и сводит к минимуму ненужные расходы для младенцев с отрицательными культурами крови [46, 47 ]. Около половины всех младенцев с ELBW получают эмпирические антибиотики в течение длительных периодов (> 3–5 дней), несмотря на отрицательные результаты посева крови [47, 48].Увеличенная продолжительность начальной эмпирической антибиотикотерапии связана с повышенным риском некротического энтероколита и смерти у детей с ELBW [48]. Кларк и др. [49] отметили, что выбор цефотаксима (цефалоспорин третьего поколения) вместо гентамицина в течение первых 3 постнатальных дней связан с более высоким уровнем смертности даже для большинства недоношенных детей. Другие побочные эффекты длительной эмпирической антибактериальной терапии включают повышенный риск неонатального кандидоза с использованием цефалоспоринов [50, 51] и изменение микрофлоры кишечника [52].Следовательно, кажется разумным ограничить продолжительность эмпирической антибактериальной терапии <3 днями, если посев крови стерилен, а у ребенка нет симптомов.
7. Продолжительность противомикробной терапии доказанного бактериального сепсиса без менингита
Продолжительность противомикробной терапии подтвержденного посевом сепсиса зависит от первоначального ответа на соответствующий противомикробный агент. В главе, посвященной бактериальному сепсису и менингиту, Кляйн рекомендует 10 дней терапии для сепсиса, подтвержденного культурой, с минимальной очаговой инфекцией или ее отсутствием [22].Однако существует мало РКИ, оценивающих обоснованность и безопасность соответствующей продолжительности терапии [53–55]. В таблице 2 описаны рандомизированные контролируемые испытания, в которых оценивались более короткие и более длительные курсы антибактериальной терапии при пневмонии новорожденных и сепсисе, подтвержденном посевом.
| |||||||||||||||||||||||||||||||||||||||||||||||
Engle et al. [53] рандомизировали случаи неонатальной пневмонии на 4-дневный или 7-дневный курс антибиотиков. Рандомизация проводилась на 4-й день антибактериальной терапии, если у младенцев не было симптомов полного бессимптомного развития в течение как минимум 48 часов.Младенцы, проходившие 4-дневный курс лечения, наблюдались в течение 24 часов после прекращения приема антибиотиков и были переоценены как амбулаторные в течение 2-3 дней после выписки. Успех терапии, определяемый по показателям благополучия младенцев после выписки и отсутствия необходимости повторной госпитализации по поводу сепсиса или пневмонии, был одинаковым в обеих группах, а продолжительность госпитализации была короче при 4-дневной терапии.
Chowdhary et al. [54] сравнили эффективность 7-дневной и 14-дневной антибактериальной терапии у 69 младенцев с подтвержденным бактериальным сепсисом крови (без менингита и глубоко расположенных инфекций).Рандомизация на 7-дневную или 14-дневную терапию проводилась на 7-й день приема антибиотиков, если у ребенка была клиническая ремиссия на 5-й день. Посев крови был повторен через 24 часа после завершения приема антибиотиков, и младенцы наблюдались в больнице в течение как минимум 72 часов. и наблюдались в течение 28 дней. Наблюдалась тенденция к большему количеству неудач лечения (определяемых как положительный посев крови или клинические признаки) в 7-дневной группе по сравнению с 14-дневной (5 младенцев против 1 младенца, = 0,19). Анализ подгрупп показал, что у пациентов с S.aureus , получавших 7-дневный курс (4 ребенка). На S. aureus приходилось 20% положительных культур. Авторы пришли к выводу, что новорожденным с инфекцией S. aureus может потребоваться 14 дней антибактериальной терапии.
Gathwala et al. [55] сравнили эффективность 10-дневного и 14-дневного курса антибактериальной терапии при неонатальном сепсисе, подтвержденном посевом крови. Шестьдесят младенцев были рандомизированы на 7-й день антибактериальной терапии, если у них была клиническая ремиссия с отрицательным С-реактивным белком (СРБ).Цефотаксим и амикацин применялись у всех младенцев. Наиболее частым возбудителем сепсиса был Pseudomonas aeruginosa в обеих группах, за которым следовали Acinetobacter и Klebsiella . Заболеваемость CoNS и S. aureus составила 3% и 8% соответственно. Первичный исход неудачного лечения в течение 28 дней произошел у одного ребенка в каждой группе. Продолжительность пребывания в стационаре была значительно короче при 10-дневном курсе по сравнению с 14-дневным курсом (13 ± 1.7 дней против 17 ± 2,2 дней). Они пришли к выводу, что 10-дневная антибактериальная терапия столь же эффективна, как и 14-дневная терапия при неонатальном сепсисе, подтвержденном посевом крови, если ребенок достиг клинической ремиссии к 7-му дню терапии.
В трех вышеупомянутых испытаниях участники были ≥32 недель или ≥1500 граммов и на момент рандомизации находились в клинической ремиссии. Имеются ограниченные данные о младенцах с более молодым гестационным возрастом (<32 недель), которые подвергаются наибольшему риску сепсиса. Другими словами, более короткая продолжительность показалась эффективной только в выбранной подгруппе новорожденных в возрасте не менее 32 недель и старше и показавших хороший начальный ответ на антибиотики (более легкое заболевание).
Таким образом, в ожидании дальнейших доказательств целесообразно лечение в течение 10–14 дней соответствующими противомикробными препаратами у младенцев с сепсисом, доказанным при посеве крови. Однако в отдельных ситуациях (новорожденные ≥32 недель беременности и ≥1500 граммов, у которых нет симптомов в течение 5 дней после соответствующей терапии), мы можем рассмотреть вопрос о прекращении приема антибиотиков через 7–10 дней при условии, что будет обеспечено надлежащее наблюдение.
8. Выбор противомикробного препарата и продолжительность терапии неонатального менингита
Решения о выборе конкретного противомикробного средства основаны на знании его активности против возбудителя болезни и относительного проникновения в спинномозговую жидкость (CSF) при воспалении мозговых оболочек. .В 2004 г. Американское общество инфекционных болезней опубликовало практические рекомендации по лечению менингита [56]. При подозрении на бактериальный менингит как часть EOS, ампициллин с аминогликозидом или цефотаксимом обычно рекомендуется в качестве начальной эмпирической терапии для лечения GBS, E. coli , Listeria monocytogenes и Klebsiella видов [56]. Для новорожденных с поздним менингитом рекомендуется схема, включающая антистафилококковые антибиотики, такие как нафциллин или ванкомицин, плюс цефотаксим или цефтазидим с аминогликозидами или без них [57].
Продолжительность противомикробной терапии пациента с бактериальным менингитом часто основывалась больше на традициях, чем на данных, основанных на фактических данных. Менингит, вызванный СГБ, обычно лечат в течение 14–21 дней при условии быстрого уничтожения бактерий из спинномозговой жидкости. При неосложненном неонатальном менингите, вызванном грамотрицательными бактериями, рекомендуется минимум 21 день [56].
Однако эти рекомендации не стандартизированы, и продолжительность терапии может потребоваться индивидуально в зависимости от клинического ответа пациента.Отсутствие стерилизации спинномозговой жидкости или сохранение симптомов должны побудить клиницистов искать возможные осложнения, такие как абсцесс головного мозга, вентрикулит или субдуральная эмпиема. Младенцев с внутричерепными абсцессами следует лечить, сочетая хирургическую аспирацию или дренирование абсцесса с антимикробной терапией в течение 4–6 недель [58]. Ранняя нейровизуализация с помощью УЗИ, магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ) показана для оценки необходимости хирургического вмешательства.Визуализацию следует повторить даже после завершения антибактериальной терапии, поскольку есть сообщения об обнаружении абсцессов через несколько недель после начала антибактериальной терапии. Несмотря на адекватную антимикробную терапию в течение 21 дня и более, при менингите, вызванном грамотрицательными кишечными бациллами, могут возникать рецидивы [59].
Систематический обзор краткосрочного курса антибактериальной терапии менингита у детей (от 3 недель до 16 лет) показал, что нет разницы между коротким курсом (4-7 дней) и долгим курсом (7-14 дней) лечения ( внутривенное введение цефтриаксона) в отношении клинического успеха в конце терапии, долгосрочных неврологических осложнений, нарушения слуха или вторичных внутрибольничных инфекций [60].При краткосрочном лечении продолжительность госпитализации была меньше. В качестве антибиотика использовался цефтриаксон во всех 5 исследованиях, включенных в систематический обзор. Концентрация цефтриаксона в спинномозговой жидкости во много раз превышает минимальную ингибирующую концентрацию для большинства патогенных микроорганизмов [61]. У новорожденных цефотаксим часто предпочтительнее цефтриаксона (особенно для пациентов с гипербилирубинемией), поскольку цефтриаксон может вытеснять билирубин из сайтов связывания альбумина. Более того, пациенты, включенные в вышеупомянутые испытания, были не моложе 3 месяцев (за исключением одного исследования, в котором участвовали начиная с 3 недель).Следовательно, результат систематического обзора не может быть экстраполирован на новорожденных, которые составляют другую подгруппу в силу их ослабленного иммунного статуса. Наконец, более короткие курсы могут быть неприменимы для пациентов, получающих адъювантную терапию дексаметазоном. Потенциальное подавление иммунных ответов, вызванных дексаметазоном, может гарантировать относительно длительную антимикробную терапию для достижения оптимальных микробиологических результатов [60].
В одном рандомизированном контролируемом исследовании не было выявлено клинических преимуществ адъювантной терапии дексаметазоном у 52 доношенных новорожденных с бактериальным менингитом [62].Однако проспективное нерандомизированное исследование, проведенное в Нигерии, показало, что дексаметазон значительно снижает смертность и неврологические последствия бактериального менингита новорожденных. В настоящее время недостаточно данных, чтобы дать рекомендации по применению дополнительного дексаметазона при бактериальном менингите новорожденных [56].
Повторить люмбальную пункцию для подтверждения стерилизации спинномозговой жидкости и улучшения параметров спинномозговой жидкости обычно не показано [56]. Однако это следует делать всем пациентам, у которых нет клинического ответа после 48 часов соответствующей антимикробной терапии.Новорожденным с менингитом, вызванным грамотрицательными бактериями, следует пройти повторные люмбальные пункции для подтверждения стерилизации спинномозговой жидкости, поскольку продолжительность антимикробной терапии частично определяется результатом. Некоторые авторы рекомендуют обследование спинномозговой жидкости по завершении терапии всем новорожденным, чтобы установить, требуется ли дополнительное лечение из-за непредсказуемого клинического течения болезни и ненадежности клинического обследования для оценки ответа на лечение у новорожденных [57].
Таким образом, комбинация ампициллина и цефотаксима или ампициллина и аминогликозида подходит для лечения предполагаемого раннего неонатального менингита. При подозрении на менингит с поздним началом рекомендуется комбинация ванкомицина и цефалоспорина третьего поколения в ожидании результатов посева ЦСЖ и определения чувствительности. Продолжительность противомикробной терапии менингита новорожденных должна составлять от 14 до 21 дня для GBS, ≥21 день для менингита L. monocytogenes и минимум 21 день для грамотрицательного менингита.
9. Заключение
Выбор антибиотиков должен основываться на возбудителях и характеристиках чувствительности к антибиотикам. Комбинация ампициллина и гентамицина является подходящим выбором для эмпирической терапии неонатальной EOS в развитых странах, где GBS и E. coli продолжают оставаться преобладающими микроорганизмами. При ЛОС у стабильного новорожденного может быть целесообразно начать лечение клоксациллина и гентамицина. Ванкомицин и цефотаксим следует назначать больным новорожденным с кардиореспираторной недостаточностью и в регионах, где преобладает MRSA.В развивающихся странах, где возбудители болезней и картина чувствительности к антибиотикам различаются, выбор противомикробной терапии должен быть изменен с учетом местной распространенности.
Продолжительность эмпирической антибактериальной терапии новорожденных должна составлять 48–72 часа до получения результатов посева при подозрении на сепсис. До получения дополнительных доказательств текущая рекомендация по 10–14-дневному лечению антимикробными препаратами подходит для сепсиса с положительным результатом посева крови без менингита. Новорожденным с бактериальным менингитом требуется более длительный срок в зависимости от изолированного организма.Повторение люмбальной пункции для документирования стерилизации спинномозговой жидкости важно из-за непредсказуемого клинического течения новорожденных. Прежде всего, дисциплинированный подход, состоящий из тщательного медицинского обследования и оценки клинического ответа на лечение, важен для определения соответствующей дозы и продолжительности приема антибиотиков у новорожденных с подозрением или доказанным сепсисом.
Тенденции в чувствительности к антибиотикам и заболеваемости поздним началом сепсиса новорожденных Klebsiella pneumoniae за шестилетний период в отделении интенсивной терапии новорожденных в Карачи, Пакистан
Введение
Заболеваемость, изменение чувствительности к антибиотикам и факторы риска, связанные с Проанализирована смертность от позднего сепсиса Klebsiella pneumoniae в период 2006–2011 гг. в отделении интенсивной терапии новорожденных (ОИТН) развивающейся страны.
Методы
Получены медицинские карты новорожденных с диагнозом сепсис при выписке с поздним началом K. pneumoniae . Регистрировались демографические особенности, гестационный возраст, дата и год поступления, чувствительность изолятов к антибиотикам и статус выписки. Сообщается о позднем начале K. pneumoniae случаев на 1000 госпитализаций в ОИТ и факторах риска смертности из-за позднего сепсиса K. pneumoniae .
Результаты
В период 2006–2011 гг. У 104 из 2768 новорожденных развилось позднее начало K.pneumoniae сепсис. Общая заболеваемость сепсисом K. pneumoniae с поздним началом составила 3,7% (37 из 1000 поступлений в ОИТН), при этом самая высокая годовая заболеваемость составила 53/1000 в 2010 г. Большинство случаев были у мужчин ( n = 64; 62%) и большинство из них были преждевременными и имели очень низкий вес при рождении ( n = 68; 65%). Более 80% изолятов были устойчивы к ампициллину + клавулановая кислота, гентамицину, азтреонаму и цефалоспоринам. Наблюдалась тенденция к увеличению устойчивости к амикацину, фторхинолонам, пиперациллину / тазобактаму и имипенему.В 2011 г. три четверти (72%; n = 13) K. pneumoniae с поздним началом были CR K. pneumoniae . Семнадцать (16%) новорожденных умерли. Мужчина ( p = 0,06, скорректированное отношение шансов (AOR) 9,2, 95% доверительный интервал (CI) 1,3–66,9), имеющий чрезвычайно низкий вес при рождении ( p = 0,01, AOR 6,1, 95% CI 0,8– 44,4), с тяжелой тромбоцитопенией ( p = 0,07, AOR 3,9, 95% ДИ 1,2–13,0) и невозможностью достичь микробиологического клиренса ( p <0.001, AOR 19,6, 95% ДИ 4,0–98,0) были значительно связаны со смертностью из-за позднего сепсиса K. pneumoniae .
Заключение
Наблюдается рост числа устойчивых к карбапенемам штаммов K. pneumoniae с поздним началом, что связано с повышенной смертностью и ограниченным выбором антибактериальных препаратов. Похоже, что борьба с противомикробными препаратами и строгие меры инфекционного контроля являются единственным способом ограничить распространение этих штаммов.
Один ребенок умирает от пневмонии каждые 39 секунд, агентства предупреждают
ЛОНДОН / НЬЮ-ЙОРК / БАРСЕЛОНА, 12 ноября 2019 г. — В прошлом году пневмония унесла жизни более 800 000 детей в возрасте до пяти лет, или по одному ребенку каждые 39 секунд, согласно новому анализу.
Большинство смертей произошло среди детей в возрасте до двух лет, и почти 153 000 смертей произошли в течение первого месяца жизни. [1]
Вызывая тревогу в связи с этой забытой эпидемией, шесть ведущих медицинских и детских организаций сегодня выступают с призывом к глобальным действиям. [2]
В январе группа будет принимать мировых лидеров на Глобальном форуме по детской пневмонии в Испании.
Генриетта Фор, исполнительный директор ЮНИСЕФ, сказала: «Ежедневно около 2200 детей в возрасте до пяти лет умирают от пневмонии, болезни, которую можно излечить и которую можно предотвратить.Твердая глобальная приверженность и увеличение инвестиций имеют решающее значение для борьбы с этой болезнью. Только с помощью экономически эффективных защитных, профилактических и лечебных мероприятий, проводимых там, где находятся дети, мы сможем по-настоящему спасти миллионы жизней ».
Пневмония вызывается бактериями, вирусами или грибами, и дети борются за дыхание, поскольку их легкие наполняются гноем и жидкостью.
В 2018 году от этой болезни умерло больше детей в возрасте до пяти лет, чем от любой другой болезни.437 000 детей в возрасте до пяти лет умерли от диареи и 272 000 детей — от малярии.
Кевин Уоткинс, исполнительный директор организации «Спасите детей», сказал: «Это забытая глобальная эпидемия, требующая срочных международных ответных мер. Миллионы детей умирают из-за отсутствия вакцин, доступных антибиотиков и планового кислородного лечения. Кризис пневмонии — это симптом пренебрежения и неоправданного неравенства в доступе к медицинской помощи ».
Всего пять стран несут ответственность за более половины случаев смерти детей от пневмонии: Нигерия (162 000), Индия (127 000), Пакистан (58 000), Демократическая Республика Конго (40 000) и Эфиопия (32 000).[3]
Дети с иммунной системой, ослабленной другими инфекциями, такими как ВИЧ или недоедание, а также дети, живущие в районах с высоким уровнем загрязнения воздуха и небезопасной водой, подвергаются гораздо большему риску.
Болезнь можно предотвратить с помощью вакцин и легко вылечить недорогими антибиотиками, если поставить правильный диагноз.
Но десятки миллионов детей по-прежнему не вакцинируются, и каждый третий с симптомами не получает необходимой медицинской помощи. [4]
Детям с тяжелыми случаями пневмонии также может потребоваться кислородная терапия, которая редко доступна в беднейших странах детям, которые в ней нуждаются.
Д-р Сет Беркли, генеральный директор Gavi, Vaccine Alliance, сказал: «Тот факт, что это предотвратимое, поддающееся лечению и легко диагностируемое заболевание по-прежнему является крупнейшим убийцей маленьких детей в мире, откровенно шокирует. За последнее десятилетие мы добились значительного прогресса: миллионы детей в беднейших странах мира сейчас получают спасительную пневмококковую вакцину. Во многом благодаря поддержке Гави охват пневмококковой вакциной в странах с низким уровнем доходов в настоящее время выше, чем в среднем в мире, но нам еще предстоит проделать работу, чтобы каждый ребенок имел доступ к этому спасателю.”
Финансирование, доступное для борьбы с пневмонией, значительно отстает от других болезней. Лишь 3% текущих глобальных расходов на исследования в области инфекционных заболеваний выделяется на пневмонию, несмотря на то, что это заболевание является причиной 15% смертей среди детей в возрасте до пяти лет.
Лейт Гринслейд, координатор проекта «Каждое дыхание на счету», сказал:
«На протяжении десятилетий главным убийцей детей была болезнь, которой не уделялось должного внимания, и самые уязвимые дети в мире расплачивались за это. Пришло время правительствам, ООН и многосторонним агентствам, компаниям и НПО объединить усилия для борьбы с пневмонией и защиты этих детей.”
В совместном призыве к действию организации призывают:
• Правительства наиболее пострадавших стран разработать и внедрить стратегии борьбы с пневмонией для сокращения детской смертности от пневмонии; и улучшить доступ к первичной медико-санитарной помощи в рамках более широкой стратегии всеобщего охвата услугами здравоохранения;
• Более богатые страны, международные доноры и компании частного сектора для увеличения охвата иммунизацией за счет снижения стоимости основных вакцин и обеспечения успешного пополнения Гави, Альянса по вакцинам; и увеличить финансирование исследований и инноваций для борьбы с пневмонией.
Для заметок редактора:
Контент и тематические исследования доступны здесь и здесь.
[1] Анализ ЮНИСЕФ, подготовленный в сентябре 2019 года, основан на предварительных оценках ВОЗ и Группы оценки материнской и детской эпидемиологии (MCEE), а также на оценках Межучрежденческой группы Организации Объединенных Наций по оценке детской смертности за 2018 год.
[2] ISGlobal, Save the Children, ЮНИСЕФ, каждое дыхание на счету, Unitaid и Gavi, Vaccine Alliance призывают страны с тяжелым бременем болезни и международных доноров взять на себя конкретные обязательства по борьбе с пневмонией.Совместно с Фондом «Ла Кайша», Фондом Билла и Мелинды Гейтс и USAID группа проведет Глобальный форум по детской пневмонии в Испании 29-31 января.
[3] В список 15 стран с наибольшим числом смертей от пневмонии среди детей в возрасте до пяти лет в 2018 г. вошли:
Название страны Расчетное число смертей от пневмонии у детей в возрасте до пяти лет, 2018 г.
1. Нигерия 162 000
2. Индия 127 000
3. Пакистан 58 000
4. Демократическая Республика Конго 40 000
5.Эфиопия 32 000
6. Индонезия 19 000
7. Китай 18 000
8. Чад 18 000
9. Ангола 16 000
10. Объединенная Республика Танзания 15 000
11. Сомали 15 000
12. Нигер 13 000
13. Мали 13 000
14. Бангладеш 12 000
15. Судан 11,000
В мире 802,000
Источник: анализ ЮНИСЕФ, основанный на оценках Межучрежденческой группы Организации Объединенных Наций по оценке детской смертности за 2018 год и промежуточных оценках ВОЗ и Группы по оценке эпидемиологии матери и ребенка (MCEE).
[4] В 2018 году 71 миллион детей не получили трех рекомендованных доз пневмококковой конъюгированной вакцины (ПКВ), что подвергло их более высокому риску пневмонии.Во всем мире 32% детей с подозрением на пневмонию не попадают в медицинские учреждения. Эта цифра возрастает до 40% для самых бедных детей в странах с низким и средним уровнем доходов.
Характеристики изолятов Klebsiella pneumoniae ST234 и ST1412, продуцирующих NDM-1, в неонатальном отделении | BMC Microbiology
Friedman ND, Carmeli Y, Walton AL, Schwaber MJ. Устойчивые к карбапенемам Enterobacteriaceae: стратегическая дорожная карта для борьбы с инфекциями. Инфекционный контроль Hosp Epidemiol. 2017; 38 (5): 580–94.
Артикул Google Scholar
Xu L, Sun X, Ma X. Систематический обзор и метаанализ смертности пациентов, инфицированных устойчивыми к карбапенемам Klebsiella pneumoniae. Анн Клин Микробиол Антимикроб. 2017; 16 (1): 18.
Артикул Google Scholar
Ye Y, Xu L, Han Y, Chen Z, Liu C, Ming L. Механизм устойчивости клинических изолятов Enterobacteriaceae к карбапенемам.Exp Ther Med. 2018; 15 (1): 1143–9.
CAS PubMed Google Scholar
Yong D, Toleman MA, Giske CG, Cho HS, Sundman K, Lee K, Walsh TR. Характеристика нового гена металло-бета-лактамазы Bla (NDM-1) и нового гена эритромицинэстеразы, несущих уникальную генетическую структуру в последовательности типа 14 Klebsiella pneumoniae из Индии. Противомикробные агенты Chemother. 2009. 53 (12): 5046–54.
CAS Статья Google Scholar
Хан А.У., Марьям Л., Заррилли Р. Структура, генетика и распространение металло-бета-лактамазы (NDM) в Нью-Дели: угроза общественному здоровью. BMC Microbiol. 2017; 17 (1): 101.
Артикул Google Scholar
Zhu J, Sun L, Ding B, Yang Y, Xu X, Liu W, Zhu D, Yang F, Zhang H, Hu F. Вспышка изолятов Klebsiella pneumoniae ST76 и ST37, продуцирующих NDM-1, в новорожденные. Eur J Clin Microbiol Infect Dis. 2016; 35 (4): 611–8.
CAS Статья Google Scholar
Zheng R, Zhang Q, Guo Y, Feng Y, Liu L, Zhang A, Zhao Y, Yang X, Xia X. Вспышка плазмид-опосредованной продуцирующей NDM-1 Klebsiella pneumoniae ST105 среди новорожденных в Юньнани, Китай. Анн Клин Микробиол Антимикроб. 2016; 15:10.
Артикул Google Scholar
Zhang X, Li X, Wang M, Yue H, Li P, Liu Y, Cao W, Yao D, Liu L, Zhou X и др. Вспышка Klebsiella pneumoniae, продуцирующая NDM-1, вызвавшая неонатальную инфекцию в учебной больнице в материковом Китае.Противомикробные агенты Chemother. 2015; 59 (7): 4349–51.
CAS Статья Google Scholar
Датта С., Митра С., Чаттопадхьяй П., Сом Т., Мукерджи С., Басу С. Распространение и обмен Bla NDM-1 у госпитализированных новорожденных: роль мобилизуемых генетических элементов. Eur J Clin Microbiol Infect Dis. 2017; 36 (2): 255–65.
CAS Статья Google Scholar
Logan LK.Устойчивые к карбапенемам энтеробактерии: новая проблема у детей. Clin Infect Dis. 2012; 55 (6): 852–9.
CAS Статья Google Scholar
CLSI, редактор. Стандарты эффективности тестирования чувствительности к противомикробным препаратам, т. Дополнение CLSI M100S. 26-е изд. Уэйн: Институт клинических и лабораторных стандартов; 2016.
Google Scholar
Европейский комитет по тестированию на чувствительность к противомикробным препаратам Доступно по адресу: http: // www.eucast.org.
Ляо ХР, Ся Дж, Ян Л, Ли Л, Сунь Дж, Лю ЮХ, Цзян Х. Характеристика бактерий Escherichia coli, продуцирующих CTX-M-14, у животных-производителей пищевых продуктов. Front Microbiol. 2015; 6: 1136.
Артикул Google Scholar
Chen L, Chen ZL, Liu JH, Zeng ZL, Ma JY, Jiang HX. Появление изолятов Escherichia coli и Enterobacter cloacae, продуцирующих метилазу RmtB, от свиней в Китае. J Antimicrob Chemother.2007. 59 (5): 880–5.
CAS Статья Google Scholar
Cattoir V, Poirel L, Rotimi V, Soussy CJ, Nordmann P. Мультиплексная ПЦР для обнаружения опосредованных плазмидами генов qnr устойчивости к хинолонам в изолятах энтеробактерий, продуцирующих БЛРС. J Antimicrob Chemother. 2007. 60 (2): 394–7.
CAS Статья Google Scholar
Diancourt L, Passet V, Verhoef J, Grimont PA, Brisse S.Мультилокусное типирование нозокомиальных изолятов Klebsiella pneumoniae. J Clin Microbiol. 2005. 43 (8): 4178–82.
CAS Статья Google Scholar
Хуан Ю.М., Чжун Л.Л., Чжан XF, Ху HT, Ли YQ, Ян XR, Фенг LQ, Хуанг X, Тянь, Великобритания. Citrobacter freundii, Escherichia coli и Acinetobacter baumannii, продуцирующие NDM-1, идентифицированы у одного пациента в Китае. Противомикробные агенты Chemother. 2015; 59 (8): 5073–7.
CAS Статья Google Scholar
Tenover FC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, Swaminathan B. Интерпретация паттернов рестрикции хромосомной ДНК, полученных с помощью гель-электрофореза в импульсном поле: критерии типирования бактериального штамма. J Clin Microbiol. 1995. 33 (9): 2233–9.
CAS PubMed PubMed Central Google Scholar
Carattoli A, Bertini A, Villa L, Falbo V, Hopkins KL, Threlfall EJ. Идентификация плазмид с помощью типирования репликонов на основе ПЦР.J Microbiol Methods. 2005. 63 (3): 219–28.
CAS Статья Google Scholar
Morrill HJ, Pogue JM, Kaye KS, LaPlante KL. Варианты лечения устойчивых к карбапенемам инфекций Enterobacteriaceae. Открытый форум инфекционных болезней. 2015; 2 (2): ofv050.
Артикул Google Scholar
Цувелекис Л.С., Маркогианнакис А., Пипераки Е., Сули М., Дайкос Г.Л.Лечение инфекций, вызванных энтеробактериями, продуцирующими карбапенемазу. Clin Microbiol Infect. 2014. 20 (9): 862–72.
CAS Статья Google Scholar
Накамура К., Канеко М., Абе Й, Ямамото Н., Мори Х., Йошида А., Охаши К., Миура С., Ян Т. Т., Момои Н. и др. Вспышка Escherichia coli, продуцирующая бета-лактамазы расширенного спектра действия, передается через совместное использование грудного молока в отделении интенсивной терапии новорожденных. J Hosp Infect.2016; 92 (1): 42–6.
CAS Статья Google Scholar
Giske CG, Froding I, Hasan CM, Turlej-Rogacka A, Toleman M, Livermore D, Woodford N, Walsh TR. Различные типы последовательностей Klebsiella pneumoniae способствуют распространению blaNDM-1 в Индии, Швеции и Великобритании. Противомикробные агенты Chemother. 2012. 56 (5): 2735–8.
CAS Статья Google Scholar
Чен Л., Чавда К.Д., Мелано Р.Г., Джейкобс М.Р., Колл Б., Хонг Т., Ройтман А.Д., Леви М.Х., Бономо Р.А., Крейсвирт Б.Н. Сравнительный геномный анализ KPC-кодирующих pKpQIL-подобных плазмид и их распределение в больницах Нью-Джерси и Нью-Йорка. Противомикробные агенты Chemother. 2014. 58 (5): 2871–7.
Артикул Google Scholar
Parvez S, Khan AU. Больничные сточные воды — резервуар для разновидностей металло-бета-лактамазы Нью-Дели (blaNDM) и энтеробактерий, продуцирующих ESBL.Int J Antimicrob Agents. 2018; 51 (1): 82–8.
CAS Статья Google Scholar
Мэджоракос А.П., Бернс К., Родригес Бано Дж., Борг М., Дайкос Дж., Думпис Ю., Люсет Дж. К., Моро М.Л., Такконелли Э., Симонсен Г.С. и др. Меры по профилактике и контролю инфекций и инструменты для предотвращения проникновения устойчивых к карбапенемам Enterobacteriaceae в медицинские учреждения: руководство Европейского центра профилактики и контроля заболеваний.Антимикробная защита от инфекций. 2017; 6: 113.
CAS Статья Google Scholar
Цефтазидим-авибактам при госпитальной пневмонии, вызванной Klebsiella pneumoniae с повышенной лекарственной устойчивостью
В редакцию : Появление обширной лекарственной устойчивости и общей лекарственной устойчивости Klebsiella pneumoniae (XDR-KP и PDR-KP) в виде внутрибольничной инфекции в педиатрическом отделении интенсивной терапии (PICU) и лечение этих случаев является сложной задачей для педиатров, поскольку доступно меньше данных [1].
Мальчик 3 лет поступил в отделение интенсивной терапии с эпилептическим статусом с внезапной головной болью в анамнезе с последующими генерализованными припадками без повышения температуры тела. Ввиду низкой шкалы комы Глазго (GCS) он был интубирован и вентилирован. МРТ-ангиограмма показала разрыв артериовенозной мальформации. Исходные лабораторные показатели были в норме. На третий день у него поднялась высокая температура с повышенным потреблением вентиляции; тесты наводили на мысль о сепсисе, пневмонии, лейкопении и тяжелой тромбоцитопении.Антибиотики были заменены с цефтриаксона на меропенем, а через 2 дня был добавлен колистин. Культура крови и эндотрахеальной трубки показала устойчивость КП ко всем антибиотикам, кроме фосфомицина. Ребенок продолжал находиться в критическом состоянии с прогрессирующей лейкопенией и тромбоцитопенией; Пленочная матрица (мультиплексная ПЦР) эндотрахеального секрета показала КП с присутствием CTX-M (цефотаксим), NDM (металло-β-лактамаза Нью-Дели) и OXA-48 подобных (оксациллиназа). Ребенок получил травму. цефтазидим-авибактам (62,5 мг / кг / доза через 8 часов), инъ.азтреонам и ин. фосфомицин. Ребенок был изолирован; экстубированные и инвазивные линии были удалены. После 14 дней приема антибиотиков он был выписан с нормальными клинико-лабораторными показателями. При активном наблюдении тот же самый организм был посажен из отсасывающей емкости отделения неотложной помощи и с кровати МРТ. Дезинфекция аспирационной бутылки проводилась 1% раствором гипохлорита, и персонал был обучен повторной обработке аспирационной бутылки. Как правило, кровать для МРТ очищается дезинфицирующим средством на основе спирта и глутарала после каждого пациента.
Цефтазидим-авибактам обладает превосходной активностью против многих β-лактамаз расширенного спектра, Amp-C, KP-карбапенемазы и OXA-48, продуцирующих энтеробактерии; однако он не активен против штаммов NDM [2]. Азтреонам эффективен против штаммов NDM, поскольку NDM не может гидролизовать азтреонам. В литературе предлагается комбинация цефтазидима-авибактама, фосфомицина и азтреонама; поскольку выживаемость при комбинированной терапии выше [3]. Авибактам ингибирует фермент KP карбапенемазу (KPC), обеспечивая активность не только цефтазидима, но и азтреонама.Также ожидается потенциальный синергетический эффект этой комбинации β-лактамов, поскольку цефтазидим и азтреонам связываются с PBP3 [4]. Цефтазидим-авибактам недавно одобрен USFDA для лечения детей с осложненной инфекцией мочевыводящих путей и внутрибрюшной инфекцией. Литературы по применению цефтазидим-авибактама в педиатрической больнице при приобретенной пневмонии недостаточно, поскольку безопасность не установлена. Однако из-за быстрого ухудшения состояния нашего пациента его использовали как спасательную терапию. В настоящее время продолжается многоцентровое клиническое исследование по оценке безопасности и переносимости цефтазидим-авибактама при внутрибольничной пневмонии [5].
Цефтазидим-авибактам выделяется как одно из наиболее важных дополнений в нашем арсенале для лечения инфекции XDR и PDR-KP.
Ссылки
- 1.
Krapp F, Ozer EA, Qi C, Hauser AR. Отчет о клиническом случае инфекции Klebsiella pneumoniae с широкой лекарственной устойчивостью с геномной характеристикой штамма и обзором аналогичных случаев в США. Открытый форум Infect Dis.2018; 5: офy074.
Артикул Google Scholar
- 2.
Iosifidis E, Chorafa E, Agakidou E, et al. Использование цефтазидим-авибактама для лечения широкой лекарственной устойчивости или общей лекарственной устойчивости Klebsiella pneumoniae у новорожденных и детей младше 5 лет. Pediatr Infect Dis J. 2019; 38: 812–5.
Артикул Google Scholar
- 3.
Европейский центр профилактики и контроля заболеваний.Вспышка продуцирующей карбапенемазы (NDM-1 и OXA-48) и колистин-резистентной Klebsiella pneumonia ST307. Северо-Восточная Германия, 2019 г. 28 октября 2019 г. ECDC: Стокгольм. 2019.
- 4.
Камарго Дж. Ф., Симкинс Дж., Бедуши Т. и др. Успешное лечение продуцирующей карбапенемазу устойчивой к противовоспалительным препаратам Klebsiella pneumoniaen бактериемии. Противомикробные агенты Chemother. 2015; 59: 5903–8.
CAS Статья Google Scholar
- 5.
Pfizer. Фаза I, открытое исследование однократной дозы для оценки фармакокинетики, безопасности и переносимости цефтазидима-авибактама (CAZ-AVI) у детей в возрасте от 3 месяцев до 18 лет, госпитализированных и получающих системную антибактериальную терапию в течение Подозреваемая или подтвержденная нозокомиальная пневмония, включая пневмонию, ассоциированную с искусственной вентиляцией легких. Доступно по адресу: https://clinicaltrials.gov/ct2/show/NCT04040621. Идентификатор NLM: NCT04040621. По состоянию на 13 августа 2020 г. Сибабратта Патнаик
- Амит Ранджан Руп
- Арун Кумар Даш
- Сибабратта Патнаик
Соответствующий автор
Переписка с Сибабратта Патнаик.
Декларации этики
Конфликт интересов
Нет.
Дополнительная информация
Примечание издателя
Springer Nature сохраняет нейтралитет в отношении юрисдикционных претензий на опубликованных картах и принадлежностей организаций.
Об этой статье
Цитируйте эту статью
Rup, A.R., Dash, A.K. И Патнаик, С. Цефтазидим-авибактам при госпитальной пневмонии из-за повышенной лекарственной устойчивости Klebsiella pneumoniae . Indian J Pediatr 88, 290–291 (2021). https://doi.org/10.1007/s12098-020-03546-y
Скачать цитату
Колонизация материнского влагалища избранными потенциальными патогенами неонатального сепсиса в эпоху устойчивости к противомикробным препаратам, опыт единого центра из Шри-Ланки
В течение За период исследования для исследования были набраны 250 доношенных беременных женщин, поступивших в исследовательское отделение. При поступлении у всех участников (250) были взяты мазки из нижнего влагалища (мазок а).Показатели колонизации до родов были рассчитаны с учетом всех 250 набранных участников.
Мазки после родов (мазок b) были взяты у 130 из 250 участников. 120 участников, у которых не было мазка после родов, принадлежали к одной из следующих четырех категорий; доставлен через экстренную LSCS ( n = 56), выписан без родов ( n = 19), ребенок помещен в отделения для новорожденных ( n = 8) или выписан до того, как исследовательская группа возьмет мазок ( n = 37).
Периректальный мазок был взят у 159 младенцев (мазок c). Все три мазка были собраны из 120 комбинаций участников «мать-ребенок», в то время как мазки матери и новорожденного (a и / или b + c) были доступны у 159 пар участников (рис. 1). Различия в показателях колонизации до и после родов были рассчитаны только для 130 участников, у которых были доступны оба мазка (a и b). Потенциальная передача инфекции от матери ребенку оценивалась в том случае, если имелся по крайней мере один мазок от матери и перианальный мазок от ребенка ( n = 159).
Рис. 1Материнский возраст варьировался от 17 до 41 года со средним возрастом 28,3 года (стандартное отклонение 5,3 года). Большинство матерей были в первой беременности (110/250, 44%). Сто восемьдесят девять (75,6%) участников были домохозяйками, а остальные работали. Двадцать пять (10%) участников имели одно или несколько сопутствующих заболеваний, которые существовали ранее или были связаны с беременностью. Пятнадцать участников имели гестационный или негестационный сахарный диабет, 8 участников имели гестационную или эссенциальную гипертензию, 2 участника лечились от гипотиреоза и у 1 участника была диагностирована анемия.Средняя продолжительность госпитализации составила 3,9 дня (стандартное отклонение 2,1), среднее время пребывания до родов — 1,8 дня (стандартное отклонение 1,9), а средняя продолжительность пребывания ребенка в больнице — 2,2 дня (стандартное отклонение 1,2).
Бактериальная колонизация перед родами (
N = 250)S. agalactiae Скорость колонизации составила 14,8% ( n = 37), в то время как скорость колонизации для Enterococcus spp. составило 24,8% ( n = 62). Все изоляты энтерококка имели МИК ванкомицина <2 мкг / мл.
Уровень колонизации по крайней мере для одного изолята Enterobacteriaceae составил 18,8% ( n = 47). Скорость колонизации по роду Klebsiella spp. составило 12,4% ( n = 31). Два Klebsiella spp. Было подтверждено, что изоляты (2 / 31,6,45%) являются продуцентами ESBL, несущими все три протестированные генетические детерминанты ( bla CTX-M , bla SHV и bla TEM ). Все Klebsiella spp.были чувствительны к имипенему, меропенему и эртапенему, а также к ципрофлоксацину и левофлоксацину. Только один изолят можно определить как организм с множественной лекарственной устойчивостью.
Частота видоспецифической колонизации для E. coli составила 5,6% ( n = 14). Было подтверждено, что два изолята E. coli являются продуцентами ESBL (2/14, 14,3%) и содержат только bla CTX-M . Все изоляты E. coli были чувствительны к имипенему, меропенему и эртапенему. Все E.coli также были чувствительны к ципрофлоксацину и левофлоксацину. Ни один из E. coli не являлся микроорганизмами с множественной лекарственной устойчивостью.
Скорость колонизации до доставки для ESBL, продуцирующей Klebsiella spp. или E.coli составило 1,6% (4/250). Показатель устойчивости к карбапенемам для Klebsiella spp. или E.coli составляла 0%. Скорость колонизации до доставки MDR Klebsiella spp. или E.coli составила 0,4% (1/250).
Показатели колонизации после родов (
N = 130)В период после родов были отобраны сто тридцать участников.Уровень колонизации S. agalactiae составил 10,8% ( n = 14), в то время как скорость колонизации для Enterococcus spp. составила 17,7% ( n = 23). Все изоляты энтерококка имели МИК ванкомицина <2 мкг / мл.
Пятьдесят четыре пациента (41,5%) были колонизированы по крайней мере одним Enterobacteriaceae. Тридцать три (25,4%) пациента носили Klebsiella spp. Было подтверждено, что три изолята (3/33, 9,1%) являются продуцентами БЛРС. Один из производителей БЛРС нес все три детерминанты БЛРС, а именно bla CTX-M , bla SHV и bla TEM, , в то время как один изолят содержал bla CTX-M , и bla ТЕМ.. Было обнаружено, что один изолят устойчив к эртапенему и имипенему, но чувствителен к меропенему. MHT установил, что этот изолят является продуцентом карбапанамазы. Два изолята были устойчивы к ципрофлоксацину и левофлоксацину (2 / 33,6,1%). Только один изолят можно определить как организм с множественной лекарственной устойчивостью, поскольку он устойчив к более чем трем классам антибиотиков.
Частота видоспецифической колонизации для E. coli составила 10,8% ( n = 14). Было подтверждено, что один изолят является продуцентом ESBL, несущим как bla CTX-M , так и bla TEM. Все изоляты были чувствительны к меропенему, имипенему, эртапенему, ципрофлоксацину и левофлоксацину. Ни один из E. coli не был МЛУ.
Таким образом, скорость колонизации после родов с ESBL, продуцирующей Klebsiella spp. или E. coli составила 3,1% (4/130). Скорость колонизации устойчивыми к карбапенемам Klebsiella spp. или E. coli составила 0,8% (1/130). Скорость колонизации MDR Klebsiella spp. или E. coli в когорте после родов также было 0.8% (1/130).
Сравнение показателей колонизации до и после родов
Этот анализ был ограничен 130 случаем, когда у одного и того же пациента были взяты мазки до и после родов. Наблюдалось значительное увеличение колонизации любыми Enterobacteriaceae и Klebsiella spp. (Таблица 1). Снижение скорости колонизации видов Enterococcus также было значительным. Изменения, наблюдаемые в S. agalactiae и E. coli , не были статистически значимыми.
Таблица 1 Сравнение колонизации до и после родов ( n = 130)Учитывая устойчивость к антибиотикам, MDR Klebsiella spp. или E. coli частота у 130 пациентов, у которых были доступны оба мазка, составила 0,8% (1/130) в период до родов, а также в период после родов. Скорость колонизации ESBL, продуцирующей Klebsiella spp. или E. coli составляли 2,3% (3/130) и 3,1% (4/130) в периоды до и после родов.Разница не была статистически значимой.
Колонизация новорожденных (
N = 159)S. agalactiae Скорость колонизации составила 5,7% ( n = 9), в то время как скорость колонизации для Enterococcus spp. составило 11,9% ( n = 19). МИК одного энтерококка для ванкомицина составляла 4 мкг / мл, тогда как у других изолятов она была <2 мкг / мл. Enterobacteriaceae были обнаружены у 34,0% ( n = 54) новорожденных, в то время как Klebsiella spp.были обнаружены среди 21,4% ( n = 34) и E. coli была обнаружена у 10,1% ( n = 16) младенцев. Было подтверждено, что два изолята E. coli являются продуцентами БЛРС, в то время как ни один из видов Klebsiella не является продуцентом БЛРС. Два производителя ESBL укрывали как bla CTX-M , так и bla TEM. Ни один из Klebsiella spp. или изолятов E. coli были устойчивы к карбапенемам, ципрофлоксацину или левофлоксацину.Ни один из изолятов не был МЛУ. Таким образом, скорость колонизации новорожденных с ESBL, продуцирующей Klebsiella spp. или E. coli составлял 1,2% (2/159), а уровни были 0% для устойчивых к карбапенемам или MDR Klebsiella spp. или E. coli.
Потенциальная передача микроорганизмов от матери к ребенку (
N = 159)Это было оценено с использованием 159 пар материнско-неонатальных пар, в которых либо до и / или после родов мазок от матери и неонатальный периректальный тампон был в наличии. S. agalactiae был обнаружен как у матери, так и у ребенка в четырех случаях (2,5%). Enterococcus видов обнаружено в парах мать – ребенок в 13 случаях (8,2%).
Было 23 (14,5%) случая, когда и мать, и ребенок были колонизированы одними и теми же энтеробактериями с одной и той же антибиотикограммой, где 4 (2,5%) пары мать-новорожденный были колонизированы E. coli , 18 (11,3 %) были с Klebsiella spp. ( К. oxytoca — 3, К.pneumoniae -15) и один был с Enterobacter cloacae ( n = 1).
Анализ результатов RAPD показал, что два из четырех E. coli , обнаруженных в материнских неонатальных парах, показали сходство более 75% при допуске 3,5 (рис. 2). Из 18 пар изолятов Klebsiella восемь пар показали сходство более 75% с допуском 3,5 (рис. 3). Enterobacter cloacae , обнаруженные в паре мать-новорожденный, показали сходство> 75% (не показано на рисунке).Таким образом, учитывая только изоляты с> 75% сходства по индексу Дайса, одиннадцать пар изолятов (11/159, 6,9%) могли быть из одного и того же происхождения, следовательно, потенциально передаваться между матерью и ребенком. Только один (1/159, 0,6%) из этих 11 был продуцентом БЛРС и ни один не являлся микроорганизмами с МЛУ.
Рис. 2Дендрограмма для демонстрации потенциального переноса от матери к ребенку — изолятов Escherichia coli . Числа на оси указывают процентное сходство в индексе Dice.Изоляты, демонстрирующие сходство> 75%: 190b — 190c и 149b — 149c. a: предродовой мазок из влагалища, b: мазок из влагалища после родов, c: периректальный мазок от ребенка. Номер обозначает номер исследования, присвоенный данной паре мать-ребенок.
Рис. 3Дендрограмма для демонстрации потенциального переноса от матери к ребенку — изолятов Klebsiella . Числа на оси указывают процентное сходство в индексе Dice. Изоляты, демонстрирующие сходство> 75%: 1b-1c, 72b-72c, 74b-74c, 82b-82c, 113b-113c, 139b-139c, 142a-142b-142c, 173b-173c.a: предродовой мазок из влагалища, b: мазок из влагалища после родов, c: периректальный мазок от ребенка.



 Речь о передаче микроба через пустышку, тарелку, погремушку и прочие предметы, на которых может оказаться микроб;
Речь о передаче микроба через пустышку, тарелку, погремушку и прочие предметы, на которых может оказаться микроб;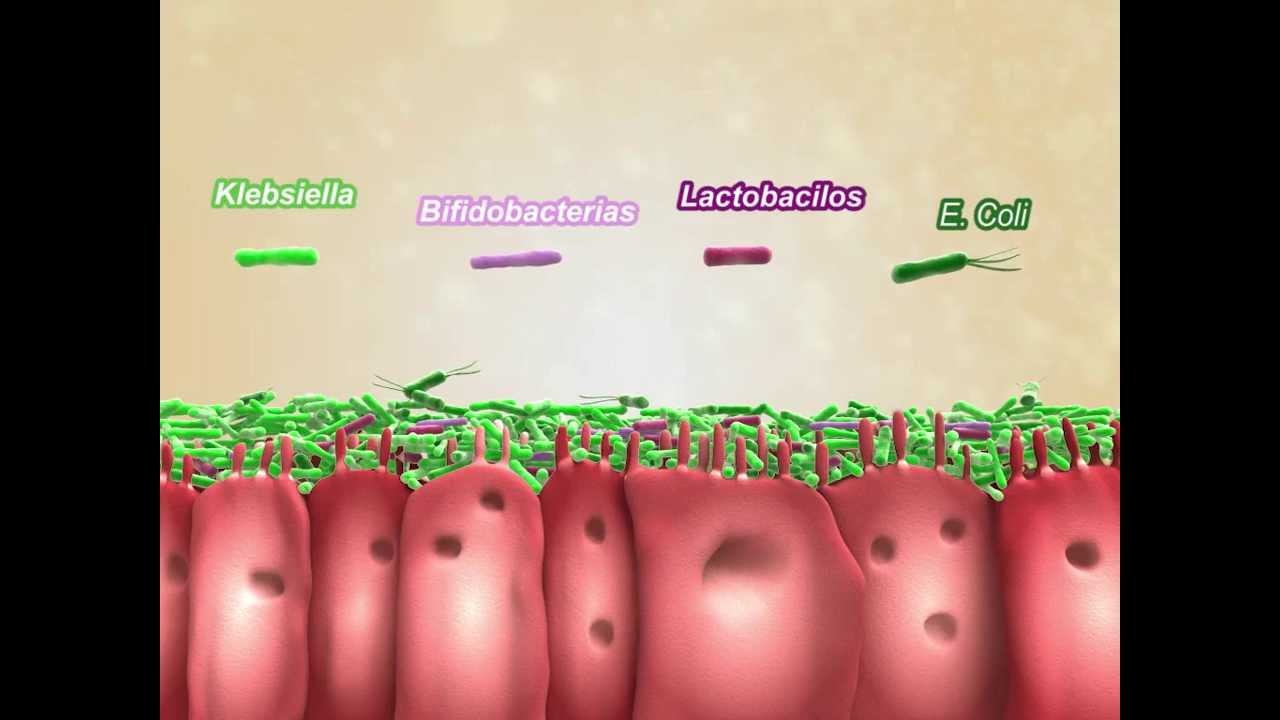


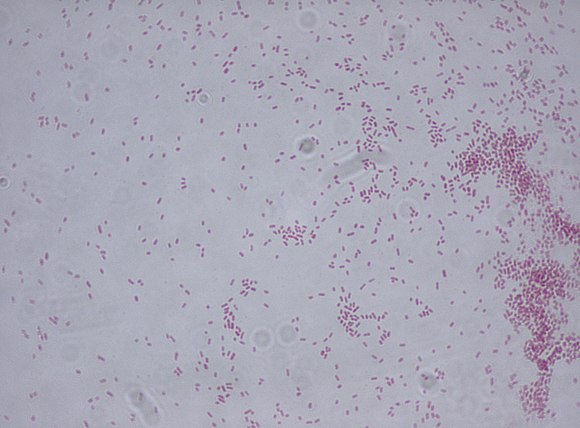

 Основные симптомы — температура, тошнота со рвотой, слабость и понос.
Основные симптомы — температура, тошнота со рвотой, слабость и понос.

 Но часто они, же приводят к дисбактериозу. Поэтому в обязательном порядке после лечения антибиотиками нужно проводить восстановительную терапию. Прием лакто и бифидо — бактерий для восстановления микрофлоры кишечника.
Но часто они, же приводят к дисбактериозу. Поэтому в обязательном порядке после лечения антибиотиками нужно проводить восстановительную терапию. Прием лакто и бифидо — бактерий для восстановления микрофлоры кишечника.