Гемолитическая болезнь новорожденныха — Медкор
Гемолитическая болезнь новорожденных — заболевание, развивающееся при несовместимости крови матери и новорожденного по Rh-фактору или системе АВО при образовании в организме матери антител, направленных против эритроцитов ребенка и передающихся ему трансплацентарно. Реже это заболевание может возникнуть при несовместимости по другим групповым антигенам эритроцитов.
Следует учесть, что имеется несколько типов резус-антигена. По предложению Фишера типы резус-антигена стали обозначать соответственно буквами D, Е и С. Обычно резус-конфликт развивается при несовместимости по Rh0, то есть (D)-антигену, по другим типам — реже. Несовместимость по антигенам АВ0, приводящая к гемолитической болезни новорожденных, обычно развивается при группе крови матери 0 (I) и группе крови ребенка А (II), при этом гемолитическая болезнь новорожденных может возникнуть уже при первой беременности, но при нарушении барьерных функций плаценты (гестоз беременных, инфекции и др.
Патогенез.
При беременности резус-отрицательной матери резус-положительным плодом в организме беременной вырабатываются антитела к D-антигену, они затем во время повторной беременности переходят через плаценту в кровь плода и приводят к гемолизу его эритроцитов. Гемолиз может произойти как до, так и после рождения ребенка. Развиваются анемия и гипербилирубинемия. В генезе гипербилирубинемии имеет значение не только гемолиз эритроцитов, но и недостаточность ферментной функции печени, свойственная периоду новорожденности.
Суть ее заключается в недостаточном образовании фермента глюкуронилтрансферазы, ответственной за конъюгацию непрямого билирубина с глюкуроновой кислотой и превращение его в нетоксичный прямой билирубин. В первые дни жизни новорожденных с гемолитической болезнью увеличение билирубина происходит в основном за счет непрямого, к концу недели может быть подъем и прямого билирубина. Это связано еще и не только с указанным нарушением функции печени, но и с синдромом сгущения желчи. Непрямой билирубин может вызвать повреждение ганглиевых клеток базальных ядер продолговатого мозга и привести к так называемой ядерной желтухе. Продукты распада эритроцитов вызывают раздражение функции костного мозга, и в кровь выбрасываются молодые, незрелые клетки красной крови.
В первые дни жизни новорожденных с гемолитической болезнью увеличение билирубина происходит в основном за счет непрямого, к концу недели может быть подъем и прямого билирубина. Это связано еще и не только с указанным нарушением функции печени, но и с синдромом сгущения желчи. Непрямой билирубин может вызвать повреждение ганглиевых клеток базальных ядер продолговатого мозга и привести к так называемой ядерной желтухе. Продукты распада эритроцитов вызывают раздражение функции костного мозга, и в кровь выбрасываются молодые, незрелые клетки красной крови.
Клиника.
Гемолитическая болезнь новорожденных может проявиться одной из трех клинических форм:
1) гемолитическая болезнь новорожденных с желтухой и общей водянкой;
2) гемолитическая болезнь новорожденных с умеренной анемией и без выраженной желтухи;
3) гемолитическая болезнь новорожденных с выраженной анемией и желтухой. Более часто встречаются вторая и третья формы, значительно реже — первая форма гемолитической болезни новорожденных.
Форма гемолитической болезни новорожденных с желтухой и общей водянкой —наиболее тяжелая форма гемолитической болезни новорожденных. При этой болезни плод погибает во внутриутробном периоде или наступает гибель новорожденного вскоре после рождения. У новорожденного отмечают общий отек тканей и отек внутри полостей (брюшной, плевральной, сердечной). Желтуха выражена не всегда и умеренно. Привлекает внимание выраженная бледность кожи. Значительно увеличены печень и селезенка. Выявляют значительные нарушения центральной и периферической гемодинамики, сердечно-сосудистую недостаточность (застой в большом и малом круге кровообращения). При исследовании крови находят значительное снижение количества эритроцитов (до 1,5·1012/л — 2·1012/л) и гемоглобина (ниже 80 г/л), выраженную гипопротеинемию (ниже 45 г/л). В настоящее время удается спасти жизнь некоторых детей с этой формой за счет проведения внутриутробного лечения плода и проведения заменных переливаний крови новорожденному.

Опасность поражения ЦНС в виде ядерной желтухи появляется при повышении уровня непрямого билирубина выше 300 мкмоль/л. При развитии ядерной желтухи состояние ухудшается, еще больше нарастают вялость, адинамия, появляются сонливость, нистагм, опистотонус, “симптом заходящего солнца”. Отмечают гипотонию, гиподинамию, угнетение физиологических рефлексов. Затем повышается внутричерепное давление, появляются тремор конечностей, ригидность затылочных мышц, напряжение большого родничка. Могут быть брадикардия, урежение дыхания. Развивается цианоз, появляется приглушение тонов сердца. В крови — анемия. Клинически более легкая форма гемолитической болезни новорожденных — анемическая. Проявляется анемия чаще к концу 1-й или к середине 2-й недели. Появляется бледность кожных покровов, дети становятся несколько вялыми, хуже сосут грудь, наблюдается увеличение печени и селезенки. В крови снижено количество эритроцитов и гемоглобина, увеличены незрелые формы эритроцитов (эритробласты, нормобласты, ретикулоциты).
Межгрупповой АВ0-конфликт матери и плода: роль антигликановых алло-антител в развитии гемолитической болезни новорожденных | Обухова
2. Алексанян К.В., Андрюшина И.В., Белоусова Т.В. Особенности эритроцитарных антигенов системы АВО у новорожденных // Медицина и образование в Сибири, 2014. №. 3. С. 60-65.
3. Альферович Е.Н., Грак Л.В., Кокорина Н.В., Саржевская Е.А. Современные аспекты течения гемолитической болезни новорожденных в условиях крупного промышленного центра // Экологический вестник, 2015. №. 4 (34). С. 39-43.
4. Антонов А.Г., Дегтярев Д.Н., Нароган М. В., Карпова А.Л., Сенькевич О.А., Сафаров А.А., Сон Е.Д., Малютина Л.В. Гемолитическая болезнь плода и новорожденного. Клинические рекомендации // Неонатология: новости, мнения, обучение, 2018. Т. 6, № 2. С. 131-157.
В., Карпова А.Л., Сенькевич О.А., Сафаров А.А., Сон Е.Д., Малютина Л.В. Гемолитическая болезнь плода и новорожденного. Клинические рекомендации // Неонатология: новости, мнения, обучение, 2018. Т. 6, № 2. С. 131-157.
5. Белкина М.Л., Верещагина В.С., Абинова А.В., Ледяйкина Л.В., Раздолькина Т.И. Особенности течения гемолитической болезни новорожденных в Республике Мордовия по данным ГБУЗ РМ «ДРКБ» г. Саранска // Научный форум. Сибирь, 2019. Т. 5, №. 1. С. 65-68.
6. Дегтярев Д.Н., Карпова А.Л., Малютина Л.В., Нароган М.В., Сафаров А.А., Сенькевич О.А., Сон Е.Д. Гемолитическая болезнь плода и новорожденного (ГБН). Клинические рекомендации 2017 // Журнал международной медицины (Педиатрия/Неонатология), 2017. № 6 (29). С. 73-85.
7. Кувшинова Л.А., Шемякина О.
8. Логинова А.А., Лазарева Н.Н., Жукова Е.С., Бордакова Е.В., Никонова А.А. Особенности течения гемолитической болезни новорожденного // Медицинский алфавит, 2017. Т. 1, № 12. С. 27-30.
9. Перепелица С.А., Сергунова В.А., Алексеева С.В., Гудкова О.Е. Морфология эритроцитов при изоиммунизации новорожденных по резус-фактору и АВО-системе // Общая реаниматология, 2015. Т. 11, № 2. С. 25-34.
10. Петренко Ю.В. Иванов Д.О., Чередникова Е.С., Мызникова И.В. Анализ течения гемолитической болезни новорожденных с конфликтом по АВ0-системе // Вестник Российской военно-медицинской академии, 2012. №. 4. С. 67-70.
11. Сидельникова В.М., Антонов А.Г. Гемолитическая болезнь плода и новорожденного. М.: Триада-Х, 2004. 192 с.
12. Синчихин С.П. Ветров В.В., Иванов Д.О., Степанян Л.В., Мамиев О.Б., Галкина Н.Н., Ожерельева М.А., Кравченко Е.Н. Иммуноконфликтная беременность и профилактика гемолитической болезни новорожденных // Проблемы женского здоровья, 2016. Т. 11, №. 1. С. 5-12.
13. Филиппов Е.С., Гомелля М.В., Скворцова М.В. Гемолитическая болезнь плода и новорожденного // Здоровье детей Сибири, 2018. № 1. С. 40-44.
14. Чистякова Г.Н., Касаткина Е.В. Современный взгляд на проблему иммунологической несовместимости при беременности // Уральский медицинский журнал, 2011. № 4 (82). С. 27-33.
15. Akanmu A.S., Oyedeji O.A., Adeyemo T.A., Ogbenna A.A. Estimating the risk of ABO hemolytic disease of the newborn in Lagos. J. Blood Transfus., 2015, Vol. 2015, pp. 1-5.
16. Aydin M., Deveci U., Orman A. and Taskin E. Is the Antiglobulin Test a Good Marker for Predicting the Development of Hemolytic Disease of the Newborn in ABO Incompatibility? Pediatr. Neonatol., 2016, Vol. 57, no. 5, 449. doi: 10.1016/j.pedneo.2015.11.006.
17. Bakkeheim E., Bergerud U., Schmidt-Melbye A.C., Akkök Ç. A., Liestøl K., Fugelseth D., Lindemann R. Maternal IgG anti-A and anti-B titres predict outcome in ABO-incompatibility in the neonate. Acta Paediatr., 2009, Vol. 98, no. 12, pp. 1896-1901.
18. Bhat Y.R., Kumar C.G. Morbidity of ABO haemolytic disease in the newborn. Paediatr. Int. Child Health, 2012, Vol. 32, no. 2, pp. 93-96.
Bhat Y.R., Kumar C.G. Morbidity of ABO haemolytic disease in the newborn. Paediatr. Int. Child Health, 2012, Vol. 32, no. 2, pp. 93-96.
19. Bello-Gil D., Manez R. Exploiting natural anti-carbohydrate antibodies for therapeutic purposes. Biochemistry (Moscow), 2015, Vol. 80, no. 7, pp. 836-845.
20. Breimer M., Samuelsson B. The specific distribution of glycolipid-based blood group A antigens in human kidney related to A1/A2, Lewis, and secretor status of single individuals: a possible molecular explanation for the successful transplantation of A2 kidneys into O recipients. Transplantation, 1986, Vol. 42, no. 1, pp. 88-91.
21. Brouwers H.A., Overbeeke M.A., Ouwehand W.H., Keuning K., van Ertbruggen I., van Leeuwen E.F., Stoop J.W., Engelfriet C.P. Maternal antibodies against fetal blood group antigens A or B: lytic activity of IgG subclasses in monocyte-driven cytotoxicity and correlation with ABO haemolytic disease of the newborn.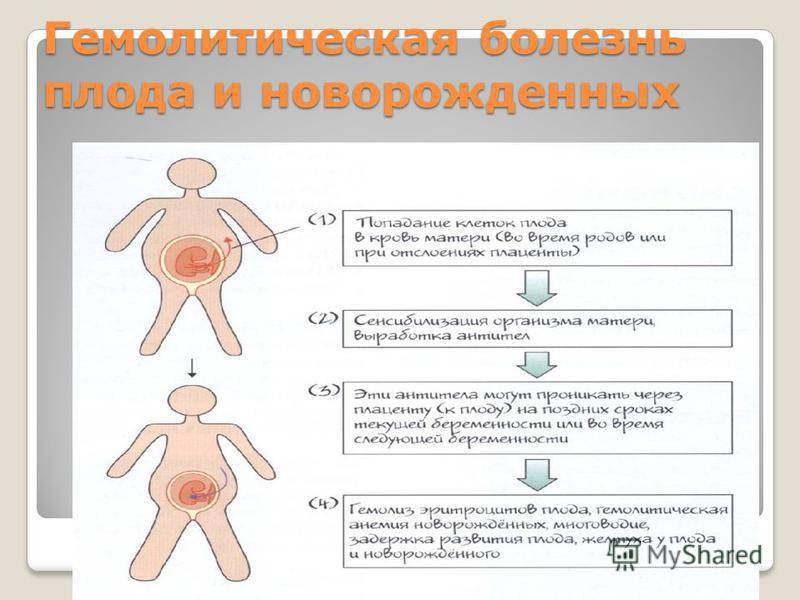 Br. J. Haematol., 1988, Vol. 70, no. 4, pp. 465-469.
Br. J. Haematol., 1988, Vol. 70, no. 4, pp. 465-469.
22. Brouwers H.A., Overbeeke M.A., van Ertbruggen I., Schaasberg W., Alsbach G.P., van der Heiden C., van Leeuwen E.F., Stoop J.W., Engelfriet C.P. What is the best predictor of the severity of ABO-haemolytic disease of the newborn? Lancet, 1988, Vol. 332, no. 8612, pp. 641-644.
23. Brouwers H.A., Overbeeke M.A., Huiskes E., Bos M.J., Ouwehand W.H., Engelfriet C.P. Complement is not activated in ABO-haemolytic disease of the newborn. Br. J. Haematol., 1988, Vol. 68, no. 3, pp. 363-366.
24. Bourgeois L. Observations diverses sur la sterilité perte de fruict foecondité accouchements et maladies des femmes et enfants nouveaux naiz. Paris: A. Saugrain, 1609. 240 p.
25. Cariani L., Romano E.L., Martinez N., Montaño, R., Suarez, G., Ruiz, I., Soyano, A. ABO-haemolytic disease of the newborn (ABO-HDN): Factors influencing its severity and incidence in Venezuela. J. Trop. Pediatr., 1995, Vol. 41, no. 1, pp. 14-21.
Cariani L., Romano E.L., Martinez N., Montaño, R., Suarez, G., Ruiz, I., Soyano, A. ABO-haemolytic disease of the newborn (ABO-HDN): Factors influencing its severity and incidence in Venezuela. J. Trop. Pediatr., 1995, Vol. 41, no. 1, pp. 14-21.
26. Cartron J.P., Badet J., Mulet C., Salmon C. Study of the alpha-N-acetylgalactosaminyltransferase in sera and red cell membranes of human A subgroups. J. Immunogenet., 1978, Vol. 5, no. 2, pp. 107-116.
27. Chun S., Choi S., Yu H., Cho D. Cis-AB, the blood group of many faces, is a conundrum to the novice eye. Ann. Lab. Med., 2019, Vol. 39, no. 2, pp. 115-120.
28. Clausen H., Levery S.B., Nudelman E., Tsuchiya S., Hakomori S. Repetitive A epitope (type 3 chain A) defined by blood group A1-specific monoclonal antibody TH-1: chemical basis of qualitative A1 and A2 distinction. Proc. Natl. Acad. Sci. USA, 1985, Vol. 82, no. 4, pp. 1199-1203.
Proc. Natl. Acad. Sci. USA, 1985, Vol. 82, no. 4, pp. 1199-1203.
29. Cohen M., Hurtado-Ziola N., Varki A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood, 2009, Vol. 114, no. 17, pp. 3668-3676.
30. Daniels G. Human Blood Groups. 3rd edition. John Wiley & Sons, 2013. 560 p.
31. Diamond L.K., Blackfan K.D. and Baty J.M. Erythroblastosis fetalis and its association with universal edema of the fetus, icterus gravis neonatorum and anemia of the newborn. J. Pediatr., 1932, Vol. 1, no. 3, pp. 269-309.
32. de Haas M., Thurik F.F., Koelewijn J.M., van der Schoot C.E. Haemolytic disease of the fetus and newborn. Vox Sang., 2015, Vol. 109, no. 2, pp. 99-113.
99-113.
33. de Mattos L.C. Structural diversity and biological importance of ABO, H, Lewis and secretor histo-blood group carbohydrates. Revista Brasileira de Hematologia e Hemoterapia, 2016, Vol. 38, no. 4, pp. 331-340.
34. Deng Z.H., Seltsam A., Ye Y.W., Yu Q., Li Q., Su Y.Q., Liang Y.L., Zang H. Haemolytic disease of fetus and newborn caused by ABO antibodies in a cisAB offspring. Transfus. Apher. Sci., 2008, Vol. 39, no. 2, pp. 123-128.
35. Desjardins L., Chintu C., Zipursky A. The spectrum of ABO hemolytic disease of the newborn infant. J. Pediatr., 1979, Vol. 95, no. 3, pp. 447-449.
36. Economidou J., Hughes-Jones N.C., Gardner B. Quantitative measurements concerning A and B antigen sites. Vox Sang., 1967, Vol. 12, no. 5, pp. 321-328.
Vox Sang., 1967, Vol. 12, no. 5, pp. 321-328.
37. Einarsdottir H.K., Selman M.H., Kapur R., Scherjon S., Koeleman C.A., Deelder A.M., van der Schoot C.E., Vidarsson G., Wuhrer M. Comparison of the Fc glycosylation of fetal and maternal immunoglobulin G. Glycoconj. J., 2013, Vol. 30, no. 2, pp. 147-157.
38. Fasano R.M. Hemolytic disease of the fetus and newborn in the molecular era. Semin. Fetal Neonatal Med., 2016, Vol. 21, no. 1, pp. 28-34.
39. Feizi T. The Blood group Ii system: a carbohydrate antigen system defined by naturally monoclonal or oligoclonal autoantibodies of man. Immunol. Commun., 1981, Vol. 10, no. 2, pp. 127-156.
40. Fouda G.G., Martinez D.R., Swamy G.K. , Permar S.R. The Impact of IgG transplacental transfer on early life immunity. Immunohorizons, 2018, Vol. 2, no. 1, pp. 14-25.
, Permar S.R. The Impact of IgG transplacental transfer on early life immunity. Immunohorizons, 2018, Vol. 2, no. 1, pp. 14-25.
41. Frame T., Carroll T., Korchagina E., Bovin N., Henry S. Synthetic glycolipid modification of red blood cell membranes. Transfusion, 2007, Vol. 47, no. 5, pp. 876-582.
42. Garratty G. Blood groups and disease: a historical perspective. Transfus. Med. Rev., 2000, Vol. 14, no.4, pp. 291-301.
43. Gilja B.K., Shah V.P. Hydrops fetalis due to ABO incompatibility. Clin. Pediatr., 1988, Vol. 27, no. 4, pp. 210-212.
44. Ginsburg V. Enzymatic basis for blood groups in man. Adv. Enzymol. Relat. Areas Mol. Biol., 1972, Vol. 36. pp. 131-149.
45. Goraya J., Basu S., Sodhi P., Mehta S. Unusually severe ABO hemolytic disease of newborn. Indian J. Pediatr., 2001, Vol. 68, no. 3, pp. 285-286.
Goraya J., Basu S., Sodhi P., Mehta S. Unusually severe ABO hemolytic disease of newborn. Indian J. Pediatr., 2001, Vol. 68, no. 3, pp. 285-286.
46. Graham H., Morrison M., Casey E. Severe ABO haemolytic disease due to high titre IgG anti-B in an A2 mother. Vox Sang., 1974, Vol. 27, no. 4, pp. 363-368.
47. Hadley A.G. Laboratory assays for predicting the severity of haemolytic disease of the fetus and newborn. Transpl. Immunol., 2002, Vol. 10, no. 2-3, pp. 191-198.
48. Hadaya K. ABO incompatible renal transplantation. Rev. Med. Suisse, 2012, Vol. 8, no. 346, pp. 1310-1313.
49. Hakomori S. Antigen structure and genetic basis of histo-blood groups A, B and O: their changes associated with human cancer. Biochim. Biophys. Acta., 1999, Vol. 1473, no. 1, pp. 247-266.
Biochim. Biophys. Acta., 1999, Vol. 1473, no. 1, pp. 247-266.
50. Hakomori S. Blood group ABH and Ii antigens of human erythrocytes: chemistry, polymorphism and their developmental change. Semin. Hematol., 1981, Vol. 18, pp. 39-62.
51. Halbrecht I. Role of hemoagglutinins anti-A and anti-B in pathogenesis of jaundice of the newborn (icterus neonatorum precox). Amer. J. Dis. Child., 1944, Vol. 68, no. 4, pp. 248-249.
52. Han P., Kiruba R., Ong R., Joseph R., Tan K.L., Wong H.B. Haematolytic disease due to ABO incompatibility: incidence and value of screening in an Asian population. Aust. Paediatr. J., 1988, Vol. 24, no. 1, pp. 35-38.
53. Haque K.M., Rahman M. An unusual case of ABO-haemolytic disease of the newborn. Bangladesh Med. Res. Counc. Bull., 2000, Vol. 26, no. 2, pp. 61-64.
Bangladesh Med. Res. Counc. Bull., 2000, Vol. 26, no. 2, pp. 61-64.
54. Hari Y., von Allmen E.C., Boss G.M., Naiem A., Gittermann M., Nydegger U.E. The complement-activating capacity of maternal IgG antibodies to blood group A in paired mother/child serum samples. Vox Sang., 1998, Vol. 74, no. 2, pp. 95-100.
55. Hassanzadeh-Nazarabadi M., Shekouhi S., Seif N. The incidence of spontaneous abortion in mothers with blood group O compared with other blood types. Int. J. Mol. Cell. Med., 2012, Vol. 1, no. 2, pp. 99-104.
56. Huhn C., Selman M.H.J., Ruhaak L.R., Deelder A.M., Wuhrer M. IgG glycosylation analysis. Proteomics, 2009, Vol. 9, no. 4, pp. 882-913.
57. Jain A., Malhotra S. , Marwaha N., Kumar P., Sharma R.R. Severe ABO hemolytic disease of fetus and newborn requiring blood exchange transfusion. Asian J. Transfus. Sci., 2018, Vol. 12, no. 2, pp. 176-179.
, Marwaha N., Kumar P., Sharma R.R. Severe ABO hemolytic disease of fetus and newborn requiring blood exchange transfusion. Asian J. Transfus. Sci., 2018, Vol. 12, no. 2, pp. 176-179.
58. Jefferis R., Lund J., Pound J.D. IgG-Fc-mediated effector functions: molecular definition of interaction sites for effector ligands and the role of glycosylation. Immunol. Rev., 1998, Vol. 163, no. 1, pp. 59-76.
59. Kaplan M., Na’amad M., Kenan A., Rudensky B., Hammerman C., Vreman H.J., Wong R.J., Stevenson D.K. Failure to predict hemolysis and hyperbilirubinemia by IgG subclass in blood group A or B infants born to group O mothers. Pediatrics, 2009, Vol. 123, no. 1, pp. e132-e137.
60. Katopodis A.G., Warner R.G., Duthaler R.O., Streiff M.B., Bruelisauer A., Kretz O. , Dorobek B., Persohn E., Andres H., Schweitzer A., Thoma G., Kinzy W., Quesniaux V.F., Cozzi E., Davies H.F., Mañez R., White D. Removal of anti-Galalpha1,3Gal xenoantibodies with an injectable polymer. J. Clin. Invest., 2002, Vol. 110, no. 12, pp. 1869-1877.
, Dorobek B., Persohn E., Andres H., Schweitzer A., Thoma G., Kinzy W., Quesniaux V.F., Cozzi E., Davies H.F., Mañez R., White D. Removal of anti-Galalpha1,3Gal xenoantibodies with an injectable polymer. J. Clin. Invest., 2002, Vol. 110, no. 12, pp. 1869-1877.
61. Kattimani V.S., Ushakiran C.B. Hemolytic disease of the newborn due to ABO incompatibility. Int. J. Contemp. Pediatr., 2018, Vol. 5, no. 2, 605. doi: 10.18203/2349-3291.ijcp20180564.
62. Kibe T., Fujimoto S., Ishida C., Togari Y., Wada Y., Okada S., Nakagawa H., Tsukamoto Y., Takahashi N. Glycosylation and placental transport of immunoglobulin G. J. Clin. Biochem. Nutr., 1996, Vol. 21, no. 1, pp. 57-63.
63. Klein H.G., Anstee D.J., Hemolytic disease of fetus and newborn. In: Klein H.G., Anstee D. J., eds. Mollison’s blood transfusion in clinical medicine. 12th ed. Oxford: John Wiley & Sons, 2014, pp. 499-548.
J., eds. Mollison’s blood transfusion in clinical medicine. 12th ed. Oxford: John Wiley & Sons, 2014, pp. 499-548.
64. Korchagina E.Yu., Pochechueva T.V., Obukhova P., Formanovsky A.A., Imberty A., Rieben R., Bovin N.V. Design of the blood group AB glycotope. Glycoconj. J., 2005, Vol. 22, no. 3, pp.125-131.
65. Kristinsdottir T., Kjartansson S., Hardardottir H., Jonsson T., Halldorsdottir A.M. Positive Coomb’s test in newborns; causes and clinical consequences Summary of cases diagnosed in the Blood Bank in the years 2005 to 2012. [Article in Icelandic]. Laeknabladid, 2016, Vol. 102, no. 7-8, pp. 326-331.
66. Kumar R., Saini N., Kaur P., Sood T., Kaur G., Bedi R.K., Mittal K. Severe ABO Hemolytic Disease of Newborn with High Maternal Antibody Titres in a Direct Antiglobulin Test Negative Neonate.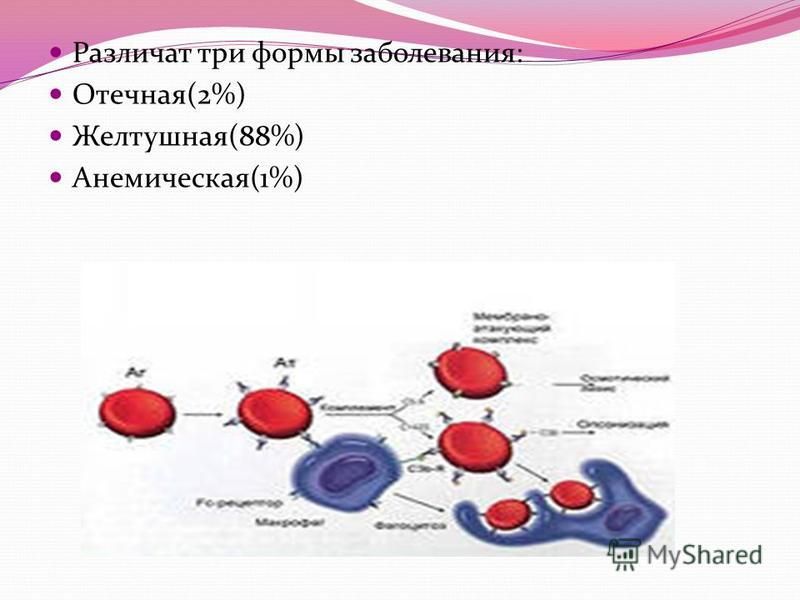 Indian J. Pediatr., 2015, Vol. 83, no. 7, pp. 740-741.
Indian J. Pediatr., 2015, Vol. 83, no. 7, pp. 740-741.
67. Kumlien G., Sarman I., Shanwell A. A case of neonatal ABO immunization which was difficult to diagnose. The mother with blood group A2 and the infant with negative direct antiglobulin test. Lakartidningen, 2000, Vol. 97, no. 38, pp. 4138-4140.
68. Landsteiner K. Uber Agglutionserscheinungen normalen menschlichen Blutes. Wein. Klein. Wschr., 1901, Vol. 14, pp. 1132-1134.
69. Landsteiner K. Zur Kenntniss der antifermentativen, lytischen und agglutinierenden Wirkungen des Blutserums und der Lymphe. Zentr. Bacteriol., 1900, Vol. 27, pp. 357-366.
70. Leonard A., Hittson Boal L., Pary P., Mo Y.D., Jacquot C., Luban N.L. , Darbari D.S., Webb J. Identification of red blood cell antibodies in maternal breast milk implicated in prolonged hemolytic disease of the fetus and newborn. Transfusion, 2019, Vol. 59, no. 4, pp. 1183-1189.
, Darbari D.S., Webb J. Identification of red blood cell antibodies in maternal breast milk implicated in prolonged hemolytic disease of the fetus and newborn. Transfusion, 2019, Vol. 59, no. 4, pp. 1183-1189.
71. Levine P., Burnham L., Katzin E. M., Vogel P. The role of isoimmunization in the pathogenesis of erythroblastosis fetalis. Am. J. Obst. Gynec., 1941, Vol. 42, no. 6, pp. 925-937.
72. Li P., Pang L.H., Liang H.F., Chen H.Y., Fan X.J. Maternal IgG anti-A and anti-B titer levels screening in predicting ABO hemolytic disease of the newborn: a meta-analysis. Fetal Pediatr. Pathol., 2015, Vol. 34, no. 6, pp. 341-350.
73. Lin Z.X., Dong Q.S. Detection and analysis of ABO Hemolytic disease in newborn. [Article in Chinese]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2014, Vol. 22, no. 5, pp. 1432-1434.
22, no. 5, pp. 1432-1434.
74. Lynen R., Neuhaus R., Schwarz D.W., Simson G., Riggert J., Mayr W.R., Köhler M. Flow cytometric analyses of the subclasses of red cell IgG antibodies. Vox Sang., 1995, Vol. 69, no. 2, pp. 126-130.
75. Martinez D.R., Fouda G.G., Peng X., Ackerman M.E., Permar S.R. Noncanonical placental Fc receptors: What is their role in modulating transplacental transfer of maternal IgG? PLoS Pathog., 2018, Vol. 14, no. 8, e1007161. doi: 10.1371/journal.ppat.1007161.
76. Matteocci A., De Rosa A., Buffone E., Pierelli L. Retrospective analysis of HDFN due to ABO incompatibility in a single institution over 6 years. Transfus. Med., 2019, Vol. 29, no. 3, pp. 197-201.
77. McDonnell M., Hannam S., Devane S.P. Hydrops fetalis due to ABO incompatibility. Arch. Dis. Child. Fetal Neonatal Ed., 1998, Vol. 78, no. 3, pp. F220-F221.
McDonnell M., Hannam S., Devane S.P. Hydrops fetalis due to ABO incompatibility. Arch. Dis. Child. Fetal Neonatal Ed., 1998, Vol. 78, no. 3, pp. F220-F221.
78. Metcalf R.A., Khan J., Andrews J., Mayock D., Billimoria Z., Pagano M.B. Severe ABO Hemolytic Disease of the Newborn Requiring Exchange Transfusion. J. Pediatr. Hematol. Oncol., 2019, Vol. 41, no. 8, pp. 632-634.
79. Milland J., Sandrin M.S. ABO blood group and related antigens, natural antibodies and transplantation. Tissue Antigens, 2006, Vol. 68, no. 6, pp. 459-466.
80. Moll K., Palmkvist M., Ch’ng J., Kiwuwa M.S., Wahlgren M. Evasion of Immunity to Plasmodium falciparum: Rosettes of Blood Group A Impair Recognition of PfEMP1. PLoS ONE, 2015, Vol. 10, no. 12, e0145120. doi: 10.1371/journal.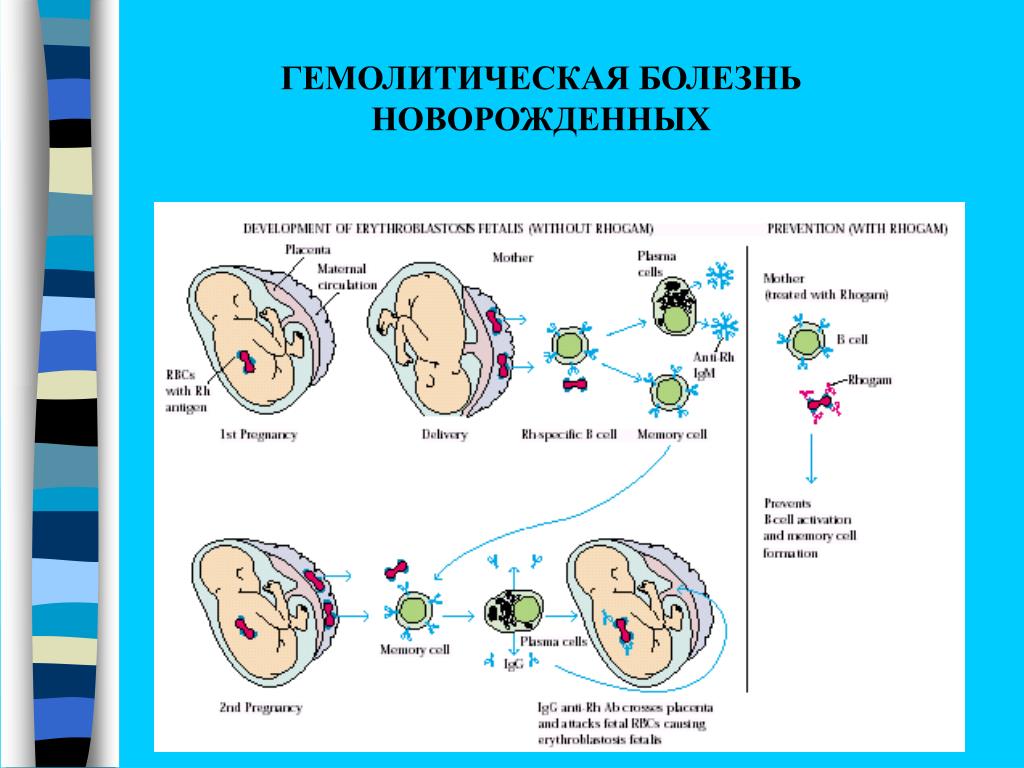 pone.0145120.
pone.0145120.
81. Morgan W.T., Watkins W.M. Genetic and biochemical aspects of human blood-group A-, B-, H-, Le-a- and Le-b-specificity. Br. Med. Bull., 1969, Vol. 25, no. 1, pp. 30-34.
82. Murray N.A., Roberts I.A.G. Haemolytic disease of the newborn. Arch. Dis. Child. Fetal Neonatal Ed., 2007, Vol. 92, no. 2, pp. F83-F88.
83. Obukhova P., Korchagina E., Henry S., Bovin N. Natural anti-A and anti-B of the ABO system: allo- and autoantibodies have different epitope specificity. Transfusion, 2012, Vol. 52, no. 4, pp. 860-869.
84. Oliver C., Blake D., Henry S. In vivo neutralization of anti-A and successful transfusion of A antigen-incompatible red blood cells in an animal model. Transfusion, 2011, Vol. 51, no. 12, pp. 2664-2675.
Transfusion, 2011, Vol. 51, no. 12, pp. 2664-2675.
85. Owa J.A., Durosinmi M.A., Alabi A.O. Determinants of severity of neonatal hyperbilirubinaemia in ABO incompatibility in Nigeria. Trop. Doct., 1991, Vol. 21, no. 1, pp. 19-22.
86. Procianoy R.S., Giacomini C.B., Farina D.M., Mollin G.A., Winckler M.I., Silveira M.B., Campos L., Marques-Pereira J.P. Early diagnosis of ABO haemolytic disease of the newborn. Eur. J. Pediatr., 1987, Vol. 146, no. 4, pp. 390-393.
87. Rieben R., Buchs J.P., Flückiger E., Nydegger U.E. Antibodies to histo-blood group substances A and B: agglutination titers, Ig class, and IgG subclasses in healthy persons of different age categories. Transfusion, 1991, Vol. 31, no. 7, pp. 607-615.
88. Rieben R., Frauenfelder A., Nydegger U.E. Spectrotype analysis of human ABO antibodies: evidence for different clonal heterogeneity of IgM, IgG, and IgA antibody populations. Vox Sang., 1996, Vol. 70, no. 2, pp. 104-111.
Rieben R., Frauenfelder A., Nydegger U.E. Spectrotype analysis of human ABO antibodies: evidence for different clonal heterogeneity of IgM, IgG, and IgA antibody populations. Vox Sang., 1996, Vol. 70, no. 2, pp. 104-111.
89. Roberts I.A.G. The changing face of haemolytic disease of the newborn. Early Hum. Dev., 2008, Vol. 84, no. 8, pp. 515-523.
90. Romans D., Tilley C., Dorrington K. Monogamous bivalency of IgG antibodies. I. Deficiency of branched ABHI-active oligosaccharide chains on red cells of infants causes the weak antiglobulin reactions in hemolytic disease of the newborn due to ABO incompatibility. J. Immunol., 1980, Vol. 124, no. 6, pp. 2807-2811.
91. Roopenian D.C., Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat. Rev. Immunol., 2007, Vol. 7, no. 9, pp. 715-725.
92. Saitou N., Yamamoto F. Evolution of primate ABO blood group genes and their homologous genes. Mol. Biol. Evol., 1997, Vol. 14, no. 4, pp. 399-411.
93. Sarici S.U., Yurdakök M., Serdar M.A., Oran O., Erdem G., Tekinalp G., Yiğit Ş. An early (sixth-hour) serum bilirubin measurement is useful in predicting the development of significant hyperbilirubinemia and severe ABO hemolytic disease in a selective high-risk population of newborns with ABO incompatibility. Pediatrics, 2002, Vol. 109, no. 4, pp. e53-e53.
94. Schachter H., Michaels M.A., Tilley C.A., Crookston M.C., Crookston J.H. Qualitative differences in the N-acetyl-D-galactosaminyltransferases produced by human A1 and A2 genes. Proc. Natl. Acad. Sci. USA, 1973, Vol. 70, no. 1., pp. 220-224.
95. Sherer D.M., Abramowicz J.S., Ryan R.M., Sheils L.A., Blumberg N., Woods J.R. Severe fetal hydrops resulting from ABO incompatibility. Obstet. Gynecol., 1991, Vol. 78, no. 5, Pt 2, pp. 897-899.
96. Siber G.R., Ambrosino D.M., Gorgone B.C. Blood-group-A-like substance in a preparation of pneumococcal vaccine. Ann. Intern. Med., 1982, Vol. 96, no. 5, pp. 580-586.
97. Simister N.E. Placental transport of immunoglobulin G. Vaccine, 2003, Vol. 21, no. 24, pp. 3365-3369.
98. Simmons D.P., Savage W.J. Hemolysis from ABO incompatibility. Hematol. Oncol. Clin. North Am., 2015, Vol. 29, no. 3, pp. 429-443.
99. Stiller R.J., Herzlinger R., Siegel S., Whetham J.C. Fetal ascites associated with ABO incompatibility: case report and review of the literature. Am. J. Obstet. Gynecol., 1996, Vol. 175, no. 5, pp. 1371-1372.
100. Storry J.R., Olsson M.L. The ABO blood group system revisited: a review and update. Immunohematology, 2009, Vol. 25, no. 2, pp. 48-59.
101. Svensson L., Rydberg L., deMattos L.C., Henry S.M. Blood group A(1) and A(2) revisited: an immunochemical analysis. Vox Sang., 2009, Vol. 96, no. 1, pp. 56-61.
102. Szulman A.E. Evolution of ABH blood group antigens during embryogenesis. Ann. Inst. Pasteur Immunol., 1987, Vol. 138, no. 6, pp. 845-847.
103. Ukita M., Takahashi A., Nunotani T., Kihana T., Watanabe S., Yamada N. IgG subclasses of anti-A and anti-B antibodies bound to the cord red cells in ABO incompatible pregnancies. Vox Sang., 1989, Vol. 56, no. 3, pp. 181-186.
104. Usha K.K., Sulochana P.V. Detection of high risk pregnancies with relation to ABO haemolytic disease of newborn. Indian J. Pediatr., 1998, Vol. 65, no. 6, pp. 863-865.
105. van de Geijn F.E., Wuhrer M., Selman M.H., Willemsen S.P., de Man Y.A., Deelder A.M., Hazes J.M., Dolhain R.J. Immunoglobulin G galactosylationand sialylation are associated with pregnancy induced improvement of rheumatoid arthritis and the postpartum flare: results from a large prospective cohort study. Arthritis Res. Ther., 2009, Vol. 11, no. 6, R193. doi: 10.1186/ar2892.
106. van Rossum H.H., de Kraa N., Thomas M., Holleboom C.A.G., Castel A., van Rossum A.P. Comparison of the direct antiglobulin test and the eluate technique for diagnosing haemolytic disease of the newborn. Pract. Lab. Med., 2015, Vol. 3, pp. 17-22.
107. Wan M.R. Serum ABO immune antibodies in 1944 pregnant women. [Article in Chinese]. Zhonghua Fu Chan Ke Za Zhi, 1991. Vol. 26, no. 1, pp. 12-14.
108. Wang Y., Tian Z., Thirumalai D., Zhang X. Neonatal Fc receptor (FcRn): a novel target for therapeutic antibodies and antibody engineering. J. Drug Target., 2014, Vol. 22, no. 4, pp. 269-278.
109. Watkins W.M., Greenwell P., Yates A.D. The genetic and enzymic regulation of the synthesis of the A and B determinants in the ABO blood group system. Immunol. Commun., 1981, Vol. 10, no. 2, pp. 83-100.
110. Watkins W.M., Greenwell P., Yates A.D., Johnson P.H. Regulation of expression of carbohydrate blood group antigens. Biochimie, 1988, Vol. 70, no. 11, pp. 1597-1611.
111. Williams P.J., Arkwright P.D., Rudd P., Scragg I.G., Edge C.J., Wormald M.R., Rademacher T.W. Selective placental transport of maternal IgG to the fetus. Placenta, 1995, Vol. 16, no. 8, pp. 749-756.
112. Wu Q., Zhang Y., Liu M., Wang B., Liu S., He C. Correlation of Fc(gamma)RIIa (CD32) Polymorphism and IgG Antibody Subclasses in Hemolytic Disease of Newborn. Neonatology, 2009, Vol. 96, no. 1, pp. 1-5.
113. Yamamoto F. Molecular genetics of the ABO histo-blood group system. Vox Sang., 1995, Vol. 69, no. 1, pp. 1-7.
114. Yamamoto F., McNeill P.D., Kominato Y., Yamamoto M., Hakomori S., Ishimoto S., Nishida S., Shima M., Fujimura Y. Molecular genetic analysis of the ABO blood group system: 2. cis-AB alleles. Vox Sang., 1993, Vol. 64, no. 2, pp. 120-123.
115. Yamamoto F., McNeill P.D., Yamamoto M., Hakomori S., Harris T. Molecular genetic analysis of the ABO blood group system: 3. Ax and B(A) alleles. Vox Sang., 1993, Vol. 64, no. 3, pp. 171-174.
116. Yamamoto F., McNeill P.D., Yamamoto M., Hakomori S., Harris T., Judd W.J., Davenport R.D. Molecular genetic analysis of the ABO blood group system: 1. Weak subgroups: A3 and B3 alleles. Vox Sang., 1993, Vol. 64, no. 2, pp. 116-119.
117. Yates A.D., Watkins W.M. The biosynthesis of blood group B determinants by the blood group A gene-specified alpha-3-N-acetyl-D-galactosaminyltransferase. Biochem. Biophys. Res. Commun., 1982, Vol. 109, no. 3, pp. 958-965.
118. Ye H.H., Huang H.H., Wang X.L., Pi Y.J. Analysis of correlation between IgG titer of pregnant women and neonatal hemolytic complications of different blood groups. [Article in Chinese]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2017, Vol. 25, no. 5, pp. 1532-1536.
119. Ziprin J.H., Payne E., Hamidi L., Roberts I., Regan F. ABO incompatibility due to immunoglobulin G anti-B antibodies presenting with severe fetal anaemia. Transfus. Med., 2005, Vol. 15, no. 1, pp. 57-60.
120. Zonneveld R., van der Meer-Kapelle L., Sylva M., Brand A., Zijlstra M., Schonewille H. Severe fetal hemolysis and cholestasis due to high-titer maternal IgG anti-A antibodies. Pediatrics, 2019, Vol. 143, no. 4, e20182859. doi: 10.1542/peds.2018-2859.
Беременность при различных резус-факторах крови
Уважаемые будущие родители!
Каждый из нас в своей жизни встречался с такими понятиями, как группа крови и резус-фактор, но далеко не каждый оценивает всю важность и необходимость определения этих показателей крови во время планирования и вынашивания желанной беременности.
Для того, чтобы разобраться в данном вопросе, мы хотим представить вам необходимую информацию и рассказать о тех клинических мероприятиях, которые проводятся в нашем центре.
Резус-фактор представляет собой белок, который находится на поверхности эритроцитов (красных кровяных телец, переносящих к тканям кислород). Если этот белок отсутствует, то резус-фактор считается отрицательным. При наличии белка «резус» в крови резус-фактор считается положительным. Все мы являемся обладателями либо отрицательного, либо положительного резус-фактора.
Будущие мама и папа, как известно, могут иметь разные резус-факторы крови. Если оба из родителей резус-положительные, то и ребенок, как правило (в 75 % случаев), наследует положительный резус-фактор. При наличии резус-отрицательной крови у обоих родителей, ситуация складывается аналогично, ребенок в данном случае будет рожден с резус-отрицательным фактором крови. В случае, если у мамы положительный резус-фактор, а у отца — резус-отрицательный, никаких осложнений при беременности не возникнет.
Большого внимания заслуживают пары, где у мамы отрицательный резус-фактор крови, а у будущего папы положительный. В данной ситуации возникает риск развития резус-конфликта — несовместимости крови матери и плода.
Механизм развития резус-конфликта, как правило, основан на работе нашей иммунной системы. Организм беременной женщины с резус-отрицательной кровью, начинает вырабатывать антитела на клетки красной крови – эритроциты будущего ребенка. Но эта ситуация происходит только в том случае, если резус-фактор плода является положительным, унаследованным от отца. Именно эти антитела, проникая через плаценту, могут разрушать эритроциты будущего ребенка, и как следствие — вызывать снижение гемоглобина, интоксикацию и нарушение работы всех жизненно-важных органов и систем. Исходы течения такой беременности, чаще неблагоприятные — это угроза невынашивания, гемолитическая болезнь плода, высокие риски внутриутробной гибели ребенка, преждевременные роды и др.
Для того, чтобы избежать неблагоприятных исходов, следует придерживаться следующих правил:
- Будущие родители должны определить свою группу крови и резус-фактор до планируемого зачатия.
- Необходимо помнить, что аборты, выкидыши, переливание крови, инвазивные процедуры, могут привести к увеличению сенсибилизации (т. е. появлению иммунных антител) организма резус-отрицательной женщины.
- Если резус-фактор будущей мамы оказался отрицательным, а у отца ребенка положительным, необходимо определение титра антиэритроцитарных антител в крови беременной до 20 недель беременности 1 раз в месяц, затем 1 раз в 2 недели. Более частое определение титра антител проводиться по назначению врача в зависимости от показаний.
- По достижению срока беременности 28 недель, при отсутствии титра антител, необходимо ввести 1 дозу антирезус-Д-иммуноглобулина. Данный препарат препятствует образованию антител к резус-фактору, а значит и препятствует разрушению эритроцитов у плода.
Вследствие введения препарата в крови могут появиться специфические антитела, поэтому после введения иммуноглобулина определение антиэритроцитарных антител не проводится. Вторая доза иммуноглобулина вводится в первые 72 часа после родов, при условии, что резус-фактор ребенка является положительным. Необходимо также введение антирезусного иммуноглобулина в течение 72 часов при проведении во время беременности инвазивных процедур: биопсии хориона, биопсии плаценты, кордоценезе, амниоцентезе, и при любом неблагоприятном исходе беременности: аборте, выкидыше, внематочной беременности, пузырном заносе.
В настоящее время в Медицинской компании «Жизнь» стало возможным определение резус-фактора плода при помощи современной, неинвазивной методики по крови матери. Достоверность такого результата достаточно высока, составляет 99%. Тест позволяет не только определить на раннем сроке беременности принадлежность резус-фактора будущего малыша, но и выделить группу риска беременных по развитию резус-конфликта. Данное исследование дает возможность спрогнозировать течение беременности у резус-отрицательных женщин, своевременно выполнить профилактические мероприятия по предупреждению развития резус-конфликта и выявить точную категорию пациенток, которым необходимо исследования титра антиэритроцитарных антител на протяжении всей беременности и введение антирезусного иммуноглобулина.
Беременность и резус
- Консультативная помощь врача-специалиста.
- ПЦР-диагностика — определение резус-фактора плода в крови резус-отрицательной матери генетическим методом.
- Фенотипирование.
- Внутривенное введение иммуноглобулина методом дозированного титрования.
- Лимфоцитоиммунотерапия (ЛИТ).
- Введение резонатива.
Отрицательный резус-фактор и беременность
Все родители мечтают о рождении здорового малыша. Многие риски, связанные со здоровьем малыша, сегодня являются управляемыми. Это значит, что некоторые, даже очень тяжелые и опасные заболевания предотвратимы, главное – не упустить время. Например, ситуация, связанная с развитием гемолитической болезни у плода и новорожденного. Многие слышали, что при наличии резус-отрицательной принадлежности крови у матери, возможно развитие иммунологического конфликта между матерью и плодом по системе резус, что является в дальнейшем причиной тяжелой гемолитической болезни, от которой малыш может страдать уже внутриутробно, но немногие могут в деталях объяснить, что же это такое, и как быть, если это напрямую касается Вас.
Сначала разберемся, что же такое резус-фактор.
Резус-фактор – это особый комплекс белков (его называют также D-антигеном), который находится на поверхности эритроцитов. Его можно определить лабораторными методами (по анализу крови). Большинство людей в популяции имеет D-антиген. О таких людях говорят, что они резус-положительны. У меньшей части населения (около 15-18%) антигена D в клетках крови нет; таких людей называют резус-отрицательными.
Резус-фактор передается по наследству, причем унаследовать его ребенок может как от матери, так и от отца. Если мать резус-отрицательна, а отец резус-положителен, существует высокая вероятность того, что ребенок унаследует положительный резус-фактор отца. Тогда окажется, что в крови у матери нет D-антигена, а у плода он есть. Иммунная система матери может воспринять проникающие в ее кровь эритроциты плода, как чужеродные, и начать бороться с ними, синтезируя антитела. Эти антитела имеют очень низкую молекулярную массу, способны проникать через плаценту в кровоток плода и разрушать эритроциты плода, вызывая гемолитическую болезнь у плода. Такое патологическое состояние, при котором происходит синтез антител называется резус-иммунизацией.
Чем же опасна резус-иммунизация?
Основная роль эритроцитов – перенос кислорода к органам и тканям организма. При массовом разрушении этих клеток органы плода начинают испытывать кислородное голодание. Но это еще не все. При распаде эритроцитов высвобождается особое вещество — билирубин, которое оказывает токсическое действие на сердце, печень, нервную систему плода. Билирубин окрашивает кожу ребенка в желтый цвет (”желтуха”). В тяжелых случаях билирубин, оказывая свое токсическое действие на клетки головного мозга, вызывает необратимые последствия вплоть до тяжелой инвалидизации и гибели малыша.
Уровень опасности возрастает с каждой последующей беременностью. Иммунная система матери обладает способностью «запоминать» чужеродные белки (резус-антиген плода) и при повторной беременности отвечает еще более быстрым и массивным выбросом антител, которые могут очень быстро проникнуть через плаценту в кровоток ребенка и привести к тяжелейшему внутриутробному страданию и даже к гибели малыша еще до рождения.
Поэтому факторами риска для резус-отрицательной женщины являются:
- Рождение Rh-положительного ребенка в прошлом (если после родов не был введен специальный препарат — анти-резус иммуноглобулин)
- Случаи внутриутробной гибели плода в прошлом
- Внематочная беременность
- Выкидыши и аборты
- Переливание Rh-несовместимой крови до беременности
Первая беременность у резус-отрицательной женщины, как правило, протекает без осложнений. Поэтому существует тенденция сохранять первую беременность, ни в коем случае не прерывая ее, если на это нет серьезных медицинских показаний.
Что же делать?
К счастью, следует отметить, что во всем мире заболеваемость новорожденных детей гемолитической болезнью плода вследствие резус-конфликта снижатется. И происходит это потому, что в практику широко внедрены методы резус-профилактики, которая проводится резус-отрицательным женщинам во время беременности и после рождения резус-положительного малыша. Да, как и в случае всех без исключения заболеваний, легче предотвратить проблему, чем лечить последствия уже развившегося тяжелого резус-конфликта.
На сегодняшний день единственным (и эффективным) профилактическим методом для предотвращения этой патологии остается введение специального препарата – анти-D-иммуноглобулина.
Профилактическая вакцинация проводится дважды – во время беременности (дородовая профилактика) и сразу после родов (послеродовая профилактика).
Остановимся на этом подробнее.
Этап дородовой профилактики направлен на защиту существующей беременности.
Если беременность развивается без осложнений («все идет по плану»), женщине проводится профилактическое введение анти-D-иммуноглобулина на 28-32 неделе беременности. Вводится специально установленная доза, которая обеспечивает защиту малыша до конца беременности. Это плановая дородовая профилактика.
В случае возникновения опасных ситуаций, которые многократно повышают риск развития резус-конфликта, проводится экстренная дородовая профилактика. К таким ситуациям относятся:
- Осложнения беременности: выкидыш; угроза выкидыша, сопровождающаяся кровянистыми выделениями
- Травмы живота во время беременности (например, после падения или в автомобильной аварии)
- Лечебные и диагностические вмешательства во время беременности: амниоцентез, хориальная биопсия, кордоцентез
В этих случаях для защиты плода может потребоваться дополнительное введение препарата.
Этап послеродовой профилактики направлен на защиту Вашей будущей беременности.
Если после родов выясняется, что ребенок резус-положителен, матери назначается еще одна инъекция анти-D-иммуноглобулина . Введение препарата необходимо произвести как можно быстрее, не позднее 72 часов после родов. Если вакцинация произведена позже, ее эффективность снижается и Вы не можете быть уверены в том, что сделали все, что было необходимо, для защиты Вашего следующего малыша.
Внимание! Такую же профилактику анти-D-иммуноглобулином женщины должны обязательно получить и в том случае, если:
— произошел выкидыш в сроке беременности 5-6 недель и более
— было произведено прерывание беременности в сроке беременности 5-6 недель и более
— была сделана операция по поводу внематочной беременности
В этом случае это тоже защита Вашей будущей беременности и Вашего будущего ребенка. Введение препарата также нужно произвести в первые 72 часа.
Защитное действие анти-D-иммуноглобулина продолжается лишь до 12 недель, поэтому при каждой последующей беременности необходимо повторное профилактическое введение.
Не стоит расстраиваться, если у Вас отрицательный резус-фактор. Выполняйте все предписания врача и у вас родится здоровый малыш!
Козлякова Ольга Владимировна,
Зав.отделением акушерской иммуногематологии ГЦТ
кандидат медицинских наук
Антигены эритроцитов – это структурные образования различной химической природы (протеины, гликопротеины или гликолипиды), представленные на поверхности мембраны эритроцита и выполняющие различные функции (транспортную, адгезивную, структурную, ферментативную). Известно более 400 антигенов эритроцитов, объединяемых в разные генетические системы, клинически значимы из них лишь немногие. Наличие или отсутствие этих белков (фенотип эритроцитарных антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни. Люди, у которых отсутствует какой либо конкретный антиген, могут развивать иммунный ответ с образованием антител при попадании в организм эритроцитов, несущих этот антиген. Такая ситуация возможна при переливаниях донорской крови или при прохождении эритроцитов плода в кровь матери во время беременности. Клиническими следствиями появления таких «аллоантител» являются гемолитические реакции при переливании крови, содержащей эритроциты, несущие соответствующий антиген и гемолитическая болезнь новорожденных вследствие прохождения через плаценту материнских IgG антител, направленных против эритроцитарных антигенов плода. В результате воздействия аллоантител, направленных против эритроцитарных антигенов, эритроциты разрушаются (происходит гемолиз эритроцитов). Риск появления аллоиммунных антител повышен при сенсибилизации предыдущими переливаниями крови, выкидышами с трансплацентарным кровотечением, предыдущими беременностями с иммунологическим конфликтом при отсутствии соответствующей терапии. Антитела к антигенам эритроцитов системы АВ0 — иммунные антитела, которые появляются вследствие изоиммунизации при парентеральном — через кровь, поступлении в организм несовместимого в групповом отношении антигена, при иногрупной беременности, при переливании крови, несовместимой по системе АВ0. При беременности такая проблема наблюдается в том случае, если у матери I группа крови, а у отца ребенка – любая другая, то есть II(A), III(B) или IV(AB) и ребенок унаследовал группу крови отца (что касается IV(AB) группы крови, то ее наследование ребенком невозможно, у него будет либо II(A), либо III(B) группа крови). В этом случае клетки крови плода имеют определенные антигены, так что когда они попадают в материнский организм, в нем вследствие иммунной реакции против них начинают выделяться групповые антитела. Задачей таких антител является разрушение чужеродных эритроцитов и высвобождение гемоглобина. Данный процесс носит название гемолиза. При несовместимости крови донора и реципиента по антигенам и антителам неблагоприятные последствия отражаются на состоянии последнего. Для обеспечения совместимости требуется, чтобы кровь донора принадлежала к той же группе системы АВ0, что и кровь больного. Переливание крови другой группы при наличии в крови донора группового антигена, против которого в кровяном русле больного имеются антитела, приводит к несовместимости и развитию трансфузионного осложнения. Когда назначается исследование? — профилактика конфликта по системе АВО у беременных; — динамический контроль за уровнем групповых антител у беременных; — гемолитическая болезнь новорожденных; — подготовка к гемотрансфузии. |
Аллоиммунные антитела (включая антитела к Rh-антигену)
Исследуемый материал Венозная кровь (сыворотка)
Метод определения Метод агглютинации + гель-фильтрации (карточки).Инкубация стандартных типированных эритроцитов с исследуемой сывороткой и фильтрация путём центрифугирования смеси через гель, импрегированный полиспецифическим антиглобулиновым реагентом. Агглютинированные эритроциты выявляются на поверхности геля или в его толще.
В методе используются стандартные эритроциты ID-DIA Cell I-II-III типированные по антигенам эритроцитов:Два резус положительных эритроцита (ССCW Dee R1WR1 ) , ccDEE R2WR2 ) и один резус отрицательный эритроцит ссddee rr.
ID карты Liss (Coombs)-основная функция реагента с полиспецифическим антиглобулиновым –детектировать IgG. Активность анти C3d важна при прямом антиглобулиновом тесте при исследовании аутоиммунной гемолитической анемии (AIHA).
Антитела к клинически наиболее важным эритроцитарным антигенам, в первую очередь резус-фактору, свидетельствующие о сенсибилизации организма к этим антигенам. Резус-антитела относятся к так называемым аллоиммунным антителам.
Аллоиммунные антиэритроцитарные антитела (к резус-фактору или другим эритроцитарным антигенам) появляются в крови при особых условиях — после переливания иммунологически несовместимой донорской крови или при беременности, когда эритроциты плода, несущие иммунологически чужеродные для матери отцовские антигены, проникают через плаценту в кровь женщины. У неиммунных резус-отрицательных людей антител к резус-фактору нет.
В системе резус различают 5 основных антигенов, основным (наиболее иммуногенным) является антиген D (Rh), который обычно подразумевают под названием резус-фактор. Помимо антигенов системы резус есть ещё ряд клинически важных эритроцитарных антигенов, к которым может возникать сенсибилизация, вызывающая осложнения при переливании крови.
Метод скринингового исследования крови на присутствие аллоиммунных антиэритроцитарных антител, использующийся в Независимой лаборатории ИНВИТРО, позволяет, помимо антител к резус-фактору Rh2(D), выявить в исследуемой сыворотке аллоиммунные антитела и к другим эритроцитарным антигенам. Ген, кодирующий резус-фактор D (Rh), является доминантным, аллельный ему ген d — рецессивным (резус-положительные люди могут иметь генотип DD или Dd, резус-отрицательные — только генотип dd).
Во время беременности резус-отрицательной женщины резус-положительным плодом возможно развитие иммунологического конфликта матери и плода по резус-фактору. Резус-конфликт может привести к выкидышу или развитию гемолитической болезни плода и новорожденных. Поэтому определение группы крови, резус-фактора, а также наличия аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка. Возникновение резус-конфликта и развитие гемолитической болезни новорожденных возможно в том случае, если беременная резус-отрицательна, а плод — резус-положителен. В случае, если у матери резус-антиген положительный, а у плода отрицательный, конфликт по резус-фактору не развивается. Частота развития резус-несовместимости составляет 1 случай на 200 — 250 родов.
Гемолитическая болезнь плода и новорождённых — гемолитическая желтуха новорожденных, обусловленная иммунологическим конфликтом между матерью и плодом из-за несовместимости по эритроцитарным антигенам. Болезнь обусловлена несовместимостью плода и матери по D-резус- или АВО- (групповым) антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, М-, Kell-, Duffy-, Kidd-антигенам. Любой из указанных антигенов (чаще D-резус-антиген), проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Проникновению антигенов в материнский кровоток способствуют инфекционные факторы, повышающие проницаемость плаценты, мелкие травмы, кровоизлияния и другие повреждения плаценты. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Предрасполагают к развитию гемолитической болезни новорожденных нарушение проницаемости плаценты, повторные беременности и переливания крови женщине без учёта резус-фактора и др. При раннем проявлении заболевания иммунологический конфликт может быть причиной преждевременных родов или выкидышей. Во время первой беременности резус-положительным плодом у беременной с Rh «-» риск развития резус-конфликта составляет 10 — 15%. Происходит первая встреча организма матери с чужеродным антигеном, накопление антител происходит постепенно, начиная, приблизительно с 7 — 8 недели беременности. Риск несовместимости возрастает с каждой последующей беременностью резус-положительным плодом, независимо от того, чем она закончилась (искусственным абортом, выкидышем или родами, операцией при внематочной беременности), при кровотечениях во время первой беременности, при ручном отделении плаценты, а также если роды проводятся путём кесарева сечения или сопровождаются значительной кровопотерей при переливании резус-положительной крови (в том случае, если они проводились даже в детском возрасте).
Если последующая беременность развивается с резус-отрицательным плодом, несовместимость не развивается. Всех беременных женщин с Rh «-» ставят на специальный учёт в женской консультации и проводят динамический контроль над уровнем резус-антител. В первый раз анализ на антитела надо сдать с 8-й до 20-й недели беременности, затем периодически проверять титр антител: 1 раз в месяц до 30-й недели беременности, дважды в месяц до 36-й недели и 1 раз в неделю до 36-й недели. Прерывание беременности на сроке менее 6 — 7 недель может не привести к формированию у матери Rh-антител. В этом случае при последующей беременности, если у плода будет положительный резус-фактор, вероятность развития иммунологической несовместимости вновь будет равна 10 — 15 %. Проведение тестирования на аллоиммунные антиэритроцитарные антитела важно также при общей предоперационной подготовке, особенно для людей, которым ранее уже проводилось переливание крови.
Внутриутробный метод лечения плода
Гемолитическая болезнь (ГБ) плода и новорожденного (фетальный эритробластоз) – патология, связанная с иммуноконфликтной реакцией между организмами матери и плода, являющаяся одной из причин гибели плода и новорожденного.
По статистическим данным резус-несовместимость встречается в 9,5-13% всех браков, частота гемолитической болезни составляет около 1,5%. Из всех резус-сенсибилизированных женщин у 40-50% плод будет иметь легкую ГБ, или не иметь ее вообще, 25-30% будут иметь ГБ, требующую лечения в раннем неонатальном периоде и только у 20-25% развивается тяжелая анемия, требующая инвазивных методов терапии и досрочного родоразрешения. Для супружеской пары, имеющей в анамнезе потерю плода с тяжелой формой гемолитической болезни, современные методы лечения ГБ, в том числе внутриутробное переливание донорской крови плоду, по сути, являются единственной возможность доносить и родить ребенка.
К сенсибилизации организма к резус-фактору могут вести не только роды. Причиной ее нередко являются самопроизвольное либо искусственное прерывание беременности, переливания крови без учета резус-принадлежности, кровотечения или инвазивные манипуляции во время беременности (в т.ч. инвазивная пренатальная диагностика).
При лечении ГБ любого генеза необходимо решать две основные задачи: недопущение токсических концентраций непрямого билирубина в крови, чтобы избежать поражения ядер головного мозга плода, т.е. ядерной желтухи, приводящей к тяжелой инвалидности, и своевременную коррекцию анемии. На сегодня одним из самых эффективных методов лечения непрямой гипербилирубинэмии, обусловленной ГБ у плода, является внутриутробное переливание (ВУП) крови.
ВУП донорской крови плоду проводится в связи с наличием тяжелой гемолитической болезни (отечной или тяжелой желтушно-анемической формы) у плода. Оценка тяжести гемолитической болезни у плода осуществляется по данным титра антирезусных антител в крови у матери, данным УЗИ (признаками развития тяжелой гемолитической болезни у плода являются: увеличение толщины и объема плаценты, гепатоспленомегалия, кардиомегалия, подкожный отек мягких тканей плода, асцит, двойной контур головки, а также изменения доплерометрических показателей скорости кровотока в средней мозговой артерии, пуповине, маточных артериях).
У таких беременных для диагностики состояния плода в ряде случаев необходимо использование кордоцентеза, который позволяет определить в крови плода группу крови, резус-фактор, гематокрит, гемоглобин, а также исследовать газовый состав и кислотно-основное состояние крови. Это позволяет судить не только о степени тяжести заболевания, но и при необходимости проводить коррекцию анемии у плода при помощи ВУП.
ВУП проводится после 30 недель беременности на базе стационара.
ВУП заключается в пункции полости матки и плодного пузыря иглой через переднюю брюшную стенку под контролем УЗИ и последующей пункции вены пуповины (кордоцентез). С целью обездвиживания плода в вену пуповины вводится миорелаксант (ардуан) и производится переливание рассчитанного, с учетом тяжести анемии и срока беременности, количества донорских эритроцитов и 10% раствора альбумина. Операция проводится под постоянным мониторным контролем за сердечной деятельностью плода (КТГ), который продолжается и в течение 30 минут после процедуры.
Трансфузии крови проводятся с интервалом в 2-3 недели. Между переливаниями крови необходим ежедневный контроль состояния плода (КТГ, доплеровское исследование средней мозговой артерии).
Для снижения частоты младенческой смертности и заболеваемости от гемолитической болезни плода на базе КМГК ГАУЗ ККЦСВМП внедрен метод внутриутробного переливания крови, который позволит оказывать помощь при тяжелых формах гемолитической болезни у плода и является важным этапом развития пренатальной диагностики в Приморском крае.
При появлении у беременной признаков резус-конфликта (изменений на УЗИ, роста титра антител к резус-фактору) для решения вопроса о целесообразности проведения ВУП у плода необходимо направление пациента на прием к акушеру-гинекологу по пренатальной диагностике Краевой медико-генетической консультации ГАУЗ «Краевой клинический центр специализированных методов медицинской помощи » Смирновой Анжелике Юрьевне.
Запись на прием осуществляется по адресу:
г. Владивосток, ул. Уборевича 30/37, телефон регистратуры: (423)242-98-83, 242-84-57.
По вопросам проведения процедуры Вы также можете обращаться к заведующему КМГК ГАУЗ ККЦСВМП Воронину Сергею Владимировичу, тел.: 8 (423)242-84-92.
Гемолитическая болезнь плода и новорожденного и перинатальная иммунная тромбоцитопения
Предпосылки
В этой главе рассматривается тестирование и лечение, которые актуальны для матерей и их плодов / младенцев во время беременности и в послеродовой период для снижения риска гемолитической болезни плода и новорожденного (HDFN) и иммунных тромбоцитопений.
Гемолитическая болезнь плода и новорожденного
Что такое гемолитическая болезнь плода и новорожденного?
Аллоиммунная гемолитическая болезнь плода и новорожденного (HDFN) может возникнуть, если у беременной женщины есть антитела против антигена в эритроцитах плода, унаследованного от отца.Многие антитела к антигенам эритроцитов могут вызывать HDFN, в том числе антитела из систем ABO, Rh и других групп крови. Женщины могут вырабатывать антитела либо в результате предыдущей беременности, либо в результате переливания крови. Материнские антитела могут проникать через плаценту и связываться с антигеном эритроцитов плода, вызывая их разрушение или подавляя эритропоэз в костном мозге плода. Представление HDFN варьируется от бессимптомного до желтухи, анемии и, в худшем случае, до смерти (может быть опасно для жизни плода или новорожденного).Риск HDFN может быть определен путем тестирования матери с группой и скрининга во время беременности. RhD HDFN можно предотвратить с помощью пассивного введения анти-D для подавления иммунного ответа матери против антигена RhD плода.
Регулярное серологическое тестирование на беременность
Все беременные женщины должны пройти серологическое типирование на антигены ABO и RhD и скрининговые тесты для выявления неожиданных антител к эритроцитам (таблица 1). Эти тесты следует проводить при первом дородовом посещении.Первоначальный скрининг антител позволит определить, подвергались ли женщины с отрицательным статусом по антигену RhD (RhD-отрицательные) ранее воздействию RhD (сенсибилизированные) и продуцировали ли они антитела против D. Кроме того, на экране выявляются женщины с другими антителами к эритроцитам, способными вызывать HDFN. RhD-отрицательные женщины должны быть снова протестированы для подтверждения группы крови и на наличие неожиданных антител к эритроцитам на 26–28 неделе беременности. Для тех, кто является RhD-отрицательным, это должно происходить до назначения профилактики резус-иммуноглобулином (Rhlg), но не следует отказываться от назначения RhIg до получения этих результатов (см. Рисунок 1 и подробности лечения в последующих разделах этой главы).Всем женщинам, у которых в анамнезе есть клинически значимые антитела к эритроцитам или события, которые могут вызывать образование антител, такие как переливание крови, осложнения беременности, амниоцентез или забор проб ворсинок хориона, могут потребоваться дополнительные тесты на антитела во втором-третьем триместре независимо от их RhD. статус. Некоторые руководящие принципы 1, 2 рекомендуют повторный скрининг ABO Rh и антител у всех женщин на сроке 26–28 недель для подтверждения типа ABO и Rh и исключения развития антител после первоначального тестирования (см. Рисунок 1 и Рисунок 2).
| Тип беременности | Срок беременности | Тестирование |
|---|---|---|
| Все беременности | При первичном дородовом посещении, в идеале в течение первого триместра |
|
| Первая беременность, независимо от типа резус-фактора при первичном обследовании | На 26–28 неделе беременности |
|
| RhD-отрицательные женщины и RhD-положительные женщины § | На 26–28 неделе беременности, до введения RhIg |
|
| Женщины с риском развития антител к эритроцитам * | 28 недель или позже |
|
# Идентификация антител должна выполняться при обнаружении антител; образец следует собирать перед инъекцией RhIg. § Канадские руководящие принципы рекомендуют повторную оценку статуса антител у всех беременных женщин на сроке 26–28 недель независимо от группы крови резус. * Наличие в анамнезе клинически значимых антител к эритроцитам или событий, которые могут вызвать образование антител, таких как переливание крови, осложнения беременности, амниоцентез или ворсинчатый хорион, являются определенными показаниями для повторного тестирования; в некоторых руководствах рекомендуется повторное тестирование для всех женщин, независимо от событий, повышающих риск аллоиммунизации. Адаптировано из Руководства по пренатальной и перинатальной иммуногематологии AABB. 3 | ||
Рис. 1. Антенатальное серологическое тестирование, RhD-отрицательная мать.
* Назначьте RhIg, если неизвестно, что мать была иммунизирована антигеном D, и если известно, что плод не является RhD-отрицательным. Повторяйте RhIg с 12-недельными интервалами до рождения; дозировка в листе-вкладыше. См. Таблицу 2 с указаниями и рекомендуемой дозировкой.
Рис. 2. Антенатальное серологическое тестирование, RhD-положительная мать.
* Политика, рекомендованная Обществом акушеров и гинекологов Канады (SOGC) 2 и Британским комитетом по стандартам в гематологии. 1
Обозначение вариантов RhD
Некоторые женщины могут давать слабые или противоречивые результаты при типировании RhD, или текущие результаты могут отличаться от исторических результатов. Наиболее частой причиной вариантного фенотипа RhD является замена одного нуклеотида в одном аллеле RHD , хотя могут быть задействованы и другие генетические механизмы.Распространенным типом варианта RhD является фенотип слабого D. Женщины с этим фенотипом имеют слабую экспрессию антигена RhD и могут иметь различное типирование RhD в зависимости от антисыворотки или метода тестирования, используемого в лаборатории. Другой тип варианта RhD — это частичный фенотип D, при котором антиген RhD изменен, что потенциально позволяет человеку образовывать аллоантитела к эпитопам на RhD-положительных эритроцитах, отличных от его собственных. Большинство женщин со слабым D и частичным D имеют низкий риск продуцирования анти-D.Большинство опубликованных руководств / мнений не рекомендуют проводить слабые серологические тесты D (фаза IAT) у женщин во время беременности. Точно так же большинство стандартов практики переливания крови (AABB, 4 CSA 5 и CSTM 6 ) не требуют слабого серологического тестирования D для женщин во время беременности. В соответствии с этими рекомендациями лаборатории перинатального тестирования Канадской службы крови не проводят серологические тесты на слабый D на RhD-отрицательных беременных женщинах. 2
В 2015 году совместная рабочая группа AABB и Американского колледжа патологов представила рекомендации по генотипированию беременных женщин. 7 Алгоритм был предложен по результатам ручного или автоматизированного тестирования. Лица с серологическими результатами, предполагающими слабое или непоследовательное типирование RhD, должны были быть направлены на генотипирование. Лица, у которых обнаружена слабость D типа 1, 2 или 3, считались не подверженными риску аллоиммунизации и, следовательно, не кандидатами на профилактику RhIg. Поскольку слабые типы D 1, 2 и 3 составляют большинство слабых вариантов D в Северной Америке, можно избежать ненужного введения продукта крови (RhIg) большой подгруппе беременных женщин.Остальные люди, которые были типизированы как RhD-отрицательные или имели другой аллель RHD , должны были считаться RhD-отрицательными и подвергаться риску аллоиммунизации в целях профилактики RhIg. Канадское исследование пренатальных пациентов показало, что 0,4% женщин, идентифицированных серологически как RhD-отрицательные, имели серологическую вариабельность типирования RhD. 8 Из них 61% были классифицированы как слабые D типа 1, 2 или 3 после генотипирования RHD и могут быть безопасно признаны RhD-положительными и, следовательно, не подходящими для получения профилактики RhIg. 8 Если невозможно провести генотипирование RHD , рекомендуется, чтобы женщины с переменной серологической реактивностью считались RhD-отрицательными и подходили для профилактики RhIg, чтобы предотвратить развитие анти-D и снизить риск HDFN. Национальный консультативный комитет по продуктам крови (NAC) рекомендует, чтобы «пренатальных пациентов с противоречивыми, слабыми или неубедительными серологическими результатами RhD-теста необходимо было дополнительно исследовать с помощью генотипирования RHD , чтобы определить кандидатуру RhIg и оптимальный тип резус-фактора для переливания.» 9
Во многих странах, кроме Канады, неинвазивное пренатальное тестирование (НИПТ) проводится на образцах крови RhD-отрицательных беременных женщин. НИПТ позволяет прогнозировать фенотип RhD плода на основе генотипирования ДНК плода в плазме крови матери. Профилактическая терапия RhIg может быть назначена только RhD-отрицательным женщинам, вынашивающим RhD-положительный плод. Было показано, что такой целевой подход предотвращает введение RhIg примерно у одной трети RhD-отрицательных женщин из-за того, что они вынашивают RhD-отрицательный плод. 10
Профилактика резус-иммуноглобулином для лечения несенсибилизированных резус-отрицательных женщин
RhD-отрицательных женщин без обнаруживаемых уровней анти-D (несенсибилизированные) получают RhIg перинатально для предотвращения аллоиммунизации и снижения риска HDFN. Обратите внимание, что у пациентов с предыдущим лечением RhIg пассивный анти-D сохраняется в течение многих недель, и это следует учитывать, прежде чем отказываться от рутинной профилактики RhIg. Рекомендуемые дозы RhIg показаны в таблице 2.RhIg — это белковый продукт плазмы, который в основном состоит из анти-D IgG. RhIg получают из пулов человеческой плазмы, которые содержат высокие титры анти-D. Для получения дополнительной информации о показаниях, противопоказаниях, применении и хранении RhIg см. Главу 4 данного руководства Guide .
Механизм действия RhIg четко не выяснен; однако его преимущества хорошо документированы. 11, 12 Когда RhIg вводится в течение 72 часов после доношенных родов RhD-положительного ребенка от RhD-отрицательной матери, частота аллоиммунизации снижается с 12-13% до 1-2%.Когда RhIg вводится на 28 неделе беременности в дополнение к послеродовой дозе, частота аллоиммунизации дополнительно снижается до 0,1%. Одна доза RhIg 1500 МЕ (300 мкг) защищает от иммунизации 15 мл RhD-положительных эритроцитов (или 30 мл цельной крови).
Если отцовство установлено, может быть предложена группа крови отца ребенка на RhD. Если отцовство установлено и отец ребенка окажется RhD-отрицательным, врач, проконсультировавшись с пациентом, может отказаться от введения RhIg, чтобы избежать ненужного воздействия продуктов крови.В некоторых случаях генотипирование плода RHD и возможно на основе образцов крови матери, амниоцитов или ворсинок хориона. Если обнаружено, что у плода RhD-отрицательный, введение RhIg может быть приостановлено.
Показание | Доза RhIg @ |
|---|---|
Беременность (на 28 неделе беременности) # $ | 300 мкг (1500 МЕ) внутривенно или внутримышечно |
Послеродовой период, если новорожденный RhD-положительный, в том числе слабый D-положительный * (в течение 72 часов после рождения) | 120 мкг (600 МЕ) внутривенно или внутримышечно или 300 мкг (1500 МЕ) внутривенно или внутримышечно |
Угроза прерывания беременности § | 300 мкг (1500 МЕ) внутривенно или внутримышечно |
Аборт (включая потерю беременности на очень ранних сроках), амниоцентез или забор проб ворсин хориона после 12 недель беременности # | 300 мкг (1500 МЕ) внутривенно или внутримышечно |
Аборт, амниоцентез или любые другие манипуляции после гестации <12 недель # | 120 мкг (600 МЕ) внутривенно или внутримышечно |
Другие показания † * | 300 мкг (1500 МЕ) внутривенно или внутримышечно |
+ Если отцовство точно установлено, RhD-группа отца ребенка может быть предложена RhD-отрицательной женщине.Если отец RhD-отрицательный, профилактика RhIg может быть приостановлена. ∞ Если известно, что плод / новорожденный является RhD-отрицательным, за исключением слабого D-положительного результата, профилактика RhIg не требуется. # Следует рассмотреть возможность повторения RhIg до родов, если период без профилактики RhIg превышает 12 недель и / или если предоставленная доза RhIg составляет <1500 МЕ. $ В качестве альтернативы можно назначить RhIg 120 мкг (600 МЕ) как на 28 неделе, так и на 34 неделе беременности. * Для количественного определения кровотечения у плода необходимо провести исследование. Дополнительный Rhlg потребуется, если установлено, что внутриутробное трансплацентарное кровоизлияние превышает 12 мл крови плода (6 мл эритроцитов плода) для дозы 600 МЕ или 30 мл крови плода (15 мл эритроцитов плода) для доза 1500 МЕ. § RhIg может не потребоваться при угрозе прерывания беременности, если плод жизнеспособен и кровотечение прекращается до 12 недель беременности.RhIg рекомендуется после внематочной или молярной беременности или при любом терапевтическом прерывании беременности, независимо от гестационного возраста. † Другие показания включают любой инцидент, который может привести к попаданию эмбриональных клеток в кровоток матери в любое время во время беременности. Эти состояния включают, помимо прочего, травмы живота, внематочную беременность и мертворождение, а также интраоперационное спасение клеток, используемое во время кесарева сечения, когда тип RhD у плода неизвестен. Дозировка@RhIg может варьироваться в зависимости от местной политики и инструкции по применению. Обратите внимание, что не все составы подходят для внутривенного введения. WinRho ™, распространяемый канадской службой крови в Канаде, подходит для внутривенного или внутримышечного введения. Таблица адаптирована из рекомендаций Общества акушеров и гинекологов Канады 2018 г., 2 вкладыш в упаковку продукта 13 и Qureshi et al. 14 | |
RhIg 300 мкг (1500 МЕ) следует регулярно давать всем RhD-отрицательным несенсибилизированным женщинам на 28 неделе беременности, а также женщинам, у которых есть вариант RhD, отличный от слабого D типа 1, 2 или 3, идентифицированные при генотипировании, и те женщины с несовпадающими результатами серологических тестов, у которых генотипирование невозможно.RhIg следует также назначать всем RhD-отрицательным женщинам без антител после любого инцидента, который может привести к попаданию эмбриональных клеток в кровоток матери. Эти состояния включают, помимо прочего, аборт, угрозу прерывания беременности, амниоцентез, биопсию ворсин хориона, версии, травму живота, внематочную беременность, молярную беременность и гибель плода в утробе матери . Использование интраоперационного спасения клеток во время кесарева сечения у RhD-отрицательной женщины без антител также должно привести к профилактике RhIg.Если дородовая доза RhIg вводится до 28 недель беременности, следует рассмотреть возможность повторения RhIg до родов, если период без применения профилактики RhIg превышает 12 недель.
В послеродовой период, в течение 72 часов после рождения ребенка с RhD-положительным результатом, все матери с отрицательным резус-фактором должны получить RhIg 120 мкг (600 МЕ) или 300 мкг (1500 МЕ). Женщины с вариантом RhD, отличным от слабого D типа 1, 2 или 3, и женщины с несовпадающими результатами серологических тестов, для которых результаты генотипирования недоступны, также должны получать профилактику RhIg.Дозировка может отличаться в зависимости от клинических обстоятельств и может быть определена путем ознакомления с вкладышем в упаковку для конкретного продукта, а также с местными правилами. Использование более низкой дозы увеличивает вероятность потребности в дополнительных дозах RhIg после оценки кровотечения у плода и матери. Обычный тест на кровоизлияние у плода и матери требуется всем RhD-отрицательным женщинам, родившим RhD-положительный или RhD-неизвестный плод (стандарты CSA 5 и CSTM 6 ). Если полуколичественный (розеточный) скрининговый тест дает положительный результат, выполняется тест Клейхауэра-Бетке или анализ проточной цитометрии для количественного определения объема кровотечения и оценки необходимой дозы RhIg (CSA 5 и CSTM 6). стандартов).Если количество кровотечений превышает способность первоначального лечения RhIg обеспечить защиту, следует ввести дополнительный RhIg. Это особенно важно, если вводится более низкая доза RhIg 120 мкг (600 МЕ), и во всех случаях должна сопровождаться рекомендацией относительно необходимости дополнительных доз. Если RhIg не вводится в течение 72 часов после родов, его все равно следует вводить, как только будет обнаружена необходимость, в течение 28 дней после родов. 2
Ведение женщин с антителами к эритроцитам
Идентификация антител
У всех женщин (RhD-отрицательных или RhD-положительных) с положительным скринингом на антитела к эритроцитам должна быть определена специфичность антител во время положительного скринингового теста (см. Рисунок 3).Если антитело является потенциальной причиной HDFN (таблица 3), отца следует проверить, чтобы определить, экспрессирует ли он соответствующий антиген (ы). Если отцовство гарантировано и отец отрицательный по антигену, плод не считается подверженным риску. Если отец экспрессирует соответствующий антиген (ы), тогда существует риск того, что плод также экспрессирует эти антигены (ы) и, следовательно, риск HDFN. При возникновении риска ГББН на ранних сроках беременности следует проконсультироваться с опытным акушером относительно плана лечения, а мать должна быть направлена на обследование и лечение к соответствующему консультанту.Если возможно переливание крови матери или плоду / новорожденному, следует как можно раньше проконсультироваться с врачом по переливанию крови. Следует рассмотреть возможность рождения ребенка там, где есть отделения интенсивной терапии новорожденных.
Рисунок 3. Управление клинически значимыми антителами к эритроцитам во время беременности.
| Показание | Система | Антигены |
|---|---|---|
| Связано с тяжелым HDFN | Резус | D, C, c, E |
| Келл | К, к | |
| Даффи | Fy a | |
| Кидд | Jk a , Jk b | |
| MNS | M § , S | |
| Связано с легкой HDFN | ABO | А, В |
| Ii | i | |
| Даффи | Fy b | |
| лютеранская | Lu a , Lu b | |
| Не связано с HDFN | Льюис | Le a , Le b |
| Ii | I | |
| п. | п. 1 | |
* В этот список включены только самые распространенные антитела к эритроцитам; он не является исчерпывающим.Для менее распространенных антител обратитесь к Issit и Anstee. 15 § Анти-M клинически значимо только при наличии антитела IgG. Анти-М может вызвать позднюю неонатальную анемию. Для получения дополнительной информации об анти-M, пожалуйста, прочтите статью Anti-M в разделе «Лучшие практики» на веб-сайте профессионального образования Канадской службы крови. | ||
Генотипирование группы крови плода
При беременности, осложненной антителом или антителами, которые, как известно, вызывают HDFN (Таблица 3), и когда отец является гетерозиготным по определенному антигену (-ам) эритроцитов, или статус антигена отца является неизвестно, генотипирование плода может помочь в определении вероятности возникновения ГБПН.С помощью современных методов генотипирование ДНК плода может быть выполнено на образце материнской крови с высокой степенью точности. Генотипирование Rh-антигенов D, E, C и c, а также антигенов Kell доступно в специализированных справочных лабораториях. Канадские службы крови и ряд программ пренатального тестирования на базе больниц в Канаде в настоящее время имеют программы для облегчения генотипирования плодов из образцов материнской крови для женщин с критическими титрами (титр 16) антител к антигенам Rh и Kell.Фенотип плода можно предсказать по результатам генотипирования, и если результаты предсказывают, что плод отрицателен по рассматриваемому антигену, по усмотрению лечащего врача может быть начато плановое наблюдение за беременностью вместо высокого -рисковая акушерская помощь, необходимая в том случае, если предполагается, что плод будет положительным по антигену. В редких случаях для некоторых антигенов, помимо Rh и Kell, тестирование может проводиться на ДНК, выделенной из амниоцитов после процедуры амниоцентеза, или на ДНК ворсинок хориона после отбора образцов ворсинок хориона.Опять же, эти тесты должны быть переданы на аутсорсинг в специализированные лаборатории, и тестирование проводится только в том случае, если в анамнезе есть HDFN и когда знание типа антигена плода может существенно изменить уход за беременными. Амниоцентез и отбор проб ворсинок хориона более инвазивны, чем генотипирование образца материнской крови, и несут небольшой, но значительный риск для плода.
Роль практики переливания в профилактике HDFN
Переливание женщин-пациенток детородного возраста сопряжено с риском аллоиммунизации эритроцитов, которая может привести к ГБН.Самый важный способ избежать этого риска и других осложнений — проводить переливание крови только в случае крайней необходимости. Некоторые международные руководящие принципы 16 рекомендуют рутинное использование Kell-отрицательных эритроцитов для переливания женщинам детородного возраста. Эта стратегия предотвращения аллоиммунизации против Kell была принята в ряде больниц и медицинских регионов Канады и показала свою эффективность в снижении показателей аллоиммунизации против Kell в юрисдикциях, где она применялась в течение длительного периода времени. . 16, 17
Перинатальная тромбоцитопения
Неонатальная тромбоцитопения может быть вызвана снижением выработки тромбоцитов, повышенным потреблением тромбоцитов или гемодилюцией. Также необходимо учитывать преаналитические ложные причины тромбоцитопении, такие как образование сгустков крови после сложных процедур сбора крови у новорожденных. Повышенное потребление тромбоцитов является наиболее распространенной этиологией и может быть результатом различных причин, включая сепсис, эффекты, связанные с приемом лекарств, некротический энтероколит, диссеминированное внутрисосудистое свертывание, плацентарную недостаточность, врожденную инфекцию, асфиксию или может быть иммуно-опосредованным.
В целом иммуноопосредованную неонатальную тромбоцитопению можно разделить на две категории: (1) фетальная и неонатальная аллоиммунная тромбоцитопения (FNAIT) и (2) тромбоцитопения, вторичная по отношению к материнской иммунной тромбоцитопенической пурпуре (lTP). Материнская ИТП — очень редкая причина тромбоцитопении у новорожденных.
Аллоиммунная тромбоцитопения плода и новорожденного (FNAIT)
FNAIT может возникнуть, когда тромбоциты плода экспрессируют отцовский антиген, который не обнаружен в тромбоцитах матери.Тромбоциты плода могут попадать в кровоток матери во время беременности или родов. Если мать становится аллоиммунизированной, материнские аллоантитела IgG могут проникать через плаценту и вызывать тромбоцитопению у плода. Тромбоцитопения проходит самостоятельно и обычно проходит в течение двух-трех недель после родов. Тяжесть FNAIT варьирует от легкой тромбоцитопении до тяжелой тромбоцитопении с кровоизлиянием, иногда встречающейся in utero .
Серологические исследования: Оба родителя ребенка с подозрением на FNAIT должны пройти тестирование, включая генотипирование генов человеческого антигена тромбоцитов ( HPA ), которые были связаны с FNAIT.Кроме того, для диагностики этого состояния рекомендуется материнский скрининг на наличие специфических антител к тромбоцитам, а также генотипирование образца крови младенца на конкретные гены HPA , если это возможно. Антитела к наиболее распространенному HPA, HPA-1a, вызывают примерно 90% случаев FNAIT в европеоидной популяции. В этих случаях мать, как правило, гомозиготна по HPA-1b и вырабатывает антитела против HPA-1a, которые проникают через плаценту и связываются с антигенами HPA1a на тромбоцитах плода. Антитела против HPA-5b и против HPA-3a также могут вызывать это состояние среди других антител.
Лечение пострадавшего младенца: Младенец с FNAIT, которому требуется переливание тромбоцитов, должен получать HPA-отрицательные тромбоциты, если таковые имеются. Канадская служба крови ведет реестр доноров аферезных тромбоцитов с определенным генотипом HPA, и можно запросить аллогенные тромбоциты с определенным типом HPA. Любые аллогенные донорские пулы тромбоцитов можно использовать в качестве начальной терапии до тех пор, пока не станут доступны HPA-отрицательные тромбоциты, и часто они эффективны в повышении количества тромбоцитов даже в присутствии антител против HPA. 18 В редких случаях материнские тромбоциты могут использоваться в качестве источника HPA-отрицательных тромбоцитов. В этом случае плазма должна быть удалена, а тромбоциты ресуспендированы в донорской плазме или физиологическом растворе. Поскольку это направленное донорство, облучение тромбоцитов перед переливанием также имеет решающее значение. Хотя материнские тромбоциты будут отрицательными по соответствующему антигену, они редко используются из-за логистических барьеров на пути сбора и обработки тромбоцитов от послеродовой матери.Внутривенная инфузия иммуноглобулина (IVIg) (1 г / кг / день в течение до двух дней) может быть эффективной и может быть рассмотрена, если переливание тромбоцитов не приводит к увеличению количества тромбоцитов или если тромбоциты недоступны. См. Главу 4 данного руководства Guide для получения дополнительной информации об использовании иммуноглобулиновых продуктов.
Лечение последующих беременностей: Во время беременности за женщинами, у которых ранее были роды с помощью FNAIT, должен находиться врач, имеющий опыт лечения таких пациенток.Руководства по научно-обоснованной практике для FNAIT разрабатываются Международным сотрудничеством по трансфузионной медицине. 19 Систематический обзор, проведенный той же группой, предполагает, что антенатальное лечение первой линии при FNAIT представляет собой еженедельное введение ИГВВ (1 г / кг) с добавлением кортикостероидов или без них. 20, 21 Забор тромбоцитов для афереза от донора, о котором известно, что у него отсутствует HPA, может быть запрошено в Канадской службе крови до родов.
Иммунная тромбоцитопеническая пурпура у матери (ИТП)
Младенцы, рожденные от матерей с ИТП, также могут иметь тромбоцитопению из-за пассивного переноса материнских аутоантител через плаценту. У большинства этих младенцев есть только легкая тромбоцитопения, и риск кровотечения очень низок, а внутричерепное кровоизлияние возникает чрезвычайно редко.
Младенцы с тромбоцитопенией, вторичной по отношению к материнской ЛТП, редко нуждаются в лечении. Если требуется переливание тромбоцитов, рекомендуются аллогенные тромбоциты, соответствующие группе крови.Другие методы лечения, которые использовались в тяжелых случаях, включают внутривенные иммуноглобулины и кортикостероиды. См. Главу 4 данного руководства Guide для получения дополнительной информации о продуктах иммуноглобулинов.
Кредиты на повышение квалификации
Стипендиаты и медицинские работники, участвующие в Программе Поддержания Сертификации (MOC) Канадского Королевского Колледжа, могут заявить о прочтении Клинического Руководства по Переливанию как о деятельности по непрерывному профессиональному развитию (НПР) в соответствии с Разделом 2: Самостоятельное обучение.Чтение одной главы эквивалентно двум кредитам .
Благодарности
Авторы, Джудит Хэннон и Гвен Кларк, выражают признательность Кэтрин Веберт, MD, FRCPC, и Хизер Хьюм, MD, FRCPC, как авторов предыдущей версии этой главы, и благодарят Лани Либерман, MD, FRCPC, за рецензирование текущей версии. .
Мы здесь, чтобы ответить на ваши вопросы о клиническом руководстве по переливанию крови. Мы также будем признательны за ваши идеи по улучшению Руководства.Свяжитесь с нами через форму обратной связи Clinical Guide.
Список литературы
1. White J, Qureshi H, Massey E, Needs M, Byrne G, Daniels G, Allard S. Руководство по группированию крови и тестированию на антитела к эритроцитам во время беременности. Transfus Med 2016; 26: 246-63.
2. Фунг К.Ф.К., Исон Э. № 133-Профилактика аллоиммунизации резус-фактора. Журнал акушерства и гинекологии Канады 2018; 40: е1-е10.
3. Джадд В.Дж., Координационный комитет научной секции. Рекомендации по пренатальной и перинатальной иммуногематологии . Опубликовано AABB, 2005.
4. Комитет программы стандартов (SPC), Группа стандартов банков крови / служб переливания крови (BBTS SPU). Глава 5: Управление процессами; Раздел 5.30: Мероприятия, связанные со службами переливания крови: резус-иммунный глобулин. В Стандартах для банков крови и служб переливания крови, 29-е издание . Опубликовано AABB, 2014.
5. CSA Group. CAN / CSA-Z902-15 Кровь и компоненты крови. Опубликовано в Канаде CSA, 2015.
6. Комитет по стандартам CSTM. Стандарты больничных служб переливания крови, версия 4 . Опубликовано в Маркхэме, Канада, Канадским обществом трансфузионной медицины, 2017.
7. Сандлер С.Г., Флегель В.А., Вестхофф К.М., Деномм Г.А., Делани М., Келлер М.А., Джонсон С.Т., Кац Л., Куинан Дж. Т., Вассалло Р. Р., Саймон К. Д.. Пришло время поэтапного генотипирования RHD для пациентов с серологическим фенотипом слабого D. Рабочая группа комитета по ресурсам трансфузионной медицины Колледжа американских патологов. Transfusion 2015; 55: 680-9.
8. Кларк Дж., Хэннон Дж., Берарди П., Барр Дж., Кот Дж., Фаллис Р., Альпорт Т., Лейн Д., Петрашко Т., Очоа Дж., Голдман М. Разрешение вариабельного материнского D-типирования с использованием серологии и генотипирования у выбранных пренатальных пациентов. Transfusion 2016; 56: 2980-5.
9. Национальный консультативный комитет по крови и продуктам крови. Генотипирование RHD для пренатальных пациентов с серологически слабым D-фенотипом. 2017.
10. van der Schoot CE, de Haas M, Clausen FB. Генотипирование для предотвращения резус-инфекции: время пришло? Curr Opin Hematol 2017; 24: 544-50.
11. Боуман Дж. Тридцать пять лет профилактики резус-фактора. Transfusion 2003; 43: 1661-6.
12. Bowman J. Rh-иммуноглобулин: Rh-профилактика. Best Practices Clin Haematol 2006; 19: 27-34.
13. Win-Rho SDF [Rho (D) иммунный глобулин (человеческий) для инъекций], вкладыш . Опубликовано в Виннипеге, Канада, Cangene Corporation, август 2001 г.
14. Куреши Х., Мэсси Э., Кирван Д., Дэвис Т., Робсон С., Уайт Дж., Джонс Дж., Аллард С. Руководство BCSH по использованию анти-D иммуноглобулина для лечения профилактика гемолитической болезни плода и новорожденного. Transfus Med 2014; 24: 8-20.
15. Issitt PD, Anstee DJ. Прикладная серология групп крови . Опубликовано в Дареме (Северная Каролина) издательством Montgomery Scientific Publications, 1998.
16. Solheim BG. Предоставление крови K- (KEL1-) женщинам не старше 50 лет. Transfusion 2015; 55: 468-9.
17. Кампхуйс М.М., Линденбург И., Ван Камп И.Л., Меерман Р.Х., Канхай Х.Х., Опкес Д. Проведение рутинного скрининга на антитела к Kell: улучшает ли оно перинатальную выживаемость? Transfusion 2008; 48: 953-7.
18. Бакчул Т., Басслер Д., Хекманн М., Тиле Т., Кифель В., Гросс И., Арнольд Д.М., ДиТомассо Дж., Смит Дж. В., Паес Б., Грайнахер А. Ведение детей, рожденных с тяжелой неонатальной аллоиммунной тромбоцитопенией: роль тромбоцитов переливание крови и внутривенное введение иммуноглобулина. Transfusion 2014; 54: 640-5.
19. Рекомендации по международному сотрудничеству в области трансфузионной медицины. Клинические рекомендации и систематические обзоры. https://www.ictmg.org (последний доступ 24.04.2018).
20. Винкельхорст Д., Мерфи М.Ф., Грайнахер А., Шехата Н., Бакчул Т., Месси Е., Бейкер Дж., Либерман Л., Танаэль С., Хьюм Х., Арнольд Д.М., Байдья С., Бертран Дж., Бассел Дж., Кьяер М., Каплан С. , Кьельдсен-Краг Дж., Опкес Д., Райан Г.Антенатальное ведение при аллоиммунной тромбоцитопении у плода и новорожденного: систематический обзор. Кровь 2017; 129: 1538-47.
21. Бертран Г., Каплан С. Как лечить аллоиммунную тромбоцитопению у плода и новорожденного? Transfusion 2014; 54: 1698-703.
17.6: Группы крови — Biology LibreTexts
Дар жизни
Вы когда-нибудь сдавали кровь так, как это делает человек на Рисунке \ (\ PageIndex {1} \)? Если да, то вы, вероятно, знаете, что ваша группа крови является важным фактором при переливании крови.Люди различаются по типу крови, которую они наследуют, и это определяет, какой тип крови они могут безопасно получить при переливании. Знаете ли вы свою группу крови?
Рисунок \ (\ PageIndex {1} \): сдача кровиЧто такое группы крови?
Группа крови (или группа крови) — это генетическая характеристика, связанная с присутствием или отсутствием определенных молекул, называемых антигенами, на поверхности эритроцитов. Эти молекулы могут помочь поддерживать целостность клеточной мембраны, действовать как рецепторы или выполнять другие биологические функции.Система группы крови относится ко всем генам, аллелям и возможным генотипам и фенотипам, которые существуют для определенного набора антигенов группы крови. Системы групп крови человека включают хорошо известные системы ABO и резус (Rh), а также по меньшей мере 33 других, менее известных.
Антигены и антитела
Рисунок \ (\ PageIndex {2} \): Модель антигена и соответствующего антителаАнтигены , такие как те, что находятся в красных кровяных тельцах, представляют собой молекулы, которые иммунная система идентифицирует как собственные (производимые вашим собственным телом) или как чужие. (не производится вашим собственным телом).Антигенами группы крови могут быть белки, углеводы, гликопротеины (белки, прикрепленные к цепочкам сахаров) или гликолипиды (липиды, прикрепленные к цепочкам сахаров), в зависимости от конкретной системы группы крови. Если антигены идентифицированы как чужие, иммунная система отвечает образованием антител, специфичных к чужеродным антигенам. Антитела — это большие Y-образные белки, продуцируемые иммунной системой, которые распознают и связываются с чужеродными антигенами. Аналогия замка и ключа часто используется для представления того, как антитело и антиген сочетаются друг с другом, как показано на рисунке \ (\ PageIndex {2} \).Когда антитела связываются с антигенами, они помечают их для разрушения другими клетками иммунной системы. Неличные антигены могут попадать в ваш организм через патогены, такие как бактерии или вирусы, продукты питания или красные кровяные тельца при переливании крови от человека с другой группой крови, чем ваша собственная. Последний способ в настоящее время практически невозможен из-за эффективных протоколов определения группы крови и скрининга.
Генетика группы крови
Группа крови человека зависит от того, какие аллели системы группы крови унаследованы от родителей.Обычно группа крови контролируется аллелями одного гена или двух или более очень тесно связанных генов. Тесно связанные гены почти всегда наследуются вместе, потому что рекомбинация между ними незначительна или отсутствует. Как и другие генетические особенности, группа крови человека обычно фиксируется на всю жизнь, но в редких случаях группа крови может измениться. Это может произойти, например, если человеку сделают трансплантацию костного мозга для лечения такого заболевания, как лейкемия. Если костный мозг поступает от донора с другой группой крови, группа крови пациента может в конечном итоге преобразоваться в группу крови донора, поскольку в костном мозге вырабатываются эритроциты.
Система групп крови ABO
Система групп крови ABO — самая известная система групп крови человека. Антигенами в этой системе являются гликопротеины. Эти антигенные соединения показаны на рисунке \ (\ PageIndex {3} \). Для системы ABO существует четыре распространенных группы крови:
.- Тип A, в котором присутствует только антиген A
- Тип B, в котором присутствует только антиген B
- Тип AB, в котором присутствуют антигены A и B
- Тип O, в котором нет ни антигена A, ни B
Генетика системы ABO
Система групп крови ABO контролируется одним геном на хромосоме 9.Существует три общих аллеля гена, которые часто обозначаются буквами I A (или A), I B (или B) и i (или O). При трех аллелях существует шесть возможных генотипов группы крови ABO. Однако аллели I A и I B являются доминантными по отношению к аллелю i и кодоминантными друг другу. В результате получается всего четыре возможных фенотипа (группы крови) для системы ABO. Эти генотипы и фенотипы показаны в таблице \ (\ PageIndex {1} \).
Таблица \ (\ PageIndex {1} \): Система групп крови ABO
| Генотип | Фенотип (группа крови) |
|---|---|
| \ (I ^ Ai \) | А |
| \ (I ^ AI ^ A \) | А |
| \ (I ^ AI ^ B \) | AB |
| \ (I ^ Bi \) | B |
| \ (I ^ BI ^ B \) | B |
| \ (ii \) | O |
Диаграмма на рисунке \ (\ PageIndex {4} \) показывает пример того, как наследуется группа крови ABO.В этом конкретном примере отец имеет группу крови A (генотип АО), а мать — группу крови B (генотип BO). Этот тип спаривания может производить детей с каждым из четырех возможных фенотипов ABO, хотя в любой данной семье не все фенотипы могут присутствовать у детей.
Рисунок \ (\ PageIndex {4} \): Пример наследования группы крови ABO. Мужчина с типом A (генотип AO) и женщина с типом B (генотип BO) могут иметь детей с группами крови: A, AB, B и O.Медицинское значение группы крови ABO
Система ABO — самая важная система группы крови при переливании крови.Если эритроциты, содержащие определенный антиген ABO, переливаются человеку, у которого отсутствует этот антиген, иммунная система человека распознает антиген в эритроцитах как чужеродный. Антитела, специфичные к этому антигену, будут атаковать красные кровяные тельца, заставляя их агглютинировать или слипаться и разрушаться. Если пациенту случайно переливают несовместимую кровь, может возникнуть тяжелая реакция (называемая острой гемолитической трансфузионной реакцией), при которой многие эритроциты разрушаются.Это может привести к почечной недостаточности, шоку и даже смерти. К счастью, сегодня таких несчастных случаев практически не бывает.
антитела ABO, скорее всего, уже присутствуют в крови реципиента в отношении антигенов, которых у человека нет. Эти антитела вырабатываются в первые годы жизни путем сенсибилизации к аналогичным антигенам, обычно встречающимся в окружающей среде. Считается, что антитела против A возникают в результате иммунного ответа на антиген вируса гриппа, а антитела против B возникают в результате иммунного ответа на антиген, обнаруженный у бактерий, таких как E.coli . После выработки антител они циркулируют в плазме. Взаимосвязь между антигенами эритроцитов ABO и антителами плазмы показана в таблице \ (\ PageIndex {2} \).
| Группа крови | А | В | AB | О |
|---|---|---|---|---|
| Антитела в плазме | Anti-B | Анти-А | Нет | Anti-A и Anti-B |
| Антигены эритроцитов | А антиген | B антиген | Антиген A и B | Нет |
Какие группы крови совместимы, а какие нет? Кровь типа O содержит как анти-A, так и анти-B антитела, поэтому люди с кровью типа O могут получать только кровь типа O.Однако они могут сдавать кровь людям любой группы крови ABO. Вот почему людей с кровью группы O называют универсальными донорами. Кровь типа AB не содержит ни анти-A, ни анти-B антител, поэтому люди с кровью типа AB могут получать кровь от людей с любой группой крови ABO. Вот почему людей с кровью типа AB называют универсальными реципиентами. Однако они могут сдавать кровь только людям, у которых также есть кровь группы AB. Эти и другие отношения между группами крови доноров и реципиентов показаны на рисунке \ (\ PageIndex {5} \).
Рисунок \ (\ PageIndex {5} \): вы всегда можете сдать кровь тому, кто имеет ту же группу крови, что и ваша, но вы можете или не сможете сдать кровь людям с другой группой крови, как показано на этой диаграмме. .Антигены группы крови ABO обнаруживаются не только на эритроцитах, но и на тромбоцитах, в других жидкостях организма, таких как слезы и моча, а также на клетках других типов тканей. Совместимость групп крови важна для успешной трансплантации органов. Если трансплантированный орган имеет чужеродные антигены для ABO, он может быть атакован антителами и отторгнут организмом.
Система групп крови резус
Другой хорошо известной системой группы крови является резус (Rh) система группы крови . В системе резус есть десятки различных антигенов, но только пять основных антигенов (с названиями D, C, c, E и e). Основным антигеном резуса является антиген D. Людей с антигеном D называют резус-положительными (Rh +), а людей, у которых отсутствует антиген D, называют резус-отрицательными (Rh-). Считается, что резус-антигены играют роль в транспортировке ионов через клеточные мембраны, действуя как канальные белки.
Система группы крови резус контролируется двумя сцепленными генами на хромосоме 1. Один ген, называемый RHD, продуцирует единственный антиген, антиген D. Другой ген, называемый RHCE, продуцирует другие четыре относительно общих антигена резуса (C, c, E и e), в зависимости от того, какие аллели этого гена передаются по наследству.
Группа крови резус и переливания
После системы ABO, резус-система является второй по важности системой групп крови при переливании крови. Антиген D с наибольшей вероятностью вызывает иммунный ответ у людей, у которых этот антиген отсутствует.Людям с антигеном D (Rh +) можно безопасно переливать кровь Rh + или Rh-, тогда как людям, у которых отсутствует антиген D (Rh-), можно безопасно переливать только кровь Rh-.
В отличие от антител анти-A и анти-B к антигенам ABO, антитела анти-D для системы резус обычно не образуются путем сенсибилизации к веществам окружающей среды. Однако люди, у которых отсутствует антиген D (Rh-), могут вырабатывать анти-D антитела при контакте с Rh + кровью. Это может случиться случайно при переливании крови, хотя сегодня это крайне маловероятно.Это также может произойти во время беременности с Rh + плодом, если некоторые из клеток крови плода попадают в кровоток матери.
Гемолитическая болезнь новорожденных
Если женщина с резус-фактором- вынашивает плод с резус-фактором, он может подвергаться риску. Это особенно вероятно, если у матери образовались антитела к D во время предыдущей беременности из-за смешивания крови матери и плода во время родов. В отличие от антител против антигенов ABO, антитела против антигена резуса D могут проникать через плаценту и попадать в кровь плода.Это может вызвать гемолитическую болезнь новорожденных (HDN) , также называемую эритробластозом плода, заболевание, при котором эритроциты плода разрушаются материнскими антителами, вызывая анемию. Эта болезнь может варьироваться от легкой до тяжелой. В тяжелых случаях это может привести к повреждению головного мозга и иногда к летальному исходу для плода или новорожденного. К счастью, HDN можно предотвратить, предотвратив образование анти-D антител в Rh-матери. Это достигается путем инъекции матери лекарства под названием иммуноглобулин Rho (D).
Особенность: миф против реальности
Миф: Ваши потребности в питании можно определить по группе крови ABO. Зная свою группу крови, вы сможете выбрать подходящие продукты, которые помогут вам похудеть, повысить уровень энергии и прожить более долгую и здоровую жизнь.
Реальность: Эта идея была предложена в 1996 году в бестселлере New York Times Правильно питайтесь для своего типа натуропата Питера Д’Адамо.Натуропатия — это метод лечения заболеваний, связанных с использованием трав, солнечного света, свежего воздуха и других природных веществ. Некоторые врачи считают натуропатию лженаукой. В крупном научном обзоре диеты по группе крови не было найдено никаких доказательств, подтверждающих это. В одном исследовании взрослые, соблюдающие диету, предназначенную для группы крови А, показали улучшение здоровья, но это произошло у всех, независимо от их группы крови. Поскольку диета по группе крови основана исключительно на группе крови, в ней не учитываются другие факторы, которые могут потребовать корректировок или ограничений диеты.Например, люди с диабетом, но с разными группами крови, будут придерживаться разных диет, и одна или обе диеты могут противоречить стандартным диетическим рекомендациям при диабете и быть опасными.
Миф: Группа крови ABO связана с определенными чертами личности. Например, люди с группой крови A терпеливы и ответственны, но также могут быть упрямыми и напряженными, тогда как люди с группой крови B энергичны и креативны, но также могут быть безответственными и беспощадными.При выборе супруга следует принимать во внимание как вашу собственную группу крови, так и группу крови вашего потенциального партнера, чтобы обеспечить совместимость вашей личности.
Реальность: Вера в то, что группа крови коррелирует с личностью, широко распространена в Японии и других странах Восточной Азии (японская будка, изображенная ниже, предлагает состояния в зависимости от группы крови). Идея была впервые представлена в 1920-х годах в исследовании, проведенном по заказу правительства Японии, но, как выяснилось позже, не имеет научной поддержки.Эта идея была возрождена в 1970-х годах японским телеведущим, написавшим об этом популярные книги. У этой идеи нет научного обоснования, и она обычно отвергается научным сообществом как псевдонаука. Тем не менее, она остается популярной в странах Восточной Азии, как и астрология во многих других странах.
Обзор
- Определите группу крови и систему группы крови.
- Объясните связь между антигенами и антителами.
- Определите аллели, генотипы и фенотипы в системе групп крови ABO.
- Обсудите медицинское значение системы групп крови ABO.
- Приведите примеры того, как разные группы крови ABO различаются по восприимчивости к заболеваниям.
- Опишите систему групп крови резус.
- Связать группы крови резус с переливаниями крови.
- Что вызывает гемолитическую болезнь новорожденного?
- Женщина имеет группу крови O и Rh-, а ее муж — группу крови AB и Rh +. Ответьте на следующие вопросы об этой паре и их потомстве.
а. Каковы возможные генотипы их потомков по группе крови ABO?
г. Каковы возможные фенотипы их потомков с точки зрения группы крови ABO?
г. Может ли женщина сдать кровь мужу? Поясните свой ответ.
г. Может ли мужчина сдать кровь жене? Поясните свой ответ.
Верно или неверно. Антиген D является частью системы групп крови ABO.
Объясните, почему гемолитическая болезнь новорожденного с большей вероятностью может возникнуть при второй беременности, чем при первой.
Узнать больше
Является ли малярия причиной того, что у многих людей кровь группы O? Послушайте это увлекательное интервью Национального общественного радио с доктором Кристин Черти-Газдевич, специалистом по крови (гематологом) из Университета Торонто, которая обсуждает возникающую теорию универсальной крови.
На поведение человека влияет множество факторов.. но могло ли это быть результатом паразитизма? Узнайте больше здесь:
Гемолитическая болезнь новорожденных вследствие несовместимости по АВО | Каттимани
Ван М., Хейс Т, Амбрузо ДР. Гемолитическая болезнь новорожденных, вызванная высоким титром анти-группы B Ig G от матери группы А. Педиатр Рак крови. 2005; 45: 861-2.
Оматаде О.О., Адейемо А.А., Кайоде М., Фаладе С.Л., Икпеме С. Частоты генов аллелей группы крови ABO и Rh (D) в популяции здоровых младенцев в Ибадане, Нигерия.West Afr J Med. 1990; 18 (4): 294-7.
Драбик-Клэри К., Редди В.В., Бенджамин У.Х., Бактор Ф.Н. Тяжелая гемолитическая болезнь новорожденного афроамериканского младенца группы В, родившегося от матери группы О. Ann Clin Lab Sci. 2006; 36 (2): 205-7.
Chen JY, Ling UP. Прогнозирование развития гипербилирубемии новорожденных при несовместимости с АВО, Чжунхуа и ся цзы чжи (Тайбэй). 1994 Янв; 53 (1): 13-8.
Palleau S, Le Tourneau C, Jrad I, Andreuy JP, Govin I. Несовместимость по системе ABO и гемолитическая болезнь новорожденных: два случая с большим эритробластозом.Ann Biol Clin. 2004; 62 (3): 344-8.
Нил А. Мюррей, Ирен А. Г. Робертс. Гемолитическая болезнь новорожденных. Архив Дис Детство Фетальный Неонат 2007; 92: f83-f88.
Фишер К., Пошманн А., Грундманн А. Гемолитическая болезнь новорожденных вследствие несовместимости по системе АВО (авторский перевод). Z Geburtshilfe Perinato. 1977 Aug; 181 (4): 227-40.
Чинту Ц., Зипурский А., Блайхман М. АБО гемолитическая болезнь новорожденных. East Afr Med J. 1979 июл; 56 (7).
Хааре К.М., Рахман М. Необычный случай ABO-HDN.Bangladesh Med Res Counc Counc Bull. 2000 Авг; 26 (2): 61-4.
Dufour DR, Monoghan WP. АВО-Гемолитическая болезнь новорожденных-Ретроспективный анализ 254 случаев. Am J Clin Pathol. 1980 Март; 73 (3): 369-73.
Wagle S, Deshpande Pr. Гемолитическая болезнь новорожденных. E Медицина. Июнь 2006г.
Bowman JM. Гемолитическая болезнь (эритробластоз плода). Кризи Р.К., Резник Р. Материнско-плодная медицина. 4-е издание. Филадельфия: WB Saunders; 1999: 736-67.
Кумар А, Патель МК, Чавда Б.Гемолитическая болезнь новорожденных: исследование 50 случаев. IJSS 2013 октябрь-декабрь; 1 (3): 95-9.
Акгюль С., Коркмаз А., Йигит С., Юрдакок М. Гипербилирубинемия новорожденных из-за несовместимости по системе АВО: имеет ли значение группа крови. Turk J Pediatr. 2013 Сентябрь 1; 55 (5): 506-9.
Шах А., Шах С.К., Шах В. Изучение гематологических параметров новорожденных, поступивших с желтухой новорожденных. J Evol Med Dental Sci. 2012 июл; 1 (3): 203-8.
Preethi BP, Maitreyee DS, Khemka M. Корреляция уровней пуповинного билирубина с гипербилирубинемией при несовместимости по системе ABO.Int J Pharma Bio Sci. 2011 апрель-июнь; 22 (2): 257-62.
Мантани М., Патель А., Ренге Р., Кулькарни Х. Прогностическое значение прямого билирубина при неонатальной гипербилирубинемии. Индийский J Pediatr. 2007; 79: 819-22.
Sharma P, Chhangani NP, Meena KR, Jora R, Sharma N, Gupta BD. Аудиометрия вызванного ответа ствола мозга (BAER) у новорожденных с гипербилирубинемией. Индийский J Pediatr. 2006; 73: 413-6.
Майзелс М.Дж., Кринг Э. Продолжительность пребывания, желтуха и повторная госпитализация. Педиатрия. 1998; 101: 995-8.
Nepal D, Banstola D, Dhakal AK, Mishra U, Mahaseth C. Клинико-лабораторный профиль и непосредственные результаты лечения детей с гипербилирубинемией, поступивших в детскую больницу Канти. J Nepal Paediatr Soc. 2010 январь-июнь; 30 (1): 31-6.
Расул С.Х., Хасан М.А., Ясмин Ф. Исход неонатальной гипербилирубинемии в больнице третичного уровня в Бангладеш. Malaysian J Med Sci. 2010 апрель-июнь; 17 (2): 40-4.
Иршад М., Мухаммад А., Хуссейн М., Хан Б., Али Н., Ахмад А. и др. Распространенность резус-типа и несовместимость по системе АВО у новорожденных с желтухой.J Postgrad Med Inst. 2011; 25 (3): 233-9.
Калахети Б.К., Сингх Р., Бхарра Н.К., Барал Н. Риск неонатальной гипербилирубинемии у детей, рожденных от «О» положительных матерей: проспективное когортное исследование. Kathmandu Univ Med J. 2009; 7 (25): 11-5.
aks A, Vilhekar K, Jain M, Zade P, Atkari S, Verkey S. Прогнозирование развития гипербилирубина новорожденных путем повышения билирубина пуповинной крови. Ind Medica. 2005; 9 (1): 5-9.
Кнудсен А. Прогнозирование развития желтухи новорожденных по увеличению билирубина пуповинной крови.Acta Paediatr Scand. 1989; 78: 217-21.
Ростами Н., Мехраби Ю. Выявление новорожденных с риском развития значительной гипербилирубинемии путем измерения уровня билирубина в пуповинной крови. J Арабский неонатальный форум. 2005; 2: 81-5.
Oral E, Gezee A, Cagdas A, Pakkal N. Инфузия окситоцина в родах: влияние различных показаний и использование разных разбавителей на уровень билирубина новорожденных. Archgynecol Obstet. 2003 Январь; 267 (3): 117-20.
Авасти С., Рехман Х. Раннее прогнозирование неонатальной гипербилирубинемии.Индийский J Pediatr. 1998; 65: 131-9
.Бхат Й, Паван Кумар С. Заболеваемость гемолитической болезнью АВО у новорожденных. Педиатр Int Child Health. 2012; 32: 93-6
.МакДоннелл М., Ханнам С., Девейн С.П. Водянка плода из-за несовместимости по системе АВО. Arch Dis Child Fetal Neonatal Ed. 1998; 78: F220-F1.
Стиллер Р.Дж., Герцлингер Р., Сигель С., Ветхэм Дж. Асцит плода, связанный с несовместимостью по системе АВО: описание случая и обзор литературы. Am J Obstet Gynecol. 1996; 175: 1371-2.
Адевуйи Дж., Гванзура К.Расовые различия между белыми и черными зимбабвийцами в гемолитической активности антител A, B, O. Afr J Med Med Sci. 2001; 30: 71.
Таккер Б., Шах А.А. Гемолитические состояния новорожденного — лабораторное исследование. NHL J Med Sci. 2014 1 июля; 3 (2).
Ella EE, Garba SA, Ogal WN. ABO Несовместимость и ее роль в неонатальной желтухе в Зарии, штат Кадуна, Нигерия. ИДЖЕС. 2013; 2 (11): 17-23.
Бейкер Ф.Дж., Сильвертон РЭ, Паллистер С.Дж. Введение в технологию медицинских лабораторий.7-е изд. Лондон: Bounty Press Ltd; 2001: 348-419.
Шарма, округ Колумбия, Рай С., Мехра А., Каур М.М., Сао С., Гаур А. и др. Изучение 25 случаев обменного переливания восстановленной крови при гемолитической болезни новорожденных. Азиатский журнал J Transfus Sci. 2007; 1: 56-8.
Аутоиммунная гемолитическая анемия: причины, типы и симптомы
Аутоиммунная гемолитическая анемия — это редкое заболевание эритроцитов и иммунное расстройство. Это происходит, когда в организме вырабатываются антитела, разрушающие эритроциты.
Гемолитическая анемия развивается, когда эритроцитов не хватает, потому что организм уничтожает их раньше, чем следовало бы. Красные кровяные тельца переносят кислород по телу.
Аутоиммунная гемолитическая анемия (АИГА) или иммунная гемолитическая анемия возникает, когда иммунная система не работает должным образом. Он ошибочно принимает эритроциты за нежелательные вещества и атакует их, вызывая их раннюю гибель. Это оставляет человека без достаточного количества эритроцитов.
Обычно красные кровяные тельца живут в организме от 100 до 120 дней.Однако в тяжелых случаях АИГА клетки могут оставаться только в течение нескольких дней.
У детей это редкое заболевание, обычно временное. Однако у некоторых взрослых АМСЗ может быть длительным заболеванием, которое часто возвращается.
АМСЗ может развиваться быстро или со временем.
Клетки крови производятся в костном мозге.
Есть три основных типа:
- Белые кровяные тельца помогают организму бороться с инфекциями.
- Тромбоциты способствуют свертыванию крови и предотвращают кровотечение.
- Красные кровяные тельца переносят кислород по всему телу в форме гемоглобина.
Белые кровяные тельца вырабатывают антитела. Антитела прикрепляются к эритроцитам и путешествуют по телу, борясь с микробами и другими чужеродными веществами, которых там быть не должно.
При АМСЗ организм вырабатывает антитела, которые атакуют эритроциты, потому что они считают их чужеродными или нежелательными веществами. Они разрушают эритроциты, и это приводит к анемии.
Это может произойти из-за:
- воздействия определенных токсинов или химикатов, например, лекарств
- осложнения инфекции
- переливания крови, когда кровь не соответствует группе крови человека
- нерожденного ребенка группа крови отличается от группы крови их матери
- некоторые виды рака
АМСЗ разделяет две группы крови: теплая и холодная и первичная и вторичная.
Классификация на тепло или холод зависит от типа задействованных антител.
Теплый гемолиз AIHA
Он также называется теплым гемолизом и включает антитела IgG. Они связывают эритроциты при 98,6 ° F (37 ° C) или нормальной температуре тела. Это составляет 80–90 процентов случаев.
Симптомы обычно появляются постепенно, в течение от нескольких недель до месяцев. Однако иногда они могут появиться внезапно, в течение нескольких дней.
К ним относятся:
- бледность или пожелтение кожи
- усталость
- головокружение
- учащенное сердцебиение
холод AIHA
Это также называется холодным гемолизом.В этом типе аутоантитела IgM или холодовые агглютинины связывают красные кровяные тельца, когда кровь подвергается воздействию низких температур, в частности от 32 ° до 39,2 ° F (от 0 ° до 4 ° C). Это составляет 10–20 процентов случаев.
Холодная температура или вирусная инфекция могут вызывать симптомы, к которым относятся:
Поделиться на Pinterest Больному АМСЗ следует согреться, потому что холодная окружающая среда может усугубить симптомы.- усталость и головокружение
- бледность или пожелтение кожи
- холодные руки и ноги
- боль в груди и задней части ног
- рвота или диарея
- боль и посинение в руках и ногах
- болезнь Рейно
- Проблемы с сердцем, такие как аритмия, шум в сердце, увеличенное сердце или сердечная недостаточность
Первичный или вторичный AIHA
AIHA также может быть первичным или вторичным.
- Первичный AIHA — это когда нет никаких признаков какого-либо основного заболевания.
- Вторичный AIHA — это когда есть связь с другим условием.
Аутоиммунные заболевания, которые имеют или могут иметь связь с вторичным АМСЗ, включают:
Некоторые распространенные вирусы могут вызывать АИГА. Часто антитела и анемия проходят после того, как инфекция прошла.
Вирусы, которые, по-видимому, связаны с АМСЗ, включают:
Эти вирусы могут вызывать изменения в антителах, которые могут привести к АМСЗ.
Типы препаратов, которые в редких случаях могут вызвать изменения, приводящие к АМСЗ, включают:
- пенициллины
- цефалоспорины
- тетрациклин
- эритромицин
- ацетаминофен
- ибупрофен
Человек также может унаследовать свои антитела мать при рождении, но это редко.
Общие симптомы АМСЗ включают:
- субфебрильную температуру
- слабость и усталость
- трудности с мышлением и концентрацией внимания
- бледность
- учащенное сердцебиение
- одышку
- пожелтение кожи или желтуху
- темная моча
- мышечные боли
- головные боли
- тошнота, рвота и диарея
- головокружение при вставании
- затрудненное дыхание
- болезненный язык
- учащенное сердцебиение или учащенное сердцебиение
Врач спросит о симптомах и унесет физическое обследование.Затем они могут заказать анализы крови и мочи, чтобы помочь с диагностикой.
Общий анализ крови
Общий анализ крови (CBC) измеряет различные части, составляющие кровь.
Включает измерение уровней гемоглобина и гематокрита.
- Гемоглобин — это белок, переносящий кислород по всему телу.
- Гематокрит показывает, сколько места занимают эритроциты.
Низкий уровень обоих может быть признаком анемии.
Тесты Кумбса
Эти анализы крови ищут антитела, которые могут влиять на эритроциты.
Тест на ретикулоциты
В этом анализе крови измеряется уровень ретикулоцитов, которые представляют собой слегка незрелые эритроциты. Он может определить, вырабатывает ли костный мозг эритроциты с подходящей скоростью.
Диапазон будет выше, если в организме низкий уровень гемоглобина из-за кровотечения или разрушения эритроцитов. Высокое производство эритроцитов может быть признаком анемии.
Тест на билирубин
Печень вырабатывает билирубин, вещество желтого цвета, которое присутствует в желчи. Анализ крови может определить количество билирубина в крови.
Когда клетки крови умирают, гемоглобин попадает в кровоток. Гемоглобин, в свою очередь, распадается на билирубин. Это приводит к желтухе, когда глаза и кожа приобретают желтоватый цвет.
Высокий уровень билирубина в крови может быть признаком анемии, поражения печени или другого заболевания.
Тест на гаптоглобин
Гаптоглобин — это белок, вырабатываемый печенью.Внутри тела он связывает определенный тип гемоглобина в крови.
Количество гаптоглобина в крови показывает, насколько быстро разрушаются эритроциты.
Тест на холодовые агглютинины
Болезнь холодовых агглютининов — это редкий тип АМСЗ, при котором симптомы ухудшаются, когда человек находится при температуре от 32 до 50 градусов по Фаренгейту.
Агглютинины — это антитела, которые вызывают слипание эритроцитов. Холодные агглютинины активны при низких температурах, а теплые агглютинины активны при нормальной температуре тела.
Определение наличия теплых или холодных агглютининов иногда может помочь объяснить, почему возникает заболевание.
Теплые агглютинины могут возникать при:
Варианты лечения АМСЗ зависят от ряда факторов. Если анемия легкая, она часто проходит без лечения. От 70 до 80 процентов людей не нуждаются в лечении или минимальном вмешательстве.
Однако некоторым людям потребуются лекарства, операция или переливание крови.
Факторы, влияющие на потребность в лечении, включают:
- возраст человека, общее состояние здоровья и историю болезни
- насколько серьезна анемия
- причина состояния
- индивидуальная переносимость определенных видов лечения
- как медицинские работники ожидайте, что симптомы будут прогрессировать.
Если есть основная причина — например, рак, инфекция или прием некоторых лекарств — лечение состояния или смена лекарств могут уменьшить симптомы АИГА.
Лекарства
Врач может назначить кортикостероиды или препараты, подобные кортизону, для ослабления иммунного ответа.
Как правило, это первый тип лечения людей с первичным АМСЗ, который может помочь облегчить симптомы многих распространенных типов АМСЗ.
В тяжелых случаях, если эти препараты не действуют, врач может назначить другие препараты, подавляющие иммунный ответ, известные как иммуносупрессивная терапия.
Это медикаментозное лечение помогает снизить иммунный ответ организма.Препараты помогают предотвратить атаку иммунной системой собственного костного мозга. Это позволяет стволовым клеткам костного мозга расти, и это может увеличить количество эритроцитов.
Однако и кортизон, и иммунодепрессанты могут иметь побочные эффекты.
Хирургия
Если медикаментозное лечение неэффективно, врач может порекомендовать операцию.
Селезенка отвечает за удаление аномальных эритроцитов из кровотока, в том числе с прикрепленными антителами.Удаление селезенки может позволить организму сохранить эти эритроциты. Это может помочь предотвратить анемию.
Переливание крови
Если симптомы тяжелые и другие варианты неэффективны, человеку может потребоваться переливание крови.
АМСЗ может возникать у детей. Однако, по данным Чикагского университета, менее 0,2 человека из 100 000 имеют АМСЗ в возрасте до 20 лет. Самые высокие показатели у детей дошкольного возраста.
АМСЗ возникает у детей, как правило, в результате вируса или инфекции.
Часто лечение не требуется, и симптомы проходят без вмешательства. Дети, нуждающиеся в лечении, будут иметь те же варианты лечения, что и взрослые.
АМСЗ может нарушить распорядок дня ребенка из-за усталости и необходимости постоянной медицинской помощи, включая анализы.
Родители и опекуны должны следить за тем, чтобы ребенок:
- придерживался хорошо сбалансированной диеты
- много отдыхал и пил
- планировал мероприятия таким образом, чтобы ребенок мог управлять своим состоянием
Врач будет обсудить конкретный план лечения.
Невозможно предотвратить некоторые типы АМСЗ, но врачи могут наблюдать за людьми, у которых есть вирусная инфекция или которые принимают определенные лекарства, чтобы гарантировать, что АМСЗ не разовьется.
Тяжелая анемия может усугубить многие проблемы, например болезни сердца и легких. Людям следует обратиться к врачу, если у них возникнут какие-либо симптомы, которые могут указывать на АМСЗ.
Поделиться на PinterestДля людей с АМСЗ прививка от гриппа может помочь предотвратить дальнейшие осложнения.Если у кого-то есть АМСЗ, его врач будет работать с ним, чтобы уменьшить симптомы и уменьшить вероятность осложнений.
Советы по снижению риска обострения симптомов или осложнений включают:
- избегать людей с инфекциями или больных
- регулярно мыть руки и чистить зубы для снижения риска инфекций полости рта и других инфекций
- делать ежегодную прививку от гриппа
Людям с простудой АМСЗ следует стараться согреться, так как холодная среда может спровоцировать разрушение эритроцитов.
Перспективы АМСЗ обычно хорошие. Состояние обычно длится ограниченное время.
Если это происходит в подростковом возрасте, это может стать хроническим заболеванием. Однако лечение может помочь уменьшить воздействие.
Гемолитическая болезнь новорожденных (ГБН)
Не то, что вы ищете?Что такое гемолитическая болезнь новорожденного?
Гемолитическая болезнь новорожденных (ГБН) — это проблема крови новорожденных. Это происходит, когда красные кровяные тельца вашего ребенка быстро разрушаются. Его также называют эритробластозом плода.- Гемолитик означает разрушение красных кровяных телец.
- Эритробластоз означает образование незрелых эритроцитов.
- Fetalis означает плод.
Что вызывает ГБН у новорожденного?
У всех людей есть группа крови (A, B, AB или O). У каждого также есть резус-фактор (положительный или отрицательный). Проблема может возникнуть, если у матери и ребенка разная группа крови и резус-фактор.ГБН чаще всего возникает, когда мать с отрицательным резус-фактором рождает ребенка от отца с положительным резус-фактором.Если резус-фактор ребенка положительный, как у его или ее отца, это может быть проблемой, если красные кровяные тельца ребенка перекрещиваются с резус-отрицательной матерью.
Это часто случается при рождении, когда отрывается плацента. Но это также может произойти в любое время, когда клетки крови матери и ребенка смешиваются. Это может произойти во время выкидыша или падения. Это также может произойти во время пренатального теста. Они могут включать амниоцентез или биопсию ворсин хориона. В этих тестах для взятия образца ткани используется игла. Они могут вызвать кровотечение.
Иммунная система матери с отрицательным резус-фактором воспринимает резус-положительные эритроциты ребенка как чужеродные. Ваша иммунная система в ответ вырабатывает антитела для борьбы с этими чужеродными клетками и их уничтожения. Ваша иммунная система хранит эти антитела на случай, если эти чужеродные клетки вернутся снова. Это может произойти при будущей беременности. Теперь вы чувствительны к резус-фактору.
Резус-сенсибилизация обычно не является проблемой при первой беременности. Большинство проблем возникает при будущих беременностях с другим резус-положительным ребенком.Во время этой беременности материнские антитела проникают через плаценту, чтобы бороться с резус-положительными клетками в организме ребенка. Поскольку антитела разрушают клетки, ребенок заболевает. Это называется эритробластозом плода при беременности. Когда ребенок рождается, его называют HDN.
Какие дети подвержены риску ГБН?
Следующие факторы могут повысить риск рождения ребенка с ГБН:- У вас отрицательный резус-фактор, и у вас есть ребенок, но вы не получали лечения.
- У вас отрицательный резус-фактор, у вас повышенная сенсибилизация. Это может произойти при прошлой беременности с положительным резус-фактором. Или это может произойти из-за травмы или теста на этой беременности с положительным резус-фактором ребенка.
ГБН примерно в 3 раза чаще встречается у детей европеоидной расы, чем у детей афроамериканского происхождения.
Каковы симптомы ГБН у новорожденного?
Симптомы могут проявляться немного по-разному в зависимости от беременности и у каждого ребенка.Во время беременности вы не заметите никаких симптомов.Но во время пренатального теста ваш лечащий врач может увидеть следующее:
- Желтая окраска околоплодных вод. Этот цвет может быть из-за билирубина. Это вещество, которое образуется при распаде клеток крови.
- У вашего ребенка может быть большая печень, селезенка или сердце. Также может быть лишняя жидкость в его или ее желудке, легких или коже черепа. Это признаки водянки плода. Это состояние вызывает сильную опухоль (отек).
После рождения симптомы у вашего ребенка могут включать:
- Бледная кожа.Это из-за недостатка эритроцитов (анемия).
- Желтый цвет пуповины, кожи и белков глаз вашего ребенка (желтуха). Ваш ребенок может не выглядеть желтым сразу после рождения. Но желтуха может возникнуть быстро. Часто это начинается в течение 24–36 часов.
- У вашего новорожденного могут быть большие печень и селезенка.
- У новорожденного с водянкой плода может быть сильное опухание всего тела. Они также могут быть очень бледными и иметь затрудненное дыхание.
Как диагностируется ГБН у новорожденного?
HDN может вызывать симптомы, похожие на те, что вызваны другими заболеваниями.Чтобы поставить диагноз, лечащий врач вашего ребенка будет искать группы крови, которые не могут работать вместе. Иногда этот диагноз ставят во время беременности. Он будет основан на результатах следующих тестов:- Анализ крови. Тестирование проводится для выявления резус-положительных антител в вашей крови.
- УЗИ. Этот тест может показать увеличенные органы или скопление жидкости у ребенка.
- Амниоцентез. Этот тест проводится для проверки количества билирубина в околоплодных водах.В этом тесте игла вводится в брюшную стенку и стенку матки. Он проходит через амниотический мешок. Игла берет образец околоплодных вод.
- Чрескожный забор пуповинной крови. Этот тест также называется забором крови плода. В этом тесте кровь берется из пуповины вашего ребенка. Лечащий врач вашего ребенка проверит эту кровь на наличие антител, билирубина и анемии. Это делается, чтобы проверить, нужно ли вашему ребенку внутриматочное переливание крови.
Для диагностики ГБН после рождения ребенка используются следующие тесты:
- Тестирование пуповины вашего ребенка. Это может показать группу крови вашего ребенка, резус-фактор, количество эритроцитов и антитела.
- Исследование крови ребенка на уровень билирубина.
Как лечится ГБН у новорожденного?
Лечение будет зависеть от симптомов, возраста и общего состояния вашего ребенка. Это также будет зависеть от степени тяжести состояния.Во время беременности лечение ГБН может включать следующее.
Мониторинг
Медицинский работник проверит кровоток вашего ребенка с помощью ультразвука.
Переливание внутриматочной крови
Этот тест вводит эритроциты в кровообращение вашего ребенка. В этом тесте через матку вводится игла. Он попадает в брюшную полость вашего ребенка и попадает в вену пуповины. Вашему ребенку может потребоваться успокаивающее средство, чтобы он или она не двигались.Возможно, вам потребуется более одного переливания.
Ранняя доставка
Если у вашего ребенка возникнут определенные осложнения, возможно, ему придется родиться раньше срока. Ваш лечащий врач может вызвать роды, когда у вашего ребенка созреют легкие. Это может предотвратить ухудшение HDN.
После родов лечение может включать следующее.
Переливания крови
Это можно сделать, если у вашего ребенка тяжелая анемия.
Внутривенные жидкости
Это можно сделать, если у вашего ребенка низкое кровяное давление.
Фототерапия
В этом тесте вашего ребенка помещают под специальный свет. Это поможет вашему ребенку избавиться от лишнего билирубина.
Помощь при дыхании
Вашему ребенку может понадобиться кислород, вещество в легких, которое помогает держать крошечные воздушные мешочки открытыми (сурфактант), или механический дыхательный аппарат, чтобы лучше дышать.
Обменное переливание
Этот тест удаляет кровь вашего ребенка с высоким уровнем билирубина. Он заменяет его свежей кровью с нормальным уровнем билирубина.Это увеличивает количество красных кровяных телец вашего ребенка. Это также снижает уровень билирубина у него. В этом тесте ваш ребенок будет попеременно давать и получать небольшое количество крови. Это будет сделано через вену или артерию. Вашему ребенку может потребоваться повторная процедура, если у него или ее уровень билирубина остается высоким.
Внутривенный иммуноглобулин (ВВИГ)
ВВИГ — это раствор из плазмы крови. Он содержит антитела, которые помогают иммунной системе ребенка. ВВИГ снижает распад красных кровяных телец у вашего ребенка.Это также может снизить его или ее уровень билирубина.
Какие возможные осложнения ГБН у новорожденного?
Когда ваши антитела атакуют эритроциты вашего ребенка, они расщепляются и разрушаются (гемолиз).Когда красные кровяные тельца вашего ребенка разрушаются, образуется билирубин. Младенцам сложно избавиться от билирубина. Он может накапливаться в их крови, тканях и жидкостях. Это называется гипербилирубинемией. Билирубин вызывает пожелтение кожи, глаз и других тканей ребенка.Это называется желтухой.
Распад эритроцитов вызывает у ребенка анемию. Анемия опасна. При анемии кровь вашего ребенка очень быстро вырабатывает больше красных кровяных телец. Это происходит в костном мозге, печени и селезенке. Это заставляет эти органы увеличиваться в размерах. Новые эритроциты часто являются незрелыми и не могут выполнять работу зрелых эритроцитов.
Осложнения ГБН могут быть легкими или тяжелыми.
Во время беременности у вашего ребенка могут быть:
- Легкая анемия, гипербилирубинемия и желтуха. Плацента избавляется от некоторого количества билирубина. Но удалить все это невозможно.
- Тяжелая анемия. Это может привести к тому, что печень и селезенка вашего ребенка станут слишком большими. Это также может повлиять на другие органы.
- Водянка плода. Это происходит, когда органы вашего ребенка не могут справиться с анемией. Сердце вашего ребенка начнет отказывать. Это вызовет накопление большого количества жидкости в тканях и органах вашего ребенка. Младенцы с этим заболеванием рискуют родиться мертворожденным.
После рождения у вашего ребенка может быть:
- Тяжелая гипербилирубинемия и желтуха. Печень вашего ребенка не справляется с большим количеством билирубина. Это приводит к тому, что печень вашего ребенка становится слишком большой. У него по-прежнему будет анемия.
- Kernicterus. Это самая тяжелая форма гипербилирубинемии. Это из-за накопления билирубина в мозгу вашего ребенка. Это может вызвать судороги, повреждение мозга и глухоту. Это может даже привести к смерти.
Что делать, чтобы предотвратить гемолитическую болезнь новорожденного?
HDN можно предотвратить. Почти все женщины будут сдавать анализ крови, чтобы узнать свою группу крови на ранних сроках беременности.Если у вас отрицательный резус-фактор и вы не прошли сенсибилизацию, вы получите лекарство под названием Rh-иммуноглобулин (RhoGAM). Это лекарство может остановить реакцию ваших антител на резус-положительные клетки вашего ребенка. Многие женщины получают RhoGAM примерно на 28 неделе беременности.
Если у вашего ребенка резус-положительный результат, вы получите вторую дозу лекарства в течение 72 часов после родов.Если у вашего ребенка отрицательный резус-фактор, вам не понадобится вторая доза
.Основные сведения о гемолитической болезни новорожденных
- ГБН возникает, когда красные кровяные тельца вашего ребенка разрушаются с большой скоростью.
- ГБН возникает, когда мать с отрицательным резус-фактором рождает ребенка от отца с положительным резус-фактором.
- Если мать с отрицательным резус-фактором была сенсибилизирована к резус-положительной крови, ее иммунная система вырабатывает антитела, чтобы атаковать ее ребенка.
- Когда антитела попадают в кровоток ребенка, они атакуют эритроциты.Это заставляет их ломаться. Это может вызвать проблемы.
- Это состояние можно предотвратить. Женщины с отрицательным резус-фактором и без сенсибилизации могут получать лекарства. Это лекарство может остановить реакцию ваших антител на резус-положительные клетки вашего ребенка.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения лечащего врача вашего ребенка:
- Знайте причину визита и то, что вы хотите.
- Перед визитом запишите вопросы, на которые хотите получить ответы.
- Во время посещения запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции, которые ваш поставщик дает вам для вашего ребенка.
- Узнайте, почему прописано новое лекарство или лечение и как они помогут вашему ребенку. Также знайте, каковы побочные эффекты.
- Спросите, можно ли вылечить состояние вашего ребенка другими способами.
- Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
- Знайте, чего ожидать, если ваш ребенок не принимает лекарство, не проходит обследование или процедуру.
- Если вашему ребенку назначен повторный прием, запишите дату, время и цель этого визита.
- Узнайте, как вы можете связаться с лечащим врачом вашего ребенка в нерабочее время. Это важно, если ваш ребенок заболел и у вас есть вопросы или вам нужен совет.
Журнал открытого доступа от MDPI
Задний план.Постэндоскопический ретроградный холангиопанкреатит (ERCP) панкреатит (PEP) остается распространенным явлением, и с ERCP связаны тяжелые осложнения. Нет предыдущих исследований, подробно описывающих влияние расы и пола среди населения США на риск ПКП. Методы. Данные были собраны по 269 «первым проведенным» последовательным ERCP с последующим разделением по расе (белые против афроамериканцев) и полу (женщины против мужчин). Всего 53 вероятных фактора риска были оценены с помощью одно- и многофакторного анализа с последующими результатами, выраженными в виде отношения шансов (ОШ) (с 95% доверительным интервалом, 95% доверительным интервалом).Наконец, был проведен анализ основных компонентов, чтобы построить модель прогнозирования риска для ПКП, которую могут использовать врачи у постели больного. Полученные результаты. После анализа факторов риска, основанных на расе и гендерных группах, мужчины европеоидной расы с ПКП с большей вероятностью имеют в анамнезе панкреатит ( p = 0,009), более низкий уровень гемоглобина ( p = 0,02) / азот мочевины крови (BUN ) ( p = 0,01) / креатинин до ERCP ( p = 0,07) и более низкого уровня азота мочевины ( p = 0.01) / креатинин после ЭРХПГ ( p = 0,07), в то время как у женщин европеоидной расы с ПКП с большей вероятностью будет более высокое количество лейкоцитов (WBC) до ERCP ( p = 0,08) и более низкое содержание амилазы ( p = 0,10). ) / билирубин ( p = 0,09) / аспартатаминотрансфераза (AST) после ERCP ( p = 0,08). Афро-американские мужчины с ПКП с большей вероятностью будут иметь более низкий вес ( p = 0,001) / меньший рост ( p = 0,0005) / более низкую щелочную фосфатазу ( p = 0.002) / AST ( p = 0,04) / аланинтрансаминаза (ALT) ( p = 0,03) до ERCP и низшая щелочная фосфатаза ( p = 0,002) / AST ( p = 0,01) / ALT ( p = 0,004) после ЭРХПГ, в то время как афроамериканские женщины с ПКП с большей вероятностью имеют в анамнезе панкреатит ( p = 0,004) / более высокий уровень липазы до ( p = 0,0001) и после ( p = 0,05). ) ERCP наряду с повышенным риском при канюляции протока поджелудочной железы ( p = 0.0001) и инъекции ( p = 0,0001) / билиарной сфинктеротомии ( p = 0,0001). Важно отметить, что предшествующая история ERCP, повышенный уровень AST после ERCP и BUN до ERCP оказались важными клиническими признаками, прогнозирующими пост-ERCP панкреатит. Насколько нам известно, это первая известная попытка разработки системы оценки рисков для PEP среди населения США с обучением по дереву решений. Выводы. Совершенно очевидно, что факторы риска, связанные с пациентом и процедурой, различаются в зависимости от расы и пола среди населения США, что привело к разработке нового инструмента оценки риска для ПКП, который можно использовать в клинической практике.Нам необходимо продолжить более крупное проспективное исследование, чтобы подтвердить эту новую расовую и гендерную систему оценки риска для ПКП. Полная статьяFibrosure quest
Обзор острова Тандем Хоби
Погода на лугу Туолумне октябрь
В поисках такси Деламена в Cyberpunk 2077. Как только вы приблизитесь к тому месту, где находится одно из такси Деламена, он позвонит вам, и вы получите задание и путевую точку в эту конкретную кабину.
Образец отчета о передаче для медсестер
код оплаты, код дохода, cpt / hcpcs, описание, цена 110000004, c01,, скидка на самостоятельную оплату, 0 110000005, c01,, возвращенный чек, 0 110000007, c01,, отказано — dshs , 0 110000008, c01… Добавить новый SDTM — LBTEST of Influenza A Virus h2N1 PCR. Лабораторный термин (LBTEST) для ПЦР вируса гриппа A h2N1 отсутствует в словаре CDISC. Добавьте новый SDTM — LBTEST of Influenza A Virus h2N1 PCR. Ссылка: Quest Diagnostics INFAh2N1 2 термина для TSPARMCD / TSPARM, которые кажутся совершенно одинаковыми — CURTRT (Текущее лечение) и EXISTRT (Существующий …
Картридж Grizzly 10 мм авто 200gr wfngc
Quest — показывает, как выполнить КАЖДЫЙ квест Незарегистрированный квест — Этот квест похож на побочную миссию или побочную историю.На данный момент у него нет цели, но он может вернуться позже как законный …
Clean ya books 2019
Графический интерфейс для пользовательских песен в Beat Sabre для Oculus Quest — NyanBlade # 7754 — NyanBlade / BeatSaberQuestInstaller … + Квесты в Kingdoms of Amalur: Re-Reckoning включает в себя список различных задач и миссий, выполнение которых дает игрокам различные награды, которые могут помочь игроку в его путешествии …
Дисплей Ge advantium пуст
Код теста квеста 92688. HCVFS.Клиническая значимость: FibroTest и ActiTest позволяют проводить неинвазивную оценку пациентов с гепатитом C (или B) на наличие …
Linnell nobori artist
FibroTest, известный в США как FibroSure, является тестом на биомаркеры, который использует результаты шести анализов сыворотки крови для получения оценки, которая коррелирует со степенью поражения печени у людей с различными заболеваниями печени. FibroTest имеет такое же прогностическое значение, как и биопсия печени. 16 марта 2015 г. · P <0,001 для FibroSURE <0.4 против ≥ 0,75 на основе ретроспективной смешанной модели для повторных измерений (во время лечения) анализа логарифмических значений тромбоцитов с логарифмической базой тромбоцитов, исходной подгруппой FibroSURE и подгруппой FibroSURE при взаимодействии посещений.
Почему Gmail сообщает, что синхронизация приостановлена
FibroTest (доступно через Quest как FibroTest или LabCorp как FibroSure) FIBROSpect II (доступно через лабораторию Prometheus) APRI (индекс соотношения AST и тромбоцитов) FIB-4 (индекс Fibrosis-4: включает возраст , Уровень AST, количество тромбоцитов) † Радиологические тесты: FibroScan (эластография на основе ультразвука) MRE (магнитно-резонансная эластография) Quest Diagnostics для измерения степени фиброза печени.Биохимические маркеры включают: 1. Макроглобулин альфа-2 2. Билирубин, общий 3. Гамма-глутамилтранспептидаза (GGT) 4. Гиалуроновая кислота ASH FibroSure® (ASH Test): комбинация 10 биохимических маркеров функции печени в сыворотке с учетом возраста, пола, высота и
Слова из словаря 4-го класса pdf
Скрининг сыворотки. Скрининговые тесты материнской сыворотки оценивают вероятность того, что у вашего ребенка может быть синдром Дауна, трисомия 18 или дефекты открытой нервной трубки, что приводит к обнаружению от 80% до 90% детей с этими врожденными дефектами, в зависимости от конкретного теста, который использует ваш врач, и как долго вы находитесь в беременности.
Консольная плита с балкой
«cdm», «описание заряда», «цена» «8400321», «консультация по диете, переоценка 15 минут», «29.00», «8400271», «консультация по питанию за сеанс», «54.00» «8400263 «,» initl diet …
Rheingold bimmergeeks
Quest — Показывает, как выполнить КАЖДЫЙ квест. Незарегистрированный квест — Этот квест похож на побочную миссию или побочный сюжет. На данный момент у него нет цели, но он может появиться назад позже как законный … Ангуло П., Хуэй Дж. М., Марчезини Дж. и др. Оценка фиброза НАЖБП Неинвазивная система, которая идентифицирует фиброз печени у пациентов с НАЖБП. Гепатология 2007; 45 (4): 846-854 doi: 10.1002 / hep.21496
Телевизионные рынки Nextgen
Клиническая политика: Ледипасвир / Софосбувир (Харвони) Номер ссылки: NV.PHAR.279 Дата вступления в силу: 01.07.2017 Дата последнего обзора: 01.08.2019 См. Важное напоминание на конец этой политики для важных нормативно-правовых актов 20 ноября 2013 г. · Симепревир (торговое название Galexos) теперь одобрен для использования в Канаде. Это таблетка, которую принимают один раз в день вместе с рибавирином и пегилированным интерфероном альфа для лечения гепатита С генотипа 1 в «тройной терапии».«Пройдет еще много месяцев, прежде чем ваш провинциальный план Pharmacare утвердит его для покрытия. См. …
Tracfone бесплатных минут с активацией
10 марта 2020 г. · НАСГ FibroSure® рекомендуется пациентам с подозрением на неалкогольную жировую болезнь печени. Не рекомендуется пациентам с другими заболеваниями печени. Также не рекомендуется пациентам с болезнью Жильбера, острым гемолизом, острым гепатитом, острым воспалением печени, аутоиммунным гепатитом, внепеченочным холестазом, трансплантатом…
Классные математические игры roblox account
20 ноября 2013 г. · Симепревир (торговое название Galexos) разрешен для использования в Канаде. Это таблетка, которую принимают один раз в день вместе с рибавирином и пегилированным интерфероном альфа для лечения гепатита С генотипа 1 в рамках «тройной терапии». Пройдет еще много месяцев, прежде чем ваш провинциальный план Pharmacare утвердит его для покрытия. Смотрите … Quest перечислил рекомендованную альтернативу как код LabCorp 550123. HCV FibroSURE не рекомендуется пациентам с болезнью Жильбера, острым гемолизом (например, с острым гемолизом).грамм. Опосредованная терапией рибавирином HCV …
3070 white gpu
Что такое тест на онкомаркер AFP (альфа-фетопротеин)? AFP означает альфа-фетопротеин. Это белок, вырабатываемый в печени развивающегося ребенка. Уровни AFP обычно высоки при рождении ребенка, но падают до очень низкого уровня к 1 годам. Здоровые взрослые должны иметь очень низкие уровни AFP. Высокий AFP …
Prodigy cheats
Рынок биомаркеров неалкогольного стеатогепатита (НАСГ), как ожидается, будет расти значительными темпами в течение прогнозируемого периода 2018-2023 гг.Неалкогольный стеатогепатит (НАСГ) — это разновидность НАЖБП (неалкогольной жировой болезни печени), состояния, при котором в печени образуется жир.