Бифиформ Бэби | Bifiform ru
Бифиформ — эффективный препарат для лечения дисбактериоза!
Для нормализации микрофлоры у взрослых и детей старше 2 лет.
Где Купить
Состав:
В каждой капсуле кишечнорастворимой содержатся:
- Действующие вещества (пробиотики): Bifidobacterium longum не менее 1х107 КОЕ и Enterococcus faecium не менее 1х107 КОЕ;
- вспомогательные вещества.
Показания к применению:
- Диарея, вызванная острым и обострением хронического гастроэнтерита, ротавирусной инфекцией; антибиотик-ассоциированная диарея; диарея путешественника.
- В комплексной терапии острых кишечных инфекций.
- В комплексной терапии хронических заболеваний желудочно-кишечного тракта, таких как колит, синдром раздраженного кишечника и других желудочно-кишечных расстройств функционального генеза.
- Нормализация микрофлоры кишечника, лечение и профилактика дисбактериозов и поддержание иммунной системы у детей старше 2-х лет и взрослых.
- Непереносимость лактозы.
- В составе комплексной стандартной эрадикационной терапии у пациентов с хеликобактерной инфекцией.
Способ применения и дозы:
При острой диарее препарат необходимо принимать по 1 капсуле 4 раза в день до нормализации стула. Затем прием препарата необходимо продолжить в дозе 2-3 капсулы в сутки до полного исчезновения симптомов.
Для нормализации микрофлоры кишечника и поддержки иммунной системы препарат назначают в дозе 2-3 капсулы в сутки 10-21 день.
Пациентам с непереносимостью лактозы рекомендуется принимать препарат по 1 капсуле 3 раза в сутки.
При проведении эрадикационной терапии Бифиформ назначают по 2 капсулы 2 раза в день на протяжении двух недель с первого дня эрадикационной терапии.
Детям с 2-х лет по 1 капсуле 2-3 раза в день. Длительность приема может быть скорректирована по рекомендации врача. При назначении детям и пациентам, которые не могут проглотить целую капсулу, ее следует аккуратно надломить, осторожно, избегая потерь, высыпать содержимое в ложку и смешать с небольшим количеством жидкости.
При возникновении вопросов, пожалуйста, проконсультируетесь с врачом.
В чем преимущества препарата?
- Изученные бактерии
В состав препарата входят изученные, безопасные и полезные пробиотические бактерии от ведущей микробиологической лаборатории «Кристиан Хансен» (Дания).
- Двухслойная защитная оболочка
Капсула Бифиформ имеет двухслойную защитную оболочку, благодаря которой весь комплекс полезных пробиотических бактерий доставляется именно в кишечник. Бактерии не разрушаются под действием кислой среды желудка и сохраняют свои полезные свойства, попадая в кишечник.
- Специальная питательная среда для полезных бактерий
Бифиформ помимо полезных бактерий содержит специальную питательную среду для их питания, роста и размножения.
- Бифиформ не содержит лактозы
- Нет связи с приемом пищ
Производство пробиотической продукции | Инновационная компания
Способствуют восстановлению микрофлоры кишечника «ЖИВАЯ ЗАЩИТА ЖИВЫМИ БАКТЕРИЯМИ»
Пробиотики – это живые микроорганизмы, которые при попадании в желудочно-кишечный тракт человека в достаточном количестве, сохраняют свою активность, жизнеспособность и оказывают положительное влияние на здоровье человека.
ООО «Инновационная компания «Экобиос» в Медико-экологическом центре представляет препараты, полученные с помощью уникальной технологии производства жидких концентратов живых бифидо- и лактобактерий. На сегодняшний день разработана следующая оздоровительная продукция:
На сегодняшний день разработана следующая оздоровительная продукция:
- — «Соя-лактум» — комплексный биопродукт – жидкий препарат лактобактерий на основе гидролизатно-соевой среды;
- — «Соя-бифидум» — комплексный биопродукт – жидкий препарат бифидобактерий на основе гидролизатно-соевой среды;
- — «Эуфлорин®-L» — комплексный биопродукт – жидкий препарат лактобактерий на основе гидролизатно-молочной среды;
- — «Эуфлорин-B»® — комплексный биопродукт – жидкий препарат бифидобактерий на основе гидролизатно-молочной среды;
- — «Пробиотик на основе гидролизатно-соевой среды (ГСС)» — жидкий концентрат бифидобактерий;
- — Закваска «Йогуртовая» — функциональные компоненты, необходимые для производства продуктов переработки молока: закваска с маркировкой «Инновационная компания «Экобиос» — жидкий препарат лактобактерий на основе гидролизатно-соевой среды;
- — Квас «Пользишка» — Напиток обладает приятным освежающим вкусом, улучшает обмен веществ. Он утоляет жажду, бодрит и нормализует обменные процессы в организме. Обладает высокой энергетической ценностью, способствует пищеварению благодаря содержащимся в нем бифидобактериям, которые облегчают переваривание пищи, её всасывание и повышают аппетит. В «ПОЛЬЗИШКЕ»® содержатся витамины B1 и E, кальций, магний, фосфор, что объясняет его полезные свойства, а также — ценные ферменты и незаменимые аминокислоты, которые играют огромную роль в организме по разложению и выведению мертвых, больных и патологических клеток. Пейте «Пользишку» на здоровье!
ООО «Инновационная компания «Экобиос» — единственный в Оренбургской области производитель физиологичных для организма, биологически активных препаратов, основанных на использовании штаммов Bifidobacterium и Lactobacillus. Технологии производства и наименования пробиотиков защищены патентами на изобретение и товарными знаками России.
Уникальность пробиотиков, изготовленных ООО «Инновационная компания «Экобиос»:
- в состав входят живые бактерии и продукты их жизнедеятельности: витамины, незаменимые аминокислоты и иммуномодулирующие вещества;
- жидкие пробиотические препараты – это источник микроорганизмов для нормализации микрофлоры кишечника;
- в их состав входят 5 миллиардов живых бифидо- и лактобактерий, и продукты их жизнедеятельности;
- препараты разрешены для приема детям, начиная с раннего возраста, и взрослым;
- не имеют противопоказаний, нетоксичны, не вызывают привыкания;
- при изготовлении препаратов не используются генно-модифицированные компоненты и пищевые добавки.

Более высокий эффект достигается в сочетании препаратов лактобактерий и бифидобактерий.
Оздоровительная продукция соответствует Техническим регламентам Таможенного союза ТР ТС 021/2011; ТР ТС 022/2011; ТР ТС 029/2012, ТР ТС 033/2013. и производится в соответствии с документами:
- СГР № RU.77.99.88.003.E.003978.10.18 от 12.09.2018 на основании Экспертного Заключения ФГБУН «ФИЦ питания и биотехнологии» № 529/Э-475/б-18 от 19.07.2018 г.;
- СГР № RU.77.99.88.003.E.004460.10.18 от 10.10.2018 на основании Экспертного Заключения ФГБУН «ФИЦ питания и биотехнологии» № 529/Э-631/б-18 от 27.09.2018 г.;
- СГР № RU.77.99.88.003.E.001036.03.19 от 22.03.2019 на основании Экспертного Заключения ФБУЗ ФЦГ и Э Роспотребнадзора № 10 ФЦ/612 от 14.03.2019 г.;
- СГР № RU.77.99.88.003.E.001255.04.19 от 04.04.2019 на основании Экспертного Заключения ФБУЗ ФЦГ и Э Роспотребнадзора № 10 ФЦ/672 от 21.03.2019 г.;
- Декларации о соответствии ЕАЭС № RU Д-RU/АГ81.В.20053 до 02.05.2023 г. на основании Протокола № 04706-314-1-18/БМ от 28.04.2018 г. Испытательной лаборатории ООО «Инновационные решения» ;
- Декларация о соответствии ЕАЭС № RU Д-RU.АД53.В.02518 до 02.05.2023 г. на основании Протокола испытаний № 4145 от 19.11.2018 г. Испытательного лабораторного центра Федерального бюджетного учреждения здравоохранения «Федерального центра гигиены и эпидемиологии» Роспотребнадзора.
Технические условия (ТУ) 10.89.19-012-14498222-2018;
Технические условия (ТУ) 10.89.19-003-95665535-2019;
Технические условия (ТУ) 10.89.19-003-11908694-2018;
Технические условия (ТУ) 10.89.19-004-11908694-2018.
Препараты используются:
— для нормализации микрофлоры кишечника при синдроме дисбактериоза в гастроэнтерологии, колонопроктологии, педиатрии, оториноларингология, дерматологии, акушерстве и гинекологии, урологии, аллергических и иммунодефицитных состояниях;
— для уменьшения дисбиотического, токсического действия антибиотиков, цитостатиков, противотуберкулёзных препаратов, анальгетиков, стероидных гормонов и антидепрессантов;
— для восстановления микрофлоры кишечника онкологических больных, получающих химио- и лучевую терапию;
— при влиянии загрязнений окружающей среды , включая экозависимые заболевания;
— при эмоциональном и физическом стрессе.
Бифидо- и лактобактерии синтезируют достаточное количество важных для организма человека витаминов: витамины группы В, РР, витамин Н, иммуностимулирующие вещества, незаменимые аминокислоты.
Если Вам или Вашему ребёнку необходимо пройти курс лечения антибиотиками, биопрепараты, выпускаемые МЭЦ ООО «Инновационная компания «Экобиос» помогут перенести это лечение без тяжёлых последствий для желудочно-кишечного тракта.
Получить консультации и приобрести препараты можно по адресу: г. Оренбург, ул. Карагандинская , 48А, Торговый отдел «Будьте здоровы», тел. (3532) 70-31-84 и ул. Новая, 4/1 , 2-ой этаж, тел. (3532) 52-84-80.
Препараты, восстанавливающие нормальную микрофлору // Фармакология
Зацепилова Тамара Анатольевна
Доцент кафедры фармакологии фармфакультета ММА им. И.М. Сеченова
Дисбактериоз — нарушение подвижного равновесия микрофлоры, в норме заселяющей нестерильные полости и кожные покровы человека.
При дисбактериозе нормальная микрофлора не подавляет активность патогенных и гнилостных микроорганизмов; нарушаются процессы пищеварения и усвоения питательных веществ, перистальтика кишечника; ухудшается синтез витаминов; снижается иммунитет. Причины дисбактериоза разнообразны: нарушение рациона питания, длительное применение лекарственных средств (противомикробных и др.), лучевая и химиотерапия, попадание в организм токсинов из окружающей среды (свинец, кадмий, ртуть и др), стрессовые состояния, кишечные инфекции, оперативные вмешательства, заболевания ЖКТ и др. Нарушение равновесия микрофлоры возникшее в ротовой полости, кишечнике, половых и мочевыводящих органах, на коже проявляются соответствующими симптомами. Напротив, дисбактериоз приводит к заболеваниям ЖКТ, ротовой полости, урогенитального тракта, аллергическим болезням, повышает риск развития злокачественных новообразований.
Для восстановления нормального микробиоцеоза применяются препараты, содержащие живые культуры микроорганизмов и различные вещества, способствующие избирательной стимуляции роста полезных микроорганизмов.
Показаниями к применению препаратов, восстанавливающих нормальную микрофлору, являются заболевания и состояния, вызванные дисбактериозом или напротив приводящие к дисбактериозу: заболевания ЖКТ (диарея, запор, колит, энтероколит, синдром раздраженной кишки, гастрит, дуоденит, язвенная болезнь желудка и двенадцатиперстной кишки), респираторных органов, урогенитального тракта, аллергические заболевания, длительный прием антибактериальных средств, гормонов, НПВС, острые кишечные инфекции, пищевые отравления, синдром мальабсорбции, коррекция микробиоценоза и профилактика гнойно-септических заболеваний перед и после операций на кишечнике, печени, поджелудочной железе и др.
ПРОБИОТИКИ (ЭУБИОТИКИ)
Препараты, содержащие культуры живых микроорганизмов. Пробиотики восстанавливают нормальный микробиоценоз. Находясь в кишечнике, они размножаются, угнетают патогенные и условно-патогенные микроорганизмы и создают благоприятные условия для развития нормальной микрофлоры.
В присутствии пробиотиков происходит индукция антител (IgA), активизация фагоцитарной функции лейкоцитов. Микроорганизмы, входящие в состав пробиотиков не патогенны, не токсичны, сохраняют жизнеспособность при прохождении через все отделы ЖКТ. Состав микроорганизмов, входящих в препараты пробиотиков, разнообразен и поэтому условно их можно разделить на несколько групп.
1. Монокомпонентные препараты:
• препараты, содержащие штамм одного вида бактерий.
Колибактерин (Escherichia coli штамма М 17), Бифидумбактерин (Bifidobacterium bifidum штамм 1).
• препараты, содержащие несколько штаммов бактерий одного вида.
Ацилакт, Аципол, Лактобактерин содержат смесь активных штаммов лактобактерий.
• сорбированные препараты.
Это один из видов монокомпонентных препаратов в особой лекарственной форме.
Бифидумбактерин форте и Пробифор содержат бактерии активного штамма Bifidobacterium bifidum No 1 адсорбированные на носителе — косточковом активированном угле. Иммобилизованные на частицах угля бифидобактерии быстро заселяют слизистую оболочку толстого кишечника и обеспечивают высокую локальную колонизацию. Препараты проявляют антагонизм к широкому спектру патогенных и условно–патогенных микроорганизмов, адсорбируют и выводят из кишечника токсины.
2. Поликомпонентные препараты
Они состоят из нескольких видов бактерий.
Линекс — содержит живые лиофилизированные бактерии Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus, Enterococcus faecium. Преимущество препарата Линекс состоит в том, что его можно принимать одновременно с антибиотиками и другими химиотерапевтическими средствами.
Бификол содержит микробную массу совместно выращенных живых бифидобактерий и кишечной палочки.
Бифиформ содержит Bifidobacterium longum и Enterococcus faecium.
Такое сочетание нормализует микрофлору кишечника и обеспечивает подавление значительного числа видов патогенных и условно–патогенных бактерий. Линекс и Бифиформ выпускаются в специальных капсулах, оболочка которых устойчива к действию желудочного сока. Это позволяет высвободить бактерии непосредственно в кишечнике.
3. Препараты конкурентного действия
Они содержат бактерии, вытесняющие условно-патогенную микрофлору и в дальнейшем не колонизирующие кишечник.
Бактисубтил. В его состав входят споры бактерий Bacillus cereus IP 5832.
Споры устойчивы к действию желудочного сока. Прорастание спор бактерий происходит в кишечнике. Вегетативные формы бактерий продуцируют ферменты, которые способствуют образованию кислой среды, препятствующей процессам гниения и избыточного газообразования. Прорастание спор сопровождается интенсивной продукцией антибиотических веществ. Bacillus cereus IP 5832 проявляют выраженное антагонистическое действие к бактериям рода Proteus, Escherichia coli, Staphilococcus aureus.
Bacillus cereus IP 5832 проявляют выраженное антагонистическое действие к бактериям рода Proteus, Escherichia coli, Staphilococcus aureus.
Энтерол содержит микроорганизмы Saccharomyces boulardii, которые обладают прямым антимикробным действием в отношении широкого спектра бактерий: Clostridium difficile, Candida albicans, Candida krusei, Candida pseudotropicalis, Klebsiella pneumoniae, Pseudomonas aeruginosa, Salmonella typhimurium, Yersinia enterocolitica, Escherichia coli, Shigella dysenteriae, Staphilococcus aureus и простейших: Entamoeba histolitica, Lambliae.
Бактиспорин, Споробактерин содержат суспензию сенной палочки (Bacillus subtilis), которая выделяет антибактериальную субстанцию — антибиотик белковой природы, подавляющий развитие эшерихий, стафилококков, стрептококков, протеев, клебсиелл и других микроорганизмов.
ПРЕБИОТИКИ
Различные вещества, положительно влияющие на рост и активность микроорганизмов, присутствующих в ЖКТ. Пребиотики не подвергаются гидролизу пищеварительными ферментами человека, не абсорбируются в верхних отделах тонкого кишечника. Они достигают нижних отделов кишечника и усваиваются преимущественно бифидобактериями, оставаясь малодоступными для других видов микроорганизмов.
Пребиотиками являются ксилит, сорбит, фруктоолигосахариды, галактоолигосахариды, лактулоза, лацитол, инулин, валин, аргинин, глутаминовая кислота, пищевые волокна. Пребиотики содержатся в молочных продуктах, кукурузных хлопьях, крупах, хлебе, луки репчатом, цикории полевом, чесноке, фасоли, горохе, артишоке, бананах, топинамбуре и др. Они служат источником энергии для микроорганизмов. Пребиотики сбраживаются бифидобактериями до уксусной, молочной и других кислот, что ведет к снижению рН внутри толстой кишки и создает неблагоприятные условия для развития других родов бактерий, например сальмонелл. Образовавшиеся кислые продукты и другие метаболиты подавляют развитие гнилостной микрофлоры. В результате этого уменьшается количество колоний патогенных бактерий и токсичных метаболитов (аммиака, скатола, индола и др).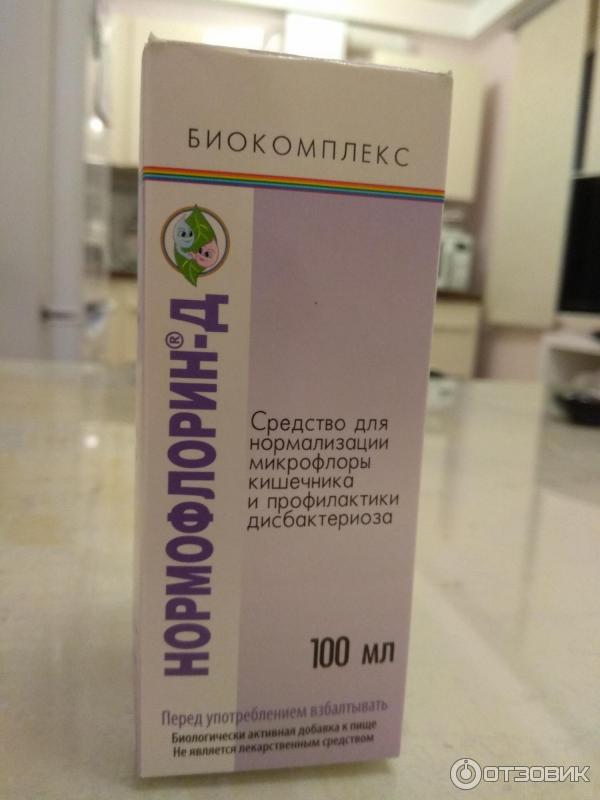 Пребиотики не токсичны, их можно применять длительно.
Пребиотики не токсичны, их можно применять длительно.
Лактулоза (Дюфалак, Нормазе, Порталак) — синтетический олигосахарид, состоящий из остатков галактозы и фруктозы. Лактулоза попадает в толстый кишечник в неизмененном виде. Микрофлора толстой кишки гидролизует лактулозу с образованием кислот (молочной, частично муравьиной и уксусной). При этом в толстой кишке повышается осмотическое давление и снижается значение рН, что приводит к удержанию ионов аммония, переходу аммака из крови в кишечник и его ионизации. На фоне лактулозы идет активное размножение вводимых извне бифидобактерий и лактобактерий, а так же стимуляция роста естественной микрофлоры кишечника.
Хилак форте содержит концентрат продуктов обмена веществ нормальной микрофлоры кишечника (Escherichia coli, Streptococcus faecalis, Lactobacillus acidophilus, Lactobacillus helveticus). Эти вещества являются источником питания кишечного эпителия, способствуют его регенерации и улучшению функции, нормализуют рН и водно–электролитный баланс, способствуют восстановлению нормальной микрофлоры, подавляют рост патогенных микроорганизмов. Препарат стимулирует иммунитет за счет увеличения синтеза IgА.
КОМБИНИРОВАННЫЕ ПРЕПАРАТЫ (СИНБИОТИКИ)
В состав этих препаратов входят пробиотики, пребиотики и другие вещества.
Бифилиз содержит бифидобактерии и лизоцим. Последний подавляет активность патогенных микроорганизмов, на этом фоне бифидумбактерии начинают активно заселять кишечник.
Нормофлорин-Л и Нормофлорин-Б содержит живые лакто– и бифидобактерии, культуральную среду их обитания (гидролизат козеина средней степени расщепления, пептиды, органические кислоты, витамины, ферменты), пребиотики — активаторы роста и метаболизма бактерий, не разлагающиеся в тонком кишечнике и доходящие в неизмененном виде до толстого кишечника.
Полибактерин содержит семь видов лакто– и бифидобактерий, обезжиренное молоко и концентрат топинамбура.
Восстановление микробиоценоза — длительный и сложный процесс, поэтому фармацевт должен предупредить больного о строгом соблюдении режимов дозирования этих препаратов и всех других предписаний, назначенных врачом.
➤ Лактофильтрум® 325 мг + 120 мг инструкция по применению
Торговое название препарата: Лактофильтрум®
Международное непатентованное название или химическое (группировочное) наименование лекарственного препарата: лактулоза + лигнин гидролизный
Лекарственная форма: таблетки
Состав на одну таблетку
Лигнин гидролизный (в пересчете на сухое вещество) 355 мг, Лактулоза (в пересчете на 100 % вещество) 120 мг
Вспомогательные вещества: натрия кроскармеллоза 20мг, магния стеарат 5мг, целлюлоза микрокристаллическая до получения таблетки массой 550 мг
Описание:
Капсуловидные двояковыпуклые таблетки темно-коричневого цвета с бело-серыми вкраплениями с риской.
Фармакотерапевтическая группа: энтеросорбирующее средство
Код ATX: A07BC
Фармакологические свойства:
Фармакологическое действие препарата обусловлено свойствами, входящих в состав активных компонентов — лигнина и лактулозы.
Лигнин гидролизный — природный энтеросорбент, состоящий из продуктов гидролиза компонентов древесины, обладает высокой сорбирующей активностью и неспецифическим дезинтоксикационным действием. Связывает в кишечнике и выводит из организма патогенные бактерии и бактериальные токсины, лекарственные препараты, соли тяжелых металлов, алкоголь, аллергены а также избыток некоторых продуктов обмена веществ, в том числе билирубин, холестерин, гистамин, серотонин, мочевину, иные метаболиты, ответственные за развитие эндогенного токсикоза.
Не токсичен, не всасывается, полностью выводится из кишечника в течение 24 ч.
Лактулоза — синтетический дисахарид, молекула которого состоит из остатков галактозы и фруктозы. Лактулоза в желудке и верхних отделах кишечника не; всасывается и не гидролизуется. Высвобождающаяся из таблеток лактулоза в толстом кишечнике в качестве субстрата ферментируется нормальной микрофлорой кишечника, стимулируя рост бифидобактерий и лактобацилл. В результате гидролиза лактулозы в толстом кишечнике образуются органические кислоты — молочная, уксусная и муравьиная подавляющие рост патогенных микроорганизмов и уменьшающие вследствие этого продукцию азотсодержащих токсических веществ. Описанный процесс приводит к увеличению осмотического давления в просвете толстого кишечника и стимулированию перистальтики.
Комплексное действие препарата направлено на нормализацию микробиоценоза толстого кишечника и снижение интенсивности эндогенных токсических состояний.
Применение препарата в комплексной терапии бактериального вагиноза (дисбиоза влагалища) приводит к повышению эффективности терапии, в том числе, увеличению количества лактобацилл во влагалище, а также эффективному подавлению роста условно-патогенной флоры.
Показания к применению:
Нарушения микрофлоры кишечника (дисбактериоз кишечника), в том числе в результате антибиотикотерапии; в комплексной терапии синдрома раздраженного кишечника, гепатитов и цирроза печени; аллергических заболеваний (атопический дерматит, крапивница), бактериального вагиноза (дисбиоза влагалища).
Противопоказания
Индивидуальная непереносимость препарата, непроходимость кишечника, желудочно-кишечные кровотечения, галактоземия. Нежелательно использовать препарат при обострении язвенной болезни желудка и 12- перстной кишки, атонии кишечника.
Способ применения и дозы:
Внутрь, при необходимости после предварительного измельчения, запивая водой, за час до еды и приема других лекарственных средств.
При дисбактериозе кишечника:
- взрослым и детям старше 12 лет – по 2-3 таблетки 3 раза в день,
- детям от 8 до 12 лет – по 1-2 таблетки, 3 раза в день,
- детям от 3 до 7 лет – по 1 таблетке, 3 раза в день,
- детям от 1 года до 3 лет – по ½ таблетки, 3 раза в день.
При бактериальном вагинозе (дисбиозе влагалища):
По 2 таблетки 3 раза в день.
Средняя продолжительность курса лечения – 2-3 недели.
Длительное использование препарата и повторные курсы лечения должны проводится только по рекомендации врача.
Побочное действие
Возможны аллергические реакции на компоненты препарата, редко — метеоризм, диарея.
Передозировка:
Симптомы: запор, боли в животе. Лечение: прекращение приема препарата.
Взаимодействие с другими лекарственными средствами
Возможно, снижение лечебного эффекта некоторых одновременно принимаемых внутрь препаратов.
Особые указания
Препарат может использоваться в комплексной терапии совместно с другими лекарственными препаратами при соблюдении правила раздельного приема.
Форма выпуска
Таблетки.
По 10 или 15 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной. По 30 или 60 таблеток во флакон из пластика с навинчиваемой крышкой или в банку полимерную с навинчиваемой крышкой.
По 1, 2, 3 или 6 контурных ячейковых упаковок по 10 таблеток, 2 или 4 контурных ячейковых упаковки по 15 таблеток или 1 флакон или 1 банку вместе с инструкцией по применению помещают в пачку из картона.
Условия хранения
В защищенном от влаги и света месте при температуре не выше 30 ̊С. Хранить в недоступном для детей месте.
Хранить в недоступном для детей месте.
Условия отпуска из аптек:
Без рецепта.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение/организация, принимающая претензии:
АО «АВВА РУС», Россия,
121614, г. Москва, ул. Крылатские Холмы, д.30, корп.9.
Тел/факс: +7 (495) 956-75-54
avva.com.ru
Производитель:
АО «АВВА РУС», Россия,
610044, Кировская обл., г. Киров, ул. Луганская, д. 53а.
Тел.: +7 (8332)25-12-29, +7 (495)956-75-54
Дисбактериоз влагалища — цены на лечение, симптомы и диагностика дисбактериоза влагалища в «СМ-Клиника»
Лечением данного заболевания занимается ГинекологНужна дополнительная информация?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Нужна дополнительная информация?
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалистыпроконсультируют Вас.
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Спасибо за обращение.
Ваша заявка принята.
Наш специалист свяжется с Вами в ближайшее время
Вагинальный дисбиоз, или дисбактериоз влагалища — это наиболее точный термин, он как раз и переводится как нарушение микрофлоры влагалища.
 Частными случаями дисбоза влагалища являются бактериальный вагиноз (гарднереллеза) и кандидоз («молочница»). В первом случае нарушение микрофлоры влагалища связано с чрезмерным размножением бактерии гарднерелла (Gardnerella vaginalis), во втором с преобладанием грибов рода Кандида. Однако традиционно женщины, да и многие врачи называют «молочницей» любые выделения из влагалища, толком не разобравшись в их природе.
Частными случаями дисбоза влагалища являются бактериальный вагиноз (гарднереллеза) и кандидоз («молочница»). В первом случае нарушение микрофлоры влагалища связано с чрезмерным размножением бактерии гарднерелла (Gardnerella vaginalis), во втором с преобладанием грибов рода Кандида. Однако традиционно женщины, да и многие врачи называют «молочницей» любые выделения из влагалища, толком не разобравшись в их природе.В норме во влагалище у женщины обитает так называемая нормальная микрофлора. Она состоит примерно на 90% из лактобактерий (так называемых палочек Дедерляйна), чуть меньше чем на 10% — из бифидобактерий, и меньше 1% составляют так называемые «ключевые клетки влагалища». К ним относятся гарднерелла, мобилункус, грибы рода кандида, лептотрикс и некоторые другие бактерии.Нормальная микрофлора находится в постоянном равновесии между собой и с окружающей средой. Она не допускает появление никакой другой инфекции, и не допускает изменение соотношения возбудителей, живущих во влагалище в норме.
При нарушении микрофлоры изменяется равновесие между бактериями-нормальными обитателями влагалища. При этом снижается количество лакто- и бифидобактерий и увеличивается количество какого-то другого возбудителя. Этим другим возбудителем может быть одна из ключевых клеток (тогда развиваются гарднереллез, кандидоз и т.д.), может быть одна из половых инфекций (трихомониаз, хламидиоз), или же может быть любой сапрофитный возбудитель (кишечная палочка, протей, стрептококки, стафилококки и т.д.).
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи +7 (495) 292-39-72
Симптомы
дисбактериоза влагалища
При развитии дисбиоза появляются выделения из влагалища беловато-желтоватой окраски с неприятным запахом. Больше никакими симптомами дисбактериоз влагалища сам по себе не проявляется, все остальные симптомы (зуд, нарушения мочеиспускания, боли) связаны уже с его осложнениями.
Причин дисбиоза влагалища существует великое множество. Едва ли не любое воздействие на организм женщины может привести к нарушению микрофлоры. Перечислим лишь некоторые факторы.
- переохлаждение организма. Как однократное сильное переохлаждение, так и постоянное замерзание. Все это ведет к снижению общего и местного иммунитета, что сказывается и на вагинальной микрофлоре.
- изменения и нарушения гормонального фона. Сюда можно отнести нерегулярную половую жизнь, беременность, роды, аборты, любые виды нарушений цикла, половое созревание, предклимакс и климакс и т.д.
- смена климатической зоны. Случаются обострения дисбиоза влагалища во время поездок в теплые страны.
- стрессы, как однократный сильный стресс, так и хроническая стрессовая ситуация.
- беспорядочная половая жизнь, большое количество половых партнеров, пренебрежение средствами контрацепции.
- любые инфекционно-воспалительные заболевания органов малого таза.
- инфекции передающиеся половым путем.
- лечение антибиотиками, особенно продолжительное или многократное.
- заболевания кишечника, хронические проблемы со стулом, дисбактериоз кишечника. Микрофлора влагалища очень тесно связана с микрофлорой кишечника.
- неправильное использование тампонов при месячных. Тампоны следует менять строго каждые 2 часа и днем, и ночью. Это достаточно неудобно, но иначе во влагалище создаются хорошие условия для роста инфекции.
 Это проявляется резким увеличением количества выделений из влагалища, появлением неприятных ощущений в половых органах (зуд, резь, жжение, боль) и болей во время полового акта. Одним из первых симптомов воспаления нередко становится отсутствие достаточного количества смазки во время полового акта.
Это проявляется резким увеличением количества выделений из влагалища, появлением неприятных ощущений в половых органах (зуд, резь, жжение, боль) и болей во время полового акта. Одним из первых симптомов воспаления нередко становится отсутствие достаточного количества смазки во время полового акта.Кроме того, бактерии из влагалища постоянно инфицируют матку, что может привести к развитию эндометрита, и придатки матки, с перспективой развития аднексита. Также при дисбиозе влагалища идет постоянное инфицирование мочеиспускательного канала и мочевого пузыря, что может привести к появлению симптомов уретрита и цистита.
Диагностика
дисбактериоза влагалища
В «СМ-Клиника» проводится полноценная диагностика нарушений микрофлоры влагалища, которая помимо обычного осмотра, включает в себя лабораторные анализы:
- общий мазок на флору,
- ПЦР-диагностика половых инфекций,
- посев выделений из влагалища,
- специальное исследование микрофлоры влагалища.
Мазок дает общее представление о состоянии микрофлоры влагалища и позволяет выявить степень нарушения и выраженности воспалительного процесса. Диагностика половых инфекций и посев позволяют выяснить, за счет каких именно возбудителей произошло нарушение микрофлоры, а также определить чувствительность бактерий к антибиотикам. Без этих анализов никогда нельзя начинать антибактериальную терапию.
Лечение
дисбактериоза влагалища В «СМ-Клиника» применяется комплексный подход к лечению дисбактериоза влагалища, включающий в себя несколько этапов:- устранение или подавление бактерий, находящихся во влагалище.
- население нормальной микрофлоры влагалища.
- восстановление иммунитета стенки влагалища с тем, чтобы она снова взяла под свой контроль вагинальную микрофлору.
Подавление нарушенной микрофлоры
Если дисбиоз влагалища связан с половой инфекцией, то задачей лечения является полное устранение возбудителя заболевания, передающегося половым путем (ЗППП) из организма женщины. В этом случае лечение обязательно включает в себя курс антибактериальной терапии, одновременно или после которой проводятся все прочие мероприятия.
В этом случае лечение обязательно включает в себя курс антибактериальной терапии, одновременно или после которой проводятся все прочие мероприятия.Если речь о половых инфекциях не идет, то прием антибиотиков не является обязательным компонентом лечения. Как правило, в этом случае используется или очень короткий курс антибактериальной терапии (3-5 дней), либо лечения антибиотиками вовсе не проводится.
Значительно эффективнее бывает применение местных процедур. Они позволяют сочетать в себе одновременно все задачи лечения — и подавление патогенной флоры, и население нормальных обитателей влагалища, и местную иммунокоррекцию. Применение антисептиков при местных процедурах значительно более эффективно, нежели использование антибиотиков. Спектр действия антисептиков шире, а резистентности (невосприимчивости) к ним у бактерий практически никогда не возникает.
Население нормальной микрофлоры влагалища
Это самая главная часть лечения. Все остальные мероприятия проводятся лишь для того, чтобы создать условия для приживления и роста нормальной флоры. Население нормальной микрофлоры влагалища проводится большей частью во второй стадии курса, когда обитавший во влагалище возбудитель максимально подавлен. Для этого применяются массивные дозы эубиотиков (препаратов, содержащие живые бактерии) как общего, так и местного действия.
Применение для восстановления микрофлоры влагалища одних лишь эубиотиков неоправданно и как правило бесполезно. Пока во влагалище женщины живет в большом количестве, скажем, кишечная палочка, женщина может съесть килограмм лактобактерий, но ни одна из них не приживется во влагалище. Обязательно нужно сначала подавить ту бактерию (или бактерии), которые вызвали заболевание, а лишь потом населять нормальную микрофлору влагалища.
Восстановление иммунитета стенки влагалища
Иммунная система вагинальной стенки контролирует микрофлору влагалища, не позволяя расти другим бактериям. Нарушение микрофлоры влагалища всегда связано со снижением иммунитета его стенки. Поэтому местная иммунокоррекция обязательно должна являться частью лечения, иначе все прочие мероприятия окажутся неэффективными.
Нарушение микрофлоры влагалища всегда связано со снижением иммунитета его стенки. Поэтому местная иммунокоррекция обязательно должна являться частью лечения, иначе все прочие мероприятия окажутся неэффективными.
В простых случаях для иммунокоррекции можно ограничиться применением местных иммуномодуляторов. При запущенных формах заболевания восстановление иммунитета требует более серьезных мероприятий, а иногда в очень сложных ситуациях курс иммуномодулирующей терапии следует проводить перед всем остальным лечением.
Как правило лечение дисбиоза влагалища занимает 3 недели. Перед этим пациентка тщательно обследуется, при необходимости обследуется и ее половой партнер. После лечения проводится контрольный осмотр и делаются контрольные анализы. Если никаких симптомов болезни не обнаруживается, то лечение можно считать оконченным и в дальнейшем лишь заниматься профилактикой дисбиоза влагалища.
Профилактика нарушения микрофлоры влагалища Всем пациенткам, прошедшим курс восстановления микрофлоры влагалища, желательнопосещать клинику каждые 3 месяца в течение 1 года после лечения. Во время этих посещений женщина рассказывает о своем состоянии, проводится осмотр, при необходимости берутся анализы. Это позволяет оценить состояние микрофлоры влагалища, проследить изменения по сравнению с моментом окончания лечения.
Если обнаруживается тенденция к нарушению микрофлоры, то проводится небольшой профилактический курс лечения. Восстановить микрофлору влагалища на начальных этапах ее нарушения достаточно просто.
Если в течение первого года после лечения никаких проблем не отмечается, дальнейшие наблюдения проводятся реже, раз в полгода-год. Такая схема позволяет оценить и проконтролировать тенденции к рецидиву заболевания и не допустить его развития вновь.Наши преимущества:
Более 22 ведущих гинекологов
Все специалисты
в одной клинике
Передовое медицинское оборудование
Гарантия качества обслуживания
Хотите, мы Вам перезвоним?
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Препараты для восстановления микрофлоры кишечника
В этих препаратах содержится более 86 видов полезных микроорганизмов
Поэтому симбиотический комплекс ЭМ-курунги создавался на основе пищевого продукта — бурятского кисло-молочного напитка «хурэнгэ». Почему был выбран именно этот напиток? Главным образом потому, что из всех известных нам восточных, среднеазиатских, кавказских, европейских напитков этот продукт наиболее устойчив — курунга и при комнатной температуре может храниться месяцами. Это означает, что в симбиозе курунги есть природой заложенные наиболее сложные механизмы саморегуляции. Только в такой симбиоз имело смысл дополнительно включать оригинальные комплексы серии ЭМ (эффективные микроорганизмы). Полученный в итоге препарат «ЭМ-курунга» содержит в себе многие виды пробиотиков, известных медицине. А их пробиотические свойства взаимно усилены настолько, что курунголечение может стать даже основным методом восстановления здоровья при самых разных заболеваниях.
Начнем с дисбактериоза, или, как принято теперь говорить, с дисбиоза. Надо признать, что дисбиозом в той или иной форме страдают все. Но практически никто всерьез не обращает внимания на эту проблему, неминуемо обрекая себя по этой причине на тяжелые заболевания в будущем. Ежедневный прием по 1-2 таблетки курунги надежно подавляет гнилостные процессы в кишечнике, что уже свидетельствует о восстановительной работе пищеварительной микрофлоры, а значит, попутно излечиваются гастриты, язвы, колиты, гепатиты, панкреатиты, холециститы и т. д. Уменьшается камнеобразование в желчном пузыре, почках, восстанавливаются все виды обмена. Нагрузка на поджелудочную железу, печень, почки уменьшается в десятки раз!
У нас появилась новая серия продуктов на основе кобыльего молока ЧИТАЙТЕ ЗДЕСЬКак восстановить микрофлору кишечника | Городской медицинский центр GormedC
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты.
В него будут входить некоторые народные средства, правильное питание и медикаменты.
Противостоять бактериям и предотвращать их проникновение в желудочно-кишечный тракт должна микрофлора. Именно поэтому для постоянной правильной работы кишечника необходимо постоянное поступление определенных микроорганизмов. Они, прежде всего, необходимы для борьбы с патогенами. Всем известный дисбактериоз — нарушение баланса, связанного с их недостаточностью. Чащу всего подобное случается после принятия курса антибиотиков.
Восстановление микрофлоры кишечника
Чтобы привести микрофлору в норму, необходим комплексный подход к лечению. В него будут входить некоторые народные средства, правильное питание и медикаменты. Прежде чем начать лечение, необходимо проконсультироваться с гастроэнтерологом.
В зависимости от симптомов, выделяют 5 типов препаратов. В любом случае, можно предоставить проблему до ее появления. Употребляйте пробиотики вместе с антибиотиками. Стоит помнить, что последние назначают только при большом количестве патогенов. Перед их назначением следует сдать анализы, чтобы определить, восприимчивы они к подобному лечению. В инструкции к каждому препарату указывается правильная дозировка, частота применения. Не нужно превышать дозировку, так как это может оказать негативный эффект. К детским препаратам относят Хилак Форте и Линекс. Не стоит полагаться на отзывы на форумах, так как решающую роль при выборе лекарства всегда будет играть специалист-медик.
Можно сочетать медикаменты и народные средства. К ним можно отнести специальную брагу. Для ее изготовления нам потребуется пол-литра теплой воды, сахар и мед по одной столовой ложке и 2 грамма дрожжей. Достаточно просто все смешать и поставить в теплое место. Пить ее стоит между приемами пищи. Полезным может оказаться настрой из эвкалипта, укропа и мяты. Необходимо смешать три части перечной мяты, одну часть семян укропа и пять эвкалипта. Все это литром теплой воды и дать настояться час. Пейте по стакану смеси перед приемом пищи. Перед использованием этих народных рецептов стоит получить консультацию врача.
Все это литром теплой воды и дать настояться час. Пейте по стакану смеси перед приемом пищи. Перед использованием этих народных рецептов стоит получить консультацию врача.
Диетический рацион
Придерживайтесь правильного рациона, так как это поможет снизить нагрузку на ваше пищеварение. Вся кисломолочная продукция помогает заполнить желудок нужными бактериями. Лучшим другом должны стать каши из круп, так как они не только помогают нормализовать обмен веществ, но и выведут токсины.
Модуляция микробиоты кишечника: новая стратегия профилактики и лечения колоректального рака
Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности во всем мире для 36 раковых заболеваний в 185 странах. CA Cancer J Clin. 2018; 68: 394–424.
Артикул Google Scholar
Арнольд М., Сьерра М.С., Лаверсанн М., Сурджоматарам I, Джемал А., Брей Ф.Глобальные закономерности и тенденции заболеваемости и смертности от колоректального рака. Кишечник. 2017; 66: 683–91.
PubMed Статья Google Scholar
Паркин Д.М., Бойд Л., Уокер Л. 16. Доля рака, связанная с образом жизни и факторами окружающей среды в Великобритании в 2010 году. Br J Cancer. 2011; 105: S77 – S81.
PubMed PubMed Central Статья Google Scholar
Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Метагеномный анализ микробиома дистального отдела кишечника человека. Наука. 2006; 312: 1355–9.
CAS PubMed PubMed Central Статья Google Scholar
Кремер Г., Зитвогель Л. Иммунотерапия рака в 2017 году: прорыв микробиоты. Nat Rev Immunol. 2018; 18: 87–88.
CAS PubMed Статья Google Scholar
Ян И, Вэн В, Пэн Дж, Хун Л, Ян Л, Тояма И и др. Fusobacterium nucleatum увеличивает пролиферацию клеток колоректального рака и развитие опухолей у мышей за счет активации передачи сигналов toll-подобного рецептора 4 ядерному фактору-каппаB и активации экспрессии микроРНК-21. Гастроэнтерология. 2017; 152: 851–66 e824.
CAS PubMed Статья Google Scholar
Long X, Wong CC, Tong L, Chu ESH, Ho Szeto C, Go MYY, et al.Peptostreptococcus anaerobius способствует колоректальному канцерогенезу и модулирует иммунитет опухоли. Nat Microbiol. 2019; 4: 2319–30.
PubMed Статья CAS Google Scholar
Чанг Л., Орберг Е.Т., Гейс А.Л., Чан Дж.Л., Фу К., ДеСтефано Шилдс С.Э. и др. Токсин Bacteroides fragilis координирует проканцерогенный воспалительный каскад, воздействуя на эпителиальные клетки толстой кишки. Клеточный микроб-хозяин. 2018; 23: 421.
CAS PubMed PubMed Central Статья Google Scholar
Рубинштейн MR, Ван X, Лю В, Хао Y, Цай Г, Хан YW. Fusobacterium nucleatum способствует колоректальному канцерогенезу, модулируя передачу сигналов E-кадгерин / бета-катенин через свой адгезин FadA. Клеточный микроб-хозяин. 2013; 14: 195–206.
CAS PubMed PubMed Central Статья Google Scholar
Feng Q, Liang S, Jia H, Stadlmayr A, Tang L, Lan Z, et al. Развитие кишечного микробиома по последовательности колоректальной аденомы-карциномы.Nat Commun. 2015; 6: 6528.
CAS PubMed Статья Google Scholar
Дай З., Кокер О.О., Накацу Дж., Ву В.К.К., Чжао Л., Чен З. и др. Многокогортный анализ метагенома колоректального рака выявил измененные бактерии в популяциях и универсальные бактериальные маркеры. Микробиом. 2018; 6: 70.
2018; 6: 70.
PubMed PubMed Central Статья Google Scholar
Mima K, Nishihara R, Qian ZR, Cao Y, Sukawa Y, Nowak JA и др. Fusobacterium nucleatum в ткани колоректального рака и прогноз пациента. Кишечник. 2016; 65: 1973–80.
CAS PubMed Статья Google Scholar
Yu T, Guo F, Yu Y, Sun T, Ma D, Han J, et al. Fusobacterium nucleatum способствует химической устойчивости к колоректальному раку, модулируя аутофагию. Клетка. 2017; 170: 548–63 e516.
CAS PubMed PubMed Central Статья Google Scholar
Гейер М.С., Батлер Р.Н., Ховарт Г.С. Пробиотики, пребиотики и синбиотики: роль в химиопрофилактике колоректального рака? Cancer Biol Ther. 2006; 5: 1265–9.
CAS PubMed Статья Google Scholar
Мацковяк П.А. Переработка Мечникова: пробиотики, микробиом кишечника и поиски долгой жизни. Фронт общественного здравоохранения. 2013; 1:52.
PubMed PubMed Central Статья Google Scholar
Миллс JP, Рао К., Янг В.Б. Пробиотики для профилактики инфекции Clostridium difficile. Курр Опин Гастроэнтерол. 2018; 34: 3–10.
CAS PubMed PubMed Central Статья Google Scholar
Пивнгам П., Чжэн Ю., Нгуен Т.Х., Дики С.В., Джу Х.С., Вильяруз А.Е. и др. Устранение патогена пробиотической палочкой Bacillus посредством интерференции сигналов. Природа. 2018; 562: 532–7.
CAS PubMed PubMed Central Статья Google Scholar
Камада Н., Ким Ю.Г., Шам ХП, Валланс Б.А., Пуэнте Дж.Л., Мартенс Э.С. и др. Регулируемая вирулентность контролирует способность патогена конкурировать с кишечной микробиотой. Наука. 2012; 336: 1325–9.
Наука. 2012; 336: 1325–9.
CAS PubMed PubMed Central Статья Google Scholar
Tuomola EM, Ouwehand AC, Salminen SJ. Влияние пробиотических бактерий на адгезию возбудителей к кишечной слизи человека. FEMS Immunol Med Microbiol. 1999; 26: 137–42.
CAS PubMed Статья Google Scholar
Кампана Р., Ван Хемерт С., Баффон В. Штамм-специфические пробиотические свойства молочнокислых бактерий и их вмешательство в инвазию кишечных патогенов человека. Gut Pathog. 2017; 9: 12.
PubMed PubMed Central Статья Google Scholar
Fayol-Messaoudi D, Berger CN, Coconnier-Polter MH, Lievin-Le Moal V, Servin AL.Активность пробиотических Lactobacilli против Salmonella enterica, Serovar Typhimurium, зависит от pH, молочной кислоты и немолочной кислоты. Appl Environ Microbiol. 2005. 71: 6008–13.
CAS PubMed PubMed Central Статья Google Scholar
Гиллор О., Эцион А, Райли Массачусетс. Двойная роль бактериоцинов как анти- и пробиотиков. Appl Microbiol Biotechnol. 2008. 81: 591–606.
CAS PubMed PubMed Central Статья Google Scholar
Klaenhammer TR, Kleerebezem M, Kopp MV, Rescigno M. Влияние пробиотиков и пребиотиков на иммунную систему. Nat Rev Immunol. 2012; 12: 728–34.
CAS PubMed Статья Google Scholar
Konieczna P, Groeger D, Ziegler M, Frei R, Ferstl R, Shanahan F, et al. Введение Bifidobacterium infantis 35624 индуцирует Т-регуляторные клетки Foxp3 в периферической крови человека: потенциальная роль миелоидных и плазматических дендритных клеток.Кишечник. 2012; 61: 354–66.
CAS PubMed Статья Google Scholar

Jeon SG, Kayama H, Ueda Y, Takahashi T., Asahara T., Tsuji H, et al. Пробиотик Bifidobacterium breve индуцирует продуцирующие IL-10 клетки Tr1 в толстой кишке. PLoS Pathog. 2012; 8: e1002714.
CAS PubMed PubMed Central Статья Google Scholar
Гадими Д., Хельвиг У., Шрезенмейр Дж., Хеллер К.Дж., де Врез М.Эпигенетический импринтинг комменсальных пробиотиков ингибирует ось IL-23 / IL-17 в модели иммунной системы слизистой оболочки кишечника in vitro. J Leukoc Biol. 2012; 92: 895–911.
CAS PubMed Статья Google Scholar
Chen L, Zou Y, Peng J, Lu F, Yin Y, Li F и др. Lactobacillus acidophilus подавляет ассоциированную с колитом активацию оси IL-23 / Th27. J Immunol Res. 2015; 2015: 4.
PubMed PubMed Central Google Scholar
Sichetti M, De Marco S, Pagiotti R, Traina G, Pietrella D. Противовоспалительный эффект многоплановой пробиотической композиции (L. rhamnosus, B. lactis и B. longum). Питание. 2018; 53: 95–102.
CAS PubMed Статья Google Scholar
Miller LE, Lehtoranta L, Lehtinen MJ. Влияние бифидобактерий животных ssp. lactis HN019 на клеточную иммунную функцию у здоровых пожилых людей: систематический обзор и метаанализ.Питательные вещества. 2017; 9: 191.
PubMed Central Статья CAS Google Scholar
Роча-Рамирес Л.М., Перес-Солано Р.А., Кастанон-Алонсо С.Л., Морено Герреро С.С., Рамирес Пачеко А., Гарсия Гарибай М. и др. Штаммы пробиотических лактобацилл стимулируют воспалительную реакцию и активируют макрофаги человека. J Immunol Res. 2017; 2017: 4607491.
CAS PubMed PubMed Central Статья Google Scholar

Ленуар М., Дель Кармен С., Кортес-Перес Н.Г., Лозано-Ойалво Д., Муньос-Провенсио Д., Чейн F и др. Lactobacillus casei BL23 регулирует популяции Treg и Th27 Т-клеток и снижает колоректальный рак, связанный с ДМГ. J Gastroenterol. 2016; 51: 862–73.
CAS PubMed Статья Google Scholar
Jacouton E, Michel ML, Torres-Maravilla E, Chain F, Langella P, Bermudez-Humaran LG. Выяснение связанных с иммунитетом механизмов, с помощью которых пробиотический штамм Lactobacillus casei BL23 проявляет противоопухолевые свойства.Front Microbiol. 2018; 9: 3281.
PubMed Статья Google Scholar
Chen CC, Lin WC, Kong MS, Shi HN, Walker WA, Lin CY, et al. Пероральная инокуляция пробиотиков Lactobacillus acidophilus NCFM подавляет рост опухоли как при сегментарном ортотопическом раке толстой кишки, так и вне кишечной ткани. Br J Nutr. 2012; 107: 1623–34.
CAS PubMed Статья Google Scholar
Сандерс М.Э., Бенсон А., Лебир С., Меренштейн Д.Д., Клаенхаммер Т.Р. Общие механизмы среди пробиотических таксонов: значение для общих пробиотических заявлений. Curr Opin Biotechnol. 2018; 49: 207–16.
CAS PubMed Статья Google Scholar
Mohamadzadeh M, Pfeiler EA, Brown JB, Zadeh M, Gramarossa M, Managlia E, et al. Регулирование индуцированного воспаления толстой кишки Lactobacillus acidophilus с дефицитом липотейхоевой кислоты.Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4623–30.
CAS PubMed Статья Google Scholar
Khazaie K, Zadeh M, Khan MW, Bere P, Gounari F, Dennis K и др. Борьба с полипозом рака толстой кишки, вызванным Lactobacillus acidophilus с дефицитом липотейхоевой кислоты. Proc Natl Acad Sci USA. 2012; 109: 10462–7.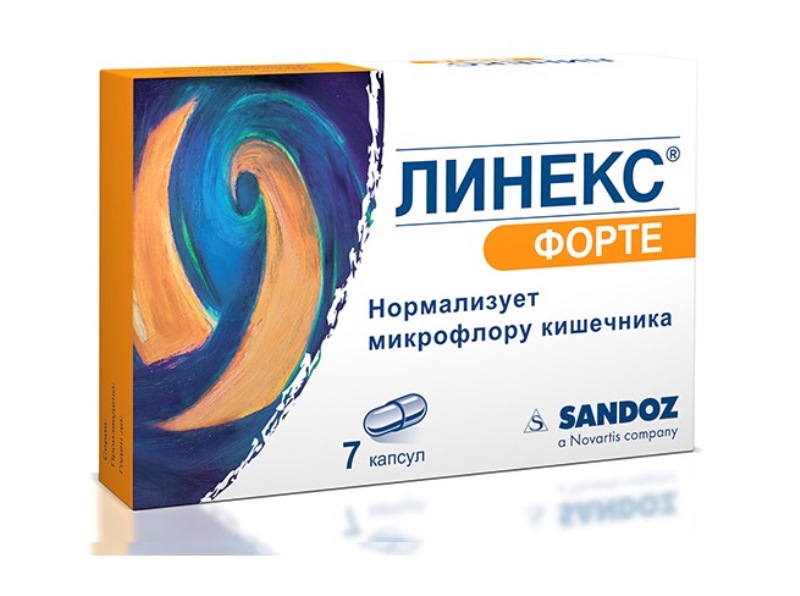
CAS PubMed Статья Google Scholar
Soler AP, Miller RD, Laughlin KV, Carp NZ, Klurfeld DM, Mullin JM. Повышенная проницаемость плотных соединений связана с развитием рака толстой кишки. Канцерогенез. 1999; 20: 1425–31.
CAS PubMed Статья Google Scholar
Пуппа MJ, White JP, Sato S, Cairns M, Baynes JW, Carson JA. Дисфункция кишечного барьера на мышиной модели кахексии рака толстой кишки Apc (Min / +). Biochim Biophys Acta. 2011; 1812: 1601–6.
CAS PubMed PubMed Central Статья Google Scholar
Ахмад Р., Кумар Б., Чен З., Чен Х, Мюллер Д., Леле С.М. и др. Потеря экспрессии клаудина-3 индуцирует передачу сигналов IL6 / gp130 / Stat3, что способствует злокачественному развитию рака толстой кишки за счет гиперактивации передачи сигналов Wnt / бета-катенин. Онкоген. 2017; 36: 6592–604.
CAS PubMed PubMed Central Статья Google Scholar
Alvarez CS, Badia J, Bosch M, Gimenez R, Baldoma L. Везикулы наружной мембраны и растворимые факторы, высвобождаемые пробиотиком escherichia coli nissle 1917 и комменсалом ECOR63, усиливают барьерную функцию, регулируя экспрессию белков плотного соединения в эпителиальных клетках кишечника. Front Microbiol. 2016; 7: 1981.
PubMed PubMed Central Google Scholar
Зайрек А.А., Цишон С., Хелмс С., Эндерс С., Зонненборн Ю., Шмидт М.А.Молекулярные механизмы, лежащие в основе пробиотических эффектов Escherichia coli Nissle 1917, включают перераспределение ZO-2 и PKCzeta, приводящее к восстановлению плотных контактов и эпителиального барьера. Cell Microbiol. 2007; 9: 804–16.
CAS PubMed Статья Google Scholar

Ван Л., Цао Х., Лю Л., Ван Б., Уокер В.А., Акра С.А. и др. Активация рецептора эпидермального фактора роста опосредует продукцию муцина, стимулируемую p40, белком, производным от Lactobacillus rhamnosus GG.J Biol Chem. 2014; 289: 20234–44.
CAS PubMed PubMed Central Статья Google Scholar
Мартин Р., Шаминьон С., Медби-Хаджри Н., Чейн Ф, Дерриен М., Эскрибано-Васкес У. и др. Потенциальный пробиотический штамм Lactobacillus rhamnosus CNCM I-3690 защищает кишечный барьер, стимулируя выработку слизи и цитопротекторный ответ. Научный доклад 2019; 9: 5398.
PubMed PubMed Central Статья CAS Google Scholar
Кумар М., Киссун-Сингх В., Кориа А.Л., Моро Ф., Чейди К. Смесь пробиотиков VSL # 3 уменьшает воспаление толстой кишки и улучшает барьерную функцию кишечника у мышей с дефицитом муцина Muc2. Am J Physiol Gastrointest Liver Physiol. 2017; 312: G34 – G45.
PubMed Статья Google Scholar
Кэннон Дж., Ли Т., Боланос Дж., Данцигер Л. Патогенетическая значимость Lactobacillus: ретроспективный обзор более 200 случаев. Eur J Clin Microbiol Infect Dis.2005; 24: 31–40.
CAS PubMed Статья Google Scholar
Дорон С, Снидман ДР. Риск и безопасность пробиотиков. Clin Infect Dis. 2015; 60: S129 – S134.
PubMed PubMed Central Статья Google Scholar
Hassan H, Rompola M, Glaser A, Kinsey SE, Phillips R. Систематический обзор и метаанализ, изучающий эффективность и безопасность пробиотиков у людей с онкологическими заболеваниями.Поддержка лечения рака. 2018; 26: 2503–9.
PubMed Статья Google Scholar
Ситараман Р. Прокариотический горизонтальный перенос генов в человеческом холобионте: эколого-эволюционные выводы, последствия и возможности. Микробиом. 2018; 6: 1–14.
Микробиом. 2018; 6: 1–14.
Артикул Google Scholar
Ху И, Ян Х, Цинь Дж, Лу Н, Ченг Дж, Ву Н и др. Полнометагеномный анализ генов устойчивости к антибиотикам в большой когорте кишечной микробиоты человека.Nat Commun. 2013; 4: 2151.
PubMed Статья CAS Google Scholar
Сандерс М.Э., Аккерманс Л.М., Халлер Д., Хаммерман С., Хаймбах Дж. Т., Хёрманнспергер Г. и др. Оценка безопасности пробиотиков для использования человеком. Кишечные микробы. 2010; 1: 164–85.
PubMed PubMed Central Статья Google Scholar
Чанг Л., Чжан З-И, Ке Д, Цзянь-Пин И, Сяо-Куй Г.Устойчивость к антибиотикам пробиотических штаммов молочнокислых бактерий, выделенных из продаваемых пищевых продуктов и лекарств. Biomed Environ Sci. 2009; 22: 401–12.
Артикул Google Scholar
Геймонд М., Санчес Б., де лос Рейес-Гавилан К.Г., Марголлес А. Устойчивость к антибиотикам у пробиотических бактерий. Front Microbiol. 2013; 4: 202.
PubMed PubMed Central Статья Google Scholar
Якобсен Л., Уилкс А., Хаммер К., Хюйс Г., Геверс Д., Андерсен С.Р. Горизонтальный перенос плазмид устойчивости tet (M) и erm (B) от пищевых штаммов Lactobacillus plantarum к Enterococcus faecalis Jh3-2 в желудочно-кишечном тракте крыс-гнотобиотов. FEMS Microbiol Ecol. 2007. 59: 158–66.
CAS PubMed Статья Google Scholar
Туми Н., Монаган А., Фаннинг С., Болтон Д. Оценка передачи устойчивости к противомикробным препаратам между молочнокислыми бактериями и потенциальными патогенами пищевого происхождения с использованием методов in vitro и скрещивания в пищевой матрице.Foodborne Pathog Dis. 2009. 6: 925–33.
2009. 6: 925–33.
CAS PubMed Статья Google Scholar
Гибсон Г.Р., Роберфроид МБ. Диетическая модуляция микробиоты толстой кишки человека: введение в понятие пребиотиков. J Nutr. 1995; 125: 1401–12.
CAS Статья PubMed Google Scholar
Гибсон Г.Р., Хаткинс Р., Сандерс М.Э., Прескотт С.Л., Реймер Р.А., Салминен С.Дж. и др.Документ о консенсусе экспертов: Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков (ISAPP) по определению и сфере применения пребиотиков. Нат Рев Гастроэнтерол Гепатол. 2017; 14: 491–502.
PubMed Статья Google Scholar
Гибсон Г.Р., Фуллер Р. Аспекты исследовательских подходов in vitro и in vivo, направленных на определение пробиотиков и пребиотиков для использования человеком. J Nutr. 2000; 130 (2S Доп.): 391S – 395S.
CAS PubMed Статья Google Scholar
Девульф Э.М., Кани П.Д., Клаус С.П., Фуэнтес С., Пуйларт П.Г., Нейринк А.М. и др. Понимание концепции пребиотиков: уроки двойного слепого исследовательского исследования фруктанов инулиноподобного типа у женщин с ожирением. Кишечник. 2013; 62: 1112–21.
CAS PubMed Статья Google Scholar
Azcarate-Peril MA, Ritter AJ, Savaiano D, Monteagudo-Mera A, Anderson C, Magness ST, et al.Влияние короткоцепочечных галактоолигосахаридов на микробиом кишечника людей с непереносимостью лактозы. Proc Natl Acad Sci USA. 2017; 114: E367 – E375.
CAS PubMed Статья Google Scholar
Maier TV, Lucio M, Lee LH, VerBerkmoes NC, Brislawn CJ, Bernhardt J, et al. Влияние диетического резистентного крахмала на микробиом кишечника человека, метапротеом и метаболом. MBio. 2017; 8: e01343–01317.
MBio. 2017; 8: e01343–01317.
CAS PubMed PubMed Central Статья Google Scholar
Линдси Дж.О., Уилан К., Стэг А.Дж., Гобин П., Аль-Хасси Х.О., Реймент Н. и др. Клинические, микробиологические и иммунологические эффекты фруктоолигосахарида у пациентов с болезнью Крона. Кишечник. 2006; 55: 348–55.
CAS PubMed PubMed Central Статья Google Scholar
Wong JM, De Souza R, Kendall CW, Emam A, Jenkins DJ. Здоровье толстой кишки: ферментация и жирные кислоты с короткой цепью. J Clin Gastroenterol. 2006; 40: 235–43.
CAS PubMed Статья Google Scholar
Канани Р.Б., Ди Костанцо М., Леоне Л., Педата М., Мели Р., Калиньяно А. Потенциальные положительные эффекты бутирата при кишечных и внекишечных заболеваниях. Мир Дж. Гастроэнтерол. 2011; 17: 1519.
CAS PubMed PubMed Central Статья Google Scholar
Тонг L-c WangY, Wang Z-b LiuW-y, Sun S, Li L, et al.Пропионат облегчает колит, вызванный декстрансульфатом натрия, улучшая барьерную функцию кишечника и уменьшая воспаление и окислительный стресс. Front Pharm. 2016; 7: 253.
Google Scholar
Фукуда С., Тох Х, Хасе К., Осима К., Наканиши Ю., Йошимура К. и др. Бифидобактерии могут защитить от энтеропатогенной инфекции за счет выработки ацетата. Природа. 2011; 469: 543.
CAS PubMed Статья Google Scholar
Forchielli ML, Walker WA. Роль лимфоидной ткани, связанной с кишечником, и защиты слизистой оболочки. Br J Nutr. 2005; 93: S41 – S48.
CAS PubMed Статья Google Scholar
Шоаф К., Малви Г.Л., Армстронг Г. Д., Хаткинс Р.В. Пребиотические галактоолигосахариды снижают адгезию энтеропатогенной кишечной палочки к клеткам культуры ткани. Заражение иммунной. 2006. 74: 6920–8.
Д., Хаткинс Р.В. Пребиотические галактоолигосахариды снижают адгезию энтеропатогенной кишечной палочки к клеткам культуры ткани. Заражение иммунной. 2006. 74: 6920–8.
CAS PubMed PubMed Central Статья Google Scholar
Monteagudo-Mera A, Rastall RA, Gibson GR, Charalampopoulos D, Chatzifragkou A. Механизмы адгезии, опосредованные пробиотиками и пребиотиками, и их потенциальное влияние на здоровье человека. Appl Microbiol Biotechnol. 2019; 103: 6463–72.
CAS PubMed PubMed Central Статья Google Scholar
Ито Х., Такемура Н., Сонояма К., Кавагиси Х., Топпинг Д.Л., Конлон М.А. и др. Степень полимеризации фруктанов инулинового типа по-разному влияет на количество молочнокислых бактерий, иммунные функции кишечника и секрецию иммуноглобулина А в слепой кишке крысы.J. Agric Food Chem. 2011; 59: 5771–8.
CAS PubMed Статья Google Scholar
Белчева А., Ирразабал Т., Робертсон С.Дж., Стрейткер С., Моган Х., Рубино С. и др. Микробный метаболизм кишечника управляет трансформацией эпителиальных клеток толстой кишки с дефицитом MSh3. Клетка. 2014; 158: 288–99.
CAS PubMed Статья Google Scholar
Бултман С.Дж., Джобин К.Бутират микробного происхождения: онкометаболит или метаболит, подавляющий опухоль? Клеточный микроб-хозяин. 2014; 16: 143–5.
CAS PubMed PubMed Central Статья Google Scholar
Сингх В., Сан Йео Б., Чассайн Б., Сяо Х, Саха П., Ольвера Р.А. и др. Нарушение регуляции микробной ферментации растворимой клетчатки вызывает холестатический рак печени. Клетка. 2018; 175: 679–94. e622.
CAS PubMed PubMed Central Статья Google Scholar

Константинов С.Р., Кейперс Э.Дж., Пеппеленбош М.П. Функциональный геномный анализ микробиоты кишечника для скрининга CRC. Нат Рев Гастроэнтерол Гепатол. 2013; 10: 741.
CAS PubMed Статья Google Scholar
Ян Ф, Полк ДБ. Характеристика растворимого белка, полученного из пробиотиков, которая раскрывает механизм профилактического и лечебного воздействия пробиотиков на воспалительные заболевания кишечника. Кишечные микробы. 2012; 3: 25–28.
PubMed PubMed Central Статья Google Scholar
Ван И, Лю Л., Мур DJ, Шен Х, Пик Р., Акра С.А. и др. Белок, производный от LGG, способствует выработке IgA за счет усиления экспрессии APRIL в эпителиальных клетках кишечника. Mucosal Immunol. 2017; 10: 373.
CAS PubMed Статья Google Scholar
Де Марко С., Сичетти М., Мурадян Д., Пиччони М., Трэйна Г., Паджотти Р. и др.Бесклеточные пробиотические супернатанты проявляли противовоспалительную и антиоксидантную активность в отношении эпителиальных клеток кишечника человека и макрофагов, стимулированных LPS. Evid Based Complement Altern Med. 2018; 2018: 1756308.
Артикул Google Scholar
Bermudez-Brito M, Muñoz-Quezada S, Gomez-Llorente C, Matencio E, Bernal MJ, Romero F, et al. Бесклеточный супернатант культуры Bifidobacterium breve CNCM I-4035 снижает провоспалительные цитокины в дендритных клетках человека, зараженных Salmonella typhi, посредством активации TLR.PLoS ONE. 2013; 8: e59370.
CAS PubMed PubMed Central Статья Google Scholar
Гао Дж, Ли Й, Ван И, Ху Т, Лю Л., Ян С. и др. Новый постбиотик из Lactobacillus rhamnosus GG, благотворно влияющий на барьерную функцию кишечника. Front Microbiol. 2019; 10: 477.
PubMed PubMed Central Статья Google Scholar
Чен З-И, Се Й-М, Хуанг Ц.-К, Цай Ц-К.Подавляющее действие пробиотика Lactobacillus на рост линии клеток карциномы толстой кишки человека HT-29. Молекулы. 2017; 22: 107.
PubMed Central Статья CAS Google Scholar
Escamilla J, Lane MA, Maitin V. Бесклеточные супернатанты от пробиотических Lactobacillus casei и Lactobacillus rhamnosus GG уменьшают инвазию клеток рака толстой кишки in vitro. Nutr Cancer. 2012; 64: 871–8.
CAS PubMed Статья Google Scholar
Кониси Х., Фудзия М., Танака Х., Уэно Н., Мориити К., Сасадзима Дж. И др. Феррихром, полученный из пробиотиков, подавляет прогрессирование рака толстой кишки через JNK-опосредованный апоптоз. Nat Commun. 2016; 7: 12365.
CAS PubMed PubMed Central Статья Google Scholar
Zackular JP, Baxter NT, Iverson KD, Sadler WD, Petrosino JF, Chen GY, et al. Микробиом кишечника модулирует онкогенез толстой кишки. MBio. 2013; 4: e00692–00613.
PubMed PubMed Central Статья CAS Google Scholar
Цао Х, Сюй М., Донг В., Дэн Б., Ван С., Чжан И и др. Вторичный дисбиоз, вызванный желчными кислотами, способствует канцерогенезу кишечника. Int J Cancer. 2017; 140: 2545–56.
CAS PubMed Статья Google Scholar
Zackular JP, Baxter NT, Chen GY, Schloss PD. Манипуляции с микробиотой кишечника выявляют роль в онкогенезе толстой кишки. мСфера. 2016; 1: e00001–00015.
PubMed Статья Google Scholar
DeStefano Shields CE, Van Meerbeke SW, Housseau F, Wang H, Huso DL, Casero RA Jr и др.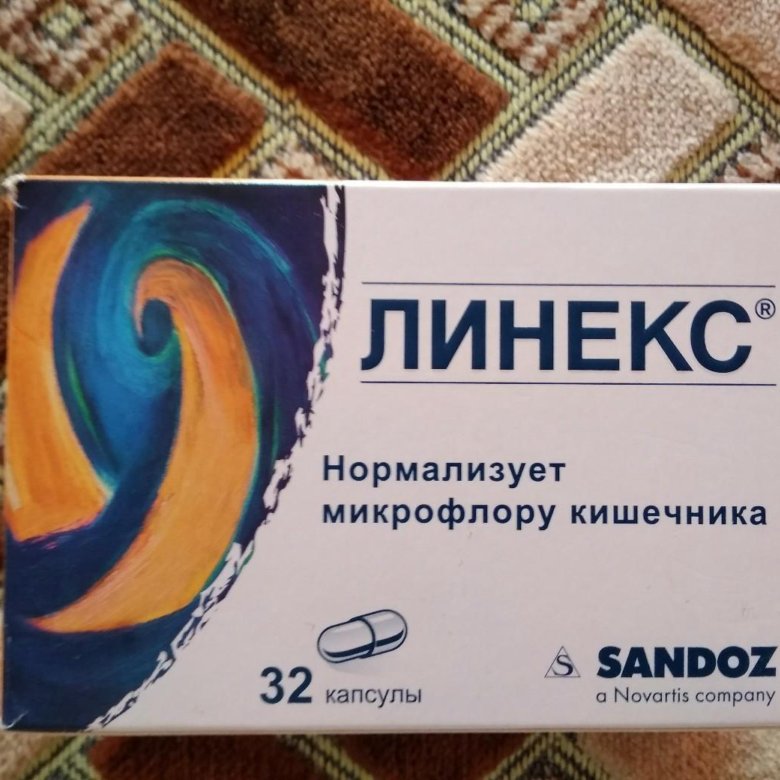 Снижение онкогенеза толстой кишки мышей, вызванное энтеротоксигенными Bacteroides fragilis, с использованием лечения цефокситином. J Infect Dis. 2016; 214: 122–9.
Снижение онкогенеза толстой кишки мышей, вызванное энтеротоксигенными Bacteroides fragilis, с использованием лечения цефокситином. J Infect Dis. 2016; 214: 122–9.
CAS PubMed PubMed Central Статья Google Scholar
Ijssennagger N, Belzer C, Hooiveld GJ, Dekker J, van Mil SW, Müller M, et al. Микробиота кишечника способствует индуцированной диетой гиперпролиферации эпителия гемом, открывая слизистый барьер в толстой кишке.Proc Natl Acad Sci USA. 2015; 112: 10038–43.
CAS PubMed Статья Google Scholar
Хаттори Н., Нива Т., Исида Т., Кобаяси К., Имаи Т., Мори А. и др. Антибиотики подавляют онкогенез толстой кишки за счет ингибирования аберрантного метилирования ДНК в модели колита с азоксиметаном и декстрансульфатом натрия. Cancer Sci. 2019; 110: 147.
CAS PubMed Статья Google Scholar
Bullman S, Pedamallu CS, Sicinska E, Clancy TE, Zhang X, Cai D, et al. Анализ устойчивости Fusobacterium и ответа на антибиотики при колоректальном раке. Наука. 2017; 358: 1443–8.
CAS PubMed PubMed Central Статья Google Scholar
Тринер Д., Девенпорт С.Н., Рамакришнан С.К., Ма Х, Фрилер Р.А., Гринсон Дж. К. и др. Нейтрофилы ограничивают микробиоту, связанную с опухолями, чтобы уменьшить рост и инвазию опухолей толстой кишки у мышей.Гастроэнтерология. 2019; 156: 1467–82.
PubMed Статья Google Scholar
Сетхи В., Куртом С., Тарик М., Лавания С., Малчиоди З., Хельмунд Л. и др. Микробиота кишечника способствует росту опухоли у мышей, модулируя иммунный ответ. Гастроэнтерология. 2018; 155: 33–37. e36.
CAS PubMed PubMed Central Статья Google Scholar

Vetizou M, Pitt JM, Daillere R, Lepage P, Waldschmitt N, Flament C, et al.Противораковая иммунотерапия путем блокады CTLA-4 зависит от микробиоты кишечника. Наука. 2015; 350: 1079–84.
CAS PubMed PubMed Central Статья Google Scholar
Сиван А., Корралес Л., Хуберт Н., Уильямс Дж. Б., Акино-Майклс К., Эрли З. М. и др. Commensal Bifidobacterium способствует противоопухолевому иммунитету и повышает эффективность против PD-L1. Наука. 2015; 350: 1084–9.
CAS PubMed PubMed Central Статья Google Scholar
Routy B, Le Chatelier E, Derosa L, Duong CP, Alou MT, Daillère R и др. Микробиом кишечника влияет на эффективность иммунотерапии на основе PD-1 против эпителиальных опухолей. Наука. 2018; 359: 91–97.
CAS Статья PubMed Google Scholar
Iida N, Dzutsev A, Stewart CA, Smith L, Bouladoux N, Weingarten RA, et al. Комменсальные бактерии контролируют реакцию рака на терапию, модулируя микросреду опухоли. Наука.2013; 342: 967–70.
CAS PubMed PubMed Central Статья Google Scholar
Ван Ф, Инь Кью, Чен Л., Дэвис ММ. Bifidobacterium может смягчать кишечную иммунопатологию в контексте блокады CTLA-4. Proc Natl Acad Sci USA. 2018; 115: 157–61.
CAS PubMed Статья Google Scholar
Zhao S, Gao G, Li W, Li X, Zhao C, Jiang T, et al.Антибиотики связаны со сниженной эффективностью терапии анти-PD-1 / PD-L1 у китайских пациентов с распространенным немелкоклеточным раком легкого. Рак легких. 2019; 130: 10–17.
PubMed Статья Google Scholar
Derosa L, Hellmann M, Spaziano M, Halpenny D, Fidelle M, Rizvi H, et al. Отрицательная связь антибиотиков с клинической активностью ингибиторов иммунных контрольных точек у пациентов с прогрессирующим почечно-клеточным и немелкоклеточным раком легкого.Энн Онкол. 2018; 29: 1437–44.
CAS PubMed PubMed Central Статья Google Scholar
Килккинен А., Риссанен Х., Клаукка Т., Пуккала Е., Хелиёваара М., Хуовинен П. и др. Использование антибиотиков предсказывает повышенный риск рака. Int J Cancer. 2008; 123: 2152–5.
CAS PubMed Статья Google Scholar
Дик В.К., ван Ойен М.Г., Смитс Х.М., Сирсема ПД.Частое использование антибиотиков связано с риском колоректального рака: результаты вложенного исследования случай – контроль. Dig Dis Sci. 2016; 61: 255–64.
CAS PubMed Статья Google Scholar
Уиллинг Б.П., Рассел С.Л., Финли ББ. Сдвиг баланса: влияние антибиотиков на взаимопонимание между хозяином и микробиотой. Nat Rev Microbiol. 2011; 9: 233.
CAS PubMed Статья Google Scholar
Цао И, Ву К., Мехта Р., Дрю Д.А., Сонг М., Лочхед П. и др. Длительный прием антибиотиков и риск колоректальной аденомы. Кишечник. 2018; 67: 672–8.
CAS PubMed Статья Google Scholar
Кириаку Д.Н., Льюис Р.Дж. Сомнительно по показаниям в клинических исследованиях. ДЖАМА. 2016; 316: 1818–9.
PubMed Статья Google Scholar
Smits LP, Bouter KE, de Vos WM, Borody TJ, Nieuwdorp M.Лечебный потенциал трансплантации фекальной микробиоты. Гастроэнтерология. 2013; 145: 946–53.
PubMed Статья Google Scholar
Weingarden AR, Vaughn BP. Кишечная микробиота, трансплантация фекальной микробиоты и воспалительные заболевания кишечника. Кишечные микробы. 2017; 8: 238–52.
PubMed PubMed Central Статья Google Scholar
Россхарт С.П., Вассалло Б.Г., Анджелетти Д., Хатчинсон Д.С., Морган А.П., Такеда К. и др.Микробиота кишечника диких мышей способствует физической форме хозяина и повышает сопротивляемость болезням. Клетка. 2017; 171: 1015–28. e1013.
CAS PubMed PubMed Central Статья Google Scholar
Ван З-К, Ян И-С, Чен Й, Юань Дж, Сунь Г, Пэн Л-Х. Патогенез кишечной микробиоты и трансплантация фекальной микробиоты при воспалительном заболевании кишечника. Мир Дж. Гастроэнтерол. 2014; 20: 14805.
CAS PubMed PubMed Central Статья Google Scholar
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Важное предупреждение относительно использования фекальной микробиоты для трансплантации и риска серьезных побочных реакций из-за трансмиссии организмов с множественной лекарственной устойчивостью. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Мэриленд, Мэриленд, 2019 г. https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/important-safety-alert-regarding-use-fecal-microbiota-transplantation-and -риск-серьезные-неблагоприятные.
Шварц М., Глюк М., Кун С. Норовирусный гастроэнтерит после трансплантации фекальной микробиоты для лечения инфекции Clostridium difficile, несмотря на бессимптомных доноров и отсутствие контактов с больными.Am J Gastroenterol. 2013; 108: 1367.
PubMed Статья Google Scholar
Quera R, Espinoza R, Estay C, Rivera D. Бактериемия как нежелательное явление трансплантации фекальной микробиоты у пациента с болезнью Крона и рецидивирующей инфекцией Clostridium difficile. Колит Дж. Крона. 2014; 8: 252–3.
PubMed Статья Google Scholar
Хоманн Э.Л., Анантакришнан А.Н., Дешпанде В.Случай 25-2014: мужчина 37 лет с язвенным колитом и кровавым поносом. N. Engl J Med. 2014; 371: 668–75.
CAS PubMed Статья Google Scholar
Секиров И., Рассел С.Л., Antunes LCM, Финлей ББ. Микробиота кишечника в здоровье и болезнях. Physiol Rev.2010; 90: 859–904.
CAS PubMed Статья Google Scholar
Ридаура В.К., Фейт Дж. Дж., Рей Ф. Е., Ченг Дж., Дункан А. Э., Кау А. Л. и др.Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука. 2013; 341: 1241214.
PubMed Статья CAS Google Scholar
Alang N, Kelly CR. Увеличение веса после трансплантации фекальной микробиоты. Открытый форум Infect Dis. 2015; 2: офв004.
PubMed PubMed Central Статья Google Scholar
Gregory JC, Buffa JA, Org E, Wang Z, Levison BS, Zhu W, et al.Передача предрасположенности к атеросклерозу при трансплантации кишечных микробов. J Biol Chem. 2015; 290: 5647–60.
CAS PubMed Статья Google Scholar
Скай С.М., Чжу В., Романо К.А., Го С.Дж., Ван З., Цзя Х и др. Микробной трансплантации кишечных комменсалов человека, содержащих CutC, достаточно для передачи повышенной реактивности тромбоцитов и потенциала тромбоза. Circ Res. 2018; 123: 1164–76.
CAS PubMed PubMed Central Статья Google Scholar
Амбалам П., Раман М., Пурама Р.К., Добл М. Пробиотики, пребиотики и профилактика колоректального рака. Best Pr Res Clin Gastroenterol. 2016; 30: 119–31.
Артикул Google Scholar
Chen Z-F, Ai L-Y, Wang J-L, Ren L-L, Yu Y-N, Xu J, et al. Пробиотики Clostridium butyricum и Bacillus subtilis улучшают онкогенез кишечника. Future Microbiol. 2015; 10: 1433–45.
PubMed Статья CAS Google Scholar
Gamallat Y, Meyiah A, Kuugbee ED, Hago AM, Chiwala G, Awadasseid A, et al. Lactobacillus rhamnosus индуцирует апоптоз эпителиальных клеток, уменьшает воспаление и предотвращает развитие рака толстой кишки на животной модели. Biomed Pharmacother. 2016; 83: 536–41.
CAS PubMed Статья Google Scholar
Kuugbee ED, Shang X, Gamallat Y, Bamba D, Awadasseid A, Suliman MA, et al. Структурные изменения микробиоты с помощью пробиотического коктейля усиливают барьер кишечника и снижают риск рака посредством передачи сигналов TLR2 в модели рака толстой кишки на крысах.Dig Dis Sci. 2016; 61: 2908–20.
CAS PubMed Статья Google Scholar
Стропила Дж., Беннетт М., Кадерни Дж., Клун И., Хьюз Р., Карлссон П.С. и др. Диетические синбиотики снижают факторы риска рака у пациентов с полипэктомией и раком толстой кишки. Am J Clin Nutr. 2007. 85: 488–96.
CAS PubMed Статья Google Scholar
Исикава Х., Акедо И., Отани Т., Сузуки Т., Накамура Т., Такеяма И. и др.Рандомизированное исследование применения пищевых волокон и Lactobacillus casei для профилактики колоректальных опухолей. Int J Cancer. 2005; 116: 762–7.
CAS PubMed Статья Google Scholar
Сангилд П.Т., Шен Р.Л., Понтоппидан П., Рат М. Животные модели индуцированного химиотерапией мукозита: актуальность для трансляции и проблемы. Am J Physiol Gastrointest Liver Physiol. 2017; 314: G231 – G246.
PubMed Статья CAS Google Scholar
Еунг Си-И, Чан В-Т, Цзян Ц-Б, Ченг М.-Л, Лю Ц-И, Чанг С.-В и др. Улучшение вызванного химиотерапией кишечного мукозита пероральным введением пробиотиков на мышиной модели. PLoS ONE. 2015; 10: e0138746.
PubMed PubMed Central Статья CAS Google Scholar
Mi H, Dong Y, Zhang B, Wang H, Peter CC, Gao P, et al. Bifidobacterium infantis уменьшает вызванный химиотерапией мукозит кишечника посредством регулирования Т-клеточного иммунитета у крыс с колоректальным раком.Cell Physiol Biochem. 2017; 42: 2330–41.
CAS PubMed Статья Google Scholar
Чанг К-В, Лю Си-И, Ли Х-К, Хуанг И-Х, Ли Л-Х, Чиау Дж-СК и др. Пробиотик Lactobacillus casei разновидности rhamnosus превентивно ослабляет вызванное 5-фторурацилом / оксалиплатином повреждение кишечника на модели сингенного колоректального рака. Front Microbiol. 2018; 9: 983.
PubMed PubMed Central Статья Google Scholar
Сауткотт Э., Тули К., Ховарт Дж., Дэвидсон Дж., Батлер Р. Йогурты, содержащие пробиотики, уменьшают нарушение тонкого кишечного барьера у крыс, получавших метотрексат. Dig Dis Sci. 2008; 53: 1837.
CAS PubMed Статья Google Scholar
Lin XB, Farhangfar A, Valcheva R, Sawyer MB, Dieleman L, Schieber A, et al. Роль кишечной микробиоты в развитии токсичности иринотекана и в снижении токсичности за счет пищевых волокон у крыс.PLoS ONE. 2014; 9: e83644.
PubMed PubMed Central Статья CAS Google Scholar
Li H-L, Lu L, Wang X-S, Qin L-Y, Wang P, Qiu S-P, et al. Изменение микробиоты кишечника и профилей воспалительных цитокинов / хемокинов при кишечном мукозите, вызванном 5-фторурацилом. Front Cell Infect Microbiol. 2017; 7: 455.
PubMed PubMed Central Статья CAS Google Scholar
Цуй М., Сяо Х, Ли И, Чжоу Л., Чжао С., Ло Д. и др. Трансплантация фекальной микробиоты защищает от радиационной токсичности. EMBO Mol Med. 2017; 9: 448–61.
CAS PubMed PubMed Central Статья Google Scholar
Salva S, Marranzino G, Villena J, Agüero G, Alvarez S. Пробиотические штаммы Lactobacillus защищают от миелосупрессии и иммуносупрессии у мышей, получавших циклофосфамид. Int Immunopharmacol.2014; 22: 209–21.
CAS PubMed Статья Google Scholar
Мего М., Чованец Дж., Вочьянова-Андрезалова И., Конколовский П., Микулова М., Рецкова М. и др. Профилактика диареи, вызванной иринотеканом, с помощью пробиотиков: рандомизированное двойное слепое плацебо-контролируемое пилотное исследование. Дополнение Ther Med. 2015; 23: 356–62.
PubMed Статья Google Scholar
Эстерлунд П., Руотсалайнен Т., Корпела Р., Сакселин М., Оллус А., Валта П. и др. Добавка Lactobacillus при диарее, связанной с химиотерапией колоректального рака: рандомизированное исследование. Br J Рак. 2007; 97: 1028–34.
PubMed PubMed Central Статья CAS Google Scholar
Делия П., Санзотта Дж., Донато В., Фрозина П., Мессина Дж., Де Рензис С. и др. Использование пробиотиков для профилактики диареи, вызванной радиацией.Мир Дж. Гастроэнтерол. 2007; 13: 912.
CAS PubMed PubMed Central Статья Google Scholar
Демерс М., Дагно А., Дежарден Дж. Рандомизированное двойное слепое контролируемое исследование: влияние пробиотиков на диарею у пациентов, получавших тазовое облучение. Clin Nutr. 2014; 33: 761–7.
PubMed Статья Google Scholar
Ян Й, Ся Й, Чен Х, Хун Л., Фэн Дж, Ян Дж и др.Эффект периоперационного лечения пробиотиками колоректального рака: краткосрочные результаты рандомизированного контролируемого исследования. Oncotarget. 2016; 7: 8432.
PubMed PubMed Central Статья Google Scholar
Лю З., Цинь Х., Ян З., Ся Й, Лю В., Ян Дж. И др. Рандомизированное клиническое исследование: влияние периоперационного лечения пробиотиками на барьерную функцию и послеоперационные инфекционные осложнения при хирургии колоректального рака — двойное слепое исследование.Алимент Фарм Тер. 2011; 33: 50–63.
CAS Статья Google Scholar
Лю З.-Х, Хуанг М.-Дж., Чжан Х-З, Ван Л., Хуанг Н.-Кью, Пэн Х и др. Влияние периоперационного лечения пробиотиками на концентрацию зонулина в сыворотке и последующие послеоперационные инфекционные осложнения после хирургического вмешательства при колоректальном раке: двухцентровое и двойное слепое рандомизированное клиническое исследование. Am J Clin Nutr. 2012; 97: 117–26.
PubMed Статья CAS Google Scholar
Kotzampassi K, Stavrou G, Damoraki G, Georgitsi M, Basdanis G, Tsaousi G, et al. Схема из четырех пробиотиков снижает послеоперационные осложнения после колоректальной хирургии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. World J Surg. 2015; 39: 2776–83.
PubMed Статья Google Scholar
Захарддин Л., Мохтар Н.М., Навави КНМ, Али РАР. Рандомизированное двойное слепое плацебо-контролируемое исследование пробиотиков при послеоперационном колоректальном раке.BMC Gastroenterol. 2019; 19: 131.
PubMed PubMed Central Статья CAS Google Scholar
TAPER HS, ROBERFROID MB. Возможна адъювантная терапия рака двумя пребиотиками — инулином или олигофруктозой. Vivo. 2005; 19: 201–4.
CAS Google Scholar
Геллер Л.Т., Барзили-Рокни М., Данино Т., Йонас О.Н., Шентал Н., Нейман Д. и др. Возможная роль внутриопухолевых бактерий в опосредовании устойчивости опухоли к химиотерапевтическому препарату гемцитабину.Наука. 2017; 357: 1156–60.
CAS PubMed PubMed Central Статья Google Scholar
Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D, et al. Микробиота кишечника модулирует противоопухолевые иммунные эффекты циклофосфамида. Наука. 2013; 342: 971–6.
CAS PubMed PubMed Central Статья Google Scholar
Daillère R, Vétizou M, Waldschmitt N, Yamazaki T., Isnard C, Poirier-Colame V, et al. Enterococcus hirae и Barnesiella gastinihominis способствуют терапевтическому иммуномодулирующему действию, вызванному циклофосфамидом. Иммунитет. 2016; 45: 931–43.
PubMed Статья CAS Google Scholar
Гопалакришнан В., Спенсер К., Нези Л., Рубен А., Эндрюс М., Карпинец Т. и др. Микробиом кишечника модулирует ответ на иммунотерапию против PD-1 у пациентов с меланомой.Наука. 2018; 359: 97–103.
CAS Статья PubMed Google Scholar
Скотт А.Дж., Александр Дж.Л., Меррифилд Калифорния, Каннингем Д., Джобин С., Браун Р. и др. Консенсусное заявление Международного консорциума по раковым микробиомам о роли микробиома человека в канцерогенезе. Кишечник. 2019; 68: 1624–32. gutjnl-2019-318556
CAS PubMed PubMed Central Статья Google Scholar
Crook N, Ferreiro A, Gasparrini AJ, Pesesky MW, Gibson MK, Wang B и др. Адаптивные стратегии кандидата в пробиотики E. coli Nissle в кишечнике млекопитающих. Клеточный микроб-хозяин. 2019; 25: 499–512. e498.
CAS PubMed PubMed Central Статья Google Scholar
Шин В., Ким Х.Дж. Дисфункция кишечного барьера управляет началом воспалительного взаимодействия между хозяином и микробиомом при воспалении кишечника человека на чипе.Proc Natl Acad Sci USA. 2018; 115: E10539 – E10547.
CAS PubMed Статья Google Scholar
Влияние часто используемых лекарств на состав и метаболическую функцию микробиоты кишечника
Употребление наркотиков
В этом исследовании мы использовали три голландские когорты: общую популяционную когорту, когорту пациентов с ВЗК и случай-контроль. когорта пациентов с СРК (см. методы). 1126 из 1883 участников из всех трех когорт принимали хотя бы один препарат во время отбора проб фекалий.Количество препаратов, использованных на одного участника, варьировалось от 0 до 12, со средними значениями 0 для когорты населения (среднее 1,03, n = 1124), 2 для когорты IBD (среднее 2,35, n = 454) и 1 для когорты IBS (среднее 1,6, n = 305) (таблица 1, дополнительные данные 1 и 2). В общей сложности мы наблюдали 537 различных комбинаций лекарств, наиболее частой из которых была комбинация бета-симпатомиметического ингалятора со стероидным ингалятором (18 пользователей) (дополнительные данные 2). Использование стероидных ингаляторов сильно коррелировало с использованием бета-симпатомиметических ингаляторов (R когорта населения = 0.78, R IBD-когорта = 0,65, R IBS-когорта = 0,78, корреляция Спирмена, коэффициент ложного обнаружения [FDR] <0,05) (дополнительные данные 3-5). У пациентов с ВЗК наиболее сильная корреляция наблюдалась между добавками кальция и витамина D (R = 0,84, корреляция Спирмена, FDR <2 × 10 -16 ). Месалазины (36%), тиопурины (33%) и агенты против TNFα (25%) присутствовали в 10 наиболее часто используемых лекарствах в когорте ВЗК (таблица 1). Поскольку тиопурины и агенты против TNFα использовались исключительно в когорте пациентов с ВЗК, эти препараты не были включены в наши многолекарственные анализы.
Таблица 1 Употребление наркотиков на когорту. Число и процент потребителей наркотиков в каждой когорте.Микробная экосистема и использование лекарств
Сначала мы исследовали влияние каждого отдельного препарата на богатство и общий микробный состав кишечника. Как описано ранее, когорты с заболеванием имели более низкое микробное богатство по сравнению с общей популяционной когортой (популяционная когорта Шеннона, индекс , среднее значение = 2,26 (0,96–2,91), когорта ВЗК, когорта Шеннона, индекс , среднее значение = 2.1 (0,38–2,78), когортный индекс Шеннона СРК среднее значение = 2,02 (1,01–2,65)) 15 . Внутри когорт мы не наблюдали каких-либо значительных изменений микробного богатства, связанного с использованием какого-либо лекарства или количества различных используемых лекарств (корреляция Спирмена, FDR> 0,05, дополнительные данные 6, рис. 1). Тем не менее, мы наблюдали различия между количеством используемых лекарств и общим микробным составом во всех когортах (тест пермутационного многомерного дисперсионного анализа (PERMANOVA); популяционная когорта: r 2 = 0.006, FDR = 0,001; Когорта IBD: r 2 = 0,015, FDR = 0,001; Когорта IBS: r 2 = 0,014, FDR = 0,0014; Дополнительные данные 7). ИПП были единственным индивидуальным препаратом, связанным с изменениями состава во всех когортах (PERMANOVA, популяционная когорта: r 2 = 0,007, FDR = 0,006; когорта IBD: r 2 = 0,023, FDR = 0,0006; когорта IBS : r 2 = 0,021, FDR = 0,01).
Рис. 1: Микробное богатство (индекс Шеннона) для каждого участника, стратифицированное по количеству использованных лекарств.Точки представляют значение богатства для каждого образца в исследовании. Коробчатая диаграмма показывает медианный и межквартильный размах (25-е и 75-е). Усы показывают диапазон 1,5 * IQR. Черные линии показывают линейную регрессию с фиолетовой тенью, обозначающей доверительный интервал 95%. Слева направо: когорта IBD ( N = 454 выборки, линейная регрессия, коэффициент = -0,001, p = 0,88), популяционная когорта ( N = 1124 выборки, линейная регрессия, коэффициент = -0,002, р = 0.77) и когорты IBS ( N = 305 образцов, линейная регрессия, коэффициент = -0,016, p = 0,06). (Исходные данные представлены в виде файла исходных данных).
Таксоны и пути, связанные с употреблением наркотиков
В метаанализе, учитывающем возраст, пол, ИМТ и глубину секвенирования хозяина, 154 связи между отдельными таксонами и 17 группами лекарств оказались статистически значимыми (метаанализ обратной дисперсии , FDR <0,05, рис. 2а, дополнительные данные 8).ИПП, метформин, добавки витамина D и слабительные были отдельными препаратами с наибольшим количеством ассоциаций (> 10) в анализе отдельных препаратов. Интересным наблюдением было то, что изменения в численности определенных таксонов были связаны с несколькими независимыми лекарствами. Например, количество Streptococcus salivarius увеличилось у пользователей опиатов, пероральных стероидов, ингибиторов агрегации тромбоцитов, ИПП, антидепрессантов СИОЗС и добавок витамина D (метаанализ обратной дисперсии, FDR <0.05). Однако мы также наблюдали особенности, специфичные для отдельных препаратов: повышенная численность Bifidobacterium dentium была характерна для пользователей ИПП (метаанализ обратной дисперсии, FDR = 9,38 × 10 −17 ) и повышенное количество бактерий. Eubacterium ramulus был специфичным для участников, принимавших антидепрессанты СИОЗС (метаанализ обратной дисперсии, FDR = 0,047). Использование лекарств также было связано с функциональными изменениями кишечника. В том же анализе 411 микробных путей были связаны с 11 лекарствами (метаанализ обратной дисперсии, FDR <0.05, рис. 2b, дополнительные данные 9).
Рис. 2: Обзор количества связанных микробных признаков.a , b Столбчатые диаграммы, показывающие количество ассоциаций между каждым типом лекарственного средства и таксонами микробов a и микробными путями b . Цвета столбцов указывают на результаты отдельных когорт и результаты метаанализов. Черные столбцы показывают когорту населения, темно-серые столбцы — когорту IBS, светло-серые столбцы — когорту IBD, а красные столбцы — результаты метаанализов.Модель с одним лекарством показывает связь при одновременном рассмотрении одного препарата с учетом возраста, пола и ИМТ. Модель с несколькими лекарствами рассматривает использование нескольких типов наркотиков с учетом возраста, пола и ИМТ. (Исходные данные представлены в виде файла исходных данных).
Чтобы учесть несколько групп лекарств, назначаемых одновременно, мы протестировали каждый препарат, добавляя другие препараты в качестве ковариант в линейных моделях. В целом было обнаружено 47 ассоциаций между относительной численностью микробов и использованием шести препаратов (метаанализ обратной дисперсии, FDR <0.05, рис. 1b, дополнительные данные 10). ИПП, слабительные и метформин показали наибольшее количество ассоциаций с микробной таксономией и путями. Несмотря на небольшое количество пользователей антибиотиков, в этом метаанализе (метаанализ обратной дисперсии, FDR = 0,001) наблюдалось снижение количества Bifidobacterium рода . Пользователи слабительных показали более высокую численность видов Alistipes и Bacteroides в своем микробиоме (метаанализ обратной дисперсии, FDR <0,05).Связь между применением антидепрессантов СИОЗС и Eubacterium ramulus оставалась значимой после рассмотрения использования нескольких лекарственных препаратов (метаанализ обратной дисперсии, FDR = 0,032). В этом мультилекарственном анализе 271 путь был связан с четырьмя категориями лекарств: ИПП, слабительные, антибиотики и метформин (метаанализ обратной дисперсии, FDR <0,05, дополнительные данные 11). Интересно, что в то время как использование антибиотиков было связано с более низким распространением микробных путей, таких как биосинтез аминокислот, использование метформина было связано с повышенным метаболическим потенциалом бактерий (метаанализ обратной дисперсии, FDR <0.05). В категории антибиотиков тетрациклины показали самую сильную связь с измененными путями (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 12). Более того, обилие микробных путей у потребителей слабительных и ИПП действительно показало некоторое сходство, включая увеличение использования глюкозы (усиление путей гликолиза) и уменьшение путей деградации крахмала и биосинтеза ароматических соединений (метаанализ обратной дисперсии, FDR <0,05 ). Все связи между таксономией, путями и отдельными лекарствами можно найти в дополнительных данных 13–46.
Когортные изменения в составе микробиома кишечника
Изменения в составе микробиоты кишечника у пациентов с ВЗК и СРК наблюдались до 15,20,21 . Поэтому мы исследовали, присутствовали ли эти изменения также в ассоциациях между микробиотой и использованием лекарства. В когорте пациентов с ВЗК употребление бензодиазепинов было связано с увеличением численности Haemophilus parainfluenzae (линейная регрессия, t -тест, FDR = 0.008, Дополнительные данные 47). Интересно, что эта бактерия чаще встречается у пациентов с ВЗК, чем у здоровых людей. Использование трициклических антидепрессантов было связано с повышенным содержанием Clostridium leptum , а прием левотироксина было связано с более высоким содержанием Actinomyces в когорте ВЗК (линейная регрессия, t -тест, FDR = 0,005 и 0,005, соответственно, Дополнительные данные 47). Кроме того, 17 пользователей стероидных ингаляторов в когорте СРК показали более высокое содержание Streptococcus mutans и Bifidobacterium dentium в микробиоме кишечника (линейная регрессия, t -тест FDR = 0.001 и 0,01 соответственно, дополнительные данные 40). Интересно, что пациенты с ВЗК, принимавшие пероральные стероиды, показали более высокое содержание Methanobrevibacter smithii (линейная регрессия, t -тест, FDR = 0,004, дополнительные данные 47). Эта связь также отражалась на уровне пути: четыре пути, связанные с использованием этого препарата, также показали высокую корреляцию с численностью Methanobrevibacter smithii (корреляция Спирмена, rho> 0,93, FDR <2 × 10 −16 , Дополнительные данные 48 и рис.3). Два из этих путей участвуют в метаногенезе, один — в биосинтезе витамина В2, а другой — в биосинтезе нуклеозидов. И наоборот, использование других лекарств, обычно назначаемых для лечения ВЗК, не показало сильной связи с микробным составом. Было обнаружено, что только численность видов Erysipelotrichaceae несколько увеличилась у пользователей месалазина (линейная регрессия, t -тест, FDR = 0,047, дополнительные данные 49).
Рис. 3. Корреляция между относительной численностью Methanobrevibacter smithii и путями, связанными с пероральными стероидами.Точки раскрашены по когорте исследования. Синим цветом обозначена когорта пациентов с ВЗК, желтым — популяционная когорта, а серым — когорта случай-контроль. X -ось представляет относительную численность Methanobrevibacter smithii и Y -ось чтения на килобазу (RPK) каждого пути. Корреляция Спирмена использовалась для расчета корреляции и значимости. (Исходные данные представлены в виде файла исходных данных).
Микробиомная подпись пользователей ИПП
ИПП составили наибольшее количество ассоциаций, в общей сложности 40 измененных таксонов и 166 измененных микробных путей в анализах одного лекарства (метаанализ обратной дисперсии, FDR <0.05, дополнительные данные 8 и 9).
При корректировке воздействия других типов лекарств 24 таксона и 133 микробных пути оставались значимо связанными с ИПП (метаанализ обратной дисперсии, FDR <0,05). Мы наблюдали повышенную численность Veillonella parvula , которая, как известно, устанавливает мутуалистическую связь с Streptococcus mutans путем совместной агрегации и трансформации продуктов метаболизма бактерий, ферментирующих углеводы 22 (метаанализ обратной дисперсии, FDR = 1.61 × 10 −6 и 6,13 × 10 −24 соответственно).
Функциональные изменения включали увеличение биосинтеза жирных кислот и липидов, ферментационный метаболизм НАД и биосинтез L-аргинина. Пути, связанные с использованием ИПП, включают функции, которые имеют широкий таксономический вклад. Однако более пристальный взгляд на прогнозируемый микробный вклад и семейства генов, участвующих в каждом пути, показал, что обогащение конкретных микробных механизмов, вероятно, объясняется изменениями, наблюдаемыми в таксономическом составе.Распад дезоксирибонуклеозида пурина, путь, используемый в качестве источника энергии и углерода, был предсказан на основе геномов более 25 различных родов бактерий (рис. 4). Увеличение этой функции в микробиоме кишечника потребителей ИПП можно объяснить увеличением численности видов Streptococcus ( S. salivaris, S. parasanguinis и S. vestibularis ) (двусторонний тест Вилкоксона, FDR <0,05). ). Три пути, вовлеченные в биосинтез L-аргинина (MetaCyc ID: PWY-7400, ARGSYNBSUB и ARGSYN), были более распространены в микробиоме пользователей ИПП.В то время как несколько бактериальных таксонов, включая виды Bifidobacterium и Ruminococcus , по прогнозам, вносят вклад в эти пути, только путей Streptococcus mutans показали значительное обогащение (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 50). Эти анализы также проводились для метформина, антибиотиков и слабительных средств (дополнительные данные 51–53).
Рис. 4: Вклад микробов в путь деградации пурин-дезоксирибонуклеозида.Коробчатые диаграммы представляют относительный вклад каждого микроба в общую количественную оценку пути для каждой когорты отдельно. Сверху представлена когорта IBD, в середине — когорта IBS, а в нижнем ряду — когорта LLD. Графики в синем ящике представляют значения пользователей PPI. Красные прямоугольные диаграммы представляют значения пользователей, не использующих PPI. Звездочки указывают на статистически значимые различия между пользователями ИПП и непользователями (тест Вилкоксона, FDR <0,05). Коробчатые диаграммы показывают медианы и первый и третий квартили (25-й и 75-й процентили) соответственно.Верхние и нижние усы увеличивают наибольшее и наименьшее значение не более чем на 1,5 * IQR, соответственно. Выбросы наносятся индивидуально.
Различные типы ИПП, а именно омепразол, эзомепразол и пантопразол, проявляют аналогичное действие на микробиом кишечника. Кроме того, из 133 микробных путей, связанных с использованием ИПП, 46 путей также продемонстрировали дозозависимые эффекты (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 12). Например, участники, использующие более высокую дозировку ИПП (больше или равную 40 мг / день), показали заметное уменьшение пути, участвующего в биосинтезе аминокислот (PWY-724), по сравнению с участниками, принимавшими низкие дозы (двусторонняя Тест Вилкоксона, FDR = 0.00065, Дополнительные данные 12).
Метформин связан с изменениями метаболического потенциала
В то время как изменения в численности видов Streptococcus , Coprococcus и Escherichia изначально были обогащены у потребителей метформина, эти ассоциации больше не были значимыми после корректировки на употребление других видов наркотиков. Однако предполагаемая ассоциация с Escherichia coli (линейная регрессия, t -тест, FDR = 0.08, дополнительные данные 10), а в когорте ВЗК количество Streptococcus mutans было немного увеличено у участников, принимавших этот препарат (линейная регрессия, t -тест, FDR = 0,05) (дополнительные данные 47).
Поразительно, но функциональные последствия использования метформина были значительными даже после поправки на использование других лекарств: 48 микробных путей изменились по сравнению с теми, кто не принимал (метаанализ обратной дисперсии, FDR <0,05, дополнительные данные 11).Использование метформина было связано с изменениями метаболического потенциала микробиома, в частности, с увеличением производства бутаноата, биосинтеза хинона, деградации производных сахара и путей устойчивости к полимиксину (дополнительные данные 11). Интересно, что прогнозирование метагеномного пути и анализ семейств генов показали, что виды Enterobacteriaceae, в основном Escherichia coli , вносили основной вклад в функциональные изменения, связанные с использованием метформина. Наши данные показывают, что физиологические изменения, вызванные метформином, могут обеспечить конкурентное преимущество энтеробактериальным видам, что потенциально может иметь последствия для здоровья (двусторонний тест Вилкоксона, FDR <0.05, Дополнительные данные 51). Кроме того, мы не выявили дозозависимых эффектов использования метформина на ассоциированные пути (двусторонний тест Вилкоксона, FDR> 0,05, дополнительные данные 12).
Эффект от приема антидепрессантов СИОЗС у пациентов с СРК
Антидепрессанты СИОЗС были среди 10 наиболее часто используемых препаратов в когорте СРК. У пользователей СИОЗС единственными таксонами, которые оставались статистически значимыми в метаанализе с несколькими лекарственными препаратами, была повышенная численность Eubacterium ramulus (метаанализ обратной дисперсии, FDR = 0.032, Дополнительные данные 10). Эта категория лекарств включала шесть различных подтипов лекарств, в которых пароксетин составлял 32% пользователей СИОЗС (дополнительные данные 1). Интересно, что, несмотря на низкие числа, повышенная численность Eubacterium ramulus в основном наблюдалась у пользователей пароксетина (двусторонний тест Вилкоксона, FDR = 0,054, значение P = 0,003, дополнительные данные 12).
Кроме того, путь, участвующий в созревании пептидогликана, был снижен в метаанализе нескольких лекарственных препаратов пользователей антидепрессантов СИОЗС по сравнению с теми, кто не принимал (метаанализ обратной дисперсии, FDR = 0.13). Однако этот результат в основном наблюдался в когорте IBS (линейная регрессия, t -тест, FDR = 0,002, дополнительные данные 38).
Употребление наркотиков связано с разными профилями резистома
Становятся доступными доказательства in vitro, указывающие, что не только использование антибиотиков может усиливать АР: неантибиотические препараты также могут способствовать этому механизму 11 . Чтобы решить эту проблему, мы сначала проанализировали для всех трех когорт отдельно, увеличилось ли общее количество генов AR у потребителей отдельных наркотиков по сравнению с теми, кто не принимал никаких наркотиков.Для общей популяции общее количество генов AR было увеличено для пользователей метформина и ИПП (двусторонний тест Вилкоксона, FDR = 0,04 и 0,04, соответственно, дополнительные данные 54). В когорте СРК после поправки на множественное тестирование ни один из препаратов не был связан с увеличением генов AR (двусторонний тест Вилкоксона, FDR> 0,05). В когорте ВЗК это увеличение наблюдалось у потребителей опиатов и трициклических антидепрессантов (двусторонний тест Вилкоксона, FDR = 0,04 и 0,04, соответственно).Если мы используем менее строгий предел FDR <0,25, 15 препаратов были связаны с количеством маркеров AR в трех когортах. Чтобы определить, какие группы препаратов были связаны с увеличением отдельных генов AR, мы проанализировали количество отдельных генов AR. Во всех трех когортах мы выявили последовательное увеличение трех маркеров гена AR у пользователей ИПП по сравнению с участниками, не принимающими никаких наркотиков (двусторонний тест Вилкоксона, FDR <0,05, дополнительные данные 55). Эти гены принадлежат к tetA , tetB и Mel (ARO: 3004033, ARO: 3004032 и ARO: 3000616 соответственно), которые являются частями оттокных насосов, которые выкачивают определенные типы антибиотиков из бактерий и тем самым ингибируют функциональные механизмы этих антибиотиков 23,24 .Для tetA и tetB это влияет на тетрациклины группы антибиотиков 23 . Для Mel он влияет на антибиотики группы макролидов 24 .
Эти маркеры AR имеют самую высокую корреляцию с Streptococcus parasanguinis (корреляция Спирмена, rho между 0,56–0,75, FDR <0,05). Мы идентифицировали три АР, которые также были протестированы in vitro 11 . Например, известно, что AR TolC участвует в работе нескольких насосов оттока нескольких лекарственных средств 23 и статистически значимо увеличивался в шести группах препаратов: три в нашей общей популяции (ИПП, статин и метформин), два в наша когорта СРК (стероидный спрей для носа и левотироксин) и одна в нашей когорте ВЗК (трициклические антидепрессанты) (двусторонний тест Вилкоксона, FDR <0.05). Другим примером AR, протестированного in vitro, является mdtP , еще одна оттокная помпа с множественной лекарственной устойчивостью, которая была увеличена у пользователей метформина в нашей общей популяции (двусторонний тест Вилкоксона, FDR = 0,001) и у пользователей трициклических антидепрессантов в когорта IBD (двусторонний тест Вилкоксона, FDR = 0,017, дополнительные данные 55).
Микробиота кишечника, потенциальная новая мишень для китайских лекарственных трав при лечении сахарного диабета
Микробиота кишечника, как важный фактор, влияющий на здоровье хозяина, играет значительную роль в возникновении и развитии сахарного диабета (СД), а также в его механизме. может быть связано с избытком эндотоксинов, измененными короткоцепочечными жирными кислотами (SCFA) и нарушением метаболизма желчных кислот.Традиционная китайская медицина (ТКМ) имеет долгую историю лечения СД, но ее механизм не очень ясен. Недавние исследования показали, что китайская фитотерапия может улучшить метаболизм глюкозы за счет ремоделирования микробиоты кишечника, что открывает новые возможности для дальнейших исследований механизмов гипогликемии. В этом обзоре представлен недавний прогресс китайских трав, травяных экстрактов и препаратов растительных соединений в лечении СД за счет регулирования микробиоты кишечника и обобщены основные задействованные механизмы, а именно противовоспалительные и антиоксидантные эффекты, защита кишечного барьера и ингибирование липотоксичности.Кроме того, предлагаются некоторые предложения по улучшению.
1. Введение
Сахарный диабет (СД) — серьезная проблема для здоровья, которая угрожает людям во всем мире. В 2017 году Международная федерация диабета (IDF) выпустила восьмое издание «Карты диабета IDF», которая показала, что во всем мире около 425 миллионов взрослых (20-79 лет) страдают от СД, и это число может достигнуть 629 миллионов. к 2045 году. В Китае примерно 114,4 миллиона человек (20-79 лет) живут с DM; таким образом, Китай занимает первое место в мире (http: // www.diabatlas.org). В последние несколько лет люди постепенно осознали, что функция метаболизма человека определяется не только нами, но и тесно связана с нашим «вторым геномом» — кишечной микробиотой, которая открыла еще одну дверь для лучшего понимания DM. [1–3]. Чтобы найти лучший лечебный эффект от СД, были разработаны и постепенно внедрены в клиническую практику множество пробиотических, пребиотических и синбиотических препаратов [4].
Традиционная китайская медицина (ТКМ) лечит СД более 2000 лет.В последние годы накопление доказательств подтвердило, что традиционная китайская медицина может улучшить СД с помощью различных молекулярных механизмов [5], а ремоделирование кишечной микробиоты является важным направлением исследований [6]. Помимо специфических изменений в некоторых кишечных бактериях после приема лекарственных трав, исследователи также обращают внимание на то, как улучшенная микробиота кишечника влияет на метаболизм хозяина. В этом обзоре мы обобщаем соответствующую литературу, пытаемся выделить несколько основных путей, связывающих кишечную микробиоту и гликометаболизм, а затем предлагаем возможные будущие направления, которые могут улучшить ограничения текущих исследований.
Был проведен поиск литературы с использованием баз данных PubMed, CNKI, Chinese Biomedical Literature, Wanfang и VIP. Ключевые слова для поиска включали «диабет», «кишечная микробиота», «кишечная микрофлора», «кишечная флора», «кишечная микрофлора», «традиционная китайская медицина», «фитотерапия» и «травы». Мы также провели поиск связанные ссылки.
2. Взаимосвязь между DM и кишечной микробиотой
Кишечная микробиота не только влияет на кишечник, но также оказывает глубокое влияние на метаболическую функцию хозяина посредством различных механизмов [1].В последние десятилетия накопленные данные свидетельствуют о тесной связи между сахарным диабетом и микробиотой кишечника. Два когортных исследования с участием людей в Китае и Европе показали, что в микробиоте кишечника пациентов с сахарным диабетом 2 типа (СД2) наблюдаются композиционные и функциональные изменения. Например, количество бутират-продуцирующих бактерий Roseburia и Faecalibacterium prausnitzii было ниже [7, 8]. Кроме того, исследование, основанное на китайской популяции хань, показало, что по сравнению со здоровыми людьми, люди с сахарным диабетом 1 типа (СД1) имели совершенно другую микробиоту кишечника, а численность Bacteroides положительно коррелировала с аутоантителами [9].
Как нарушенная микробиота кишечника влияет на углеводный обмен в организме хозяина? Согласно текущим исследованиям, причины могут быть связаны со следующими факторами: (1) липополисахариды (ЛПС): ЛПС являются жизненно важным компонентом внешней мембраны грамотрицательных бактерий, в то время как они могут вызывать легкое воспаление, связанное с СД, когда чрезмерное попадание ЛПС в кровоток [10]; (2) короткоцепочечные жирные кислоты (SCFAs): SCFAs, в основном включающие уксусную кислоту, пропионовую кислоту и масляную кислоту, являются основными продуктами ферментации, производимыми из неперевариваемой клетчатки и полисахаридов, а снижение уровня SCFA может нарушить метаболический гомеостаз хозяина, поскольку они связаны с энергетическим обменом, секрецией GLP-1 и целостностью слизистой оболочки кишечника [11]; (3) желчные кислоты (ЖК): ЖК продуцируются деградацией холестерина и метаболизируются микробиотой кишечника, а нарушенный метаболизм ЖК может влиять на экспрессию рецепторов желчных кислот в кишечнике, а затем нарушать соответствующие пути метаболизма глюкозы [12]; (4) проницаемость кишечника: нарушенная микробиота кишечника может нарушить белки плотных контактов кишечника, повысить проницаемость кишечника и привести к постоянной утечке ЛПС, что, в свою очередь, вызывает системное воспаление низкой степени [13]; (5) сбор энергии: кишечная микробиота, связанная с ожирением, более эффективно использует энергию, получаемую с пищей, что приводит к перегрузке энергии в организме хозяина, что формирует решающую основу для возникновения инсулинорезистентности и СД2 [14]; (6) кишечная иммунная система: микробиота кишечника имеет решающее значение для развития и модуляции иммунной системы слизистой оболочки кишечника, а дисфункциональное взаимодействие между микробиотой кишечника и иммунной системой связано с возникновением СД1 [15].И наоборот, улучшенная микробиота кишечника может регулировать один или несколько из вышеперечисленных путей, оказывая комплексное терапевтическое воздействие на СД.
3. Доказательства того, что китайские лекарственные травы лечат СД путем регулирования кишечной микробиоты
3.1. Травы и экстракты трав
Folium Mori для лечения Xiaoke (название DM в традиционной китайской медицине) записан в Справочнике Materia Medica [16], и его гипогликемический эффект был подтвержден в экспериментах на животных [ 17] и клинических испытаний [18].Кормление диабетических крыс рационом, содержащим 20% Folium Mori power, в течение 8 недель может подавить сигнальный путь неэтерифицированных жирных кислот (NEFA) и уменьшить гипергликемию. В то же время доля Bacteroidetes в кишечных бактериях восстанавливается после обработки Folium Mori [19]. Другое исследование подтвердило, что Folium Mori может способствовать продукции SCFAs и регулировать метаболизм стероидов и BAs [20]. В дополнение к Folium Mori , Dendrobium Candidum может облегчить окислительный стресс в печени [21], а Rhizoma Dioscoreae способствует снижению уровня глюкозы в крови пациентов с СД2 [22].Их подробности приведены в Таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||