норма в анализе крови у взрослых и детей, причины повышения
Противостоять болезням организму помогают антитела. Их выработка происходит в костном мозге. Здесь идёт созревание лимфоцитов, нейтрофилов, базофилов, эозинофилов, моноцитов. Больше всего образуется лимфоцитов – главных борцов иммунной системы, которые занимаются защитой организма. Наряду с ними существуют клетки с особыми параметрами, функциями. Атипичные лимфоциты – это разновидность иммунных тел. Причиной их появления становятся аллергические реакции, инфекции. Воздействие патогенных организмов меняет их структуру, форму. При нормальном состоянии человека они отсутствуют. Разного рода заболевания провоцируют их появление.
Особенности
Атипичный или реактивный лимфоцит имеет особенности. Его отличают:
- Форма неправильного многоугольника с рваными краями. Для здорового лейкоцита характерны ровные границы, округлость.
- Увеличение размера. Самыми крупными лейкоцитами являются макрофаги. Их размер достигает 12 мкм. Для лимфоцитов характерен небольшой размер. Они увеличиваются под влиянием вирусов и достигают 30 мкм.
- Клеточное ядро вытягивается, становится продолговатым. При исследовании под микроскопом видны трещины.
- Окрашивание в яркий цвет при анализе с использованием гематоксилина и эозина. Клетки меняют окрас на синий, иногда на тёмно-серый. Цвет ядра становится фиолетовым.


Чтобы выявить присутствие аномальных клеток, анализируют состав крови, так как она содержит большое число иммунных тел. Ткани организма аккумулируют их в меньшем количестве.
Разновидности
Структура клетки меняется под воздействием микроорганизмов. Как результат, полностью меняются её функции и параметры.
Дегенеративные
Период длительной интоксикации приводит к образованию дегенеративных клеток, которые не способны делиться и функционировать из-за скопившихся токсинов. Их размер уменьшается либо увеличивается. Виновниками изменений называют дистрофию печени, сепсис, абсцесс.
Клетки Дауни
Размер атипичных мононуклеаров больше, чем здоровых лимфоцитов. Для них характерно наличие моноцитарного ядра. Лимфомоноциты являются показателем наличия вирусной инфекции. Чаще всего это герпес либо мононуклеоз. Выздоровление приводит к нормализации состава крови. В крови у детей атипичные мононуклеары присутствуют в количестве не более 1%. Показатели могут быть повышены из-за недавно перенесённых болезней или прививки. У взрослых их также обнаруживают. Появление таких клеток связывают с ростом вероятности заражения герпесом или проявлением аллергии.
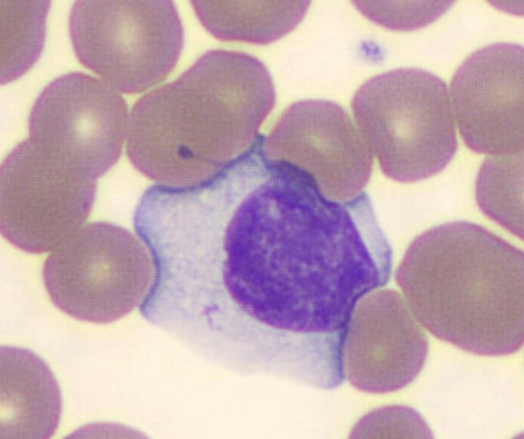

Клетки Дауни в крови
Клетки-тени Боткина-Клейна-Гумпрехта
Это понятие включает разрушенные лимфоидные клетки, полученные при подготовке исследуемого материала к анализу. Это значит, что кровяные тельца подвержены быстрому разрушению. Из-за сложности обнаружения они названы тенями. Характерно для хронического лимфолейкоза.
Клетки Ридера
Обнаружение почкообразных клеток с ядрами, имеющими зазубренный контур, сигнализирует о серьёзных заболеваниях. Чаще всего человек болен лейкемией, пернициозной анемией, тяжёлыми инфекциями.
Что вызывает появление
При обследовании обнаруживают атипичные лимфоциты в анализе крови даже при отсутствии жалоб. При развитии болезни их число растёт, попутно появляются новые атипичные клетки, главными виновниками возникновения которых становятся инфекции вирусного происхождения, аллергия. Попадание микробов внутрь организма провоцирует защитную реакцию иммунной системы. Начинается выработка антител для борьбы с возбудителем заболевания. При сниженной иммунной защите созревание может не произойти, клетка видоизменяется, приобретает иные качества.
Превышение нормы содержания в крови лимфоцитов, а также образование атипичных клеток может возникать при наличии рака. Наряду с ним существуют другие причины. Самая частая – инфекции, а также аллергия, от которой страдают жители мегаполисов. Приумножение числа лимфоцитов ведёт к лимфоцитозу.
Выявление клеток с нетипичными свойствами ассоциируется с опасными болезнями. Известны четыре основных группы факторов, влияющих на их возникновение:
- Присутствие в организме инфекций, вызванных вирусами, бактериями.
- Последствия интоксикации.
- Радиационное воздействие.
- Онкологические заболевания, наличие генетических патологий.
Нетипичные лимфоцитарные клетки образуются, если человек болен:
- Бруцеллёзом – заболеванием домашних животных, передающимся людям. Недуг протекает с поражением нервной системы, сердца, сосудов, костей, суставов.
- Лимфолейкозом – онкологией, при которой злокачественные клетки поражают ткани лимфы.
- Сифилисом – венерическим заболеванием с поражением кожных, слизистых покровов. Болезнь ухудшает состояние костной ткани, осложняет работу органов и систем.
- Токсоплазмозом – бессимптомной инфекцией, вызванной токсоплазмами. Источником заражения становятся кошки.
Лекарства и сыворотки, имеющие животное происхождение, также способствуют формированию реактивных лимфоцитов. У ребёнка этот процесс вызывают менингококковая инфекция, коклюш, корь, ряд других заболеваний.
Диагностика выявляет присутствие атипичных лимфоцитов у здоровых людей. Даже если взрослый человек не жалуется на проявления болезней, ему рекомендуют обратиться за консультацией к гематологу.

Реактивные лимфоциты в детском возрасте
Обозначение нормы состава крови детей и взрослых отличается. В организме здорового ребёнка отсутствуют атипичные лимфоциты. Часто причиной их появления становится мононуклеоз. При этой болезни нарушается целостность лейкоцитов, меняется состав их ядра. В результате иммунитет ослабевает, ребёнок заражается инфекциями.
Причинами лимфоцитоза у детей считают:
- вирусный гепатит;
- приём лекарств, таких как Тетрациклин;
- дефицит витаминов и минералов;
- проблемы пищеварительных органов;
- ветрянку, корь, скарлатину.
Ускорить выздоровление, избежать осложнений помогает ранняя диагностика. Выявить наличие проблемы способен анализ крови. Известный педиатр Комаровский рекомендует проводить такое исследование минимум один раз в год. Это позволит иметь сравнительные данные о составе крови, когда ребёнок здоров, а также во время болезни.
Симптомы
Атипичные лимфоциты никак не проявляются. Симптоматика возникает, когда болезнь поражает органы. Родители отмечают у детей:


- повышение температуры;
- появление сонливости, слабости;
- распространение инфекции на органы дыхания.
В ряде случаев появляются высыпания, кожа начинает зудеть. Отсутствие лечения ухудшает состояние. Требуется получить медицинскую помощь.
Лечение
Для нормализации состояния врачи проводят комплексную терапию:
- Лимфоцитарными препаратами снижают уровень лимфоцитов.
- Противовирусными, противовоспалительными средствами, антибиотиками борются с вирусами, инфекциями.
- Подбирают диету. Рекомендуют питание с высоким содержанием витаминов, микроэлементов. Ограничивают потребление жиров, соли.
- С онкологическими заболеваниями борются проведением курса химиотерапии.
Допустимые значения
Присутствие атипичных лимфоцитов допустимо у совершенно здорового человека, их норма – менее 6%. Повышенные показатели говорят о развитии патологии, необходимости начать лечение. В такой ситуации врач проводит диагностику и обследование. Для выбора лечения выясняют первопричину недуга.
Часто рекомендуют употреблять витамины, минералы, чтобы укрепить иммунитет. Заболевание вирусного характера лечат противовирусными препаратами. Аллергию устраняют противогистаминными, антиаллергенными средствами. Врачи советуют придерживаться диеты, исключить вредные привычки.
Клетки с атипичными свойствами в организме сигнализируют о проникновении вируса, развитии патологии. Обращение в поликлинику поможет выявить причину и устранить её.
Хронический лимфолейкоз — Википедия
| Хронический лимфолейкоз | |
|---|---|
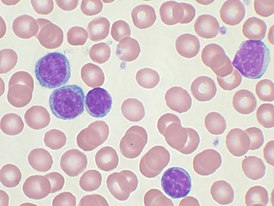 Злокачественные клетки в мазке периферической крови | |
| МКБ-10 | C91.191.1 |
| МКБ-10-КМ | C91.1 и C91.10 |
| МКБ-9 | 204.9204.9 |
| МКБ-9-КМ | 204.1[1][2] |
| МКБ-О | 9823/3 |
| OMIM | 109543, 151400, 609630, 612557, 612558, 612559, 151400, 609630, 109543, 612557, 612559 и 612558 |
| DiseasesDB | 2641 |
| MedlinePlus | 000532 |
| eMedicine | med/370 |
| MeSH | D015462 |
 | |
Хронический лимфолейкоз, или хронический лимфоцитарный лейкоз (ХЛЛ), — злокачественное клональное лимфопролиферативное заболевание, характеризующееся накоплением атипичных зрелых CD5/CD19/CD23-положительных В-лимфоцитов преимущественно в крови, костном мозге, лимфатических узлах, печени и селезёнке[3].
Хронический лимфолейкоз — одно из наиболее распространённых онкогематологических заболеваний[4]. Также это наиболее частый вариант лейкоза среди представителей европеоидной расы. По непонятным причинам редко встречается среди населения стран Восточной Азии. Дебют заболевания, как правило, происходит в пожилом возрасте — медианный возраст на момент постановки диагноза составляет 70—72 года. Мужчины болеют в 1,5—2 раза чаще, чем женщины. Ежегодная заболеваемость составляет 6,8 случаев на 100 тыс. мужчин и 3,5 случая на 100 тыс. женщин [5].
Предрасположенность к заболеванию передаётся по наследству — риск развития хронического лимфоцитарного лейкоза у непосредственных родственников в 8,5 раз превышает популяционный, однако даже при этом остается ниже 1%[6]. Описаны семейные случаи с относительно высокой пенетрантностью. Большей части случаев ХЛЛ, если не всем, предшествует предлейкозное состояние (моноклональный В-клеточный лимфоцитоз), которое наблюдается у 5—10 % людей в возрасте старше 40 лет и прогрессирует в ХЛЛ с частотой около 1 % в год[7].
Наследственные факторы[править | править код]
Анализ генома людей с наследственным ХЛЛ позволил идентифицировать однонуклеотидные полиморфизмы, ассоциированные с этим состоянием. Полиморфизмы были обнаружены примерно в 30 локусах, например, в генах IRF4, LEF1[en] и BCL2[5].
Факторы окружающей среды[править | править код]
Контакт с агентом «оранж»[8] и инсектицидами[9] могут повышать риск развития ХЛЛ.
Этиологическая связь ХЛЛ с ионизирующим излучением, вирусными инфекциями, питанием и образом жизни не доказана[5].
Первоначально хронический лимфоцитарный лейкоз рассматривали как онкологическое заболевание, характеризующееся накоплением долгоживущих, но очень редко делящихся иммунологически некомпетентных B-лимфоцитов[10]. Однако исследования с использованием тяжёлой воды показали, что злокачественные клетки пролиферируют, и достаточно быстро — количество новых клеток, образующихся за день, составляет от 0,1 до более чем 1 % от общего числа клеток клона[11]. Причём при высокой скорости пролиферации более вероятно агрессивное течение болезни.
Клеточное микроокружение (ниша) играет большую роль в патогенезе хронического лимфолейкоза. Пролиферация злокачественных клеток происходит в микроанатомических структурах, которые называются пролиферативными центрами, или псевдофолликулами. Псевдофолликулы представляют собой скопления лейкозных клеток, находящихся в контакте со вспомогательными клетками (например, стромальными клетками), которые стимулируют их пролиферацию и выживание [12]. Пролиферативные центры в основном находятся в лимфатических узлах и в меньшей степени в костном мозге[13].
Происхождение злокачественного клона[править | править код]
Злокачественные клетки имеют CD19/CD5/CD23-положительный иммунофенотип и низкий уровень мембранных иммуноглобулинов. Нормальные популяции В-клеток с таким набором поверхностных маркеров неизвестны, что мешает установить, какой тип клеток может давать начало злокачественному клону при ХЛЛ. Анализ транскриптома показал, что опухолевые клетки по набору синтезируемых мРНК похожи на зрелые В-клетки, которые прошли активацию антигеном. В норме таким профилем экспрессии генов обладают В-клетки памяти и В-клетки краевой зоны лимфатических фолликулов, поэтому предполагают, что именно они могут быть предшественниками лейкозных клеток[7].
В отличие от других B-клеточных лейкозов, для ХЛЛ не удалось выявить типичных хромосомных транслокаций, затрагивающих онкогены. Кроме того, крупные хромосомные перестройки редко наблюдаются на ранних стадиях заболевания, так что маловероятно, что они являются первичной причиной ХЛЛ. Однако по мере прогрессирования заболевания такие перестройки происходят: чаще всего это делеции участков хромосом 11, 13 и 17
Характерен абсолютный лимфоцитоз в периферической крови (по данным гемограммы) и костном мозге (по данным миелограммы). На ранних стадиях лимфоцитоз является единственным проявлением заболевания. Пациенты могут предъявлять жалобы на так называемые «конституциональные симптомы» — астению, повышенную потливость, спонтанное снижение массы тела.
Характерна генерализованная лимфаденопатия. Увеличение внутригрудных и внутрибрюшных лимфатических узлов выявляется при ультразвуковом или рентгенологическом обследовании, периферические лимфоузлы доступны пальпации. Лимфатические узлы могут достигать значительных размеров, образовывать мягкие или плотноватые конгломераты. Сдавление внутренних органов не характерно.
На более поздних стадиях заболевания присоединяется гепатомегалия и спленомегалия. Увеличение селезёнки может проявляться ощущением тяжести или дискомфорта в левом подреберье, феноменом раннего насыщения.
За счёт накопления опухолевых клеток в костном мозге и вытеснения нормального гемопоэза на поздних стадиях могут развиваться анемия, тромбоцитопения, редко нейтропения. Поэтому пациенты могут жаловаться на общую слабость, головокружения, петехии, экхимозы, спонтанную кровоточивость.
Анемия и тромбоцитопения также могут иметь аутоиммунный генез.
Для заболевания характерна выраженная иммуносупрессия, затрагивающая преимущественно гуморальный иммунитет (гипогаммаглобулинемия). Из-за этого имеется предрасположенность к инфекциям, например, рецидивирующим простудным заболеваниям и пневмонии.
Необычным клиническим проявлением заболевания может быть гиперреактивность на укусы насекомых.
Для дифференциальной диагностики хронического лимфоцитарного лейкоза с другими лимфопролиферативными заболеваниями необходимо проанализировать количество В-клеток в периферической крови, мазок крови и провести иммунофенотипирование циркулирующих в крови лимфоцитов. Дополнительно для определения прогноза (но не схемы лечения) иногда проводят цитогенетическое исследование, определяют мутационный статус локуса IgVH, количество ZAP-70 или CD38 в клетках ХЛЛ, количество CD23, тимидинкиназы и β2-микроглобулина в сыворотке крови, а также анализируют биоптат или аспират костного мозга[14].
Анализ крови[править | править код]
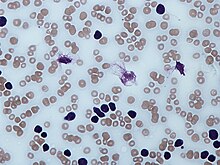 Тени Гумпрехта в мазке крови
Тени Гумпрехта в мазке кровиНеобходимым критерием диагноза хронического лимфоцитарного лейкоза является повышение абсолютного числа В-лимфоцитов в крови до или более 5×10 9/л. Кроме того, эти лимфоциты должны иметь характерный иммунофенотип: на их поверхности должны обнаруживаться CD19, CD5, CD23, небольшие количества CD20 и CD79b, а также лёгкие цепи иммуноглобулинов[15].
В мазке крови обнаруживаются опухолевые клетки, которые имеют морфологию зрелых (малых) лимфоцитов: «штампованное» ядро с конденсированным хроматином без ядрышка, узкий ободок цитоплазмы. Характерно наличие так называемых теней Гумпрехта, которые представляют собой лейкозные клетки, разрушившиеся в процессе приготовления мазка. Помимо малых лимфоцитов в мазке могут присутствовать более крупные или атипичные клетки, иногда отмечается существенная (более 10 %) примесь омоложенных клеток (пролимфоцитов и параиммунобластов), требующая проведения дифференциального диагноза с пролимфоцитарным лейкозом[14].
Иммунофенотипирование[править | править код]
Иммунофенотипирование лимфоцитов методом проточной цитометрии обязательно для подтверждения диагноза. Высокочувствительная проточная цитометрия позволяет обнаруживать одну злокачественную клетку на 10 000 нормальных лейкоцитов
Подозрение на хронический лимфоцитарный лейкоз также возникает в случае обнаружения у в остальном здоровых людей увеличения абсолютного числа клональных B-лимфоцитов соответствующего иммунофенотипа, даже если общее их количество в периферической крови меньше 5000/микролитр. Если этому признаку не сопутствует лимфаденопатия или органомегалия, цитопении или другие признаки заболевания, такое состояние диагностируется как моноклональный B-лимфоцитоз[14]. Согласно исследованию, проведённому на 1520 участниках в возрасте от 62 до 80 лет с нормальными показателями крови, моноклональный B-лимфоцитоз с иммунофенотипом ХЛЛ обнаруживается у 5 % людей в этой возрастной группе. Такой лимфоцитоз может прогрессировать в ХЛЛ со скоростью около 1 % в год[15].
Цитогенетическое исследование[править | править код]
Цитогенетическое исследование проводится методом стандартного кариотипирования или FISH. Задача исследования — выявление хромосомных мутаций, часть из которых имеет прогностическую значимость. Из-за возможности клональной эволюции исследование должно повторяться перед каждой линией терапии и в случае возникновения рефрактерности.
Стандартное кариотипирование возможно только для клеток в метафазе клеточного цикла. Так как злокачественные клетки при ХЛЛ обладают низкой митотической активностью, для получения необходимого для анализа количества метафаз требуется применение митогенов. Но даже в таком случае хромосомные мутации удаётся обнаружить только в 40—50 % случаев
Интерфазная FISH при хроническом лимфоцитарном лейкозе не требует применения митогенов и отличается большей чувствительностью. При анализе используют локус-специфичные зонды, позволяющие выявлять наиболее распространённые хромосомные перестройки (как правило делеции). Этот метод позволяет детектировать хромосомные мутации в более чем 80 % случаев хронического лимфоцитарного лейкоза[16].
У каждого отдельного пациента может быть обнаружена одна, две и более стандартных мутации. Исследование, проведённое на 325 пациентах с хроническим лимфоцитарным лейкозом, позволило установить иерархию кариопитов по их прогностической способности: del17p, del11q, трисомия 12, нормальный кариотип и del13q. Если у пациента обнаружено больше одной мутации, то прогноз делают по той из них, которая находится выше в этом списке[16].
Результат FISH-исследования. Определяется только один аллель гена ATM (зеленая метка). У пациента имеется del11q22.3.Хромосомные перестройки ассоциированы с определёнными клиническими характеристиками заболевания[16]:
- del13q14 выявляется в ~55 % случаев, делеция может быть моно- и биаллельной, заболевание, как правило, диагностируется на ранней стадии и развивается медленно, прогноз благоприятный;
- трисомия по хромосоме 12 выявляется в ~15 % случаев, прогноз обычный;
- del11q выявляется в ~15 % случаев, болезнь диагностируют на более поздних стадиях, выше вероятность проявления конституциональных симптомов, болезнь быстро прогрессирует, прогноз неблагоприятный, данная мутация может ассоциироваться с резистентностью к алкилирующим химиопрепаратам;
- del17p13 выявляется в ~7 % случаев, болезнь диагностируют на более поздних стадиях, выше вероятность проявления конституциональных симптомов, болезнь быстро прогрессирует, прогноз наиболее неблагоприятный, клоны часто бывают устойчивы к стандартным схемам химиотерапии с использованием алкилирующих препаратов и/или аналогов пурина[14];
- del6q21 характеризуется неблагоприятным прогнозом[3].
Другие методы[править | править код]
Рутинный физикальный осмотр позволяет получить достаточное представление о клинической динамике, поскольку заболевание носит системный характер. Выполнение УЗИ и компьютерной томографии для оценки объёма внутренних лимфоузлов не является обязательным вне клинических исследований.
Тест на гемолитическую анемию из-за высокой частоты аутоиммунных осложнений при ХЛЛ необходим даже при отсутствии её явных клинических проявлений. Рекомендуется проводить прямую пробу Кумбса, подсчёт числа ретикулоцитов и определение уровня фракций билирубина.
Как правило проведение биопсии костного мозга не требуется для поставки диагноза. Анализ биоптата может помочь сделать прогноз относительно скорости развития болезни, но последние наблюдения показывают, что использование других прогностических маркеров может давать лучшие результаты. Однако анализ аспирата или пунктата костного мозга может понадобиться для выяснения причин цитопении (специфическое поражение костного мозга или аутоиммунное осложнение) путём исследования миелограммы[14].
Некоторые дополнительные тесты используются для предсказания скорости прогрессирования заболевания, но не влияют на выбор схемы лечения. К таким тестам относится определение наличия соматических мутаций в вариабельной области генов тяжёлых цепей иммуноглобулинов (IgVH) и определение количества CD38 и ZAP-70 в клетках, поражённых хроническим лимфоцитарным лейкозом. IgVH без мутаций указывают для более агрессивную болезнь и менее благоприятный прогноз[17][18][19]. Экспрессия CD38 и ZAP-70 коррелирует с отсутствием мутаций в IgVH и плохим прогнозом. Однако пока не до конца ясно, являются ли эти молекулы независимыми прогностическими факторами[14]. Также на агрессивность болезни указывают повышенное количество тимидинкиназы[20], CD23[21] и β2-микроглобулина[22] в сыворотке крови.
Используются системы стадирования, предложенные K. Rai[23] и J. Binet[24]. Оригинальная система Rai была модифицирована с целью снизить количество определяемых групп риска с 5 до 3[14]. Обе системы опираются на данные физического осмотра и стандартные лабораторные анализы и легки в применении. В них отражено естественное течение заболевания — постепенное накопление опухолевой массы. Стадирование позволяет делать прогнозы о выживаемости: прогноз пациентов на поздних стадиях может быть хуже, чем на более ранних. Однако эти системы не дают возможности прогнозировать индивидуальный риск прогрессирования заболевания и выживания на ранних стадиях (стадии 0-II по Rai, A по Binet)[16]. По этой причине стали широко использовать другие прогностические маркеры, такие как цитогенетические характеристики злокачественных клонов, мутационный статус локуса IgVH и количество ZAP-70 или CD38.
|
| |||||||||||||||||||||||
Хронический лимфолейкоз является практически неизлечимым медленнопрогрессирующим (индолентным) заболеванием.
Лечение не начинается сразу после подтверждения диагноза. Заболевание может сохранять стабильность годами, иногда в течение всей жизни больного. Часто наблюдается волнообразное течение с периодами увеличения и уменьшения опухолевого объема. Решение о необходимости начала терапии принимается обычно после периода более или менее длительного наблюдения.
Показания для начала лечения сформулированы в современных рекомендациях. Они отражают картину активной прогрессии заболевания, приводящей к ухудшению медицинского состояния больного и/или качества его жизни.
Из-за системного характера заболевания радиотерапия при хроническом лимфоцитарном лейкозе не применяется. Стандартом терапии являются химиотерапевтические режимы с включением нуклеотидных аналогов, алкилирующих препаратов и моноклональных антител.
Один из наиболее эффективных режимов — «FCR» (англ. fludarabine, cyclophosphamide, rituximab). Он позволяет получить полную ремиссию примерно у 85 % больных низкой группы риска. Однако этот режим имеет побочные эффекты, которые не позволяют использовать его для пациентов пожилого возраста. Кроме того, режим малоэффективен для больных группы высокого риска (например, имеющих делецию 17p)[25].
Активно исследуется возможность применения в терапии алкилирующего препарата бендамустин.
Резистентость к цитостатикам, как правило, обусловлена нарушением механизмов инициации апоптоза в ответ на повреждения ДНК в клетках опухоли. Наиболее типичны мутации гена TP53, приводящие к его инактивации. Клетки с инактивированным p53 не погибают при накоплении повреждений генома. Более того, мутации, индуцированные цитостатиками, могут давать таким клеткам дополнительное преимущество за счет активации онкогенов или инактивации антионкогенов. Таким образом, мутагенез, индуцированный цитостатиками, может являться двигателем клональной эволюции.
У пациентов с резистентным течением в настоящее время используются высокие дозы глюкокортикостероидов, алемтузумаб (моноклональное антитело к CD52[26]), режимы, его содержащие, а также аллогенная трансплантация костного мозга.
Проведение интенсивной химиотерапии и трансплантации костного мозга у пожилых может быть затруднено плохим соматическим статусом и наличием серьезных сопутствующих заболеваний. В этой группе больных часто используется хлорамбуцил или комбинации на его основе.
Новые препараты (леналидомид, BGB-3111, акалабрутиниб, дувелисиб, умбралисиб) и комбинированные режимы на их основе в настоящее время проходят заключительные этапы клинических испытаний.
Существует также значительное количество новых экспериментальных подходов к терапии хронического лимфоцитарного лейкоза, эффективность и безопасность которых окончательно не установлена.
В последние годы показана высокая эффективность ингибиторов тирозинкиназ Btk[27][28] (ибрутиниб, акалабрутиниб и др.) и PI3Kdelta (иделалисиб и др.), а также высокоселективного ингибитора Bcl-2 (венетоклакс). В 2014 году FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) выдало разрешение на применение ибрутиниба у больных ХЛЛ, предварительно прошедших как минимум один курс лечения[29]. Данные таргетные препараты обладают высокой активностью даже у пациентов с неблагоприятным прогнозом (del17p) и относительно малотоксичны. В то же время, недостатком является их крайне высокая стоимость.
По клиническим проявлениям хронический лимфоцитарный лейкоз является довольно гетерогенным заболеванием: болезнь может протекать длительно без прогрессии или, наоборот, очень агрессивно[7]. Примерно в 30 % случаев болезнь прогрессирует медленно, так что смерть наступает по причине, не связанной с болезнью. В 15 % случаев смерть от болезни и/или побочных эффектов лечения наступает в течение 2—3 лет с момента постановки диагноза. В остальных случаях болезнь медленно прогрессирует в течение 5—10 лет, после чего наступает терминальная стадия заболевания, за которой следует смерть[30]. В случае пациентов из группы низкого риска медиана выживаемости от момента постановки диагноза достигает 8—10 лет. Известен ряд факторов, которые позволяют прогнозировать результаты лечения и продолжительность жизни, в том числе:
- Наличие или отсутствие признаков соматической гипермутации в генах вариабельных фрагментов иммуноглобулинов В-клеточного рецептора,
- Использование определенных V-генов в структуре В-клеточного рецептора (например, VH3—21),
- Уровень экспрессии тирозинкиназы Zap-70,
- Уровень экспрессии поверхностного маркера CD38,
- Хромосомные мутации del17p, del11q, затрагивающие гены TP53 и ATM,
- Уровень бета-2-микроглобулина в сыворотке крови,
- Стадия заболевания по Rai и Binet,
- Время удвоения числа лимфоцитов периферической крови и т. д.
Опухолевая трансформация, при которой клетки клона приобретают новые характеристики, делающие их похожими на диффузную крупноклеточную лимфому, носит название синдром Рихтера. Прогноз при наличии трансформации крайне неблагоприятный.
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 3 4 Chiorazzi N., Rai K. R., Ferrarini M. Chronic lymphocytic leukemia // N Engl J Med. — 2005. — Т. 352, вып. 8. — С. 804—815. — PMID 15728813.
- ↑ Jemal A., Siegel R., Xu J., Ward E. Cancer statistics, 2010 // CA Cancer J Clin. — 2010. — Т. 60, вып. 5. — С. 277—300. — doi:10.3322/caac.20073. — PMID 20610543.
- ↑ 1 2 3 Kipps T. J., Stevenson F. K., Wu C. J., Croce C. M., Packham G., Wierda W. G., O’Brien S., Gribben J., Rai K. Chronic lymphocytic leukaemia. (англ.) // Nature reviews. Disease primers. — 2017. — Vol. 3. — P. 16096. — doi:10.1038/nrdp.2016.96. — PMID 28102226. [исправить]
- ↑ Cerhan J. R., Slager S. L. Familial predisposition and genetic risk factors for lymphoma. (англ.) // Blood. — 2015. — Vol. 126, no. 20. — P. 2265—2273. — doi:10.1182/blood-2015-04-537498. — PMID 26405224. [исправить]
- ↑ 1 2 3 Gaidano G., Foà R., Dalla-Favera R. Molecular pathogenesis of chronic lymphocytic leukemia // J Clin Invest. — 2012. — Т. 122, вып. 10. — С. 3432-3438. — doi:10.1172/JCI64101. — PMID 23023714.
- ↑ Baumann Kreuziger L. M., Tarchand G., Morrison V. A. The impact of Agent Orange exposure on presentation and prognosis of patients with chronic lymphocytic leukemia. (англ.) // Leukemia & lymphoma. — 2014. — Vol. 55, no. 1. — P. 63—66. — doi:10.3109/10428194.2013.794267. — PMID 23573826. [исправить]
- ↑ Schinasi L. H., De Roos A. J., Ray R. M., Edlefsen K. L., Parks C. G., Howard B. V., Meliker J. R., Bonner M. R., Wallace R. B., LaCroix A. Z. Insecticide exposure and farm history in relation to risk of lymphomas and leukemias in the Women’s Health Initiative observational study cohort. (англ.) // Annals of epidemiology. — 2015. — Vol. 25, no. 11. — P. 803—810. — doi:10.1016/j.annepidem.2015.08.002. — PMID 26365305. [исправить]
- ↑ Dameshek W. Chronic lymphocytic leukemia — an accumulative disease of immunologically incompetent lymphocytes // Blood. — 1967. — Т. 29, вып. 4:Suppl. — С. 566—584. — PMID 6022294.
- ↑ Messmer B. T., Messmer D., Allen S. L., Kolitz J. E., Kudalkar P., Cesar D., Murphy E. J., Koduru P., Ferrarini M., Zupo S., Cutrona G., Damle R. N., Wasil T., Rai K. R., Hellerstein M. K., Chiorazzi N. In vivo measurements document the dynamic cellular kinetics of chronic lymphocytic leukemia B cells // J Clin Invest. — 2005. — Т. 115, вып. 3. — С. 755—764. — doi:10.1172/jci23409.
- ↑ D’Cruz O. J., Uckun F. M. Novel Bruton’s tyrosine kinase inhibitors currently in development // Onco Targets Ther. — 2013. — Т. 6. — С. 161—176. — doi:10.2147/OTT.S33732. — PMID 23493945.
- ↑ Krysov S., Dias S., Paterson A., Mockridge C. I., Potter K. N., Smith K. A., Ashton-Key M., Stevenson F. K., Packham G. Surface IgM stimulation induces MEK1/2-dependent MYC expression in chronic lymphocytic leukemia cells. (англ.) // Blood. — 2012. — Vol. 119, no. 1. — P. 170—179. — doi:10.1182/blood-2011-07-370403. — PMID 22086413. [исправить]
- ↑ 1 2 3 4 5 6 7 8 Hallek M., Cheson B. D., Catovsky D. et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines // Blood. — 2008. — Т. 111, вып. 12. — С. 5446-5456. — doi:10.1182/blood-2007-06-093906. — PMID 18216293.
- ↑ 1 2 3 Rawstron A. C., Bennett F. L., O’Connor S. J., Kwok M., Fenton J. A., Plummer M., de Tute R., Owen R. G., Richards S. J., Jack A. S., Hillmen P. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia // N Engl J Med. — 2008. — Вып. 359. — № 6. — С. 575-83. — doi:10.1056/NEJMoa075290. — PMID 18687638.
- ↑ 1 2 3 4 5 Döhner H., Stilgenbauer S., Benner A., Leupolt E., Kröber A., Bullinger L., Döhner K., Bentz M., Lichter P. Genomic aberrations and survival in chronic lymphocytic leukemia // N Engl J Med. — 2000. — Т. 343, № 26. — С. 1910-6. — PMID 11136261.
- ↑ Damle R. N., Wasil T., Fais F., Ghiotto F., Valetto A., Allen S. L., Buchbinder A., Budman D., Dittmar K., Kolitz J., Lichtman S. M., Schulman P., Vinciguerra V. P., Rai K. R., Ferrarini M., Chiorazzi N. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 94, no. 6. — P. 1840—1847. — PMID 10477712. [исправить]
- ↑ Hamblin T. J., Davis Z., Gardiner A., Oscier D. G., Stevenson F. K. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 94, no. 6. — P. 1848—1854. — PMID 10477713. [исправить]
- ↑ Hamblin T. J., Orchard J. A., Ibbotson R. E., Davis Z., Thomas P. W., Stevenson F. K., Oscier D. G. CD38 expression and immunoglobulin variable region mutations are independent prognostic variables in chronic lymphocytic leukemia, but CD38 expression may vary during the course of the disease. (англ.) // Blood. — 2002. — Vol. 99, no. 3. — P. 1023—1029. — PMID 11807008. [исправить]
- ↑ Hallek M., Langenmayer I., Nerl C., Knauf W., Dietzfelbinger H., Adorf D., Ostwald M., Busch R., Kuhn-Hallek I., Thiel E., Emmerich B. Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, nonsmoldering chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 93, no. 5. — P. 1732—1737. — PMID 10029603. [исправить]
- ↑ Knauf W. U., Langenmayer I., Ehlers B., Mohr B., Adorf D., Nerl C. H., Hallek M., Zwingers T. H., Emmerich B., Thiel E. Serum levels of soluble CD23, but not soluble CD25, predict disease progression in early stage B-cell chronic lymphocytic leukemia. (англ.) // Leukemia & lymphoma. — 1997. — Vol. 27, no. 5-6. — P. 523—532. — doi:10.3109/10428199709058320. — PMID 9477135. [исправить]
- ↑ Gentile M., Cutrona G., Neri A., Molica S., Ferrarini M., Morabito F. Predictive value of beta2-microglobulin (beta2-m) levels in chronic lymphocytic leukemia since Binet A stages. (англ.) // Haematologica. — 2009. — Vol. 94, no. 6. — P. 887—888. — doi:10.3324/haematol.2009.005561. — PMID 19483161. [исправить]
- ↑ Rai K. R., Sawitsky A., Cronkite E. P., Chanana A. D., Levy R. N., Pasternack B. S. Clinical staging of chronic lymphocytic leukemia // Blood. — 1975. — Т. 46, вып. 2. — С. 219—234. — PMID 1139039.
- ↑ Binet J. L., Auquier A., Dighiero G., Chastang C., Piguet H., Goasguen J., Vaugier G., Potron G., Colona P., Oberling F., Thomas M., Tchernia G., Jacquillat C., Boivin P., Lesty C., Duault M. T., Monconduit M., Belabbes S., Gremy F. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis // Cancer. — 1981. — Т. 48, вып. 1. — С. 198-206. — PMID 7237385.
- ↑ Riches J. C., Ramsay A. G., Gribben J. G. Chronic lymphocytic leukemia: an update on biology and treatment // Curr Oncol Rep. — 2011. — Т. 13, вып. 5. — С. 379-385. — doi:10.1007/s11912-011-0188-6. — PMID 21773694.
- ↑ Лекарство, применяемое при лейкемии, может стать мощным оружием в борьбе против рассеянного склероза
- ↑ O’Brien S., Furman R. R., Coutre S. E., Sharman J. P., Burger J. A., Blum K. A., Grant B., Richards D. A., Coleman M., Wierda W. G., Jones J. A., Zhao W., Heerema N. A., Johnson A. J., Izumi R., Hamdy A., Chang B. Y., Graef T., Clow F., Buggy J. J., James D. F., Byrd J. C. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. (англ.) // The lancet oncology. — 2014. — Vol. 15, no. 1. — P. 48—58. — doi:10.1016/S1470-2045(13)70513-8. — PMID 24332241. [исправить]
- ↑ Byrd J. C., Furman R. R., Coutre S. E., Flinn I. W., Burger J. A., Blum K. A., Grant B., Sharman J. P., Coleman M., Wierda W. G., Jones J. A., Zhao W., Heerema N. A., Johnson A. J., Sukbuntherng J., Chang B. Y., Clow F., Hedrick E., Buggy J. J., James D. F., O’Brien S. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. (англ.) // The New England journal of medicine. — 2013. — Vol. 369, no. 1. — P. 32—42. — doi:10.1056/NEJMoa1215637. — PMID 23782158. [исправить]
- ↑ FDA NEWS RELEASE (неопр.). Дата обращения 24 июля 2014.
- ↑ Spaargaren M., de Rooij M. F., Kater A. P., Eldering E. BTK inhibitors in chronic lymphocytic leukemia: a glimpse to the future. (англ.) // Oncogene. — 2015. — Vol. 34, no. 19. — P. 2426—2436. — doi:10.1038/onc.2014.181. — PMID 24954503. [исправить]
- Патологическая анатомия. Курс лекций. Под ред. В. В. Серова, М. А. Пальцева. — М.: Медицина, 1998
B-лимфоциты — Википедия
 Принципиальная схема механизма иммунной памяти у В-лимфоцитов
Принципиальная схема механизма иммунной памяти у В-лимфоцитов(B-клетки, от bursa fabricii птиц, где впервые были обнаружены) — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета. При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. Помимо продукции антител, В-клетки выполняют множество других функций: выступают в качестве антигенпрезентирующих клеток, продуцируют цитокины и экзосомы[1].
У эмбрионов человека и других млекопитающих B-лимфоциты образуются в печени и костном мозге из стволовых клеток, а у взрослых млекопитающих — только в костном мозге. Дифференцировка В-лимфоцитов проходит в несколько этапов, каждый из которых характеризуется присутствием определённых белковых маркеров и степенью генетической перестройки генов иммуноглобулинов.
Аномальная активность В-лимфоцитов может быть причиной аутоиммунных и аллергических заболеваний[1].
B-лимфоциты происходят от плюрипотентных гемопоэтических стволовых клеток, дающих также начало всем клеткам крови. Стволовые клетки находятся в определённом микроокружении, которое обеспечивает их выживание, самообновление или, при необходимости, дифференцировку. Микроокружение определяет, по какому пути пойдёт развитие стволовой клетки (эритроидному, миелоидному или лимфоидному)[1].
Дифференцировка В-лимфоцитов условно делится на две стадии — антигеннезависимую (в которую происходит перестройка генов иммуноглобулинов и их экспрессия) и антигензависимую (при которой происходит активация, пролиферация и дифференцировка в плазматические клетки). Выделяют следующие промежуточные формы созревающих В-лимфоцитов:
- Ранние предшественники В-клеток — не синтезируют тяжёлых и лёгких цепей иммуноглобулинов, содержат зародышевые гены IgH и IgL, но содержат антигенный маркер, общий со зрелыми пре-В-клетками.
- Ранние про-В-клетки — D-J-перестройки в генах IgН.
- Поздние про-В-клетки — V-DJ-перестройки в генах IgН.
- Большие пре-В-клетки — гены IgН VDJ-перестроены; в цитоплазме есть тяжёлые цепи класса μ, экспрессируется пре-В-клеточный рецептор.
- Малые пре-В-клетки — V-J-перестройки в генах IgL; в цитоплазме есть тяжёлые цепи класса μ.
- Малые незрелые В-клетки — гены IgL VJ-перестроены; синтезируют тяжёлые и лёгкие цепи; на мембране экспрессируются иммуноглобулины (B-клеточный рецептор).
- Зрелые В-клетки — начало синтеза IgD.
В-клетки поступают из костного мозга во вторичные лимфоидные органы (селезёнку и лимфатические узлы), где происходит их дальнейшее созревание, презентация антигена, пролиферация и дифференцировка в плазматические клетки и В-клетки памяти.

Экспрессия всеми В-клетками мембранных иммуноглобулинов позволяет осуществляться клональному отбору под действием антигена. При созревании, стимулировании антигеном и пролиферации существенно меняется набор маркеров В-клеток. По мере созревания В-клетки переключаются от синтеза IgM и IgD на синтез IgG, IgA, IgE (при этом у клеток сохраняется способность синтезировать также IgM и IgD — вплоть до трёх классов одновременно). При переключении синтеза изотипов антигенная специфичность антител сохраняется. Различают следующие типы зрелых В-лимфоцитов:
- Собственно В-клетки (ещё называемые «наивными» В-лимфоцитами) — неактивированные В-лимфоциты, не контактировавшие с антигеном. Не содержат тельца Голла, в цитоплазме рассеяны монорибосомы. Полиспецифичны и имеют слабое сродство к многим антигенам.
- В-клетки памяти — активированные В-лимфоциты, вновь перешедшие в стадию малых лимфоцитов в результате кооперации с Т-клетками. Являются долгоживущим клоном В-клеток, обеспечивают быстрый иммунный ответ и выработку большого количества иммуноглобулинов при повторном введении того же антигена. Названы клетками памяти, так как позволяют иммунной системе «помнить» антиген на протяжении многих лет после прекращения его действия. В-клетки памяти обеспечивают долговременный иммунитет.
- Плазматические клетки являются последним этапом дифференцировки активированных антигеном В-клеток. В отличие от остальных В-клеток, несут мало мембранных антител и способны секретировать растворимые антитела. Являются большими клетками с эксцентрично расположенным ядром и развитым синтетическим аппаратом — шероховатый эндоплазматический ретикулум занимает почти всю цитоплазму, также развит и аппарат Гольджи. Живут недолго (2—3 дня) и быстро элиминируются при отсутствии антигена, вызвавшего иммунный ответ.
Характерной особенностью В-клеток является наличие поверхностных мембраносвязанных антител, относящихся к классам IgM и IgD. В комплексе с другими поверхностными молекулами иммуноглобулины формируют антигенраспознающий рецептивный комплекс — B-клеточный рецептор, ответственный за узнавание антигена. Также на поверхности В-лимфоцитов расположены антигены МНС класса II, важные для взаимодействия с Т-клетками, также на некоторых клонах В-лимфоцитов присутствует маркер CD5, общий с Т-клетками. Рецепторы компонентов системы комплемента C3b (Cr1, CD35) и C3d (Cr2, CD21) играют определённую роль в активации В-клеток. Следует отметить, что маркеры CD19, CD20 и CD22 используются для идентификации В-лимфоцитов. Также на поверхности В-лимфоцитов обнаружены Fc-рецепторы.
Антигенпрезентирующие клетки (макрофаги, клетки Купфера, фолликулярные дендритные клетки, интердигитальные дендритные клетки и т. д.) вскоре после процессирования патогена выносят эпитопы на поверхность клетки при помощи белков МНС II, делая их доступными для Т-клеток. Т-хелпер при помощи Т-клеточного рецептора распознаёт комплекс эпитоп—МНС II. Активированный Т-хелпер выделяет цитокины, усиливающие антигенпрезентирующую функцию, а также цитокины, активирующие В-лимфоцит — индукторы активации и пролиферации. В-лимфоциты присоединяются при помощи мембраносвязанных антител, выступающих в роли рецепторов, к «своему» антигену и в зависимости от получаемых от Т-хелпера сигналов пролиферируют и дифференцируются в плазматическую клетку, синтезирующую антитела, либо перерождаются в В-клетки памяти. При этом от качества и количества антигена будет зависеть исход взаимодействия в данной трёхклеточной системе. Описанный механизм справедлив для полипептидных антигенов, относительно неустойчивых к фагоцитарному процессингу — т. н. тимусзависимых антигенов. Для тимуснезависимых антигенов (обладающих высокой полимерностью с часто повторяющимися эпитопами, относительно устойчивых к фагоцитарному перевариванию и обладающих свойствами митогена) участия Т-хелпера не требуется — активация и пролиферация В-лимфоцитов происходит за счёт собственной митогенной активности антигена.
Роль В-лимфоцитов в презентации антигена[править | править код]
В-клетки способны интернализовать свои мембранные иммуноглобулины вместе со связанным с ними антигеном и затем презентировать фрагменты антигена в комплексе с молекулами МНС класса II. При низкой концентрации антигена и при вторичном иммунном ответе В-клетки могут выполнять функцию основных антигенпрезентирующих клеток.
Выделяют две субпопуляции В-клеток: В-1 и B-2. Субпопуляцию В-2 составляют обычные В-лимфоциты, к которым относится всё сказанное выше. В-1 — это относительно небольшая группа В-клеток, обнаруживаемая у человека и мышей. Они могут составлять около 5 % от общей популяции B-клеток. Такие клетки появляются в течение эмбрионального периода. На своей поверхности они экспрессируют IgM и небольшое количество (или вовсе не экспрессируют) IgD. Маркером этих клеток является CD5. Однако он не является обязательным компонентом клеточной поверхности. В эмбриональном периоде В1-клетки появляются из стволовых клеток костного мозга. В течение жизни пул B-1-лимфоцитов поддерживается за счёт активности специализированных клеток–предшественников и не пополняется за счёт клеток, происходящих из костного мозга. Клетка–предшественница отселяется из кроветворной ткани на свою анатомическую нишу — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B-1-лимфоцитов — прибарьерные полости.
B-1-лимфоциты значительно отличаются от B-2-лимфоцитов по антигенной специфичности продуцируемых антител. Антитела, синтезированные B-1-лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых антигенов, и эти антигены — наиболее распространённые соединения клеточных стенок бактерий. Все B-1-лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. Антитела, продуцируемые B-1-лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B-1-лимфоцитах не «предусмотрено». Таким образом, B-1-лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B-1-лимфоцитов, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения.
- ↑ 1 2 3 Samitas K., Lötvall J., Bossios A. B cells: from early development to regulating allergic diseases // Arch Immunol Ther Exp (Warsz).. — 2010. — Т. 58, вып. 3. — С. 209—225. — doi:10.1007/s00005-010-0073-2. — PMID 20458549.
- А. Ройт, Дж. Брюсстофф, Д. Мейл. Иммунология — М.: Мир, 2000 — ISBN 5-03-003362-9
- Иммунология (в 3 т.) / Под. ред. У. Пола. — М.: Мир, 1988
что это такое, что значит лимфоциты ниже нормы
Лимфопения (лимфоцитопения) – уменьшение концентрации лимфоцитов в крови. Общей причиной являются вирусные инфекции, а более редкой – иммунодефициты. Некоторые лекарства могут вызывать лимфопению. Если лимфоциты понижены, могут возникать серьезные осложнения, поскольку они играют важную роль в защите от инфекций. Лимфопения увеличивает риск развития вирусной инфекции. Некоторые контролируемые иммунной системой («мелкие») вирусы в организме могут быть реактивированы при данной патологии. В статье рассмотрено, что это такое – лимфопения.
Что такое лимфопения?

Понижение количества лимфоцитов представляет угрозу для организма, поскольку он становится более уязвимым к различным инфекциям
Лимфоциты, которые являются подмножеством лейкоцитов, могут быть подразделены на различные типы клеток с различными ролями в приобретенной иммунной системе. Лимфоциты имеют размер 6-12 мкм и отличаются большим ядром, которое заполняет почти всю клетку. Остальная часть клетки может быть распознана как тонкое цитоплазматическое пространство, в котором только несколько митохондрий и рибосомы для синтеза белков.
Предполагается, что более крупные формы лимфоцитов, которые также имеют более мелкое клеточное ядро, активируются бактериальной или вирусной инфекцией. Меньшие неактивные лимфоциты более распространены в теле, чем крупные. Продолжительность жизни может быть очень разной в связи с различными задачами. В среднем лимфоциты живут несколько дней. Плазматические клетки могут жить до 4 недель.
Выделяют 2 формы лимфопении:
- Абсолютная.
- Относительная.
В международной классификации болезней (МКБ-10) лимфопения обозначается кодом D72.8.
Симптомы снижения лимфоцитов в крови
Относительная лимфоцитопения, как и абсолютная, в большинстве случаев протекает бессимптомно. Расстройство крови выявляется случайно, в ходе профилактических анализов крови. Сопутствующие симптомы обычно соответствуют причинному заболеванию. Экзема, расширенные капилляры с кровотечением и другие симптомы обычно вызваны не лимфопенией, а заболеванием крови.
Причины

Одна из причин возникновения лимфопении (временного характера) – длительное пребывание в стрессовых ситуациях
Почему возникает эта патология? Точная причина возникновения лимфопении у взрослых отличается, поскольку может быть вызвана различными заболеваниями. Специфические инфекции могут спровоцировать разрастание гранулоцитов, что приводит к относительной лимфопении. Абсолютная лимфопения возникает вследствие различных вирусных и аутоиммунных заболеваний, таких как ВИЧ, корь, желтая лихорадка, рассеянный склероз, целиакия, болезнь Ходжкина или ревматоидный артрит.
ВИЧ-инфекция является наиболее распространенной причиной инфекционной лимфопении в мире. Различные формы лейкоза также вызывают лимфопению.
Во многих случаях снижение лимфоцитов вызвано нежелательными побочными эффектами иммунодепрессантов, цитостатиков или глюкокортикоидных средств. Белковая недостаточность, которая распространена в некоторых развивающихся странах, является другой наиболее частой причиной лимфопении.
Ятрогенная лимфопения возникает при лечении других заболеваний. Следующие виды лечения могут увеличить риск развития патологии:
- Лучевая терапия.
- Цитотоксическая (разрушающая клетки) химиотерапия.
- Применение антилимфоцитарного глобулина.
- Долгосрочная фототерапия в сочетании с ультрафиолетовым облучением, используемая для лечения псориаза, мастоцитоза и других заболеваний.
Врожденная лимфопения может быть признаком наследственного иммунодефицита, а также других заболеваний, которые нарушают рост и развитие лимфоцитов. Дефицит аденозиндезаминазы, пуриновой нуклеозид-фосфорилазы и синдром Вискотта-Олдрича – другие потенциальные наследственные заболевания, связанные с разрушением Т-клеток.
Длительное пребывание на солнце также может снизить концентрацию лимфоцитов в кровеносном русле из-за действия ультрафиолетового излучения.
При разрушении тимуса также может возникать абсолютная лимфоцитопения. Ревматоидный артрит, синдром Гордона, миастения (мышечная слабость) и системная красная волчанка также могут привести к патологии.
Осложнения
В большинстве случаев лимфопения не приводит к серьезным осложнениям. По этой причине она выявляется относительно поздно, что также приводит к позднему лечению. Как правило, ее можно диагностировать только с использованием анализа крови. Пациенты могут страдать от различных кровотечений, которые возникают без конкретной причины. В редких случаях кровотечение или отек приводит к боли или другим ограничениям в повседневной жизни. Пациенты часто страдают от инфекций и воспалений. Дальнейший курс лечения лимфопении во многом зависит от причинного заболевания.
Лечение направлено прежде всего на основное заболевание. Во многих случаях проблемы могут быть решены трансплантацией стволовых клеток, поэтому продолжительность жизни пациента не уменьшается.
Лимфоциты ниже нормы: что это значит и какие методы диагностики используют?

Сдача крови – самый эффективный и распространенный способ для диагностирования лимфопении
Абсолютную или относительную лимфопению можно выявить с помощью анализа крови. Однако из-за отсутствия конкретных симптомов обследование обычно не назначается. Часто лимфопения обнаруживается случайно, только во время обследования по другим причинам. Ситуация не меняется, пока пациент не жалуется на повторяющиеся инфекции. При подозрении на иммунодефицит врач может инициировать начало обследований. В этих случаях анализ крови может предоставить информацию об абсолютном количестве и относительном распределении различных лейкоцитов, а также лимфоцитов.
Чтобы узнать, снижены ли у взрослого лимфоциты в крови, врач может порекомендовать один или несколько следующих тестов.
Полный анализ крови измеряет различные компоненты: он анализирует количество красных кровяных клеток, лейкоцитов и тромбоцитов и, таким образом, может определить, есть ли недостаток белых кровяных клеток.
Лимфоциты представляют собой лишь небольшой процент (20-40%) белых кровяных клеток. Общий анализ крови способен определить общее количество лейкоцитов, но не способен выявить лимфопению. Также анализ крови не может указать на признаки или симптомы лимфопении.
Проточная цитометрия исследует различные типы лейкоцитов подробнее, чем подсчет крови с помощью лейкоцитарной формулы. Проточная цитометрия способна измерять концентрации различных типов лимфоцитов: Т-лимфоцитов, В-лимфоцитов и NK-лимфоцитов.
Обследование может помочь диагностировать лимфоцитопению. Отсутствие Т-лимфоцитов может быть вызвано различными аутоиммунными заболеваниями. Инфекционные патологии способны привести к уменьшению В- или NK-лимфоцитов.
Лимфатические узлы являются частью иммунной системы и находятся в разных областях тела. Во время физического осмотра врач может узнать, увеличены ли лимфоузлы. В случае лимфоцитопении они, вероятно, будут слегка увеличенными и покрасневшими. Рассматриваемый лимфатический узел необходимо удалить и отправить на гистологическое исследование.
Когда следует обратиться к врачу?
Если выявляется лихорадка, недомогание и другие признаки лимфопении, необходима медицинская консультация. Пациенты, которым требуется лечение, должны немедленно обратиться к врачу и уточнить состояние, особенно если возникает желтуха, кровотечение или поражения кожи. Воспаление, экзема и расширенные капилляры также должны быть изучены врачом, поскольку они могут быть признаком серьезного заболевания.
Лимфопения обычно развивается медленно и вызывает явные признаки заболевания только на поздней стадии. Поэтому следует обратиться к врачу при первых признаках расстройства крови.
В группу риска входят больные раком, а также пациенты, страдающие пневмонией, другими бактериальными или вирусными заболеваниями. Пациенты, которые перенесли краснуху или сильное воспаление, должен поговорить с семейным врачом при первых признаках лимфопении. Он может диагностировать заболевание и при необходимости направить к другим специалистам – дерматологу, неврологу, отоларингологу, онкологу, инфекционисту, а также физиотерапевтам.
Как повысить лимфоциты: лечение и профилактика

Для повышения лимфоцитов в крови следует больше употреблять витамина С, который повышает выработку белых кровяных клеток, в том числе лимфоцитов
Лечение лимфопении направлено на устранение основного заболевания. Если лимфоциты снижены из-за побочных эффектов препаратов, необходимо изменить схему медикаментозной терапии. Если врожденный иммунный дефицит приводит к хроническому недостатку иммуноглобулинов и частым инфекциям, можно назначить внутривенное введение гамма-глобулинов. Если вливание гамма-глобулинов не вызывает желаемого эффекта, рекомендуется трансплантация гемопоэтических стволовых клеток. Лимфопения, вызванная белковым недоеданием, может быть вылечена изменением рациона питания.
Прямых профилактических мер, которые могут предотвратить возникновение лимфопении, не существует, потому что расстройство обычно проявляется как сопутствующее другому заболеванию. Существуют простые профилактические меры двух ведущих причин лимфопении – хронической белковой недостаточности и ВИЧ-инфекции. В первом случае рекомендуется употреблять богатую белками пищу, а во втором – использовать контрацептивы при половом акте с незнакомыми людьми.
Исследователи разрабатывают эффективные методы трансплантации стволовых клеток крови и костного мозга. Эти трансплантаты могут помочь лечить или облегчать некоторые заболевания, вызывающие лимфоцитопению. Однако другие исследования посвящены разработке лекарств и других продуктов, которые могут помочь организму вырабатывать больше лимфоцитов.
Ранняя диагностика может быть полезна для мониторинга лимфоцитопении. В Соединенных Штатах младенцы регулярно проходят скрининг, чтобы исключить иммунную дисфункцию, которая может вызвать лимфоцитопению. Исследование позволяет выявить диагноз до возникновения более серьезных проблем.
Если лимфопения вызвана некоторыми лекарствами, эти препараты следует прекратить принимать. Смена лекарств должна проводиться только после консультации с врачом, чтобы избежать осложнений. Иногда лимфопению можно лечить только путем трансплантации стволовых клеток. Если патология приводит к психическому дискомфорту, рекомендуется посетить психотерапевта. Кроме того, контакт с другими людьми с лимфопенией может часто оказывать положительное влияние на психическое состояние пациента.
Прогноз лимфопении
Прогноз лимфопении напрямую зависит от основного заболевания. Если лимфопения возникает без других сопутствующих расстройств, она может протекать бессимптомно и без серьезных осложнений.
Длительность течения зависит от причинного заболевания. Лечение также зависит от причины и тяжести основного заболевания. Для большинства случаев лимфоцитопении терапия не требуется. Если лимфоцитопения вызывает тяжелые инфекции, вероятно, необходимо будет прибегнуть к антибиотикам или другим методам лечения.
Профилактика различных заболеваний

Личная гигиена и чистота – главный фактор для профилактики лимфопении
Основным риском, связанным с лимфоцитопенией, являются инфекционные заболевания. При лимфопении пациенты должны избегать и минимизировать риск развития бактериальных, грибковых, вирусных и паразитарных заболеваний.
Косвенные меры профилактики:
- Минимизировать контакт с больными людьми и не посещать многолюдные места.
- Не употреблять продукты, которые могут содержать бактерии (сырые яйца или мясо).
- Часто мыть руки.
- Чистить зубы и регулярно посещать стоматолога, чтобы уменьшить риск заражения рта и горла.
- Вакцинация против гриппа.
Пациенту необходимо научиться распознавать симптомы инфекций – лихорадку, озноб, боль в мышцах и слабость. При возникновении любых симптомов рекомендуется обращаться к врачу, чтобы предотвратить развитие опасных для жизни осложнений. Пациенту также рекомендуется избегать физического и психоэмоционального перенапряжения, поскольку это может усугублять течение абсолютной лимфопении.