Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии.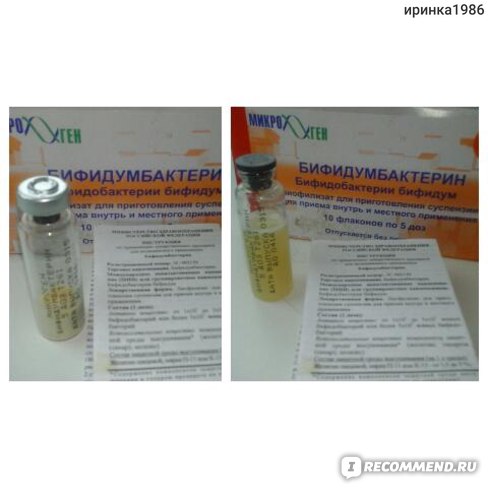
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника. Это означает, что патогенных микроорганизмов может стать значительно больше, чем полезных. Иногда сам организм может справиться с временно возникшими изменениями в кишечной микрофлоре, но при определенных ситуациях для лечения дисбактериоза используются пробиотики, содержащие полезные микроорганизмы 2.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Эксперт БФУ рассказал о роли и месте пробиотиков в профилактике и лечении коронавируса
Формирование иммунитета человека происходит в кишечнике, именно по этой причине важно поддерживать в нем нормальную микрофлору. Когда человек неправильно питается или принимает лекарства, баланс микроорганизмов в организме нарушается.
— Валерий Иванович, расскажите, пожалуйста, что такое пробиотики?
— Пробиотики – это полезные бактерии, которые нормализуют работу кишечника и отвечают за реакцию иммунитета на патогенные микроорганизмы. Пробиотиковые препараты содержат различные штаммы бактерий. Большинство пробиотиков-бактерий относятся к двум родам: лактобактерии (лат. Lactobacillus) и бифидобактерии (лат. Bifidobacterium), хотя надо знать, что существует много других видов бактерий-пробиотиков.
— Что такое бифидобактерии и лактобактерии?
— Бифидобактерии — род грамположительных анаэробных бактерий, представляющих собой слегка изогнутые палочки длиной 2—5 мкм, иногда ветвящиеся на концах. Бифидобактерии составляют 80—90 % кишечной флоры детей, находящихся на грудном вскармливании. Присутствие бифидобактерий в кишечнике полезно для ребёнка, так как бифидобактерии подавляют развитие различных гнилостных и болезнетворных микроорганизмов, способствуют перевариванию углеводов. По окончании молочного вскармливания бифидофлора сменяется обычной кишечной микрофлорой, характерной для взрослых организмов. Живую культуру бифидобактерий используют для изготовления лекарственных препаратов, используемых для нормализации микрофлоры кишечника и противодиарейной терапии.
По утверждению производителей, живые бифидобактерии обладают высокой антагонистической активностью (совокупностью защитных свойств) против широкого спектра патогенных и условно-патогенных микроорганизмов кишечника (включая стафилококки, протеев, энтеропатогенную кишечную палочку, шигеллы, некоторые дрожжеподобные грибы), восстанавливают равновесие кишечной и влагалищной микрофлоры, нормализуют пищеварительную и защитную функции кишечника, активизируют обменные процессы, повышают неспецифическую резистентность организма.

Лактобактерии – это грамположительные, факультативно анаэробные или микроаэрофильные бактерии из семейства Lactobacillaceae. Микроорганизмы обладают способностью превращать лактозу и прочие углеводы в молочную кислоту. Большинство из бактерий непатогенные, принимают активное участие в процессах пищеварения в ЖКТ человека. В норме присутствуют лактобактерии в мазке из влагалища и кишечной флоре, где и составляют значительную часть микрофлоры.
Бифидо — и Лактобактерии относятся к классу бацилл, типу фирмикуты. Микроорганизмы принимают активное участие в процессах пищеварения, разложении растений, продукции молочной кислоты. Некоторые виды применяют в пищевой промышленности для производства сыров, йогуртов и кефира, при засолке овощей, брожении силоса (корм для животных). В медицине молочнокислые бактерии входят в состав лекарств-пробиотиков.
—Понятно, что есть лекарственные препараты группы пробиотиков. А расскажите пожалуйста подробнее о том, какие есть природные источники пробиотиков?
— Источниками пребиотиков являются молочные продукты, хлеб, крупы, горох, кукурузные хлопья, чеснок, бананы, репчатый лук, фасоль и некоторые другие виды продуктов. Одним из самых популярных продуктов, который обеспечивает потребление пробиотиков, является йогурт. Помимо этого, их источниками являются: большинство молочных продуктов, например, сыр, кефир, творог, пахта. Есть еще несколько примеров пробиотиков: квашеная капуста, маринованные огурцы, хлеб, вино, соевый соус.
— Если мы говорим о препаратах пробиотиков, то по какому принципу нужно их подбирать?
— Очень важно правильно подобрать оптимальный пробиотик для лечения конкретного состояния. Для подбора пробиотика можно пользоваться следующими простыми правилами:
1. При подозрении на бактериальное поражение кишечника (острое или хроническое) рекомендуется принимать комплексные препараты, содержащие лактобактерии и бифидобактерии одновременно (например, Бактериобаланс, Бифидин, Линекс и др. ).
).
2. При подозрении на вирусное поражение кишечника (острое или хроническое) рекомендуется принимать препараты, содержащие лактобактерии (например, Лактобактерин, Наринэ, Биобактон, Примадофилус и др.).
3. При подозрении на грибковое поражение кишечника и половых органов (кандидоз кишки и влагалища) рекомендуется принимать препараты, содержащие бифидобактерии (например, Пробиформ, Биовестин, Бифидумбактерин и др.).
При терапии дисбактериоза кишечника рекомендуется сначала пить препараты с лактобактериями, затем с бифидобактериями и только после этого с колибактериями (например, Колибактерин). Можно начинать прием сразу комплексных препаратов, одновременно содержащих бифидобактерии и лактобактерии.
— В каких еще случаях нужно вспомнить о пробиотиках?
— В настоящее время пробиотики наиболее часто назначают при лечении следующих заболеваний и состояний:
1. Инфекционная диарея, вызванная ротавирусной инфекцией, в том числе у младенцев и маленьких детей — штаммы лактобактерий видов Lactobacillus rhamnosus и Lactobacillus casei.
2. Синдром раздраженного кишечника — пробиотические штаммы молочнокислых бактерий Bifidobacterium infantis и Lactobacillus plantarum и грибки Sacchromyces boulardii, а также комбинация пробиотиков могут помочь с налаживанием дефекации.
3. Антибиотико-ассоциированная диарея — Saccharomyces boulardii могут предотвратить рецидивы наиболее опасных и наиболее часто встречающихся антибиотико-ассоциированных диарей, вызванных Clostridium difficile.
Помимо этого врач-гастроэнтеролог может назначить пробиотики при жалобах пациента на нарушение стула, колики и частые вздутие и метеоризм, ощущение тяжести в желудке.
— Есть ли противопоказания у пробиотиков?
— Противопоказания к применению пробиотиков включают в себя достаточно немного состояний, так как в целом данные препараты являются практически безвредными. Перед использованием пробиотиков необходимо учитывать срок годности и правила его хранения. Этот нюанс обязателен, так как по истечении срока любой препарат утрачивает свои целебные свойства и может привести к непредвиденным последствиям. Противопоказания к применению пробиотиков также предусматривают их применение во время беременности и малышами, так как не каждое средство разрешено в такой период времени.
Этот нюанс обязателен, так как по истечении срока любой препарат утрачивает свои целебные свойства и может привести к непредвиденным последствиям. Противопоказания к применению пробиотиков также предусматривают их применение во время беременности и малышами, так как не каждое средство разрешено в такой период времени.
Не стоит забывать об индивидуальных особенностях организма, ведь у человека может быть аллергия на некоторые компоненты пробиотика, которые входят в его состав. В результате повышается риск развития аллергической реакции, проявляющейся высыпаниями, отечностью и головокружением. Еще одной группой противопоказаний являются иммунодефицитные состояния, такие как СПИД, ВИЧ, онкологическое поражение кровеносной и лимфатической системы, что ведет к повышению вероятности инфицирования организма.
— Есть ли какие-то актуальные новости о пробиотиках в связи с коронавирусом?
— Недавние исследования состава и функций микробиома человека вызвали большой интерес к цели применения и разработки пробиотиков для предотвращения коронавирусной инфекции. Однако вопрос о свойствах пробиотических микроорганизмов, который необходимо подчеркнуть для профилактики или выбора лечения этой конкретной патологии, остается открытым. Большинство обычно используемых пробиотических бактерий представляют собой виды Lactobacillus и Bifidobacterium. Однако их пробиотические эффекты обладают специфичностью штамма, что, очевидно, влияет на их биологическую активность. Применение пробиотиков для профилактики и лечения коронавирусной инфекции может быть эффективным, что было продемонстрировано результатами некоторых исследований.
В целях укрепления иммунитета против инфекций рекомендованы к применению физиологичные пробиотики — сочетание активных культур бифидо- и пропионовокислых бактерий, т.к. указанная комбинация пробиотических микроорганизмов (Bifidobacterium longum B379M + Propionibacterium freudenreichii subsp. shermanii KM-186) помимо повышенной иммуномодулирующей активности обладает выраженным синергизмом (эффект взаимоусиления) в плане антибиотического и антимутагенного действия.
Пробиотики могут блокировать прикрепление вируса также посредством процесса конкуренции за определенные точки приложения. Восстановление слизистой оболочки усиливается за счет способности муцина (основного компонента секрета слизистых желез) предотвращать прикрепление вируса к эпителиальным клеткам и подавлять размножение вируса.
Настроение плохое, болит голова, постоянные простуды — при чем здесь боли в животе?: Люди: Из жизни: Lenta.ru
Когда мы предвидим опасность, часто говорим, что чуем ее нутром, а не головой. Любовь же рождается не только в сердце, но и в животе, в котором порхают бабочки. Эти фразы не оторваны от реальности — они связаны с физиологическими процессами в кишечнике, который часто называют «вторым мозгом». «Лента.ру» разобралась, какую роль кишечник играет в организме и как наладить его работу.
В кишечнике около 100 миллионов нейронов — это больше, чем в спинном мозге или периферической нервной системе. Пусть кишечник не играет роли в сочинении симфоний, но он достаточно умен для того, чтобы выполнять пищеварительную работу автономно, не подключая сознание.
Состояние кишечника влияет на эмоциональное состояние человека. Около 90 процентов серотонина — «гормона счастья» — вырабатывается в кишечнике. Ученые Калифорнийского технологического института уверены, что изменения в микробном составе кишечника влияют на выработку серотонина, а значит, и на настроение. Считается, что нарушения в работе «второго мозга» могут быть одной из причин депрессии, расстройства сна, тревожности, мигрени, ожирения.
В кишечнике трудится большое количество микроорганизмов, известных как кишечная микробиота, — это около 100 триллионов различных бактерий. Если в микробиоме происходит сбой, это может отразиться на всем организме. Поскольку в теле человека так много микроорганизмов, нужна система, которая будет защищать организм от вторжений болезнетворных микробов и вирусов. Эту роль выполняет иммунитет.
В кишечнике находится 70-80 процентов иммунных клеток. В нормальных условиях иммунная система и микробиота сотрудничают: первая помогает размножению полезных бактерий и поддерживает стабильное микробное сообщество, а вторая способствует развитию иммунных клеток и участвует в настройке иммунных реакций.
В нормальных условиях иммунная система и микробиота сотрудничают: первая помогает размножению полезных бактерий и поддерживает стабильное микробное сообщество, а вторая способствует развитию иммунных клеток и участвует в настройке иммунных реакций.
Кишечник населяет микрофлора — дружественная и патогенная. Если верх одерживают враждебные микроорганизмы, возникает дисбактериоз. Причины нарушения состояния кишечной микробиоты могут быть разными — непереносимость молочных продуктов, хронические заболевания, употребление некоторых лекарств, — но куда чаще это результат наших личных усилий. На состояние микрофлоры влияют однообразная диета, вредные привычки (алкоголь и курение), стрессы, недостаток сна и малоподвижный образ жизни.
Обычные простудные заболевания и грипп тоже влияют на расстановку сил в микробиоме. Как только мы становимся жертвами инфекции, активизируются лимфоциты (они находятся в лимфатической ткани кишечника) и начинают синтезировать защитные антитела. Параллельно с ними на стражу здоровья встают микроорганизмы, населяющие кишечник. Чаще всего наш организм справляется без посторонней помощи, но микрофлоре неизбежно наносится ущерб, поэтому поддерживать ее во время болезни — хорошая привычка.
Главное испытание для микрофлоры — прием антибиотиков. Многие россияне пьют их при первых признаках простуды. Казалось бы, ну и что? Особенно если завтра на работу или важную встречу. Но антибиотики не разбирают, патоген перед ними или нормальная микрофлора, а действуют на все бактерии. Это оправданно, иначе было бы не победить тяжелую болезнь, но у эффективности антибиотиков есть своя цена. После их приема снижается количество полезных бифидо- и лактобактерий.
Дальше — замкнутый круг: чем хуже состояние микрофлоры кишечника, тем хуже иммунитет. Начинаются простуды, дисбактериоз, хроническая усталость, проблемы с кожей. Признаками слабого иммунитета (а значит, и нарушенной микрофлоры кишечника) считаются простуды, случающиеся у взрослых людей чаще пяти раз в год.
Чтобы антибиотики не нарушали тонкий баланс микрофлоры и не приводили к ослаблению иммунитета, важно правильно поддерживать кишечник во время и после болезни.
Обычно для восстановления микрофлоры врачи рекомендуют пробиотики и пребиотики.
Пробиотики — живые микроорганизмы и бактерии, содержащиеся в нормальной микрофлоре кишечника и выполняющие жизненно важные функции. Наиболее распространенные пробиотики — лакто- и бифидобактерии.
Чаще всего пробиотики назначают одновременно с антибиотиками, чтобы остановить рост патогенной микрофлоры. Но, к сожалению, доктора не всегда объясняют, как принимать пробиотики, чтобы они приносили максимум пользы.
Начинать курс приема пробиотиков и антибиотиков в один день. Бытует мнение, что принимать оба препарата одновременно бесполезно. Но уже давно разработаны пробиотики, которые прикрепляются к стенкам кишечника и не боятся антибиотиков. Кишечник надо поддерживать сразу, а не ждать, пока антибиотики вместе с лечением инфекции нанесут ущерб микробиоте.
Пить пробиотик через три часа после антибиотика. Этого времени как раз достаточно для того, чтобы антибиотик не повредил пробиотику.
Принимать пробиотик не менее двух недель. Микрофлора восстанавливается долго, и если курс пробиотиков прервать, на место полезных бактерий может прийти условно-патогенная флора, а с ней — проблемы в кишечнике, вирусные инфекции и многое другое.
Хотя лактобактерии и бифидобактерии можно найти в кисломолочных продуктах, доказанная польза есть только у лекарственных препаратов. В том же кефире плотность нужных бактерий недостаточна, поэтому заменять им лечение не стоит.
Отсутствие пробиотической помощи или нарушение правил приема ведет к тому, что на фоне лечения антибиотиками возникает масса побочных эффектов — вплоть до диареи. Люди прерывают курс лечения, самостоятельно меняют препарат, и все это ведет к развитию у бактерий устойчивости к антибиотикам. Из-за этого многие болезни все сложнее лечить. Чтобы не наступили времена, когда простуда или грипп станут опасными болезнями, надо пить полный курс антибиотиков, а для комфорта кишечника поддерживать его пробиотиками.
Чтобы не наступили времена, когда простуда или грипп станут опасными болезнями, надо пить полный курс антибиотиков, а для комфорта кишечника поддерживать его пробиотиками.
После курса пробиотиков, которые подавят враждебную микрофлору, полезно увеличить в диете количество пребиотиков. Пребиотики — это сложные углеводы, основной источник питания микрофлоры. Они содержатся во фруктах, овощах и цельнозерновых продуктах, богатых клетчаткой. Это могут быть лук, отруби, бананы, брокколи, нут, чечевица, фасоль, хлебцы. Суточная норма для взрослого человека составляет от 30 до 50 граммов клетчатки. И пробиотики, и пребиотики важны для здоровья микрофлоры, поэтому отлично подходят для профилактики ЖКТ-проблем.
На восстановление микробиоты после приема антибиотиков организму нужно, по результатам разных исследований, от полутора месяцев до полугода. Важно помнить, что правильная и своевременная поддержка кишечника нужна для ускорения этого процесса. И тогда «второй мозг» перестанет недовольно ворчать, а вы — переживать.
Линекс® экспертный подход к решению любых ситуаций для восстановления баланса микрофлоры
Москва. 30 июля 2015 г. Компания «Сандоз» расширяет линейку препаратов Линекс® — лидера безрецептурного портфеля компании и пробиотика №1 в России.*
Пробиотики являются одной из наиболее динамично развивающихся категорий на мировом фармацевтическом рынке. Связано это с тем, что характер питания населения развитых стран изменился: в рационе большинства современных горожан преобладают продукты, подвергшиеся рафинированию, термической обработке или замораживанию, генной модификации для улучшения вкусовых качеств и продления срока годности. Поэтому пробиотики – препараты, позволяющие поддерживать в норме состояние микрофлоры и здоровье желудочно-кишечного тракта – все чаще используются как в лечебных, так и в профилактических целях. Мировой рынок производства пробиотиков растет ежегодно на 7%. По данным Euromonitor, к 2017 году он составит 33,5 млрд евро1.
По данным Euromonitor, к 2017 году он составит 33,5 млрд евро1.
Линекс® хорошо известен российским врачам и потребителям благодаря высочайшему качеству и широкой линейке препаратов, в которой каждый сможет найти для себя оптимальный вариант пробиотика. В июле 2015 году, помимо всеми любимого Линекс® и Линекс для детей®, линейка пополнилась новинкой — Линекс® Форте. Новинка содержит комплекс из 2-х наиболее изученных бактерий BB-12 и LA-5 в высокой концентрации,что позволяет принимать от одной капсулы в день. что особенно удобно для проведения курсов лечения.Входящие в состав препарата пробиотические штаммы подавляют рост патогенных бактерий и оказывают благотворное влияние на состав кишечной микробиоты (микрофлоры).
Нормальная микрофлора снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи. Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов (от 1013 до 1014) весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья человека, являясь, по существу, органом, ответственным за ряд ключевых метаболических процессов в организме1-3. Но существует множество факторов, оказывающих негативное влияние на микробиоту кишечника и приводящих к дисбалансу. Это особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов4. Для коррекции состояния кишечной микробиоты при различных патологических состояниях: дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекциях и др. – используются препараты-пробиотики.
По словам директора по корпоративным связям компании «Сандоз» Юрия Головатчика, новинка станет значимым подспорьем в лечении ряда болезней:
«В состав пробиотика Линекс® Форте в суточной дозировке входят 2 хорошо изученные бактерии, являющие представителями нормальной микрофлоры кишечника — лакто- и бифидобактерии. Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней Педиатрического факультета Первого Московского государственного медицинского университета (Первого МГМУ) им. И.М. Сеченова, Светлана Ильинична Эрдес отметила: «Кишечник не напрасно называют «вторым мозгом» человека. Наше здоровое состояние во многом зависит от микрофлоры кишечника, основы основ слаженной работы организма. Именно поэтому пробиотики препараты, дающие возможность поддерживать в норме бактериальный состав кишечника – так важны в жизни современного человека. Погрешности в питании, стресс, прием антибиотиков и множество других факторов могут привести к нарушению состава кишечной микробиоты. Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
О компании «Сандоз»
Компания «Сандоз», дженериковое подразделение группы компаний «Новартис», является лидером в отрасли воспроизведенных лекарственных средств и постоянно стремится к повышению уровня доступности высококачественной медицинской помощи для пациентов. «Сандоз» располагает штатом свыше 26 000 сотрудников по всему миру. Компания поставляет широкий спектр доступных по цене лекарственных препаратов пациентам в разных странах мира.
Достигнув объема продаж в 9,6 млрд. долларов США в 2014 г. и обладая портфелем лекарственных средств, состоящим из более чем 1100 химических соединений, компания «Сандоз» занимает лидирующую позицию в мире как в области биоаналогов, так и на рынке противоинфекционных и офтальмологических дженериков, а также дженериков применяемых в трансплантологии. Кроме того, компания «Сандоз» является одним из мировых лидеров на рынке дженериков в таких ключевых терапевтических областях как: инъекционные и дерматологические препараты, препараты для лечения заболеваний дыхательной, центральной нервной, сердечно-сосудистой и пищеварительной систем, метаболических нарушений и болевых синдромов.
Кроме того, компания «Сандоз» является одним из мировых лидеров на рынке дженериков в таких ключевых терапевтических областях как: инъекционные и дерматологические препараты, препараты для лечения заболеваний дыхательной, центральной нервной, сердечно-сосудистой и пищеварительной систем, метаболических нарушений и болевых синдромов.
Компания «Сандоз» разрабатывает, производит и продает лекарственные средства, а также фармацевтические и биотехнологические активные субстанции действующих веществ. Около половины портфеля препаратов «Сандоз» состоит из различных категорий лекарственных средств, более сложных в разработке и производстве, чем стандартные дженерики.
Начиная с 2003 года, когда компания консолидировала различные направления производства дженериков под брендом «Сандоз», мы наблюдаем высокий естественный рост бизнеса за счет увеличения продаж. В дополнение к этому, рост обусловлен рядом целевых приобретений, которые компания «Сандоз» осуществила в различных регионах и направлениях бизнеса, в том числе «Гексал» (Германия), «Эбеве Фарма» (Австрия) и «Фуджера Фармасьютикалс» (США).
Компания «Сандоз» представлена в Twitter. Подписывайтесь на новости компании по ссылке http://twitter.com/Sandoz_Global.
**По продажам в упаковках по данным ООО “АЙ ЭМ ЭС Хэлс”, январь-декабрь 2014
Amann R, Fuchs BM. Nat Rev Microbiol 2008; 6:339.
Zhao L. Nature Review. Microbiology, Sept 2013; 11:639-47
O’Hara AM&Shanahan F. Best Practice / Research Clinical Gastroenterology 2014; 28:585-97
Приказ N 231 от 9 июня 2003 г. Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника»
Хилак Форте инструкция по применению: показания, противопоказания, побочное действие – описание Hylak Forte капли д/приема внутрь (со вкусом вишни): фл. 30 мл или 100 мл с пробкой-капельницей (46417)
Капли для приема внутрь в виде прозрачного или слегка мутного раствора желтовато-коричневого цвета с характерным кисловатым карамелеподобным запахом.
| 100 мл | |
| водный субстрат продуктов обмена веществ Escherichia coli DSM 4087* | 24.9481 г |
| водный субстрат продуктов обмена веществ Enterococcus faecalis DSM 4086* | 12.4741 г |
| водный субстрат продуктов обмена веществ Lactobacillus acidophilus DSM 4149* | 12.4741 г |
| водный субстрат продуктов обмена веществ Lactobacillus helveticus DSM 4183* | 49.896 г |
* субстраты содержат лактозу.
Вспомогательные вещества: натрия фосфат гептагидрат — 1.159 г, дикалия фосфат — 1.265 г, молочная кислота — 2.5-6.25 г, фосфорная кислота концентрированная — 0.352 г, калия сорбат — 0.1114 г, лимонной кислоты моногидрат — 0.0322 г, вода — до 100 мл.
1.1 мл — саше из лакированной ламинированной фольги из полиэтилентерефталата/алюминия/полиэтилена (30) — пачки картонные.
2.2 мл — саше из лакированной ламинированной фольги из полиэтилентерефталата/алюминия/полиэтилена (30) — пачки картонные.
30 мл — флаконы темного стекла (1) с пробкой-капельницей и пластмассовой крышкой с контролем первого вскрытия — пачки картонные.
100 мл — флаконы темного стекла (1) с пробкой-капельницей и пластмассовой крышкой с контролем первого вскрытия — пачки картонные.
Капли для приема внутрь (со вкусом вишни) в виде прозрачного или слегка мутного раствора желтовато-коричневого цвета с характерным запахом вишни.
| 100 мл | |
| водный субстрат продуктов обмена веществ Escherichia coli DSM 4087* | 24.9481 г |
| водный субстрат продуктов обмена веществ Enterococcus faecalis DSM 4086* | 12.4741 г |
| водный субстрат продуктов обмена веществ Lactobacillus acidophilus DSM 4149* | 12.4741 г |
| водный субстрат продуктов обмена веществ Lactobacillus helveticus DSM 4183* | 49.896 г |
* субстраты содержат лактозу.
Вспомогательные вещества: натрия фосфат гептагидрат — 1.159 г, дикалия фосфат — 1.265 г, молочная кислота — 2.5-6.25 г, фосфорная кислота концентрированная — 0.352 г, калия сорбат — 0.1114 г, лимонной кислоты моногидрат — 0.0322 г, натрия сахаринат — 0.02 г, натрия цикламат — 0.2 г, ароматизатор кремовый — 0.2 г, ароматизатор вишневый — 0.5 г, вода — до 100 мл.
30 мл — флаконы темного стекла (1) с пробкой-капельницей и пластмассовой крышкой с контролем первого вскрытия — пачки картонные.
100 мл — флаконы темного стекла (1) с пробкой-капельницей и пластмассовой крышкой с контролем первого вскрытия — пачки картонные.
Энтерожермина® Форте
КУПИТЬ
УТВЕРЖДЕНА
Приказом Председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «28» июня 2018 г.
№ N015703
Инструкция по медицинскому применению
лекарственного средства
ЭНТЕРОЖЕРМИНА® ФОРТЕ
Торговое название
Энтерожермина® Форте
Международное непатентованное название
Нет
Лекарственная форма
Суспензия для перорального применения 4 миллиарда/5 мл
Состав
5 мл суспензии содержит
активное вещество — споры Bacillus clausii, полирезистентного к различным химиотерапевтическим препаратам и антибиотикам — 4 миллиарда спор, вспомогательное вещество — вода очищенная.
Описание
Беловатая опалесцирующая жидкость
Фармакотерапевтическая группа
Пищеварительный тракт и обмен веществ. Противодиарейные, кишечные противовоспалительные/противомикробные препараты. Антидиарейные микроорганизмы.
Код АТХ А07FА
Фармакологические свойства
Фармакокинетика
Поскольку активным веществом препарата Энтерожермина® Форте являются споры бактерий, локализованные и действующие исключительно в просвете желудочно-кишечного тракта, фармакокинетические исследования не проводились.
Фармакодинамика
Энтерожермина® Форте является препаратом, состоящим из спор Bacillus clausii – обычного обитателя кишечника, не оказывающего патогенного действия.
При пероральном приеме споры Bacillus clausii, благодаря своей высокой устойчивости к химическим и физическим веществам, проходят через барьер желудочного сока и в неповрежденном состоянии достигают кишечного тракта, где они преобразуются в метаболически активные вегетативные клетки. Bacillus clausii способен вырабатывать различные витамины, в частности, витамины группы B, вследствие чего препарат может применяться при авитаминозах вследствие антибиотикотерапии или химиотерапии. Благодаря действию Bacillus clausii, применение Энтерожермина® Форте способствует восстановлению кишечной микрофлоры, измененной в результате нарушения микробной флоры различного происхождения.
Энтерожермина® Форте позволяет достичь неспецифического антигенного и антитоксического эффекта, связанного с метаболическим действием B.Clausii. Кроме того, Bacillus clausii обладает в высокой степени гетерогенной устойчивостью к антибиотикам (вызванной искусственно), которая обеспечивает терапевтическую основу для предупреждения изменения кишечной микрофлоры после воздействия антибиотиков, особенно антибиотиков широкого спектра действия, или для восстановления баланса кишечной микрофлоры.
В связи с данной устойчивостью к антибиотикам препарат Энтерожермина® Форте можно применять в промежутке между двумя дозами антибиотиков.
Препарат обладает устойчивостью в отношении пенициллинов (если не в комбинации с ингибиторами бета-лактамазами), цефалоспоринов (частичная устойчивость в большинстве случае), тетрациклинов, макролидов, аминогликозидов (за исключением гентамицина и амикацина), новобиоцина, хлорамфеникола, тиамфеникола, линкомицина, клиндамицина, изониазида, циклосерина, рифампицина, новобиоцина, налидиксовой кислоты и пипемидовой кислоты (промежуточная устойчивость) и метронидазола.
Показания к применению
- лечение и профилактика нарушений микрофлоры кишечника и последующего эндогенного дисвитаминоза
- вспомогательная терапия для восстановления микрофлоры кишечника, измененной в результате лечения антибиотиками или химиотерапии
- острые или хронические желудочно-кишечные расстройства у детей, включая грудной возраст, вызванные кишечным дисбактериозом (дисмикробиозом) и дисвитаминозом
Способ применения и дозы
Взрослым: 1 флакон в день.
Детям, включая грудной возраст с 4 недель жизни: 1 флакон в день.
Содержимое флакона принимают без разведения или разводят в воде или других напитках (например, в молоке, чае, апельсиновом соке).
Этот препарат предназначен только для приема внутрь. Не вводить парентерально и не применять другим способом! Лекарственное средство должно быть использовано сразу во избежание загрязнения суспензии.
Продолжительность лечения определяется индивидуально врачом. Рекомендована следующая продолжительность лечения в зависимости от показания к применению:
- лечение нарушенной микрофлоры кишечника и последующего эндогенного дисвитаминоза (вследствие нарушения всасывания и усвоения витаминов в кишечнике): при острой диарее 5-7 дней, при хронической диарее до 30 дней;
- профилактика нарушений микрофлоры кишечника и последующего эндогенного дисвитаминоза во время антибактериальной терапии: во время лечения антибиотиками и до 1 недели после окончания лечения антибиотиками
- вспомогательное лечение для восстановления микрофлоры кишечника, изменившейся во время лечения антибиотиками или химиотерапии: во время лечения антибиотиками и до 1 недели после окончания лечения антибиотиками;
- лечение острых желудочно-кишечные расстройств у взрослых и детей, включая грудной возраст, связанные с отравлением или вызванные кишечным дисбактериозом (дисмикробиозом) и дисвитаминозом: острая диарея 5-7 дней;
- лечение хронических желудочно-кишечных расстройств у взрослых и детей, включая грудной возраст, связанных с отравлением или вызванные кишечным дисбактериозом (дисмикробиозом) и дисвитаминозом: хроническая диарея до 30 дней.

Побочные действия
Частота неизвестна- реакции гиперчувствительности, включая сыпь, крапивницу и ангионевротический отек
Важно сообщать о подозреваемых побочных реакциях в пострегистрационный период применения лекарственного средства. Это позволяет вести непрерывный мониторинг соотношения польза/риск препарата. Специалисты в области здравоохранения обязаны сообщать о любых случаях подозреваемых побочных реакций через национальную систему отчетности.
Противопоказания
- повышенная чувствительность к активному веществу или компонентам препарата
Лекарственные взаимодействия
Не установлены
Особые указания
Возможно наличие видимых включений во флаконах препарата Энтерожермина® Форте, что обусловлено агрегатами спор Bacillus clausii, это не означает, что препарат претерпел изменения.
Необходимо встряхнуть флакон перед применением.
Данный препарат предназначен только для перорального приема.
Запрещен инъекционный или любой другой путь введения в связи с высоким риском тяжелых анафилактических реакций, таких как анафилактический шок.
Во время терапии антибиотиками препарат следует принимать между двумя последовательными приемами дозы антибиотика.
Беременность и период лактации
Приём данного лекарственного препарата НЕ ПРОТИВОПОКАЗАН во время беременности и в период лактации.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Препарат не влияет на способность управлять транспортным средством или движущимися механизмами.
Передозировка
До настоящего момента не сообщалось о клинических проявлениях передозировки.
Форма выпуска и упаковка
По 5 мл препарата разливают в однодозовые флаконы полиэтиленовые. На флаконы наклеивают этикетки самоклеющиеся.
По 10 флаконов вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 30oС.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не применять по истечении срока годности.
Условия отпуска
Без рецепта
Производитель/ Владелец регистрационного удостоверения
Санофи С. П. А., Италия
VIALE EUROPA, 11 ORIGGIO (VA) ITALIA
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей
ТОО «Санофи-авентис Казахстан»
Республика Казахстан, 050013, Алматы, пр-т Назарбаева 187 «Б»
телефон: +7 (727) 244-50-96
факс: +7 (727) 258-25-96
e-mail: [email protected]
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
ТОО «Санофи-авентис Казахстан»
Республика Казахстан, 050013, Алматы, пр-т Назарбаева 187 Б
телефон: +7(727) 244-50-96
факс: +7 (727) 258-25-96
e-mail: [email protected]
Перед применением ознакомьтесь с инструкцией по медицинскому применению. Самолечение может быть вредным для вашего здоровья.
Препараты зеленой аптеки от дисбактериоза
Содержание
Около 70 % населения мира имеют дисбактериоз — нарушение баланса микрофлоры кишечника, которое приводит к сбою его деятельности.
В норме основу кишечного биоценоза человека составляют «полезные» бактерии, которые защищают организм от инфекций и помогают пищеварению. Дефицит таких бактерий и чрезмерный рост патогенных микроорганизмов вызывают дисбактериоз.
Дисбактериоз не возникает как самостоятельное заболевание, а является следствием болезней ЖКТ, стрессов, инфекций, приема антибиотиков или неправильного питания.
Для восстановления сбалансированной микробиологической среды кишечника пациентам назначают специальную диету, антисептические средства, пробиотики и витамины. Медикаментозное лечение обычно сочетают с фитопрепаратами.
Благодаря мощным противовоспалительным и спазмолитическим свойствам травяные сборы в виде чаев, настоев, отваров подавляют гнилостные процессы в кишечнике, снимают воспаление слизистой и устраняют симптомы дисбактериоза:
- метеоризм,
- запор или диарею,
- урчание и боли в животе,
- неприятный привкус во рту,
- тошноту, снижение аппетита.
Подобранные специалистом растительные средства позволяют уменьшить медикаментозную нагрузку на больного, ведь останавливают развитие патогенной микрофлоры в кишечнике, создают условия для размножения «дружественных» бактерий и не раздражают желудок. А минимальный перечень противопоказаний и польза для иммунитета позволяют применять лекарственные травы даже детям от шести месяцев.
Лекарственные растения для восстановления микрофлоры кишечника
Иммунитет человека во многом зависит от здоровья ЖКТ. Проявления дисбактериоза — вздутие, колики, нерегулярный стул — истощают организм и могут свидетельствовать о серьезных заболеваниях пищеварительной системы.
Народная медицина предлагает немало лекарственных растений, которые борются с патогенной микрофлорой кишечника, уменьшают газообразование и помогают восстановить комфортное пищеварение. К ним относятся:
- фенхель,
- тмин,
- аир,
- полынь горькая,
- ромашка,
- тысячелистник,
- анис,
- мята,
- укроп и др.

Высокая эффективность трав в борьбе с дисбактериозом объясняется наличием в их составе эфирных масел, фитонцидов, флавоноидов, горьких и дубильных веществ, которые обеспечивают антибактериальный, ветрогонный эффект, снимают спазмы и улучшают моторику кишечника.
О полезных лекарственных растениях и сборах от дисбактериоза рассказываем далее.
Тысячелистник
Растение содержит сесквитерпены, флавоноиды, горькие, дубильные вещества, благодаря которым:
- обладает мощным антисептическим, противогрибковым и бактерицидным действием;
- нормализует моторику ЖКТ и уменьшает проявления метеоризма;
- блокирует спастические боли в кишечнике;
- активизирует выделение желудочного сока и усиливает аппетит;
- увеличивает желчеотделение.
Чтобы приготовить целебный настой от дисбактериоза, 1 ст. л. травы тысячелистника смешайте с 1 ч. л. травы полыни горькой, залейте 300 мл кипятка и настаивайте в течение 20 минут. Принимайте по 1 ст. л. 2–3 раза в день за 15 минут до еды.
Как заварить настой из тысячелистника и ромашки против дисбактериоза, читайте в нашем материале.
Крапива
Богатая на витамины, органические кислоты и гликозиды крапива — эффективное растительное средство от дисбактериоза, поскольку:
- нормализует липидный обмен и кислотность желудка;
- оказывает противовоспалительное и регенеративное действие — заживляет ранки на слизистой органов пищеварения;
- активизирует выделение желчи;
- укрепляет иммунную систему.
Листья крапивы применяют при запорах, геморрое, диарее, заболеваниях печени.
Для стимуляции обмена веществ в ЖКТ и смягчения стула готовят отвар из крапивы и крушины. Для этого 2 ч. л. листьев крапивы смешивают с 1 ч. л. коры крушины, заливают 500 мл кипятка и держат на слабом огне 10 минут.Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
Аир
Благодаря полезным биологически активным веществам — эфирным маслам и горькому гликозиду акорину — настои из корневища аира:
- устраняют гнилостные процессы в кишечнике;
- уменьшают газообразование;
- усиливают рефлекторное выделение желудочного сока;
- возбуждают окончания вкусовых рецепторов и повышают аппетит;
- снимают спазмы кишечника;
- усиливают желчную функцию печени.
Для облегчения симптомов дисбактериоза 1 ст. л. корневищ растения поместите в эмалированную посуду, залейте стаканом кипятка и, накрыв крышкой, держите на водяной бане 15 минут. Дайте остыть.Принимайте настой три раза в день по ¼ стакана за 15 минут до еды.
Аир часто входит в состав желудочных сборов, ведь корневища растения — один из самых эффективных фитопрепаратов против метеоризма.
Какие травяные настои и отвары от дисбактериоза можно пить детям?
Дисбактериоз — один из самых распространенных диагнозов у детей до года. Среди причин развития патогенной микрофлоры у новорожденных:
- физиологическая незрелость моторной функции кишечника;
- позднее прикладывание к груди;
- искусственное вскармливание;
- раннее введение прикорма, употребление аллергенов;
- прием лекарств.
Симптомы дисбактериоза у грудных детей:
- боль в животе (ребенок может надрывно плакать, поджимать, напрягать ножки)
- частые срыгивания, отрыжка;
- частый стул: зеленого цвета, с непереваренными остатками пищи и резким кислым запахом;
- повышенное газообразование;
- белый налет на языке;
- неприятный запах изо рта;
- снижение аппетита, плохой набор веса;
- высыпания на коже;
- вялость, плохой сон.

Проявления дисбактериоза можно спутать с симптомами инфекционного заболевания или отравления, поэтому сначала рекомендуют выяснить и устранить первопричину расстройства пищеварения у малыша.
Содержание микрофлоры детского организма в нормальном состоянии является чрезвычайно важной задачей. Это способствует качественному перевариванию пищи, синтезу необходимых витаминов и формированию иммунной системы.
К наиболее эффективным лекарственным растениям от дисбактериоза у детей относятся:
- Тмин. Самое популярное средство от повышенного газообразования. Тминную водичку рекомендуют даже малышам. Плоды тмина имеют сильное бактерицидное, обезболивающее и ветрогонное эффект, нормализуют работу всего ЖКТ.
- Фенхель. Эффективное и безопасное природное средство при коликах у детей. Улучшает моторику кишечника, способствует быстрому и безболезненному выведению газов. Обладает секретолитическим, спазмолитическим, ветрогонным, противомикробным действием.
- Ромашка. Растительное средство мягкого действия, которое эффективно снимает воспаление и спазмы кишечника, уменьшает вздутие, устраняет отрыжку. Цветы ромашки имеют противомикробный эффект, благодаря чему подавляют развитие патогенной флоры ЖКТ.
- Укроп. Регулирует моторную деятельность кишечника, избавляет от метеоризма и спазмов. Повышает секрецию желудочных желез, улучшает аппетит.
Под наблюдением врача настои на основе этих растений можно применять даже детям от шести месяцев.
Если дисбактериоз сопровождают вздутие и метеоризм, облегчить страдания малыша может легкий массаж животика по часовой стрелке, использование газоотводной трубки или выкладывание на живот.
Если ребенок на грудном вскармливании, хотим напомнить, что натуральный фиточай «Лактафитол» от компании «Лектравы» — средство, которое не только повышает лактацию у мамы, но и из-за обогащения грудного молока полезными веществами налаживает работу ЖКТ малыша.
Это возможно благодаря карвону в плодах тмина и аниса, которые входят в состав препарата. Получая эти вещества вместе с грудным молоком, малыш чувствует облегчение при спазмах и коликах.
Дисбактериоз у беременных: можно ли лечиться травами?
Беременность может стать серьезным испытанием для организма будущей мамы.
Уже в первые дни после зачатия тело активно меняется, в нем вырабатываются различные гормоны, важные для сохранения и полноценного развития плода. В некоторых случаях этот процесс существенно снижает иммунитет, вследствие чего может развиться дисбактериоз.
Поскольку бактериальная флора мамы — фундамент для формирования микрофлоры малыша, лечение следует начать уже при первых симптомах недомогания.
Лекарственные растения для лечения дисбактериоза у беременных должны назначаться с особой осторожностью: только врачом и только тогда, когда польза для матери превышает потенциальный риск для плода.
Чтобы облегчить проявления метеоризма, спастической боли в животе и нормализовать стул, будущим мамам рекомендуют чаи, настои, отвары из ромашки и мяты перечной. Эти растения обладают стойким противомикробным действием, поддерживают иммунитет и являются эффективным успокаивающим средством.
Для приготовления полезного травяного настоя смешайте 1 ч. л. цветков ромашки с 1 ч. л. листья мяты перечной. Залейте 250 мл кипятка и дайте настояться в течение 15 минут. Беременным женщинам такой настой рекомендуется принимать раз в трое суток.
Здоровье органов пищеварения — гарантия отличного самочувствия и крепкого иммунитета! Поэтому прислушивайтесь к собственному телу и не откладывайте визит к врачу, когда неприятные ощущения в желудке мешают вашему комфорту.
Текущий рейтинг: 4.17 из 5. Количество голосов: 147
Развитие кишечного микробиома у детей и его последствия для ожирения и кардиометаболических заболеваний на протяжении всей жизни
Дети (Базель). 2018 Dec; 5 (12): 160.
2018 Dec; 5 (12): 160.
Стефани Г. Паттерсон
2 Отделение реанимации, отделение педиатрии, Медицинский центр Университета Вандербильта, Нэшвилл, TN 37232, США; [email protected]
2 Отделение интенсивной терапии, отделение педиатрии, Медицинский центр Университета Вандербильта, Нэшвилл, TN 37232, США; [email protected]† Эти авторы внесли одинаковый вклад в эту работу.
Поступило 23.10.2018 г .; Принято 22 ноября 2018 г.
Лицензиат MDPI, Базель, Швейцария. Эта статья представляет собой статью в открытом доступе, распространяемую в соответствии с условиями лицензии Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/). Эта статья цитировалась другими статьями в PMC. .Abstract
Новые данные свидетельствуют о том, что состав и функция микробиома связаны с развитием ожирения и нарушений обмена веществ.Колонизация микробов быстро увеличивается после рождения, и состав микробиома особенно меняется в младенчестве. Факторы, влияющие на формирование микробиома кишечника в младенчестве и детстве, могут оказывать значительное влияние на развитие ожирения и метаболической дисфункции с последствиями на всю жизнь. В этом обзоре мы исследуем детерминанты состава микробиома кишечника в младенчестве и детстве и оцениваем потенциальное влияние на ожирение и кардиометаболический риск.
Ключевые слова: микробиом, ожирение, кардиометаболическое заболевание
1.Введение
Хронические кардиометаболические заболевания являются основной причиной смертности в США, при этом болезни сердца и диабет обходятся в 500 миллиардов долларов в год [1,2] и затрагивают около 60% людей на протяжении всей жизни [1,3]. Риску заболевания способствуют многие факторы, в том числе воздействие окружающей среды, диета и генетический фон. Патогенез развивается на протяжении десятилетий, что делает факторы риска, возникающие в детстве, особенно важными для риска пожизненных заболеваний. Роль микробиома как модулятора болезни все больше признается и изучается [4,5].Микробиом кишечника человека может действовать как центральный регулятор метаболизма, реагируя на изменения в рационе питания или физиологии хозяина [6,7]. Микробиом кишечника быстро увеличивается у младенцев после рождения [7,8], а дисбактериоз в младенчестве или детстве может повлиять на здоровье микробиома кишечника в долгосрочной перспективе. В разделах этого обзора и в кратком изложении мы оцениваем несколько известных детерминант состава микробиома и исследуем, как изменение состава микробиома у детей может повлиять на риск ожирения и кардиометаболических заболеваний в течение всей жизни.
Роль микробиома как модулятора болезни все больше признается и изучается [4,5].Микробиом кишечника человека может действовать как центральный регулятор метаболизма, реагируя на изменения в рационе питания или физиологии хозяина [6,7]. Микробиом кишечника быстро увеличивается у младенцев после рождения [7,8], а дисбактериоз в младенчестве или детстве может повлиять на здоровье микробиома кишечника в долгосрочной перспективе. В разделах этого обзора и в кратком изложении мы оцениваем несколько известных детерминант состава микробиома и исследуем, как изменение состава микробиома у детей может повлиять на риск ожирения и кардиометаболических заболеваний в течение всей жизни.
Детерминанты состава микробиома и потенциальные механизмы, связывающие микробиоту с заболеванием.
2. Детерминанты колонизации кишечного микробиома новорожденных
2.1. Способ доставки
Обширная колонизация микробиома младенца происходит во время рождения и может произойти даже до рождения. Инокуляция имеет стохастические компоненты с участием материнской микробиоты, а также условно-патогенную колонизацию микробиотой, присутствующей на других проксимальных особях и в местной среде.Состав кишечного микробиома сильно варьируется в раннем младенчестве, и из штаммов, которые достигают кишечника младенца, только часть успешно колонизируется [7]. В исследовании 25 пар мать-младенец развитие микробиома младенца оценивалось от рождения до 4 месяцев после родов [9]. Было обнаружено, что микробиом новорожденных содержит материнские вагинальные, кожные, оральные и фекальные штаммы с вариабельностью в том, какой участок вносит наибольший вклад, несмотря на то, что все дети рождаются естественным путем. Передача через кожу и влагалище оказалась преходящей, при этом микробиом кишечника младенца имел наибольшее сходство с микробиомом кишечника матери к 4 месяцам после рождения [9].В нескольких исследованиях изучалось влияние вагинальных родов по сравнению с кесаревым сечением, чтобы проверить гипотезу о том, что первоначальное воздействие влагалищной микробиоты по сравнению с микробиотой кожи оказывает долгосрочное влияние на состав микробиома.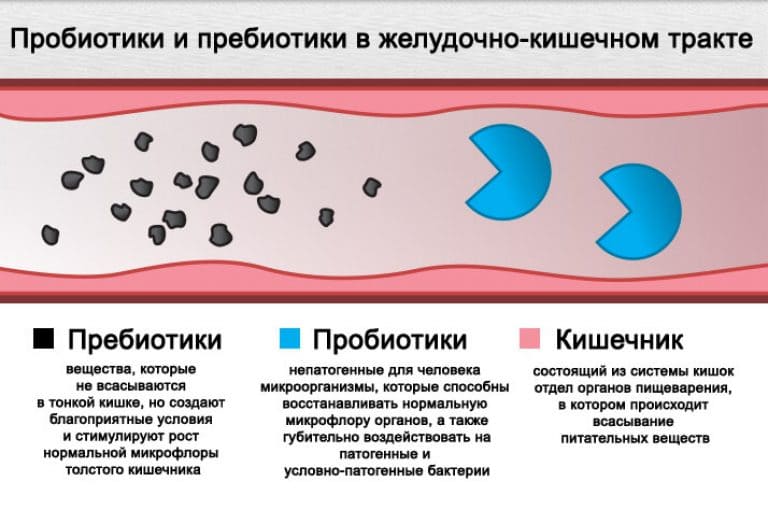 Показано, что скорость колонизации кишечника у младенцев, рожденных с помощью кесарева сечения, замедляется [10], при этом уровень бактериальной колонизации у младенцев, рожденных с помощью кесарева сечения, ниже [11]. У младенцев, рожденных с помощью кесарева сечения, наблюдается меньшее микробное разнообразие, и этот эффект может сохраняться не менее двух лет [12].Однако в другой выборке у недоношенных новорожденных, рожденных естественным путем, разнообразие было ниже по сравнению с кесаревым сечением [13], что потенциально могло быть связано с дополнительными родовыми осложнениями у недоношенных детей. Кесарево сечение было связано с некоторыми долгосрочными результатами, включая избыточный вес [11,14,15,16], хотя другие исследования не обнаружили различий, и причинно-следственная связь не была установлена [17,18].
Показано, что скорость колонизации кишечника у младенцев, рожденных с помощью кесарева сечения, замедляется [10], при этом уровень бактериальной колонизации у младенцев, рожденных с помощью кесарева сечения, ниже [11]. У младенцев, рожденных с помощью кесарева сечения, наблюдается меньшее микробное разнообразие, и этот эффект может сохраняться не менее двух лет [12].Однако в другой выборке у недоношенных новорожденных, рожденных естественным путем, разнообразие было ниже по сравнению с кесаревым сечением [13], что потенциально могло быть связано с дополнительными родовыми осложнениями у недоношенных детей. Кесарево сечение было связано с некоторыми долгосрочными результатами, включая избыточный вес [11,14,15,16], хотя другие исследования не обнаружили различий, и причинно-следственная связь не была установлена [17,18].
2.2. Преждевременные роды
Недоношенные дети имеют недоразвитый кишечник, что может нарушить развитие взаимоотношений здорового хозяина и микробиоты в раннем возрасте [19].Недоношенные дети подвергаются гораздо более высокому риску развития осложнений после рождения, включая некротический энтероколит (НЭК), который может быть связан с нарушением усвоения кишечного микробиома [20]. Было обнаружено, что у недоношенных новорожденных, у которых развился НЭК, увеличилось количество Proteobacteria и уменьшилось количество Firmicutes и Bacteroidetes [20]. Имеются также данные о том, что изменение состава материнского микробиома может быть связано с риском преждевременных родов [21], предполагая, что изменение состава микробиома является как причиной, так и следствием преждевременных родов.Было показано, что у недоношенных детей различия в разнообразии микробиома зависят от гестационного возраста [22]. Дисбиоз кишечника недоношенных детей связан со способом доставки, применением стероидов и антибиотиков, которые влияют на развитие кишечного микробиома [13,23,24].
2.3. Дородовая микробная колонизация
Вопрос о том, является ли передача комменсальных микробов плоду от матери обычным явлением, остается открытым. До относительно недавнего времени среда матки считалась стерильной.Это предположение было опровергнуто несколькими исследованиями, в которых были обнаружены доказательства наличия микробиоты в матке [25], плаценте [26], пуповине [27] и околоплодных водах [28], а также в меконии [29], что указывает на то, что микробиота может передаваться во время внутриутробного развития. Однако данные противоречивы [30,31]; микробная ДНК может быть обнаружена из-за контаминации, присутствия ДНК от мертвых бактерий или сбора после разрыва мембраны [32], и до сих пор не было доказано, что микробы жизнеспособны в утробе матери.Несмотря на то, что данные подтверждают некоторую передачу микробного материала плоду, еще предстоит определить, вносит ли это значительный вклад в микробиом плода и влияет ли это на развитие или исходы.
До относительно недавнего времени среда матки считалась стерильной.Это предположение было опровергнуто несколькими исследованиями, в которых были обнаружены доказательства наличия микробиоты в матке [25], плаценте [26], пуповине [27] и околоплодных водах [28], а также в меконии [29], что указывает на то, что микробиота может передаваться во время внутриутробного развития. Однако данные противоречивы [30,31]; микробная ДНК может быть обнаружена из-за контаминации, присутствия ДНК от мертвых бактерий или сбора после разрыва мембраны [32], и до сих пор не было доказано, что микробы жизнеспособны в утробе матери.Несмотря на то, что данные подтверждают некоторую передачу микробного материала плоду, еще предстоит определить, вносит ли это значительный вклад в микробиом плода и влияет ли это на развитие или исходы.
3. Влияние практики вскармливания детей раннего возраста на развитие микробиома
3.1. Грудное молоко и смеси для кормления
Считается, что кормление грудным молоком защищает от развития множества заболеваний, включая ожирение [33], диабет [34], а также потенциально иммуноопосредованные заболевания, такие как астма и аллергия [35].Механизм, посредством которого грудное молоко определяет предрасположенность ребенка к кардиометаболическим и воспалительным заболеваниям, еще не полностью определен, но может быть опосредован долгосрочным воздействием на микробиоту кишечника. В частности, как единственный источник питания в первые 4–6 месяцев жизни, состав грудного молока или смеси определяет доступность питательных веществ для кишечной микробиоты младенца и может оказывать избирательное давление. Ключевое различие между грудным молоком и смесью — наличие пребиотиков, олигосахаридов и антител, которые могут выборочно регулировать численность бактерий [36].Само грудное молоко содержит микробиоту, в том числе виды Bifidobacterium , Streptococcus и Lactobacillus [37,38,39], которые могут вносить непосредственный вклад в микробиом желудочно-кишечного тракта младенца. Однако состав грудного молока человека сильно варьируется [40,41,42], который зависит от состояния здоровья матери [43,44,45]. Состав грудного молока динамичен, меняется со временем и может зависеть от таких характеристик младенца, как пол [46] или динамические сигналы во время болезни.Еще предстоит определить, отвечает ли «основная» группа компонентов грудного молока, общих для большинства людей, за большинство защитных эффектов [47]. У недоношенных детей кормление грудным молоком, по-видимому, смягчило некоторые негативные последствия низкой массы тела при рождении для развития микробиома [48]. Исследования микробиомов у младенцев были сосредоточены на изобилии конкретных бактерий, а также на их разнообразии. В одном исследовании было обнаружено, что младенцы, находящиеся на грудном вскармливании, имеют большее количество Bifidobacterium , но микробиом младенцев на искусственном вскармливании был более разнообразным [49].Другое исследование обнаружило обогащение Actinobacteria и Firmicutes и истощение Proteobacteria у детей, находящихся на грудном вскармливании, по сравнению с младенцами, вскармливаемыми смесью [50]. Смесительное вскармливание было связано с изменением бактериального разнообразия у младенцев [51], при этом микробиота младенцев, которых кормили как грудным молоком, так и смесями, больше сходна с младенцами на искусственном вскармливании, чем с младенцами, вскармливаемыми исключительно грудью [33]. Кормление смесью в 3 месяца было связано с повышенным риском избыточной массы тела в 12 месяцев, определяемого как младенцы, у которых соотношение веса к длине тела> 85-го процентиля [33].В проспективном исследовании дети с избыточной массой тела в возрасте 7 лет имели более низкий уровень колонизации Bifidobacterium и более высокий уровень колонизации Staphylococcus aureus в младенчестве по сравнению с детьми с аналогичным нормальным весом [52]. Иммуноглобулины, полученные из грудного молока, модулируют иммунную функцию кишечника и состав кишечного микробиома [53], что дает дополнительные доказательства механизмов, связывающих вскармливание грудным молоком с иммунозащитой.
Однако состав грудного молока человека сильно варьируется [40,41,42], который зависит от состояния здоровья матери [43,44,45]. Состав грудного молока динамичен, меняется со временем и может зависеть от таких характеристик младенца, как пол [46] или динамические сигналы во время болезни.Еще предстоит определить, отвечает ли «основная» группа компонентов грудного молока, общих для большинства людей, за большинство защитных эффектов [47]. У недоношенных детей кормление грудным молоком, по-видимому, смягчило некоторые негативные последствия низкой массы тела при рождении для развития микробиома [48]. Исследования микробиомов у младенцев были сосредоточены на изобилии конкретных бактерий, а также на их разнообразии. В одном исследовании было обнаружено, что младенцы, находящиеся на грудном вскармливании, имеют большее количество Bifidobacterium , но микробиом младенцев на искусственном вскармливании был более разнообразным [49].Другое исследование обнаружило обогащение Actinobacteria и Firmicutes и истощение Proteobacteria у детей, находящихся на грудном вскармливании, по сравнению с младенцами, вскармливаемыми смесью [50]. Смесительное вскармливание было связано с изменением бактериального разнообразия у младенцев [51], при этом микробиота младенцев, которых кормили как грудным молоком, так и смесями, больше сходна с младенцами на искусственном вскармливании, чем с младенцами, вскармливаемыми исключительно грудью [33]. Кормление смесью в 3 месяца было связано с повышенным риском избыточной массы тела в 12 месяцев, определяемого как младенцы, у которых соотношение веса к длине тела> 85-го процентиля [33].В проспективном исследовании дети с избыточной массой тела в возрасте 7 лет имели более низкий уровень колонизации Bifidobacterium и более высокий уровень колонизации Staphylococcus aureus в младенчестве по сравнению с детьми с аналогичным нормальным весом [52]. Иммуноглобулины, полученные из грудного молока, модулируют иммунную функцию кишечника и состав кишечного микробиома [53], что дает дополнительные доказательства механизмов, связывающих вскармливание грудным молоком с иммунозащитой. Было обнаружено, что в популяции, подверженной риску недоедания, более низкие уровни сиалированных олигосахаридов в грудном молоке связаны с задержкой роста ребенка, а включение сиалилированных олигосахаридов в рацион лабораторных животных было связано с массой тела в зависимости от микробиома кишечника [ 54].Хотя требуется гораздо больше исследований, эти данные выделяют раннее младенчество как критический период, когда микробный дисбиоз может привести к избыточному весу в более позднем возрасте, потому что микробиом может быть не в состоянии оправиться от дисбактериоза, установленного в раннем возрасте. Компоненты грудного молока могут формировать микробиом младенца, обеспечивая пожизненную защиту от ожирения и других метаболических заболеваний. Однако, учитывая большую вариабельность состава грудного молока и возможность взаимодействия с генетическим фоном, также могут быть случаи, когда грудное молоко способствует менее благоприятному развитию микробиома.
Было обнаружено, что в популяции, подверженной риску недоедания, более низкие уровни сиалированных олигосахаридов в грудном молоке связаны с задержкой роста ребенка, а включение сиалилированных олигосахаридов в рацион лабораторных животных было связано с массой тела в зависимости от микробиома кишечника [ 54].Хотя требуется гораздо больше исследований, эти данные выделяют раннее младенчество как критический период, когда микробный дисбиоз может привести к избыточному весу в более позднем возрасте, потому что микробиом может быть не в состоянии оправиться от дисбактериоза, установленного в раннем возрасте. Компоненты грудного молока могут формировать микробиом младенца, обеспечивая пожизненную защиту от ожирения и других метаболических заболеваний. Однако, учитывая большую вариабельность состава грудного молока и возможность взаимодействия с генетическим фоном, также могут быть случаи, когда грудное молоко способствует менее благоприятному развитию микробиома.
3.2. Добавки с пребиотиками и пробиотиками
Конкретный состав различных типов смесей может влиять на микробиом. В нескольких исследованиях оценивалось включение пробиотиков или пребиотиков, таких как олигосахариды, в детские смеси для более точного имитации состава грудного молока [55]. Смесь для младенцев, дополненная несколькими штаммами Bifidobacterium , изменила состав микробиома у младенцев, но не повлияла на долгосрочную колонизацию [56]. Не наблюдалось значительного влияния добавок олигосахаридов и Bifidobacterium на диарею или фебрильную инфекцию, однако микробиота младенцев, получавших добавки, больше напоминала микробиоту грудных детей [57].Включение лактозы в гидролизованные смеси, разработанные для младенцев с аллергией на молоко, способствовало росту Bifidobacterium и Lactobacillales и увеличению количества жирных кислот с короткой цепью кишечника (SCFA) [58]. Было обнаружено, что добавка Lactobacillus изменяет состав микробиома кишечника [59]. Текущие данные свидетельствуют о том, что включение пре- и пробиотиков в смесь хорошо переносится, однако пока не известно, оказывает ли это положительное влияние на долгосрочные результаты.
Текущие данные свидетельствуют о том, что включение пре- и пробиотиков в смесь хорошо переносится, однако пока не известно, оказывает ли это положительное влияние на долгосрочные результаты.
3.3. Метод доставки молока
Существуют некоторые данные о различных эффектах прямого грудного вскармливания и сцеживания из бутылочки [60]. Во время кормления грудью младенцы подвергаются воздействию микробиоты кожи матери, а также откладывают слюну, которая содержит микробиоту и патогены, которые могут передаваться обратно матери, потенциально вызывая изменения в составе грудного молока через петлю обратной связи [61,62]. Эта область интригует, но требует дальнейших исследований.
3.4. Донорское грудное молоко
Из-за потенциальных преимуществ грудного молока донорское молоко иногда используется, когда молоко от биологической матери младенца недоступно. Это особенно актуально для недоношенных детей. Однако остается неясным, обладает ли донорское молоко такими же защитными свойствами [63]. В рандомизированном исследовании с участием недоношенных детей донорское молоко не показало преимущества перед смесями по сравнению с материнским молоком [64]. Донорское молоко обычно пастеризуется, чтобы снизить риск заражения, и его часто берут из нескольких донорских источников.Пастеризация может разрушить пре- и пробиотики, уменьшая благотворное влияние грудного молока. Кроме того, вариабельность состава грудного молока может привести к тому, что донорское молоко окажется неоптимальным для неродственного младенца. Однако требуется гораздо больше исследований, чтобы установить потенциальные преимущества и риски использования донорского молока в качестве альтернативы смеси.
4. Диетические модуляторы состава кишечного микробиома в детстве
Введение твердой пищи связано со сдвигом в микробиоме младенца, чтобы он больше напоминал профили взрослых, однако детский микробиом остается в движении, по крайней мере, в течение первых 3 лет жизни [7].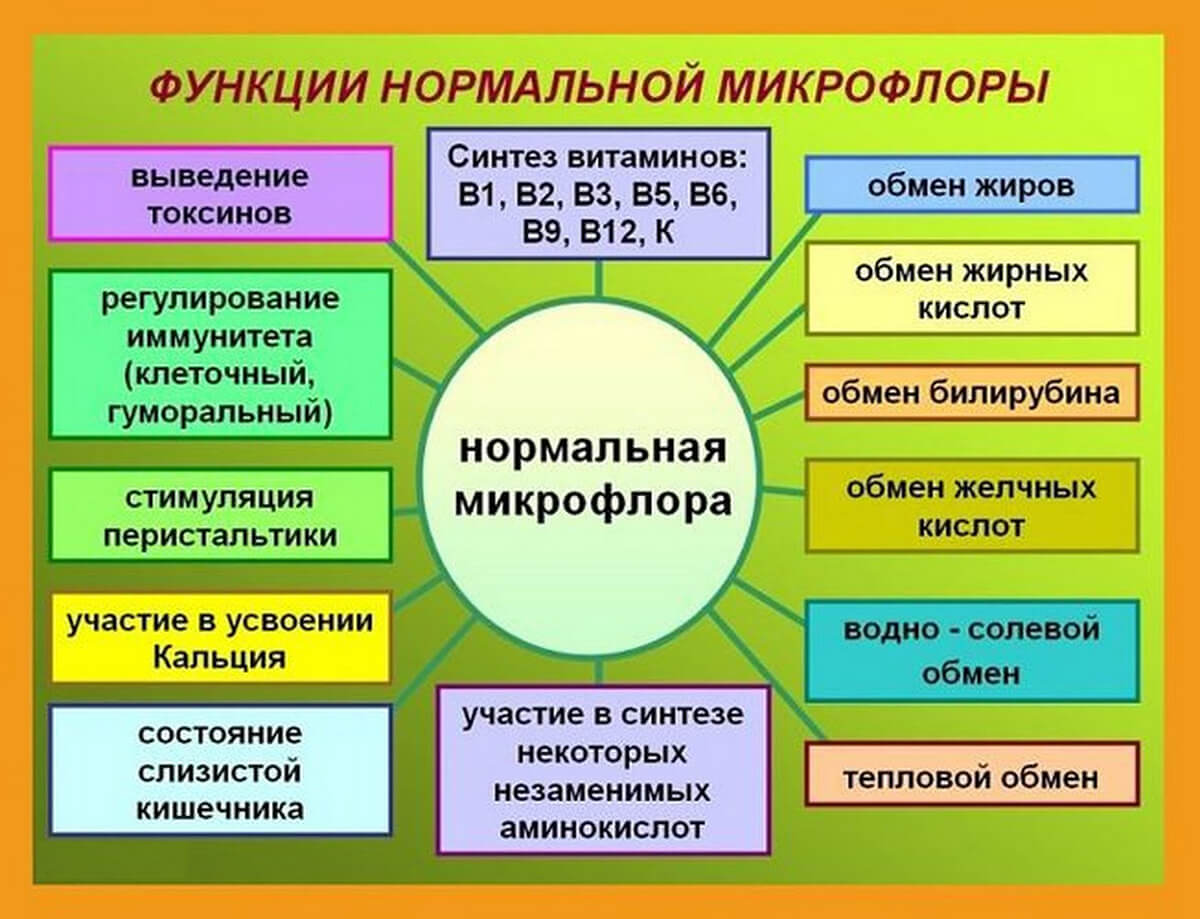 Это предполагает период относительно гибкости и подразумевает, что диета в раннем детстве может иметь непропорционально большое влияние на состав микробиома на протяжении всей жизни и связанные с этим воздействия на здоровье. У взрослых изменение диеты значительно влияет на состав микробиома кишечника, при этом наблюдаются значительные изменения в микробном составе в течение 24 часов после существенных или резких изменений в диете, таких как внезапный переход на продукты исключительно растительного или животного происхождения. Почти полное возвращение к исходному составу можно наблюдать через 48 ч после возобновления нормальной диеты [6].Данные о влиянии диетического вмешательства на микробиом у детей ограничены, но, учитывая, что профили микробиома у детей в возрасте старше 3 лет очень похожи на таковые у взрослых, вполне вероятно, что диетические изменения могут быстро повлиять на состав микробиома у детей.
Это предполагает период относительно гибкости и подразумевает, что диета в раннем детстве может иметь непропорционально большое влияние на состав микробиома на протяжении всей жизни и связанные с этим воздействия на здоровье. У взрослых изменение диеты значительно влияет на состав микробиома кишечника, при этом наблюдаются значительные изменения в микробном составе в течение 24 часов после существенных или резких изменений в диете, таких как внезапный переход на продукты исключительно растительного или животного происхождения. Почти полное возвращение к исходному составу можно наблюдать через 48 ч после возобновления нормальной диеты [6].Данные о влиянии диетического вмешательства на микробиом у детей ограничены, но, учитывая, что профили микробиома у детей в возрасте старше 3 лет очень похожи на таковые у взрослых, вполне вероятно, что диетические изменения могут быстро повлиять на состав микробиома у детей.
4.1. Влияние западной диеты на микробиом кишечника
Западная диета с высоким содержанием животного белка и жира, высоким содержанием рафинированных углеводов и низким содержанием растительной клетчатки, фитохимических веществ и ферментированных продуктов была связана с относительно недавним быстрым ростом потребления воспалительные заболевания, включая кардиометаболические и кишечные заболевания.Появляется все больше доказательств того, что это может быть опосредовано микробиотой кишечника [65,66]. Было обнаружено, что западная диета снижает общую бактериальную нагрузку, а также таковую полезных родов, таких как Bifidobacterium и Eubacterium [67]. Исследования вегетарианских и веганских диет выявили различные уровни различий в составе микробиома по сравнению с типичной неограниченной западной диетой с потенциально незначительными различиями в общей функциональной способности микробиоты [68,69,70,71].Исследование, посвященное влиянию западной и традиционной растительной диеты на детей в Таиланде, обнаружило различия в составе и использовало метагеномный прогноз для выявления недостаточной представленности генов, отвечающих за биосинтетические пути бутирата у детей, потребляющих западную диету [72], что может влиять на иммунитет кишечника. гомеостаз [73]. Аналогичным образом было обнаружено, что дети, соблюдающие традиционные диеты в сельских районах Малави и Венесуэлы, имеют различия в содержании метаболических генов в микробиоме по сравнению с детьми в США, потребляющими западную диету [7].В небольшом исследовании городских посетителей традиционной деревни с тропическим лесом было обнаружено, что микробиом детей более подвержен изменениям по сравнению с относительно стабильным микробиомом у взрослых, что подчеркивает более высокую пластичность микробиома у детей [74]. Диеты с высоким содержанием общего белка связаны с повышенным риском воспалительных заболеваний кишечника (ВЗК) [75]. Употребление гороха и сывороточного протеина было связано с повышенным уровнем комменсалов Bifidobacterium и Lactobacillus [76], а ферментированный сывороточный протеин снижает количество потенциально патогенных видов Bacteroides fragilis и Clostridium perfringens [77].Некоторые виды, численность которых увеличивается в результате употребления красного мяса, связаны с более высокими уровнями проатерогенного химического триметиламин-N-оксида (ТМАО), связанного с увеличением риска сердечно-сосудистых заболеваний [78]. Диета с высоким содержанием белка у лиц моложе 65 лет связана с увеличением выработки инсулиноподобного фактора роста 1, фактора риска рака, диабета и смертности [79]. Было показано, что диета с высоким содержанием жиров у людей увеличивает относительное количество анаэробных бактерий и Bacteroidetes, тогда как диета с низким содержанием жиров увеличивает количество фекальных Bifidobacterium и снижает общий холестерин и глюкозу натощак [80].У мышей наблюдалось значительное влияние на состав микробиома при сравнении рационов с полиненасыщенными жирами (рыбий жир) и насыщенными жирами (сало) [81]. У мышей, которых кормили жиром, наблюдалось усиление системного и жирового воспаления и пониженная чувствительность к инсулину по сравнению с мышами, получавшими рыбий жир.
гомеостаз [73]. Аналогичным образом было обнаружено, что дети, соблюдающие традиционные диеты в сельских районах Малави и Венесуэлы, имеют различия в содержании метаболических генов в микробиоме по сравнению с детьми в США, потребляющими западную диету [7].В небольшом исследовании городских посетителей традиционной деревни с тропическим лесом было обнаружено, что микробиом детей более подвержен изменениям по сравнению с относительно стабильным микробиомом у взрослых, что подчеркивает более высокую пластичность микробиома у детей [74]. Диеты с высоким содержанием общего белка связаны с повышенным риском воспалительных заболеваний кишечника (ВЗК) [75]. Употребление гороха и сывороточного протеина было связано с повышенным уровнем комменсалов Bifidobacterium и Lactobacillus [76], а ферментированный сывороточный протеин снижает количество потенциально патогенных видов Bacteroides fragilis и Clostridium perfringens [77].Некоторые виды, численность которых увеличивается в результате употребления красного мяса, связаны с более высокими уровнями проатерогенного химического триметиламин-N-оксида (ТМАО), связанного с увеличением риска сердечно-сосудистых заболеваний [78]. Диета с высоким содержанием белка у лиц моложе 65 лет связана с увеличением выработки инсулиноподобного фактора роста 1, фактора риска рака, диабета и смертности [79]. Было показано, что диета с высоким содержанием жиров у людей увеличивает относительное количество анаэробных бактерий и Bacteroidetes, тогда как диета с низким содержанием жиров увеличивает количество фекальных Bifidobacterium и снижает общий холестерин и глюкозу натощак [80].У мышей наблюдалось значительное влияние на состав микробиома при сравнении рационов с полиненасыщенными жирами (рыбий жир) и насыщенными жирами (сало) [81]. У мышей, которых кормили жиром, наблюдалось усиление системного и жирового воспаления и пониженная чувствительность к инсулину по сравнению с мышами, получавшими рыбий жир. Трансплантация фекалий воспроизводила метаболический и воспалительный фенотип, демонстрируя случайный эффект микробиоты [81]. Микробиом кишечника животных, получавших диету с высоким содержанием жиров или сахара, более уязвим к нарушению циркадного ритма [82].Учитывая особую важность сна для детей, сочетание плохого питания и нарушения сна может привести к изменениям в составе микробиома кишечника.
Трансплантация фекалий воспроизводила метаболический и воспалительный фенотип, демонстрируя случайный эффект микробиоты [81]. Микробиом кишечника животных, получавших диету с высоким содержанием жиров или сахара, более уязвим к нарушению циркадного ритма [82].Учитывая особую важность сна для детей, сочетание плохого питания и нарушения сна может привести к изменениям в составе микробиома кишечника.
4.2. Пребиотики растительного происхождения
Неперевариваемые углеводы растительного происхождения, такие как некоторые крахмалы и клетчатка, выживают в толстой кишке, где они ферментируются микробиомом толстой кишки с образованием короткоцепочечных жирных кислот (SCFA) [83]. Эпителиальные клетки толстой кишки используют SCFAs, особенно бутират, на 60–70% своей энергии, и они способствуют укреплению слизистого барьера [84].SCFAs также регулируют метаболизм глюкозы и липидов и иммунную функцию [73,85]. Бутират действует как ингибитор гистондеацетилазы, участвуя в эпигенетическом контроле производства и поддержания регуляторных Т-клеток [86]. Дисбактериоз кишечника, связанный с западной диетой, может способствовать протеканию кишечной мембраны и метаболической эндотоксемии [87], что приводит к увеличению риска кардиометаболических заболеваний. Диета с низким содержанием пребиотиков снижает общую бактериальную нагрузку и разнообразие, в то время как диета с высоким содержанием растений увеличивает богатство генов микробиома и улучшает маркеры воспаления [88,89,90].В исследовании коммерчески доступных злаков для младенцев разные типы злаков были связаны с изменениями в составе микробиома и различиями в продукции SCFA на модели кишечника младенца in vitro [91].
4.3. Другие диетические модуляторы состава микробиома
В то время как большинство исследований диеты и микробиома в основном сосредоточено на западных и традиционных диетах, изучались также и другие диетические компоненты. Было обнаружено, что в Мексике у детей с недостаточным питанием и ожирением наблюдается более низкое бактериальное разнообразие по сравнению с хорошо питающимися детьми с нормальным весом [92]. Имеются ограниченные данные об отдельных диетических эффектах на микробиом у детей, но данные, полученные от взрослых, предполагают, что состав микробиома формируется множеством компонентов, полученных из рациона. Безглютеновые диеты были связаны с изменениями микробиоты, со снижением количества Bifidobacterium , Lactobacillus и Clostridium , а также увеличением количества других бактерий, включая потенциальные условно-патогенные микроорганизмы [93,94]. Было показано, что искусственные подсластители изменяют микробиоту кишечника [95] и вызывают непереносимость глюкозы за счет своего воздействия на микробиоту желудочно-кишечного тракта [96].Другие растительные компоненты, включая полифенолы, также могут модулировать микробиом кишечника [97,98,99]. Ферментированные продукты действуют как естественный источник пробиотиков, причем ферментированные молочные продукты [100,101] и овощи [102,103] вносят вклад в рацион бактерий, хотя степень, в которой эти бактерии выживают и колонизируют кишечник у людей с установленным микробиомом, неясна [104] . Испытания детских пробиотических добавок, как правило, не выявили долгосрочного воздействия добавок на метаболические и воспалительные маркеры [105,106].Микробиом адаптируется к доступным источникам пищи; хотя некоторые профили могут быть более полезными, чем другие, существует сложное взаимодействие между диетой, микробиотой и последующими метаболическими эффектами, которые еще предстоит изучить.
Имеются ограниченные данные об отдельных диетических эффектах на микробиом у детей, но данные, полученные от взрослых, предполагают, что состав микробиома формируется множеством компонентов, полученных из рациона. Безглютеновые диеты были связаны с изменениями микробиоты, со снижением количества Bifidobacterium , Lactobacillus и Clostridium , а также увеличением количества других бактерий, включая потенциальные условно-патогенные микроорганизмы [93,94]. Было показано, что искусственные подсластители изменяют микробиоту кишечника [95] и вызывают непереносимость глюкозы за счет своего воздействия на микробиоту желудочно-кишечного тракта [96].Другие растительные компоненты, включая полифенолы, также могут модулировать микробиом кишечника [97,98,99]. Ферментированные продукты действуют как естественный источник пробиотиков, причем ферментированные молочные продукты [100,101] и овощи [102,103] вносят вклад в рацион бактерий, хотя степень, в которой эти бактерии выживают и колонизируют кишечник у людей с установленным микробиомом, неясна [104] . Испытания детских пробиотических добавок, как правило, не выявили долгосрочного воздействия добавок на метаболические и воспалительные маркеры [105,106].Микробиом адаптируется к доступным источникам пищи; хотя некоторые профили могут быть более полезными, чем другие, существует сложное взаимодействие между диетой, микробиотой и последующими метаболическими эффектами, которые еще предстоит изучить.
5. Другие детерминанты состава микробиома в детстве
5.1. Влияние антибиотиков и лекарственного взаимодействия
Частое употребление антибиотиков в детстве связано с повышенным риском устойчивости к антибиотикам [107] и может предрасполагать людей к повышенному риску заболеваний, включая избыточный вес и ожирение [108,109], а также воспалительные заболевания [110], потенциально через модуляцию микробиома.Использование антибиотиков приводит к снижению разнообразия микробиома и сокращению количества резидентных полезных комменсалов в кишечнике [111]. Низкое разнообразие связано с увеличением массы тела, инсулинорезистентностью, воспалительным тонусом и дислипидемией по сравнению с более высоким разнообразием кишечника [112]. Хотя наибольшее влияние оказывают антибиотики широкого спектра действия, эффекты смягчаются, но все же присутствуют, если антибиотик нацелен на определенный патоген. Это нарушение способствует размножению как потенциально патогенных бактерий, так и бактерий, способствующих ожирению и нарушению регуляции метаболизма [113,114].Воздействие может быть особенно большим, если эти нарушения происходят в раннем возрасте, до появления относительно стабильного зрелого микробиома в возрасте двух-трех лет [115,116]. Микробиому требуется несколько недель, чтобы восстановиться после курса антибиотиков, часто никогда полностью не восстанавливая доантибиотическое разнообразие [117]. Использование антибиотиков в течение первых 6 месяцев жизни было связано с более высоким риском избыточного веса среди детей матерей с нормальным весом, хотя, что интересно, использование антибиотиков было связано со сниженным риском избыточного веса у детей матерей с избыточным весом [118].Было обнаружено, что связь между повышенным индексом массы тела (ИМТ) и кумулятивным воздействием антибиотиков в раннем детстве была несколько выше, если использовались антибиотики широкого спектра действия [119]. Сообщалось о значительном половом взаимодействии, когда прием антибиотиков в первые 12 месяцев жизни ассоциировался с повышенным ИМТ у мальчиков, но не у девочек [120].
Низкое разнообразие связано с увеличением массы тела, инсулинорезистентностью, воспалительным тонусом и дислипидемией по сравнению с более высоким разнообразием кишечника [112]. Хотя наибольшее влияние оказывают антибиотики широкого спектра действия, эффекты смягчаются, но все же присутствуют, если антибиотик нацелен на определенный патоген. Это нарушение способствует размножению как потенциально патогенных бактерий, так и бактерий, способствующих ожирению и нарушению регуляции метаболизма [113,114].Воздействие может быть особенно большим, если эти нарушения происходят в раннем возрасте, до появления относительно стабильного зрелого микробиома в возрасте двух-трех лет [115,116]. Микробиому требуется несколько недель, чтобы восстановиться после курса антибиотиков, часто никогда полностью не восстанавливая доантибиотическое разнообразие [117]. Использование антибиотиков в течение первых 6 месяцев жизни было связано с более высоким риском избыточного веса среди детей матерей с нормальным весом, хотя, что интересно, использование антибиотиков было связано со сниженным риском избыточного веса у детей матерей с избыточным весом [118].Было обнаружено, что связь между повышенным индексом массы тела (ИМТ) и кумулятивным воздействием антибиотиков в раннем детстве была несколько выше, если использовались антибиотики широкого спектра действия [119]. Сообщалось о значительном половом взаимодействии, когда прием антибиотиков в первые 12 месяцев жизни ассоциировался с повышенным ИМТ у мальчиков, но не у девочек [120].
Новые исследования выявляют взаимодействия между микробиомом и лекарствами, как в том, как эффективность лекарства модулируется микробиотой, так и в том, как использование фармакологических агентов может формировать микробиом.Было показано, что многие лекарства по-разному метаболизируются микробиотой [121, 122, 123], и дальнейшее рассмотрение состава микробиома может повлиять на дозировку лекарств у детей. Также было показано, что различные лекарства изменяют состав микробиома, включая ингибиторы протонной помпы, а также статины и антидиабетические препараты [124,125,126,127], хотя долгосрочные эффекты неизвестны. В связи с важной ролью микробиома кишечника в развитии иммунной системы было выдвинуто предположение, что флора кишечника может влиять на реакцию хозяина на вакцины.Хотя исследований по составу микробиома и вакцинации было относительно немного, данные показывают, что микробиота играет роль в ответе на вакцину [128]. Более высокая относительная численность Actinobacteria и Firmicutes была связана с более высокими гуморальными и клеточными ответами на вакцины, в то время как высокая относительная численность Proteobacteria и Bacteroidetes была связана с более низкими ответами [129, 130, 131]. Еще предстоит определить, вызывает ли вакцинация какие-либо изменения в микробиоме.Несмотря на преимущества для спасения жизни, данные показывают, что раннее и повторное использование антибиотиков и, возможно, других лекарств в детстве является важным фактором, определяющим состав микробиома, который может повлиять на риск заболевания в будущем.
В связи с важной ролью микробиома кишечника в развитии иммунной системы было выдвинуто предположение, что флора кишечника может влиять на реакцию хозяина на вакцины.Хотя исследований по составу микробиома и вакцинации было относительно немного, данные показывают, что микробиота играет роль в ответе на вакцину [128]. Более высокая относительная численность Actinobacteria и Firmicutes была связана с более высокими гуморальными и клеточными ответами на вакцины, в то время как высокая относительная численность Proteobacteria и Bacteroidetes была связана с более низкими ответами [129, 130, 131]. Еще предстоит определить, вызывает ли вакцинация какие-либо изменения в микробиоме.Несмотря на преимущества для спасения жизни, данные показывают, что раннее и повторное использование антибиотиков и, возможно, других лекарств в детстве является важным фактором, определяющим состав микробиома, который может повлиять на риск заболевания в будущем.
5.2. Пол и генетические различия в микробиоме
Мало что известно о том, как генетика хозяина может определять колонизацию микробиома в младенчестве, однако данные, полученные у взрослых, предполагают наличие генетического компонента микробиома [132, 133, 134].Остается неясным, является ли секс важным модулятором состава микробиома у детей. Было обнаружено, что у младенцев мужского пола общее количество бактерий при рождении выше, чем у младенцев женского пола, на основании первой дефекации, в то время как половые различия в колонизации Lactobacillus наблюдались как при рождении, так и через несколько месяцев [135]. Сообщалось о половых различиях в составе микробиома у взрослых [136], и они могут взаимодействовать с половыми гормонами, изменяя риск заболевания [137, 138]. Микробиом может действовать как промежуточный механизм, связывающий генетику с заболеванием, однако необходимы дальнейшие исследования, чтобы понять потенциальные причинные связи.
5.3. Экологические модификаторы состава микробиома
Ранний контакт с домашними животными был связан с увеличением бактериального богатства и разнообразия микробиома кишечника младенца, что может защитить от ожирения и аллергии [139, 140]. Присутствие братьев и сестер в домашнем хозяйстве было связано как с увеличением разнообразия [141], так и с уменьшением разнообразия и богатства [139], а также с различиями в конкретных бактериях [111,135]. Есть также свидетельства того, что воздействие городской и сельской окружающей среды помогает формировать микробиом у детей [142].В соответствии с гипотезой гигиены, вполне вероятно, что воздействие микробиоты домашних животных и других детей может способствовать развитию здорового микробиома. Однако относительная важность воздействия внутри общего домохозяйства по сравнению со всеми другими географическими и экологическими воздействиями остается неясной.
Присутствие братьев и сестер в домашнем хозяйстве было связано как с увеличением разнообразия [141], так и с уменьшением разнообразия и богатства [139], а также с различиями в конкретных бактериях [111,135]. Есть также свидетельства того, что воздействие городской и сельской окружающей среды помогает формировать микробиом у детей [142].В соответствии с гипотезой гигиены, вполне вероятно, что воздействие микробиоты домашних животных и других детей может способствовать развитию здорового микробиома. Однако относительная важность воздействия внутри общего домохозяйства по сравнению со всеми другими географическими и экологическими воздействиями остается неясной.
5.4. Сопутствующие заболевания
Существенные медицинские события и сопутствующие заболевания могут иметь большое влияние на микробиом. Госпитализация связана с повышенным риском колонизации Clostridium difficile [111, 143].Было обнаружено, что изменения микробиоты кишечника и повышенная транслокация кишечных бактерий происходят после травм, включая ожоги и черепно-мозговые травмы [144, 145]. Хотя такие травмы сами по себе могут вызывать у детей долгосрочные последствия, последствия связанных с травмами изменений в составе микробиома являются важным фактором, который остается малоизученным. Аутизм был связан с различиями в составе микробиома [146], и было показано, что методы лечения для изменения состава микробиома, включая трансплантацию фекалий и добавки с пробиотиками, улучшают определенные симптомы у детей с аутизмом [147,148].Необходимы исследования, чтобы выяснить, как сопутствующие заболевания влияют на различия в составе и функциях микробиома.
6. Механизмы, связывающие измененный состав микробиома с развитием ожирения и кардиометаболических заболеваний
Как уже отмечалось, на развитие микробиома влияет множество различных факторов, и многие из них также связаны с последствиями для здоровья. В настоящее время существует пробел в знаниях, поскольку у нас нет проспективных лонгитюдных или интервенционных исследований, которые причинно связывают измененный состав микробиома с заболеванием. Однако, как указано, многие исследования предполагают такую связь, и исследования трансплантации фекального микробиома установили причинно-следственную связь у мышей и, в ограниченной степени, также у людей [113, 149, 150, 151, 152]. В настоящее время конкретные механизмы, посредством которых микробиом изменяет кардиометаболическое заболевание, менее ясны. Ранние события, определяющие состав микробиома, вероятно, влияют на риск заболевания на протяжении всей жизни, изменяя долгосрочную функцию микробиома. Как показано ниже, микробиота, вероятно, влияет на риск кардиометаболических заболеваний у хозяина посредством по крайней мере трех потенциальных механизмов: (1) контроль биодоступности питательных веществ; (2) взаимодействие с иммунной системой для модуляции воспаления; и (3) производство специфических защитных или патогенных метаболитов.Доказательства, подтверждающие эти механизмы, обсуждаются ниже.
Однако, как указано, многие исследования предполагают такую связь, и исследования трансплантации фекального микробиома установили причинно-следственную связь у мышей и, в ограниченной степени, также у людей [113, 149, 150, 151, 152]. В настоящее время конкретные механизмы, посредством которых микробиом изменяет кардиометаболическое заболевание, менее ясны. Ранние события, определяющие состав микробиома, вероятно, влияют на риск заболевания на протяжении всей жизни, изменяя долгосрочную функцию микробиома. Как показано ниже, микробиота, вероятно, влияет на риск кардиометаболических заболеваний у хозяина посредством по крайней мере трех потенциальных механизмов: (1) контроль биодоступности питательных веществ; (2) взаимодействие с иммунной системой для модуляции воспаления; и (3) производство специфических защитных или патогенных метаболитов.Доказательства, подтверждающие эти механизмы, обсуждаются ниже.
6.1. Энергетический метаболизм и ожирение
Многочисленные исследования выявили различия в составе микробиома по массе тела [153,154,155], при этом Bifidobacterium участвовали в нескольких исследованиях, связывающих микробиом кишечника с ожирением [52]. Эксперименты по трансплантации фекального микробиома показали, что микробиота людей или животных с ожирением способствует ожирению, доказывая, что сама микробиота может вызывать ожирение [113, 150, 156].Кроме того, было показано, что фекальные трансплантаты модулируют чувствительность к инсулину у людей, хотя долгосрочные эффекты неизвестны [151, 152]. Упрощенные расчеты энергетического содержания пищи и отношения к массе тела предполагают, что калории в данной пище в равной степени доступны всем людям. Однако с ростом понимания роли микробиоты становится ясно, что это не так [113, 157]; Поскольку комменсальные микробы избирательно метаболизируют пищу в кишечнике, они могут контролировать поступление питательных веществ, в том числе короткоцепочечных жирных кислот, к хозяину.Микробиота также способствует биосинтезу аминокислот и витаминов, а это означает, что одни и те же продукты могут обеспечивать разную биодоступность калорий и питательных веществ для разных людей. Микробиота предпочтительно переваривает пищевые пребиотики, включая клетчатку, которые не легко усваиваются хозяином. У людей, потребляющих диету с низким содержанием клетчатки, недостаточное количество пребиотиков может вызвать изменения в составе микробиома и метаболизме, что влияет на метаболизм хозяина [158]. Хотя этот процесс сложен и осложняется множеством переменных, влияющих на массу тела и выбор пищи, тонких различий в доступности энергии с течением времени может быть достаточно, чтобы сместить людей от худощавого к фенотипу ожирения [159, 160].
Микробиота предпочтительно переваривает пищевые пребиотики, включая клетчатку, которые не легко усваиваются хозяином. У людей, потребляющих диету с низким содержанием клетчатки, недостаточное количество пребиотиков может вызвать изменения в составе микробиома и метаболизме, что влияет на метаболизм хозяина [158]. Хотя этот процесс сложен и осложняется множеством переменных, влияющих на массу тела и выбор пищи, тонких различий в доступности энергии с течением времени может быть достаточно, чтобы сместить людей от худощавого к фенотипу ожирения [159, 160].
6.2. Воспаление
Воспаление — ключевой компонент поддержания здоровья, однако неконтролируемое воспаление может иметь разрушительные последствия, при этом хроническое воспаление слабой степени способствует развитию кардиометаболического заболевания [161, 162]. Между комменсальными микробами и иммунной системой хозяина существует сложное взаимодействие, которое при нарушении регуляции может способствовать развитию патогенного воспаления. Хотя данные свидетельствуют о том, что микробиом частично можно модифицировать на протяжении всей жизни, первоначальное развитие микробиома может иметь особое значение для создания основного микробиома, устойчивого к более поздним модификациям.Нарушение регуляции в ранние критические периоды в младенчестве может иметь пожизненные последствия для иммунной и метаболической функции, которые может быть трудно обратить вспять [163, 164, 165, 166]. Эксперименты на мышах показали, что возрастная экспрессия TLR5 в кишечном эпителии новорожденных способствует селективной колонизации не жгутиковой микробиотой [166]. Это предполагает критические периоды во время развития, когда воздействие определенных бактерий способствует нормальному развитию отношений между хозяином и микробиотой. Исследования на животных показали, что микробиота необходима для нормального развития кишечника и созревания иммунной системы посредством передачи сигналов, опосредованной toll-подобным рецептором 2 (TLR2) [167, 168, 169].В исследованиях способов родоразрешения и кормления у младенцев наблюдались различия в биомаркерах иммунной функции, включая иммуноглобулины и цитокины, одновременно с изменениями в микробиоме [12, 170]. Транслокация микробов, микробных нуклеиновых кислот и липополисахаридов бактериального происхождения (ЛПС) из кишечника в кровоток происходит не только при кишечных заболеваниях, но и регулярно у людей с нарушенной функцией кишечного барьера или без нее, например, во время диеты. постпрандиальная метаболическая эндотоксемия [87, 112, 171, 172, 173, 174].Бактерии и бактериальные РНК были обнаружены в тканях по всему телу, включая атеросклеротические бляшки и липопротеины [175], предполагая, что транслокация комменсальных микробов может играть причинную роль в этиологии заболевания [176].
6.3. Модуляция метаболитов
Помимо воздействия на воспалительную передачу сигналов, микробиота также производит и модифицирует другие сигнальные молекулы. Метаболиты образуются в кишечнике в результате метаболизма микробов, взаимодействия микробов с хозяевами и действия микробиоты на пищевые субстраты [4,177].Микробный метаболизм диетического карнитина и холина до триметиламина и последующее окисление в печени до проатерогенного метаболита ТМАО, как было обнаружено, связаны с повышенным риском атеросклероза [5,178,179], хотя остается неясным, является ли ТМАО неизменно патогенным [180]. Опосредованный кишечником метаболизм изофлавонов сои, полученных из пищевых продуктов, связан с измененным метаболизмом и кардиометаболическим риском [181, 182, 183, 184]. Многие другие взаимодействия диеты и микробиома могут модулировать риск заболевания с помощью параллельных механизмов.Микробиом может также модулировать биомаркеры заболевания независимо от потребления пищи, включая модуляцию липидов крови [185], биомаркеров, связанных с сердечно-сосудистыми заболеваниями [133], и гомеостаза глюкозы и инсулина [186].
7. Выводы
Как отмечалось в этом обзоре, существует множество доказательств связи состава микробиома кишечника с патофизиологией кардиометаболических заболеваний. В настоящее время наши знания в основном ограничиваются наблюдательными исследованиями и краткосрочными вмешательствами, которые позволяют оценить, какие факторы влияют на состав микробиома кишечника и какие последствия можно ожидать от нарушения регуляции.Однако необходимы крупномасштабные проспективные продольные исследования, чтобы расширить наши знания о динамике микробиома с течением времени и на протяжении всего развития болезни. Хотя существуют определенные стратегии изменения состава микробиома, включая изменение диеты или трансплантацию фекалий, в настоящее время они являются неспецифическими и нецелевыми. Стратегии, нацеленные на конкретные бактерии или функциональные пути, могут дать многообещающие результаты, но еще предстоит проверить в надлежащим образом разработанных испытаниях на людях. Основным ограничением является то, что мы еще не знаем, что представляет собой «здоровый» микробиом.Это необходимо, но будет непросто, потому что на здоровый микробиом, вероятно, повлияют многие факторы, и он может различаться у разных людей и в зависимости от стадии жизни. Выяснение специфических функций различной микробиоты в контексте экосистемы хозяина и микроба необходимо, и это может существенно повлиять на нашу способность понимать сложные предикторы прогрессирования заболевания и определять цели для будущих терапевтических средств микробиома.
Вклад авторов
Написание — подготовка оригинального проекта, A.I.M., E.B.S. и J.F.F .; Написание — обзор и редактирование, A.I.M., E.B.S., S.G.W. и J.F.F.
Финансирование
J.F.F. был поддержан грантом развития ученых Американской кардиологической ассоциации (15SDG248
) и премией P&F Исследовательского центра пищеварительных заболеваний Медицинского центра Университета Вандербильта при поддержке P30DK058404.Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов. Финансирующие организации не играли никакой роли в разработке исследования; при сборе, анализе или интерпретации данных; в написании рукописи и в решении опубликовать результаты.
Ссылки
1. Бенджамин Е.Дж., Вирани С.С., Каллавей С.В., Чемберлен А.М., Чанг А.Р., Ченг С., Чиув С.Э., Кушман М., Деллинг Ф.Н., Део Р. и др. Обновление статистики сердечных заболеваний и инсульта за 2018 г .: отчет Американской кардиологической ассоциации. Тираж. 2018; 137: e67 – e492. DOI: 10.1161 / CIR.0000000000000558. [PubMed] [CrossRef] [Google Scholar] 3. Уилкинс Дж. Т., Нин Х., Берри Дж., Чжао Л., Дайер А. Р., Ллойд-Джонс Д. М. Пожизненный риск и годы жизни без сердечно-сосудистых заболеваний.ДЖАМА. 2012; 308: 1795–1801. DOI: 10.1001 / jama.2012.14312. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 4. Фергюсон Дж. Ф., Аллай Х., Герштен Р. Э., Идеераабдулла Ф., Крис-Этертон П. М., Ордовас Дж. М., Римм Э. Б., Ван Т. Дж., Беннетт Б. Дж., Совет Американской кардиологической ассоциации по функциональному Г. и др. Нутригеномика, микробиом и взаимодействия генов и окружающей среды: новые направления в исследованиях, профилактике и лечении сердечно-сосудистых заболеваний: научное заявление Американской кардиологической ассоциации.Circ. Кардиоваск. Genet. 2016; 9: 291–313. DOI: 10.1161 / HCG.0000000000000030. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 5. Wang Z., Klipfell E., Bennett B.J., Koeth R., Levison B.S., Dugar B., Feldstein A.E., Britt E.B., Fu X., Chung Y.M. и др. Метаболизм фосфатидилхолина в кишечной флоре способствует развитию сердечно-сосудистых заболеваний. Природа. 2011; 472: 57–63. DOI: 10,1038 / природа09922. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Дэвид Л.А., Морис К.Ф., Кармоди Р.Н., Гутенберг Д. Б., Баттон Дж.E., Wolfe B.E., Ling A.V., Devlin A.S., Varma Y., Fischbach M.A. и др. Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Природа. 2014; 505: 559–563. DOI: 10,1038 / природа12820. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Яцуненко Т., Рей Ф.Э., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М., Идальго Г., Бальдассано Р.Н., Анохин А.П. и др. Микробиом кишечника человека в зависимости от возраста и географии. Природа. 2012; 486: 222–227. DOI: 10,1038 / природа11053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8.Filippo CD, Cavalieri D., Paola MD, Ramazzotti M., Poullet JB, Massart S., Collini S., Pieraccini G., Lionetti P. Влияние диеты на формирование микробиоты кишечника, выявленное в сравнительном исследовании у детей из Европы и сельских районов. Африка. Proc. Natl. Акад. Sci. США. 2010; 107: 14691–14696. DOI: 10.1073 / pnas.1005963107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Ferretti P., Pasolli E., Tett A., Asnicar F., Gorfer V., Fedi S., Armanini F., Truong D.T., Manara S., Zolfo M., et al. Передача микробов от матери ребенку из разных участков тела формирует развивающийся микробиом кишечника ребенка.Клеточный микроб-хозяин. 2018; 24 DOI: 10.1016 / j.chom.2018.06.005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. Грёнлунд М.М., Лехтонен О.П., Эерола Э., Керо П. Фекальная микрофлора у здоровых младенцев, рожденных разными способами: постоянные изменения кишечной флоры после кесарева сечения. J. Pediatr. Гастроэнтерол. Nutr. 1999; 28: 19–25. DOI: 10.1097 / 00005176-1990-00007. [PubMed] [CrossRef] [Google Scholar] 11. Лавин Т., Прин Д. Исследование родов с помощью кесарева сечения как фактора риска избыточной массы тела у детей.Ребенок. Ожирение. 2018; 14: 131–138. DOI: 10.1089 / chi.2017.0034. [PubMed] [CrossRef] [Google Scholar] 12. Jakobsson H.E., Abrahamsson T.R., Jenmalm M.C., Harris K., Quince C., Jernberg C., Björkstén B., Engstrand L., Andersson A.F.Уменьшение разнообразия кишечной микробиоты, задержка колонизации Bacteroidetes и снижение ответа Th2 у младенцев, рожденных с помощью кесарева сечения. Кишечник. 2014; 63: 559–566. DOI: 10.1136 / gutjnl-2012-303249. [PubMed] [CrossRef] [Google Scholar] 13. Черникова Д.А., Кестлер Д.К., Хоен А.Г., Housman M.L., Hibberd P.L., Moore J.H., Morrison H.G., Sogin M.L., Zain-Ul-Abideen M., Madan J.C. Воздействие на плод и перинатальное влияние на микробиоту стула недоношенных детей. J. Matern. Фетальный. Неонатальный. Med. 2016; 29: 99–105. DOI: 10.3109 / 14767058.2014.987748. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. Мюллер Н.Т., Мао Г., Беннет В.Л., Хуриган С.К., Домингес-Белло М.Г., Аппель Л.Дж., Ван X. Снижают ли или усиливают ли вагинальные роды связь между поколениями избыточного веса и ожирения? Выводы Бостонской когорты рождения.Int. J. Obes. (Лондон) 2017; 41: 497–501. DOI: 10.1038 / ijo.2016.219. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Ли Х.-Т., Чжоу Ю.-Б., Лю Ж.-М. Влияние кесарева сечения на избыточную массу тела и ожирение у потомства: систематический обзор и метаанализ. Int. J. Obes. (Лондон) 2013; 37: 893–899. DOI: 10.1038 / ijo.2012.195. [PubMed] [CrossRef] [Google Scholar] 16. Тун Х.М., Бриджмен С.Л., Чари Р., Филд С.Дж., Гуттман Д.С., Беккер А.Б., Мандхейн П.Дж., Турви С.Э., Суббарао П., Сирс М.Р. и др.Роли способа рождения и микробиоты кишечника младенца в передаче избыточного веса и ожирения от матери к потомству из поколения в поколение. JAMA Pediatr. 2018; 172: 368–377. DOI: 10.1001 / jamapediatrics.2017.5535. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17. Смитерс Л.Г., Мол Б.В., Джеймисон Л., Линч Дж. Кесарево сечение не связано с индексом массы тела в раннем детстве. Педиатр. Ожирение. 2018; 12: 120–124. DOI: 10.1111 / ijpo.12180. [PubMed] [CrossRef] [Google Scholar] 18. Баррос А.Дж., Сантос Л.П., Вермайстер Ф., Мотта Д.В.Д.С., Матиясевич А., Сантос И.С., Менезеш А.М.Б., Гонсалвес Х., Ассунсао М.К.Ф., Орта Б.Л. и др. Кесарево сечение и ожирение в возрасте 6, 18 и 30 лет: результаты трех когорт детей Pelotas (Бразилия). BMC Public Health. 2017; 17: 256. DOI: 10.1186 / s12889-017-4165-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Унгер С., Стинци А., Шах П., Мак Д., О’Коннор Д.Л. Микробиота кишечника младенца с очень низкой массой тела при рождении. Педиатр. Res. 2015; 77: 205–213.DOI: 10.1038 / pr.2014.162. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 20. Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В., Грегори К.Э., Кролл Дж. С., Макмертри В., Феррис М.Дж. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31. DOI: 10.1186 / s40168-017-0248-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 21. Принц А.Л., Ма Дж., Каннан П.С., Альварес М., Гисслен Т., Харрис Р.А., Суини Е.Л., Нокс С.Л., Ламберс Д.С., Джоб А.Х. и др. Микробиом плацентарной мембраны изменяется у субъектов со спонтанными преждевременными родами с хориоамнионитом и без него. Являюсь. J. Obstet. Гинеколь. 2016; 214: 627.e1–627.e16. DOI: 10.1016 / j.ajog.2016.01.193. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 22. Черникова Д.А., Мадан Дж.С., Хаусман М.Л., Заин-Уль-Абидин М., Лундгрен С.Н., Моррисон Х.Г., Согин М.Л., Уильямс С.М., Мур Дж.Х., Карагас М.Р. и др. Микробиом кишечника недоношенных детей в течение первых 6 недель жизни различается в зависимости от гестационной зрелости при рождении.Педиатр. Res. 2018; 84: 71–79. DOI: 10.1038 / s41390-018-0022-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Ho T.T.B., Groer M.W., Kane B., Yee A.L., Torres B.A., Gilbert J.A., Maheshwari A. Дихотомическое развитие кишечного микробиома у недоношенных детей. Микробиом. 2018; 6: 157. DOI: 10.1186 / s40168-018-0547-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 24. Вандро С., Осборн С., Энрикес К., Биксби К., Арриета А., Уайтсон К. Микробиом и метаболом стула недоношенных детей персонализированы и не зависят от последствий для здоровья, включая некротический энтероколит и поздний сепсис.мСфера. 2018; 3 DOI: 10.1128 / mSphere.00104-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25. Митчелл К.М., Хейк А., Нквопара Э., Гарсия Р., Ренди М., Агнью К., Фредрикс Д.Н., Эшенбах Д. Колонизация верхних половых путей вагинальными бактериями у небеременных женщин. Являюсь. J. Obstet. Гинеколь. 2015; 212: 611.e1–611.e9. DOI: 10.1016 / j.ajog.2014.11.043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 26. Аагаард К., Ма Дж., Энтони К.М., Гану Р., Петросино Дж., Версалович Дж.Плацента содержит уникальный микробиом. Sci. Пер. Med. 2014; 6: 237ra65. DOI: 10.1126 / scitranslmed.3008599. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27. Хименес Э., Фернандес Л., Марин М.Л., Мартин Р., Одриозола Дж. М., Нуэно-Палоп К., Нарбад А., Оливарес М., Хаус Дж., Родригес Дж. М. Выделение комменсальных бактерий из пуповинной крови здоровых новорожденных. путем кесарева сечения. Curr. Microbiol. 2005. 51: 270–274. DOI: 10.1007 / s00284-005-0020-3. [PubMed] [CrossRef] [Google Scholar] 28.Бирфилд К., Давенпорт Е.С., Сивапатхасундарам В., Аллакер Р.П. Возможная связь между инфекцией микроорганизмов околоплодных вод и микрофлорой во рту. BJOG. 2002; 109: 527–533. DOI: 10.1111 / j.1471-0528.2002.01349.x. [PubMed] [CrossRef] [Google Scholar] 29. Хименес Э., Марин М.Л., Мартин Р., Одриозола Дж. М., Оливарес М., Хаус Дж., Фернандес Л., Родригес Дж. М. Действительно ли меконий от здоровых новорожденных бесплоден? Res. Microbiol. 2008. 159: 187–193. DOI: 10.1016 / j.resmic.2007.12.007. [PubMed] [CrossRef] [Google Scholar] 30.Перес-Муньос М.Е., Арриета М.-К., Рамер-Тейт А.Е., Вальтер Дж. Критическая оценка гипотез «стерильной матки» и «внутриутробной колонизации»: значение для исследований микробиома новорожденных. Микробиом. 2017; 5: 48. DOI: 10.1186 / s40168-017-0268-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 32. Ребиндер Е.М., Лёдруп Карлсен К.С., Стафф А.С., Энджелл И.Л., Ландро Л., Хильде К., Гаустад П., Руди К. Нет ли бактерий в околоплодных водах женщин с неосложненной доношенной беременностью? Являюсь.J. Obstet. Гинеколь. 2018 doi: 10.1016 / j.ajog.2018.05.028. [PubMed] [CrossRef] [Google Scholar] 33. Форбс Дж. Д., Азад М. Б., Велинг Л., Тун Х. М., Конья Т. Б., Гутман Д. С., Филд С. Дж., Лефевр Д., Сирс М. Р., Беккер А. Б. и др. Связь воздействия смеси в больнице и последующей практики вскармливания младенцев с кишечной микробиотой и риском избыточного веса в первый год жизни. JAMA Pediatr. 2018; 172: e181161. DOI: 10.1001 / jamapediatrics.2018.1161. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34.Rosenbauer J., Herzig P., Giani G. Раннее вскармливание и риск сахарного диабета 1 типа — общенациональное популяционное исследование методом случай-контроль среди детей дошкольного возраста. Метаб. Диабета. Res. Ред. 2008; 24: 211–222. DOI: 10.1002 / dmrr.791. [PubMed] [CrossRef] [Google Scholar] 35. Munblit D., Peroni D.G., Boix-Amorós A., Hsu P.S., Van’t Land B., Gay M.C.L., Kolotilina A., Skevaki C., Boyle R.J., Collado M.C., et al. Человеческое молоко и аллергические заболевания: неразгаданная загадка. Питательные вещества. 2017; 9: 894. DOI: 10.3390 / nu94.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 37. Гомес-Гальего К., Моралес Дж., Монлеон Д., дю Тойт Э., Кумар Х., Линдерборг К., Чжан Ю., Ян Б., Изолаури Э., Салминен С. и др. Метаболомический профиль ЯМР грудного молока человека в определенных географических регионах и его связь с микробиотой молока. Питательные вещества. 2018; 10: 1355. DOI: 10.3390 / nu10101355. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 38. Солис Г., де Лос Рейес-Гавилан К.Г., Фернандес Н., Марголлес А., Геймонд М.Создание и развитие микробиоты молочнокислых бактерий и бифидобактерий в грудном молоке и кишечнике младенцев. Анаэроб. 2010. 16: 307–310. DOI: 10.1016 / j.anaerobe.2010.02.004. [PubMed] [CrossRef] [Google Scholar] 39. Геймонд М., Лайтинен К., Салминен С., Изолаури Э. Грудное молоко: источник бифидобактерий для развития и созревания кишечника младенца? Неонатология. 2007. 92: 64–66. DOI: 10,1159 / 000100088. [PubMed] [CrossRef] [Google Scholar] 41. Ву X., Джексон Р.Т., Хан С.А., Ахуджа Дж., Перссон П.R. Состав питательных веществ человеческого молока в Соединенных Штатах: современные знания, проблемы и потребности в исследованиях. Curr. Dev. Nutr. 2018; 2: nzy025. DOI: 10.1093 / cdn / nzy025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 42. Гей М., Колева П., Слупски К., Тойт Э., Эггесбо М., Джонсон К., Вегиенка Г., Шимоджо Н., Кэмпбелл Д., Прескотт С. и др. Мировые различия в метаболизме человеческого молока: показатели физиологии груди и образа жизни матери? Питательные вещества. 2018; 10: 1151. DOI: 10.3390 / nu100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43.Панагос П.Г., Вишванатан Р., Пенфилд-Сир А., Маттан Н.Р., Шиваппа Н., Вирт М.Д., Хеберт Дж.Р., Сен С. Грудное молоко от тучных матерей обладает провоспалительными свойствами и снижает нейропротективные факторы. J. Perinatol. 2016; 36: 284–290. DOI: 10.1038 / jp.2015.199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Bzikowska-Jura A., Czerwonogrodzka-Senczyna A., Olędzka G., Szostak-Węgierek D., Weker H., Wesołowska A., Bzikowska-Jura A., Czerwonogrodzka-Senczyna A., Olędzka-Wędzka-G. ., и другие. Питание матери и состав тела во время грудного вскармливания: связь с составом грудного молока. Питательные вещества. 2018; 10: 1379. DOI: 10.3390 / nu10101379. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Twigger A.-J., Küffer G., Geddes D., Filgueria L., Twigger A.-J., Küffer GK, Geddes DT, Filgueria L. Экспрессия гранулисина, перфорина и гранзимов в грудном молоке во время лактации и в Случай материнской инфекции. Питательные вещества. 2018; 10: 1230. DOI: 10.3390 / nu100. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 46.Галанте Л., Милан А.М., Рейнольдс К.М., Камерон-Смит Д., Викерс М.Х., Пундир С. Половой состав человеческого молока: роль пола младенцев в определении питания в раннем возрасте. Питательные вещества. 2018; 10: 1194. DOI: 10.3390 / nu100
- . [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 47. Руис Л., Эспиноза-Мартос И., Гарсиа-Каррал К., Манзано С., Макгуайр М.К., Михан С.Л., Макгуайр М.А., Уильямс Дж.Э., Фостер Дж., Селлен Д.В. и др. Что нормально? Иммунное профилирование грудного молока здоровых женщин, проживающих в различных географических и социально-экономических условиях.Фронт. Иммунол. 2017; 8: 696. DOI: 10.3389 / fimmu.2017.00696. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Грегори К.Е., Сэмюэл Б.С., Хоутелинг П., Шан Г., Осубель Ф.М., Садреев Р.И., Уокер В.А. Влияние потребления материнского грудного молока на приобретение кишечного микробиома у недоношенных детей. Микробиом. 2016; 4: 68. DOI: 10.1186 / s40168-016-0214-х. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 49. Безирцоглоу Э., Циоциас А., Веллинг Г.В. Профиль микробиоты в кале новорожденных, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием флуоресцентной гибридизации in situ (FISH) анаэробов.2011; 17: 478–482. DOI: 10.1016 / j.anaerobe.2011.03.009. [PubMed] [CrossRef] [Google Scholar] 50. Fan W., Huo G., Li X., Yang L., Duan C., Wang T., Chen J. Разнообразие кишечной микробиоты в различных моделях кормления младенцев с помощью высокопроизводительного секвенирования Illumina. World J. Microbiol. Biotechnol. 2013; 29: 2365–2372. DOI: 10.1007 / s11274-013-1404-3. [PubMed] [CrossRef] [Google Scholar] 51. Бокулич Н.А., Чунг Дж., Батталья Т., Хендерсон Н., Джей М., Ли Х., Д. Либер А., Ву Ф., Перес-Перес Г.И., Чен Ю., и другие. Антибиотики, способ родов и диета влияют на созревание микробиома в молодом возрасте. Sci. Пер. Med. 2016; 8: 343ra82. DOI: 10.1126 / scitranslmed.aad7121. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Каллиомяки М., Колладо М.С., Салминен С., Изолаури Э. Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Являюсь. J. Clin. Nutr. 2008; 87: 534–538. DOI: 10.1093 / ajcn / 87.3.534. [PubMed] [CrossRef] [Google Scholar] 53. Rogier E.W., Frantz A.L., Bruno M.E.C., Wedlund L., Cohen D.A., Stromberg A.J., Kaetzel C.S. Секреторные антитела в грудном молоке способствуют долгосрочному гомеостазу кишечника, регулируя микробиоту кишечника и экспрессию генов хозяина. Proc. Natl. Акад. Sci. США. 2014; 111: 3074–3079. DOI: 10.1073 / pnas.1315792111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Шарбонно М.Р., О’Доннелл Д., Блэнтон Л.В., Тоттен С.М., Дэвис Дж.К.С., Барратт М.Дж., Ченг Дж., Гурудж Дж., Талкотт М., Бейн Дж. Р. и др. Сиалированные олигосахариды молока способствуют росту, зависящему от микробиоты, в моделях недоедания младенцев.Клетка. 2016; 164: 859–871. DOI: 10.1016 / j.cell.2016.01.024. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Базанелла М., Майер Т.В., Клавель Т., Лагкувардос И., Лусио М., Мальдонадо-Гомес М.Х., Отран К., Вальтер Дж., Боде Л., Шмитт-Копплин П. и др. Рандомизированное контролируемое исследование влияния вмешательства бифидобактерий в раннем возрасте на фекальную микробиоту и метаболом здоровых младенцев. Являюсь. J. Clin. Nutr. 2017; 106: 1274–1286. DOI: 10.3945 / ajcn.117.157529. [PubMed] [CrossRef] [Google Scholar] 57.Radke M., Picaud J.-C., Loui A., Cambonie G., Faas D., Lafeber H.N., de Groot N., Pecquet S.S., Steenhout P.G., Hascoet J.-M. Стартовая смесь, обогащенная пребиотиками и пробиотиками, обеспечивает нормальный рост младенцев и способствует здоровью кишечника: рандомизированное клиническое исследование. Педиатр. Res. 2017; 81: 622–631. DOI: 10.1038 / pr.2016.270. [PubMed] [CrossRef] [Google Scholar] 58. Франкавилла Р., Калассо М., Калаче Л., Сирагуса С., Ндагижимана М., Вернокки П., Брунетти Л., Манчино Г., Тедески Г., Герцони Э. и др.Влияние лактозы на микробиоту кишечника и метаболом младенцев с аллергией на коровье молоко. Педиатр. Allergy Immunol. 2012; 23: 420–427. DOI: 10.1111 / j.1399-3038.2012.01286.x. [PubMed] [CrossRef] [Google Scholar] 59. Ринне М., Каллиомаки М., Салминен С., Изолаури Э. Пробиотическое вмешательство в первые месяцы жизни: краткосрочное воздействие на желудочно-кишечные симптомы и долгосрочное воздействие на микробиоту кишечника. J. Pediatr. Гастроэнтерол. Nutr. 2006; 43: 200–205. DOI: 10.1097 / 01.mpg.0000228106.
- 1-20151112-09. [PubMed] [CrossRef] [Google Scholar] 116. Кокс Л.М., Яманиши С., Сон Дж., Алексеенко А.В., Люн Дж. М., Чо И., Ким С.Г., Ли Х., Гао З., Махана Д. и др. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия.Клетка. 2014; 158: 705–721. DOI: 10.1016 / j.cell.2014.05.052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 117. Детлефсен Л., Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc. Natl. Акад. Sci. США. 2011; 108 (Приложение 1): 4554–4561. DOI: 10.1073 / pnas.1000087107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 118. Айслев Т.А., Андерсен К.С., Гамборг М., Соренсен Т.И.А., Джесс Т. Детский избыточный вес после установления микробиоты кишечника: роль способа родов, веса до беременности и раннего приема антибиотиков.Int. J. Obes. (Лондон) 2011; 35: 522–529. DOI: 10.1038 / ijo.2011.27. [PubMed] [CrossRef] [Google Scholar] 119. Бейли Л.С., Форрест К.Б., Чжан П., Ричардс Т.М., Лившиц А., ДеРуссо П.А. Связь антибиотиков в младенчестве с ожирением в раннем детстве. JAMA Pediatr. 2014. 168: 1063–1069. DOI: 10.1001 / jamapediatrics.2014.1539. [PubMed] [CrossRef] [Google Scholar] 120. Мерфи Р., Стюарт А. В., Брейтуэйт И., Бизли Р., Хэнкокс Р. Дж., Митчелл Е. А., Третий этап исследовательской группы ISAAC Лечение антибиотиками в младенчестве и повышение индекса массы тела у мальчиков: международное перекрестное исследование.Int. J. Obes. (Лондон) 2014; 38: 1115–1119. DOI: 10.1038 / ijo.2013.218. [PubMed] [CrossRef] [Google Scholar] 121. Азиз Р.К., Хегази С.М., Яссер Р., Ризкаллах М.Р., ЭльРакайби М.Т. Фармакобиомика лекарств и токсикомикробиомика: от разрозненных отчетов до систематических исследований взаимодействий лекарств и микробиома. Мнение эксперта. Drug Metab. Toxicol. 2018: 1–13. DOI: 10.1080 / 17425255.2018.1530216. [PubMed] [CrossRef] [Google Scholar] 122. Уилсон И.Д., Николсон Дж. К. Взаимодействие микробиома кишечника с метаболизмом, эффективностью и токсичностью лекарств.Пер. Res. 2017; 179: 204–222. DOI: 10.1016 / j.trsl.2016.08.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 124. Ле Бастард К., Аль-Галит Г.А., Грегуар М., Шапле Г., Джаводен Ф., Дайли Э., Батард Э., Найтс Д., Монтассье Э. Систематический обзор: дисбактериоз кишечника человека, вызванный лекарствами, отпускаемыми по рецепту, не содержащим антибиотики . Алимент. Pharmacol. Ther. 2018; 47: 332–345. DOI: 10.1111 / apt.14451. [PubMed] [CrossRef] [Google Scholar] 125. Имханн Ф., Вич Вила А., Бондер М.Дж., Лопес Маносальва А.Г., Коонен Д.П.Я., Фу Дж., Вейменга К., Жернакова А., Веерсма Р.К. Влияние ингибиторов протонной помпы и других часто используемых лекарств на микробиоту кишечника. Кишечные микробы. 2017; 8: 351–358. DOI: 10.1080 / 194
.2017.1284732. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 126. Фридберг Д.Э., Туссент Н.С., Чен С.П., Ратнер А.Дж., Уиттиер С., Ван Т.К., Ван Х.Х., Абрамс Дж.А. Ингибиторы протонной помпы изменяют специфические таксоны в желудочно-кишечном микробиоме человека: перекрестное испытание. Гастроэнтерология.2015; 149: 883–885. DOI: 10.1053 / j.gastro.2015.06.043. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 127. Castellani C., Singer G., Kashofer K., Huber-Zeyringer A., Flucher C., Kaiser M., Till H. Влияние ингибиторов протонной помпы на фекальный микробиом младенцев с гастроэзофагеальным рефлюксом — проспективное продольное исследование . Фронт. Клетка. Заразить. Microbiol. 2017; 7: 444. DOI: 10.3389 / fcimb.2017.00444. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 128. Циммерманн П., Кертис Н. Влияние кишечного микробиома на реакцию на вакцину. Вакцина. 2018; 36: 4433–4439. DOI: 10.1016 / j.vaccine.2018.04.066. [PubMed] [CrossRef] [Google Scholar] 129. Харрис В.К., Армах Г., Фуэнтес С., Корпела К.Э., Парашар У., Виктор Дж. К., Тейт Дж., Де Верт К., Джакинто К., Виерсинга В. Дж. И др. Существенная корреляция между микробиомом кишечника младенцев и реакцией на ротавирусную вакцину в сельских районах Ганы. J. Infect. Дис. 2017; 215: 34–41. DOI: 10.1093 / infdis / jiw518. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 130.Худа М.Н., Льюис З., Каланетра К.М., Рашид М., Ахмад С.М., Ракиб Р., Кадри Ф., Андервуд М.А., Миллс Д.А., Стивенсен К.Б. Микробиота стула и реакция младенцев на вакцины. Педиатрия. 2014; 134: e362–372. DOI: 10.1542 / peds.2013-3937. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 131. Mullié C., Yazourh A., Thibault H., Odou M.-F., Singer E., Kalach N., Kremp O., Romond M.-B. Повышенный ответ кишечных антител к полиовирусу совпадает с продвижением Bifidobacterium longum-infantis и Bifidobacterium breve у младенцев: рандомизированное двойное слепое плацебо-контролируемое исследование.Педиатр. Res. 2004. 56: 791–795. DOI: 10.1203 / 01.PDR.0000141955.47550.A0. [PubMed] [CrossRef] [Google Scholar] 132. Гудрич Дж. К., Уотерс Дж. Л., Пул А. К., Саттер Дж. Л., Корен О., Блехман Р., Бомонт М., Ван Треурен В., Найт Р., Белл Дж. Т. и др. Человеческая генетика формирует микробиом кишечника. Клетка. 2014; 159: 789–799. DOI: 10.1016 / j.cell.2014.09.053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 133. Жернакова Д.В., Ле Т.Х., Курильщиков А., Атанасовская Б., Бондер М.Дж., Санна С., Кларингбоулд А., Выса Ю., Дилен П., LifeLines Cohort Study et al. Индивидуальные различия в уровнях белка, связанного с сердечно-сосудистыми заболеваниями, обусловлены генетикой и микробиомом кишечника. Nat. Genet. 2018 DOI: 10.1038 / s41588-018-0224-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 134. Колде Р., Франзоза Э.А., Рахнавард Г., Холл А.Б., Вламакис Х., Стивенс К., Дейли М.Дж., Ксавьер Р.Дж., Хаттенхауэр К. Генетическая изменчивость хозяина и ее взаимодействия с микробиомом в рамках проекта «Микробиом человека». Genome Med. 2018; 10: 6.DOI: 10.1186 / s13073-018-0515-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 135. Мартин Р., Макино Х., Четинюрек Явуз А., Бен-Амор К., Рулофс М., Исикава Э., Кубота Х., Суинкельс С., Сакаи Т., Оиси К. и др. События раннего возраста, включая способ доставки и тип кормления, братьев и сестер и пол, формируют развивающуюся микробиоту кишечника. PLoS ONE. 2016; 11: e0158498. DOI: 10.1371 / journal.pone.0158498. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 136. Мюллер С., Сонье К., Ханиш К., Norin E., Alm L., Midtvedt T., Cresci A., Silvi S., Orpianesi C., Verdenelli M.C. и др. Различия в фекальной микробиоте в разных европейских исследуемых популяциях в зависимости от возраста, пола и страны: перекрестное исследование. Прил. Environ. Microbiol. 2006. 72: 1027–1033. DOI: 10.1128 / AEM.72.2.1027-1033.2006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 137. Маркл Дж. Г. М., Фрэнк Д. Н., Мортин-Тот С., Робертсон С. Е., Физель Л. М., Ролле-Кампчик Ю., фон Берген М., Маккой К. Д., Макферсон А.J., Danska J.S. Половые различия в микробиоме кишечника управляют гормонально-зависимой регуляцией аутоиммунитета. Наука. 2013; 339: 1084–1088. DOI: 10.1126 / science.1233521. [PubMed] [CrossRef] [Google Scholar] 138. Юрковецкий Л., Берроуз М., Хан А.А., Грэм Л., Волчков П., Беккер Л., Антонопулос Д., Умесаки Ю., Червонский А.В. Гендерная предвзятость аутоиммунитета зависит от микробиоты. Иммунитет. 2013; 39: 400–412. DOI: 10.1016 / j.immuni.2013.08.013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 139.Азад МБ, Конья Т., Моган Х., Гутман Д.С., Филд С.Дж., Сирс М.Р., Беккер А.Б., Скотт Дж.А., Козырский А.Л., исследователи детского исследования Микробиота кишечника младенца и гигиеническая гипотеза аллергического заболевания: влияние домашних животных и братьев и сестер на состав и разнообразие микробиоты. Allergy Asthma Clin. Иммунол. 2013; 9:15. DOI: 10.1186 / 1710-1492-9-15. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 140. Тун Х.М., Конья Т., Такаро Т.К., Брук Дж.Р., Чари Р., Филд С.Дж., Гутман Д.С., Беккер А.Б., Мандхейн П.Дж., Турви С.Е. и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Микробиом. 2017; 5: 40. DOI: 10.1186 / s40168-017-0254-х. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 141. Лаурсен М.Ф., Захариассен Г., Бахл М.И., Бергстрём А., Хёст А., Михаэльсен К.Ф., Лихт Т.Р. Наличие старших братьев и сестер связано с развитием кишечной микробиоты в раннем детстве. BMC Microbiol. 2015; 15: 154. DOI: 10.1186 / s12866-015-0477-6.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 142. Де Филиппо К., Ди Паола М., Рамазотти М., Альбанезе Д., Пьераччини Г., Банчи Э., Мильетта Ф., Кавальери Д., Лионетти П. Диета, окружающая среда и кишечная микробиота. Предварительное исследование детей, живущих в сельских и городских районах Буркина-Фасо и Италии. Фронт. Microbiol. 2017; 8: 1979. DOI: 10.3389 / fmicb.2017.01979. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 143. Нур А., Крылов Л.Р. Инфекция Clostridium difficile у детей. Педиатр.Аня. 2018; 47: e359 – e365. DOI: 10.3928 / 19382359-20180803-01. [PubMed] [CrossRef] [Google Scholar] 144. Эрли З.М., Ахтар С., Грин С.Дж., Накиб А., Хан О., Кэннон А.Р., Хаммер А.М., Моррис Н.Л., Ли Х., Эберхардт Дж.М. и др. Ожоговая травма изменяет микробиом кишечника и увеличивает проницаемость кишечника и бактериальную транслокацию. PLoS ONE. 2015; 10: e0129996. DOI: 10.1371 / journal.pone.0129996. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 145. Чжу К.С., Гранди Р., Паттерсон Т.Т., Николсон С.E. Обзор травматического повреждения мозга и микробиома кишечника: понимание новых механизмов вторичного повреждения мозга и перспективных целей для нейрозащиты. Brain Sci. 2018; 8: 113. DOI: 10.3390 / brainsci8060113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 146. Страти Ф., Кавальери Д., Альбанезе Д., Де Феличе К., Донати К., Хайек Дж., Юссон О., Леонсини С., Ренци Д., Калабро А. и др. Новые данные об измененной микробиоте кишечника при расстройствах аутистического спектра. Микробиом. 2017; 5: 24. DOI: 10.1186 / s40168-017-0242-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 147. Гримальди Р., Гибсон Г. Р., Вулевич Дж., Гиаллуру Н., Кастро-Мехиа Дж. Л., Хансен Л. Х., Ли Гибсон Э., Нильсен Д. С., Костабиле А. Исследование пребиотического вмешательства в микробиоме детей с расстройствами аутистического спектра (РАС). 2018; 6: 133. DOI: 10.1186 / s40168-018-0523-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 148. Канг Д.-В., Адамс Дж.Б., Грегори А.К., Бороди Т., Читтик Л., Фазано А., Хоруц А., Гейс Э., Мальдонадо Дж., Макдоно-Минс С. и др. Терапия переноса микробиоты изменяет экосистему кишечника и улучшает симптомы желудочно-кишечного тракта и аутизма: открытое исследование. Микробиом. 2017; 5: 10. DOI: 10.1186 / s40168-016-0225-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 149. Грегори Дж. К., Буффа Дж. А., Орг Э., Ван З., Левисон Б. С., Чжу В., Вагнер М. А., Беннетт Б. Дж., Ли Л., ДиДонато Дж. А. и др. Передача предрасположенности к атеросклерозу при трансплантации кишечных микробов. J. Biol. Chem. 2015; 290: 5647–5660.DOI: 10.1074 / jbc.M114.618249. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 150. Ридаура В.К., Фейт Дж. Дж., Рей Ф. Э., Ченг Дж., Дункан А. Е., Кау А. Л., Гриффин Н. В., Ломбард В., Хенриссат Б., Бейн Дж. Р. и др. Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука. 2013; 341: 1241214. DOI: 10.1126 / science.1241214. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 151. Вризе А., Ван Нуд Э., Холлеман Ф., Салоярви Дж., Кутте Р.С., Бартельсман Дж. Ф., Даллинга-Ти Г.М., Акерманс М.Т., Серли М.Дж., Узир Р. и др. Перенос кишечной микробиоты от худых доноров увеличивает чувствительность к инсулину у людей с метаболическим синдромом. Гастроэнтерология. 2012; 143 DOI: 10.1053 / j.gastro.2012.06.031. [PubMed] [CrossRef] [Google Scholar] 152. Кутте Р.С., Левин Э., Салоярви Дж., Смитс Л.П., Хартстра А.В., Удаяппан С.Д., Гермес Г., Боутер К.Э., Купен А.М., Холст Дж. Дж. И др. Повышение чувствительности к инсулину после обедненного донорского фекалий при метаболическом синдроме обусловлено исходным составом кишечной микробиоты.Cell Metab. 2017; 26: 611–619. DOI: 10.1016 / j.cmet.2017.09.008. [PubMed] [CrossRef] [Google Scholar] 153. Мбаква К.А., Гермес Г.Д.А., Пендерс Дж., Савелкул П.Х.М., Тийс К., Дагнели П.С., Моммерс М., Зоетендал Е.Г., Смидт Х., Arts I.C.W. Микробиота кишечника и масса тела у детей школьного возраста: когортное исследование KOALA. Ожирение (Серебряная весна) 2018 doi: 10.1002 / oby.22320. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 154. Мбаква К.А., Пендерс Дж., Савелкул П.Х., Тийс К., Дагнели П.С., Моммерс М., Arts I.C.W. Колонизация кишечника methanobrevibacter smithii связана с увеличением веса у детей. Ожирение (Серебряная весна) 2015; 23: 2508–2516. DOI: 10.1002 / oby.21266. [PubMed] [CrossRef] [Google Scholar] 155. Питерс Б.А., Шапиро Дж.А., Черч Т.Р., Миллер Г., Трин-Шеврин К., Юэн Э., Фридлендер К., Хейс Р. Б., Ан Дж. Таксономический признак ожирения в большом исследовании взрослых американцев. Sci. Отчет 2018; 8: 9749. DOI: 10.1038 / s41598-018-28126-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 156.Тернбо П.Дж., Хамади М., Яцуненко Т., Кантарел Б.Л., Дункан А., Лей Р.Э., Согин М.Л., Джонс В.Дж., Роу Б.А., Affourtit J.P. и др. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009. 457: 480–484. DOI: 10,1038 / природа07540. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 157. Стэнхоуп К.Л., Горан М.И., Бози-Вестфаль А., Кинг Дж.С., Шмидт Л.А., Шварц Дж.-М., Стайс Э., Сильвецкий А.С., Тернбо П.Дж., Брей Г.А. и др. Пути и механизмы, связывающие диетические компоненты с кардиометаболическим заболеванием: не ограничиваясь калориями.Ожирение. Ред. 2018; 19: 1205–1235. DOI: 10.1111 / obr.12699. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 158. Медина Д.А., Пинто Ф., Овалле А., Томсон П., Гарридо Д. Пребиотики опосредуют микробные взаимодействия в консорциуме кишечного микробиома младенцев. Int. J. Mol. Sci. 2017; 18: 2095. DOI: 10.3390 / ijms18102095. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 159. Мерфи Е.Ф., Коттер П.Д., Хили С., Маркес Т.М., О’Салливан О., Фухи Ф., Кларк С.Ф., О’Тул П.В., Куигли Е.М., Стэнтон К., и другие. Состав и способность собирать энергию микробиоты кишечника: связь с диетой, ожирением и временем на моделях мышей. Кишечник. 2010; 59: 1635–1642. DOI: 10.1136 / gut.2010.215665. [PubMed] [CrossRef] [Google Scholar] 160. Арора Т., Шарма Р. Ферментационный потенциал кишечного микробиома: значение для энергетического гомеостаза и управления весом. Nutr. Ред. 2011; 69: 99–106. DOI: 10.1111 / j.1753-4887.2010.00365.x. [PubMed] [CrossRef] [Google Scholar] 162. Данеш Дж., Уинкап П., Уокер М., Леннон Л., Томсон А., Эпплби П., Галлимор Дж. Р., Пепис М. Б. Воспаление низкой степени и ишемическая болезнь сердца: проспективное исследование и обновленные метаанализы. BMJ. 2000. 321: 199–204. DOI: 10.1136 / bmj.321.7255.199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 163. Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–544. DOI: 10.1126 / science.aad9378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 164.Olszak T., An D., Zeissig S., Vera M.P., Richter J., Franke A., Glickman J.N., Siebert R., Baron R.M., Kasper D.L. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–493. DOI: 10.1126 / science.1219328. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 165. Гомес де Агуэро М., Ганал-Вонарбург С.С., Фюрер Т., Рупп С., Учимура Ю., Ли Х., Штайнерт А., Хайкенвальдер М., Хапфельмайер С., Зауэр У. и др. Материнская микробиота способствует раннему постнатальному развитию врожденного иммунитета.Наука. 2016; 351: 1296–1302. DOI: 10.1126 / science.aad2571. [PubMed] [CrossRef] [Google Scholar] 166. Fulde M., Sommer F., Chassaing B., van Vorst K., Dupont A., Hensel M., Basic M., Klopfleisch R., Rosenstiel P., Bleich A., et al. Отбор новорожденных по Toll-подобному рецептору 5 влияет на долгосрочный состав кишечной микробиоты. Природа. 2018 DOI: 10.1038 / s41586-018-0395-5. [PubMed] [CrossRef] [Google Scholar] 167. Чоудхури S.R., King D.E., Willing B.P., Band M.R., Beever J.E., Lane A.B., Loor J.J., Marini J.К., Рунд Л.А., Шук Л.Б. и др. Транскриптомное профилирование эпителия тонкой кишки у стерильных по сравнению с обычными поросятами. BMC Genomics. 2007; 8: 215. DOI: 10.1186 / 1471-2164-8-215. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 168. Hörmann N., Brandão I., Jäckel S., Ens N., Lillich M., Walter U., Reinhardt C. Микробная колонизация кишечника регулирует экспрессию TLR2, передачу сигналов и пролиферацию эпителия в слизистой оболочке тонкого кишечника. PLoS ONE. 2014; 9: e113080. DOI: 10,1371 / журнал.pone.0113080. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 169. Карио Э., Геркен Г., Подольский Д.К. Toll-подобный рецептор 2 контролирует воспаление слизистой оболочки, регулируя барьерную функцию эпителия. Гастроэнтерология. 2007. 132: 1359–1374. DOI: 10.1053 / j.gastro.2007.02.056. [PubMed] [CrossRef] [Google Scholar] 170. Ринне М., Каллиомаки М., Арвиломми Х., Салминен С., Изолаури Э. Влияние пробиотиков и грудного вскармливания на микробиоту бифидобактерий и лактобацилл / энтерококков и гуморальные иммунные ответы.J. Pediatr. 2005. 147: 186–191. DOI: 10.1016 / j.jpeds.2005.03.053. [PubMed] [CrossRef] [Google Scholar] 171. Пия М.К., Харт А.Л., МакТернан П.Г. Метаболическая эндотоксемия: это больше, чем просто ощущение кишечника? Curr. Opin. Липидол. 2013; 24: 78–85. DOI: 10.1097 / MOL.0b013e32835b4431. [PubMed] [CrossRef] [Google Scholar] 172. Морейра А.П., Тексейра Т.Ф., Феррейра А.Б., Пелузио Мдо С., Альфенас Рде С. Влияние диеты с высоким содержанием жиров на микробиоту кишечника, кишечную проницаемость и метаболическую эндотоксемию. Br. J. Nutr.2012; 108: 801–809. DOI: 10.1017 / S0007114512001213. [PubMed] [CrossRef] [Google Scholar] 173. Кани П.Д., Осто М., Геуртс Л., Эверард А. Вовлечение микробиоты кишечника в развитие воспаления низкой степени и диабета 2 типа, связанного с ожирением. Кишечные микробы. 2012; 3: 279–288. DOI: 10.4161 / gmic.19625. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 174. Патель П. Н., Шах Р. Ю., Фергюсон Дж. Ф., Рейли М. П. Экспериментальная эндотоксемия человека в моделировании патофизиологии, геномики и терапии врожденного иммунитета при сложных кардиометаболических заболеваниях.Артериосклер. Тромбоз Vasc. Биол. 2015; 35: 525–534. DOI: 10.1161 / ATVBAHA.114.304455. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 175. Аллен Р.М., Чжао С., Рамирес Солано М.А., Чжу В., Мичелл Д.Л., Ван Ю., Шир Ю., Сетупати П., Линтон М.Ф., Граф Г.А. и др. Биоинформатический анализ эндогенных и экзогенных малых РНК на липопротеинах. J. Extracell. Везикулы. 2018; 7: 1506198. DOI: 10.1080 / 20013078.2018.1506198. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 176. Корен О., Спор А., Felin J., Fak F., Stombaugh J., Tremaroli V., Behre C.J., Knight R., Fagerberg B., Ley R.E. и др. Микробиота ротовой полости, кишечника и зубного налета человека у пациентов с атеросклерозом. Proc. Natl. Акад. Sci. США. 2011; 108 (Приложение 1): 4592–4598. DOI: 10.1073 / pnas.1011383107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 177. Marcobal A., Kashyap P.C., Nelson T.A., Aronov P.A., Donia M.S., Spormann A., Fischbach M.A., Sonnenburg J.L. Метаболомный взгляд на то, как микробиота кишечника человека влияет на метаболом хозяина с использованием гуманизированных и гнотобиотических мышей.ISME J. 2013; 7: 1933–1943. DOI: 10.1038 / ismej.2013.89. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 178. Koeth R.A., Wang Z., Levison B.S., Buffa J.A., Org E., Sheehy B.T., Britt E.B., Fu X., Wu Y., Li L., et al. Метаболизм L-карнитина, питательного вещества красного мяса, микробиоты кишечника способствует развитию атеросклероза. Nat. Med. 2013; 19: 576–585. DOI: 10,1038 / нм. 3145. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 179. Tang W.H., Wang Z., Levison B.S., Koeth R.A., Britt E.B., Fu X., Wu Y., Хазен С.Л. Кишечный микробный метаболизм фосфатидилхолина и сердечно-сосудистый риск. N. Engl. J. Med. 2013; 368: 1575–1584. DOI: 10.1056 / NEJMoa1109400. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 180. Ландфальд Б., Валер Дж., Берстад А., Раа Дж. Микробный триметиламин-N-оксид как маркер заболевания: что-то подозрительное? Microb. Ecol. Health Dis. 2017; 28 DOI: 10.1080 / 16512235.2017.1327309. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 181. Миллер Л.М., Лампе Дж.В., Ньютон К.М., Гундерсен Г., Фуллер С., Рид С.Д., Франкенфельд С.Л. Избыточный вес или ожирение связаны с наличием микробного сообщества кишечника, не способного метаболизировать соевый изофлавон даидзеин в O-десметиланголенсин у женщин в пери- и постменопаузе. Maturitas. 2017; 99: 37–42. DOI: 10.1016 / j.maturitas.2017.02.006. [PubMed] [CrossRef] [Google Scholar] 182. Панасевич М.Р., Шустер К.М., Филлипс К.Э., Меерс Г.М., Чинтапалли С.В., Ванкхэйд У.Д., Шанкар К., Буттайгер Д.Н., Крул Э.С., Тайфолт Дж. П. и др. Соя по сравнению с молочным белком в западной диете изменяет фекальную микробиоту и снижает стеатоз печени у тучных крыс OLETF.J. Nutr. Биохим. 2017; 46: 125–136. DOI: 10.1016 / j.jnutbio.2017.05.004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 183. Guadamuro L., Dohrmann A.B., Tebbe C.C., Mayo B., Delgado S. Бактериальные сообщества и метаболическая активность фекальных культур у женщин-продуцентов и непродуцентов в менопаузе, получающих лечение изофлавонами сои. BMC Microbiol. 2017; 17: 93. DOI: 10.1186 / s12866-017-1001-у. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 184. Фернандес-Раудалес Д., Хефлингер Дж.Л., Бриндж Н.А., Кокс С.Б., Дауд С.Э., Миллер М.Дж., Гонсалес де Мехиа Э. Потребление различных составов соевого молока по-разному влияет на микробиомы кишечника мужчин с избыточным весом и мужчин с ожирением. Кишечные микробы. 2012; 3: 490–500. DOI: 10.4161 / gmic.21578. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 185. Fu J., Bonder M.J., Cenit M.C., Tigchelaar E.F., Maatman A., Dekens J.A.M., Brandsma E., Marczynska J., Imhann F., Weersma R.K. и др. Микробиом кишечника вносит значительный вклад в изменение липидов крови.Circ. Res. 2015; 117: 817–824. DOI: 10.1161 / CIRCRESAHA.115.306807. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 186. Камеяма К., Ито К. Колонизация кишечника бактерией Lachnospiraceae способствует развитию диабета у мышей с ожирением. Microbes Environ. 2014; 29: 427–430. DOI: 10.1264 / jsme2.ME14054. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Стабильность и устойчивость кишечной микробиоты у детей в детских садах — 12-месячное когортное исследование | BMC Microbiology
- 1.
Kostic AD, Xavier RJ, Gevers D. Микробиом при воспалительном заболевании кишечника: текущее состояние и будущее. Гастроэнтерология. 2014; 146: 1489–99.
CAS Статья Google Scholar
- 2.
Becker-Dreps S, Allali I, Monteagudo A, Vilchez S, Hudgens MG, Rogawski ET, et al. Состав кишечного микробиома у маленьких никарагуанских детей во время эпизодов диареи и выздоровления. Am J Trop Med Hyg. 2015; 93: 1187–93.
CAS Статья Google Scholar
- 3.
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS Статья Google Scholar
- 4.
Флинт Х.Дж., Скотт К.П., Луис П., Дункан Ш. Роль микробиоты кишечника в питании и здоровье. Нат Рев Гастроэнтерол Гепатол. 2012; 9: 577–89. https://doi.org/10.1038/nrgastro.2012.156.
CAS Статья PubMed Google Scholar
- 5.
Сяо А., Ахмед А.М.С., Субраманиан С., Гриффин Н.В., Дрюри Л.Л., Петри В.А. и др. Члены кишечной микробиоты человека участвуют в выздоровлении от инфекции Vibrio cholerae . Природа. 2014; 515: 423–6. https://doi.org/10.1038/nature13738.
CAS Статья PubMed PubMed Central Google Scholar
- 6.
Монира С., Накамура С., Гото К., Идзуцу К., Ватанабе Х., Алам Н.Х. и др. Метагеномный профиль микробиоты кишечника у детей при холере и выздоровлении. Gut Pathog. 2013; 5 (1).
- 7.
Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K, Rutgeerts P, et al. Дисбиоз фекальной микробиоты у пациентов с болезнью Крона и их здоровых родственников. Кишечник. 2011; 60: 631–7. https://doi.org/10.1136/gut.2010.223263.
Артикул PubMed Google Scholar
- 8.
Роуэн Ф, Дочерти Н.Г., Мерфи М., Мерфи Б., Коффи Дж. С., О’Коннелл, ПР. Количество видов бактерий Desulfovibrio увеличивается при язвенном колите. Dis Colon Rectum. 2010; 53: 1530–6.
Артикул Google Scholar
- 9.
Mondot S, Kang S, Furet JP, Aguirre De Carcer D, McSweeney C, Morrison M, et al. Выявление новых филогенетических особенностей микробиоты болезни Крона. Воспаление кишечника. 2011; 17: 185–92.
CAS Статья Google Scholar
- 10.
Микель С., Мартин Р., Росси О., Бермудес-Хумаран Л.Г., Шатель Дж. М., Сокол Н. и др. Faecalibacterium prausnitzii и здоровье кишечника человека. Curr Opin Microbiol. 2013; 16: 255–61.
CAS Статья Google Scholar
- 11.
Тохо Р., Суарес А., Клементе М.Г., Де лос Рейес-Гавилан К.Г., Марголлес А., Геймонд М. и др. кишечная микробиота в здоровье и болезни: роль бифидобактерий в гомеостазе кишечника. Мир Дж. Гастроэнтерол. 2014; 20: 15163–76.
Артикул Google Scholar
- 12.
Канг Д. В., Парк Дж. Г., Ильхан З. Э., Уоллстром Дж., Ла Баер Дж., Адамс Дж. Б. и др. Снижение встречаемости Prevotella и других ферментеров в микрофлоре кишечника аутичных детей. PLoS One. 2013; 8 (7): e68322.
CAS Статья Google Scholar
- 13.
Винсент С., Стивенс Д.А., Лу В.Г., Эденс Т.Дж., Бер М.А., Дьюар К. и др. Уменьшение кишечных Clostridiales предшествует развитию внутрибольничной инфекции Clostridium difficile.Микробиом. 2013; 1:18. https://doi.org/10.1186/2049-2618-1-18.
Артикул PubMed PubMed Central Google Scholar
- 14.
Саманта А.К., Торок В.А., Перси, штат Нью-Джерси, Абимослех С.М., Ховарт Г.С. Микробный дактилоскопический анализ позволяет выявить уникальные бактериальные сообщества в фекальной микробиоте крыс с экспериментально вызванным колитом. J Microbiol. 2012; 50: 218–25.
Артикул Google Scholar
- 15.
Scanlan PD, Shanahan F, Marchesi JR. Независимый от культуры анализ десульфовибрионов в дистальном отделе толстой кишки у здоровых людей, больных колоректальным раком и полипэктомированных лиц. FEMS Microbiol Ecol. 2009; 69: 213–21.
CAS Статья Google Scholar
- 16.
Хеббельструп Йенсен Б., Стенсволд С.Р., Струве С., Ольсен КЕП, Шойц Ф., Бойзен Н. и др. Энтероагрегантная кишечная палочка в детском саду — динамическое когортное исследование в течение 1 года. Front Cell Infect Microbiol.2016; 6. https://doi.org/10.3389/fcimb.2016.00075.
- 17.
Hebbelstrup Jensen B, Röser D, Andreassen BU t, Olsen KEP, Nielsen HV e, Roldgaard BB j, et al. Детская диарея в датских детских садах может быть связана с младенческими коликами, низкой массой тела при рождении и приемом антибиотиков. Acta Paediatr. 2016; 105: 90–5. https://doi.org/10.1111/apa.13209.
Артикул PubMed Google Scholar
- 18.
Клементе Дж. К., Урселл Л.К., Парфри Л.В., Найт Р.Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Клетка. 2012; 148: 1258–70.
CAS Статья Google Scholar
- 19.
Collado MC, Cernada M, Baüerl C, Vento M, Pérez-Martínez G. Микробная экология и взаимодействие хозяина и микробиоты на ранних этапах жизни. Кишечные микробы. 2012; 3: 352–65.
Артикул Google Scholar
- 20.
Дэвид Л.А., Матерна А.С., Фридман Дж., Кампос-Баптиста М.И., Блэкберн М.К., Перротта А. и др.Образ жизни хозяина влияет на микробиоту человека ежедневно. Genome Biol. 2015; 15: R89.
Артикул Google Scholar
- 21.
Ng SC, Lam EFC, Lam TTY, Chan Y, Law W., Tse PCH и др. Влияние пробиотических бактерий на микробиоту кишечника при синдроме раздраженного кишечника. J Gastroenterol Hepatol. 2013. 28 (10): 1624–31. https://doi.org/10.1111/jgh.12306.
Артикул PubMed Google Scholar
- 22.
Guarner F, Малагелада J-R. Флора кишечника в норме и при болезнях. Ланцет. 2003; 361: 512–9. https://doi.org/10.1016/S0140-6736(03)12489-0.
Артикул PubMed Google Scholar
- 23.
Бергстрём А., Сков Т.Х., Бахл М.И., Роагер Х.М., Кристенсен Л.Б., Эйлерсков К.Т. и др. Установление кишечной микробиоты в раннем возрасте: продольное, исследовательское исследование большой когорты датских младенцев. Appl Environ Microbiol. 2014; 80: 2889–900.https://doi.org/10.1128/AEM.00342-14.
CAS Статья PubMed PubMed Central Google Scholar
- 24.
Лаурсен MF, Zachariassen G, Bahl MI, Bergström A, Høst A, Michaelsen KF, et al. Наличие старших братьев и сестер связано с развитием кишечной микробиоты в раннем детстве. BMC Microbiol. 2015; 15: 154. https://doi.org/10.1186/s12866-015-0477-6.
CAS Статья PubMed PubMed Central Google Scholar
- 25.
Стокгольм Дж., Блазер М.Дж., Торсен Дж., Расмуссен М.А., Вааге Дж., Виндинг Р.К. и др. Созревание микробиома кишечника и риск астмы в детстве. Nat Commun. 2018; 9 (1): 704.
Артикул Google Scholar
- 26.
Vandeputte D, Falony G, Vieira-Silva S, Tito RY, Joossens M, Raes J. Консистенция стула тесно связана с богатством и составом кишечной микробиоты, энтеротипами и скоростью роста бактерий. Кишечник. 2016; 65: 57–62.
CAS Статья Google Scholar
- 27.
Дэвид Л.А., Вейл А., Райан Е.Т., Колдервуд С.Б., Харрис Дж. Б., Чоудхури Ф. и др. Последовательность кишечных микробов следует за острой секреторной диареей у людей. MBio. 2015; 6: e00381–15. https://doi.org/10.1128/mBio.00381-15.
Артикул PubMed PubMed Central Google Scholar
- 28.
Йокелайнен П., Хеббельструп Йенсен Б., Андреассен Б.У., Петерсен А.М., Рёзер Д., Крогфельт К.А. и др.Dientamoeba fragilis, комменсал для детей в датских детских садах. J Clin Microbiol. 2017; 55: 1707–13. https://doi.org/10.1128/JCM.00037-17.
Артикул PubMed PubMed Central Google Scholar
- 29.
Sydenham TV, Jensen BH, Petersen AM, Krogfelt KA, Justesen US. Устойчивость к противомикробным препаратам в группе Bacteroides fragilis в фекальной микробиоте здоровых датских детей. Int J Antimicrob Agents. 2017; 49: 573–8.https://doi.org/10.1016/j.ijantimicag.2017.01.011.
CAS Статья PubMed Google Scholar
- 30.
Мирсепаси Х., Перссон С., Струве С., Андерсен ЛОБ, Петерсен А.М., Крогфельт К.А. Разнообразие микроорганизмов в образцах фекалий зависит от метода экстракции ДНК: экстракция ДНК EasyMag по сравнению с экстракцией мини-набора для ДНК QIAamp. BMC Res Notes. 2014; 7:50.
Артикул Google Scholar
- 31.
Накано Р., Накано М. Эффективные методы обработки образцов и синтеза кДНК с помощью ОТ-ПЦР для обнаружения вирусов и вироидов виноградной лозы. J Virol Methods. 2006; 134: 244–9.
CAS Статья Google Scholar
- 32.
Smith B, Li N, Andersen AS, Slotved HC, Krogfelt KA. Оптимизация выделения бактериальной ДНК из образцов фекалий: сравнение трех методов. Откройте Microbiol J. 2011; 5: 14–7. https://doi.org/10.2174/1874285801105010014.
CAS Статья PubMed PubMed Central Google Scholar
- 33.
Neefs JM, De Wachter R. Предложение о вторичной структуре вариабельной области эукариотической малой рибосомной субъединицы РНК, предполагающей существование псевдоузла. Nucleic Acids Res. 1990; 18: 5695–704.
CAS Статья Google Scholar
- 34.
Yu Y, Lee C, Kim J, Hwang S.Группоспецифичные наборы праймеров и зондов для обнаружения метаногенных сообществ с использованием количественной полимеразной цепной реакции в реальном времени. Biotechnol Bioeng. 2005; 89: 670–9.
CAS Статья Google Scholar
- 35.
Sundberg C, Al-Soud WA, Larsson M, Alm E, Yekta SS, Svensson BH, et al. 454 пиросеквенирования анализа бактериального и архейного богатства в 21 полномасштабном биогазовом варочном котле. FEMS Microbiol Ecol. 2013; 85: 612–26. https: // doi.org / 10.1111 / 1574-6941.12148.
CAS Статья PubMed Google Scholar
- 36.
Такай К., Хорикоши К. Быстрое обнаружение и количественная оценка членов сообщества архей с помощью количественной ПЦР с использованием флуорогенных зондов. Appl Environ Microbiol. 2000. 66 (11): 5066–72.
- 37.
Мортенсен М.С., Брейнрод А.Д., Роггенбак М., Абу аль-Суд В., Балле С., Крогфельт К.А. и др. Развитие микробиоты гортани в молодом возрасте.Микробиом. 2016; 4: 70. https://doi.org/10.1186/s40168-016-0215-9.
- 38.
Kimer N, Pedersen JS, Tavenier J, Christensen JE, Busk TM, Hobolth L, et al. Рифаксимин оказывает незначительное влияние на бактериальный состав, воспаление и бактериальную транслокацию при циррозе; рандомизированное испытание. J Gastroenterol Hepatol. 2018; 33 (1): 307–14. https://doi.org/10.1111/jgh.13852.
CAS Статья PubMed Google Scholar
- 39.
Эдгар RC. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика. 2010; 26: 2460–1. https://doi.org/10.1093/bioinformatics/btq461.
CAS Статья Google Scholar
- 40.
Эдгар Р.С. UPARSE: высокоточные последовательности OTU, полученные при считывании микробного ампликона. Нат методы. 2013; 10: 996–8. https://doi.org/10.1038/nmeth.2604.
CAS Статья PubMed Google Scholar
- 41.
Хаас Б.Дж., Геверс Д., Эрл А.М., Фельдгарден М., Уорд Д.В., Яннукос Г. и др. Образование и обнаружение последовательности химерной 16S рРНК в ампликонах ПЦР, секвенированных по Сенгеру и 454-пиросеквенированию. Genome Res. 2011; 21: 494–504. https://doi.org/10.1101/gr.112730.110.
CAS Статья PubMed PubMed Central Google Scholar
- 42.
Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, et al. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом для описания и сравнения сообществ микробов.Appl Environ Microbiol. 2009; 75: 7537–41. https://doi.org/10.1128/AEM.01541-09.
CAS Статья PubMed PubMed Central Google Scholar
- 43.
Капорасо Дж. Г., Биттингер К., Бушман Ф. Д., ДеСантис Т. З., Андерсен Г. Л., Найт Р. PyNAST: гибкий инструмент для выравнивания последовательностей с целью выравнивания матрицы. Биоинформатика. 2010; 26: 266–7. https://doi.org/10.1093/bioinformatics/btp636.
CAS Статья PubMed Google Scholar
- 44.
Цена МН, Дехал П.С., Аркин А.П. FastTree: вычисление больших деревьев минимальной эволюции с профилями вместо матрицы расстояний. Mol Biol Evol. 2009; 26: 1641–50. https://doi.org/10.1093/molbev/msp077.
CAS Статья PubMed PubMed Central Google Scholar
- 45.
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, et al. QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью.Нат методы. 2010; 7: 335–6. https://doi.org/10.1038/nmeth.f.303.
CAS Статья PubMed PubMed Central Google Scholar
- 46.
McDonald D, Price MN, Goodrich J, Nawrocki EP, DeSantis TZ, Probst A, et al. Улучшенная таксономия Greengenes с явными рангами для экологического и эволюционного анализа бактерий и архей. ISME J. 2012; 6: 610–8. https://doi.org/10.1038/ismej.2011.139.
CAS Статья Google Scholar
- 47.
R Основная команда. R: язык и среда для статистики. Вычислительная техника. 2015; http://www.r-project.org/.
- 48.
McMurdie PJ, Holmes S. Phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS One. 2013; 8: e61217. https://doi.org/10.1371/journal.pone.0061217.
CAS Статья PubMed PubMed Central Google Scholar
- 49.
Оксанен Дж., Бланше Ф.Г., Киндт Р., Лежандр П., Минчин П.Р., О’Хара Р.Б. и др.Веганство: экологический пакет сообщества. 2015. http://cran.r-project.org/package=vegan.
Google Scholar
- 50.
Торсен Дж., Брейнрод А., Мортенсен М., Расмуссен М.А., Стокгольм Дж., Аль-Суд В.А. и др. Крупномасштабный сравнительный анализ показывает ложные открытия и чувствительность к трансформации подсчета в методах анализа данных ампликона гена 16S рРНК, используемых в исследованиях микробиома. Микробиом. 2016; 4 (1): 62.
Артикул Google Scholar
- 51.
Russel J, Thorsen J, Brejnrod AD, Bisgaard H, Sørensen SJ, Burmølle M. DAtest: основа для выбора метода дифференциальной численности или экспрессии bioRxiv 2018. doi: https: //doi.org/10.1101/241802.
- 52.
Wickham H. ggplot2: Элегантная графика для анализа данных. 2-е изд. Нью-Йорк: Спрингер-Верлаг; 2016. http://ggplot2.org
- 1.
Milani C, Duranti S, Bottacini F, Turroni F, Mahony J и др. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81 (4). https://doi.org/10.1128/MMBR.00036-17.
- 2.
Korpela K, Costea P, Coelho LP, Kandels-Lewis S, Willemsen G, Boomsma DI, et al. Селективный материнский посев и окружающая среда формируют микробиом кишечника человека. Genome Res. 2018; 28 (4): 561–8.
CAS Статья Google Scholar
- 3.
Krautkramer KA, Kreznar JH, Romano KA, Vivas EL, Barret-Wilt GA, Rabaglia ME, et al. Взаимодействие диеты и микробиоты опосредует глобальное эпигенетическое программирование в нескольких тканях хозяина. Mol Cell. 2016; 64: 982–92.
CAS Статья Google Scholar
- 4.
Maynard CL, Elson CO, Hatton RD, Weaver CT. Взаимодействие кишечной микробиоты и иммунной системы. Природа. 2012; 489: 231–41.
CAS Статья Google Scholar
- 5.
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS Статья Google Scholar
- 6.
Blanton LV, Charbonneau MR, Salih T., Barratt MJ, Venkatesh S, Ilkaveya O, et al. Кишечные бактерии, предотвращающие нарушение роста, передаваемое микробиотой от недоедающих детей. Наука. 2016; 351: aad3311.
Артикул Google Scholar
- 7.
Biasucci G, Rubini M, Riboni S, Morelli L, Bessi E, Retetangos C. Способ доставки влияет на бактериальное сообщество в кишечнике новорожденного. Early Hum Dev. 2010; 86: 13–5.
Артикул Google Scholar
- 8.
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н. и др. Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci.2010; 107: 11971–5.
Артикул Google Scholar
- 9.
Bäckhed F, Roswall J, Peng Y, Feng Q, Jia H, Kovatcheva-Datchary P, et al. Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин. 2015; 17: 690–703.
Артикул Google Scholar
- 10.
Персо Р., Азад Б., Конья Т., Гутман Д., Чари Р., Сирс М. и др. Влияние перинатального воздействия антибиотиков на микробиоту кишечника младенца в возрасте одного года.Allergy Asthma Clin Immunol. 2014; 10: А31.
Артикул Google Scholar
- 11.
Korpela K, Salonen A, Virta LJ, Kekkonen RA, de Vos WM. Связь использования антибиотиков в раннем возрасте и защитные эффекты грудного вскармливания: роль кишечной микробиоты. JAMA Pediatr. 2016; 170 (8): 750–7.
Артикул Google Scholar
- 12.
Мюллер Н.Т., Уайатт Р., Хёпнер Л., Оберфилд С., Домингес-Белло М.Г., Виден Е.М. и др.Пренатальное воздействие антибиотиков, кесарево сечение и риск детского ожирения. Int J Obes. 2015; 39: 665–70.
CAS Статья Google Scholar
- 13.
Саари А., Вирта Л.Дж., Санкилампи У., Дункель Л., Саксен Х. Воздействие антибиотиков в младенчестве и риск ожирения в первые 24 месяца жизни. Педиатрия. 2015; 135: 617–26.
Артикул Google Scholar
- 14.
Багер П., Вольфарт Дж., Вестергард Т. Кесарево сечение и риск атопии и аллергических заболеваний: метаанализы. Clin Exp Allergy. 2008; 38: 634–42.
CAS Статья Google Scholar
- 15.
van Nimwegen FA, Penders J, Stobberingh EE, Postma DS, Koppelman GH, Kerkhof M, et al. Способ и место родов, микробиота желудочно-кишечного тракта и их влияние на астму и атопию. J Allergy Clin Immunol. 2011; 128: 948–55.
Артикул Google Scholar
- 16.
Cardwell C, Stene L, Joner G, Cinek O, Scensson J, Goldacre MJ и др. Кесарево сечение связано с повышенным риском развития сахарного диабета 1 типа в детстве: метаанализ обсервационных исследований. Диабетология. 2008. 51: 726–35.
CAS Статья Google Scholar
- 17.
Hviid A, Svanstrom H, Frisch M. Использование антибиотиков и воспалительные заболевания кишечника в детстве. Кишечник. 2011; 60: 49–54.
Артикул Google Scholar
- 18.
Вирта Л., Аувинен А., Хелениус Х, Хуовинен П., Колхо К. Связь повторяющегося воздействия антибиотиков с развитием болезни Крона у детей — общенациональное финское исследование методом случай-контроль на основе регистров. Am J Epidemiol. 2012; 175: 775–84.
Артикул Google Scholar
- 19.
Рассел С.Л., Голд М.Дж., Хартманн М., Виллинг Б.П., Торсон Л., Влодарска М. и др. Изменения микробиоты в раннем возрасте, вызванные приемом антибиотиков, повышают восприимчивость к аллергической астме.EMBO Rep. 2012; 13: 440–7.
CAS Статья Google Scholar
- 20.
Кокс Л.М., Яманиши С., Сон Дж., Алексеенко А.В., Леунг Дж. М., Чо И. и др. Изменение кишечной микробиоты во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS Статья Google Scholar
- 21.
Бергус Г.Р., Леви Б.Т., Леви С.М., Слагер С.Л., Кирицы М.Ц.Использование антибиотиков в течение первых 200 дней жизни. Arch. Fam. Med. 1996; 5: 523–6.
CAS Статья Google Scholar
- 22.
Betrán AP, Ye J, Moller AB, Zhang J, Gülmezoglu AM, Torloni MR. Тенденция к увеличению частоты кесарева сечения: глобальные, региональные и национальные оценки: 1990-2014 гг. PLoS One. 2016; 11: e0148343.
Артикул Google Scholar
- 23.
Корреа Н.Б., Перет Филью Л.А., Пенна Ф.Дж., Лима ФМС, Николи младший.Рандомизированное контролируемое исследование формулы Bifidobacterium lactis и Streptococcus thermophilus для профилактики диареи, связанной с антибиотиками, у младенцев. J Clin Gastroenterol. 2005; 39: 385–9.
Артикул Google Scholar
- 24.
Куйтунен М., Кукконен К., Юнтунен-Бакман К., Корпела Р., Пусса Т., Тууре Т. и др. Пробиотики предотвращают IgE-ассоциированную аллергию до 5 лет у детей, родившихся после кесарева сечения, но не во всей когорте.J Allergy Clin Immunol. 2009; 123: 335–41.
Артикул Google Scholar
- 25.
Lombard V, Golaconda Ramulu H, Drula E, Coutinho PM, Henrissat B. База данных по углеводно-активным ферментам (CAZy) в 2013 г. Nucleic Acids Res. 2013; 42: D490–5.
Артикул Google Scholar
- 26.
Джеймс К., Мазеруэй М.О., Боттачини Ф., Ван Синдерен Д. Bifidobacterium breve UCC2003 метаболизирует олигосахариды грудного молока, лакто-N-тетраозу и лакто-N-нео-тетраозу, через перекрывающиеся, но разные пути.Научный доклад 2016; 6: 38560.
CAS Статья Google Scholar
- 27.
Coppa GV, Gabrielli O, Pierani P, Catassi C, Carlucci A, Giorgi PL. Изменения углеводного состава грудного молока за 4 месяца лактации. Педиатрия. 1993; 91: 637–41.
CAS PubMed Google Scholar
- 28.
Thurl S, Müller-Werner B, Sawatzki G. Количественное определение отдельных олигосахаридных соединений из грудного молока с использованием анионообменной хроматографии с высоким pH.Анальная биохимия. 1996. 235: 202–6.
CAS Статья Google Scholar
- 29.
Кент Дж. К., Митулас Л. Р., Креган М. Д., Рамзи Д. Т., Доэрти Д. А., Хартманн ЧП. Объем и частота кормлений грудью, а также жирность грудного молока в течение дня. Педиатрия. 2006; 117: 387–95.
Артикул Google Scholar
- 30.
Моро Г., Миноли I, Моска М., Фанаро С., Елинек Дж., Шталь Б. и др.Связанные с дозировкой бифидогенные эффекты галакто- и фруктоолигосахаридов у доношенных детей, находящихся на искусственном вскармливании. J Pediatr Gastroenterol Nutr. 2002; 34: 291–5.
CAS Статья Google Scholar
- 31.
Rinne M, Gueimonde M, Kalliomäki M, Hoppu U, Salminen SJ, Isolauri E. Аналогичные бифидогенные эффекты частично гидролизованной детской смеси с пребиотиками и грудного вскармливания на микробиоту кишечника младенца. FEMS Immunol Med Microbiol. 2005; 43: 59–65.
CAS Статья Google Scholar
- 32.
Руис-Мойано С., Тоттен С., Гарридо Д., Смиловиц Дж., Герман Дж., Лебрилла С. и др. Изменения в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Прил. Environ. Microbiol. 2013; 79: 6040–9.
CAS Статья Google Scholar
- 33.
Дуйяр Ф.П., Риббера А., Кант Р., Пиетила Т., Ярвинен Х., Мессинг М. и др.Сравнительный геномно-функциональный анализ 100 штаммов Lactobacillus rhamnosus и их сравнение со штаммом GG. PLoS Genet. 2013; 9: e1003683.
CAS Статья Google Scholar
- 34.
Моллой А.М., Кирк П.Н., Броуди Л.К., Скотт Дж. М., Миллс Дж. Л.. Влияние дефицита фолиевой кислоты и витамина B12 во время беременности на развитие плода, младенца и ребенка. Еда Nutr Bull. 2008; 29: 101–11.
Артикул Google Scholar
- 35.
Дегучи Ю., Моришита Т., Мутаи М. Сравнительные исследования синтеза водорастворимых витаминов среди человеческих видов бифидобактерий. Agric Biol Chem. 1985; 49: 13–9.
CAS Google Scholar
- 36.
Краузе Л.Дж., Форсберг С.В., Коннор Д.Л. Кормление крыс грудным молоком увеличивает количество бифидобактерий в слепой и толстой кишке, что коррелирует с повышенным статусом фолиевой кислоты. J Nutr. 1996; 126: 1505.
CAS Статья Google Scholar
- 37.
Pompei A, Cordisco L, Amaretti A, Zanoni S, Raimondi S, Matteuzzi D, et al. Введение бифидобактерий, продуцирующих фолат, улучшает статус фолиевой кислоты у крыс Wistar. J Nutr. 2007. 137: 2742–6.
CAS Статья Google Scholar
- 38.
Penders J, Thijs C, Vink C, Stelma FF, Snijders B., Kummeling I, et al. Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия. 2006; 118: 511–21.
Артикул Google Scholar
- 39.
Penders J, Gerhold K, Stobberingh EE, Thijs C, Zimmermann K, Lau S и др. Установление кишечной микробиоты и ее роль в развитии атопического дерматита в раннем детстве. J Allergy Clin Immunol. 2013; 132: 601–7.
Артикул Google Scholar
- 40.
Домингес-Белло М.Г., Хесус-лаби К., Шен Н., Кокс Л., Амир А., Гонсалес А. и др. Частичное восстановление микробиоты младенцев, рожденных после кесарева сечения, посредством вагинального микробного переноса.Nat. Med. 2016; 22: 250–3.
CAS Статья Google Scholar
- 41.
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. Педиатрия JAMA. 2016; 170: 212–9.
Артикул Google Scholar
- 42.
Чу Д.М., Ма Дж., Принц А.Л., Энтони К.М., Сеферович М.Д., Аагаард К.М.Созревание структуры и функции сообщества микробиома младенца во многих участках тела и в зависимости от способа доставки. Nat Med. 2017; 23: 314–26.
CAS Статья Google Scholar
- 43.
Sordillo JE, Zhou Y, McGeachie MJ, Ziniti J, Lange N, Laranjo N, et al. Факторы, влияющие на микробиом кишечника младенцев в возрасте 3-6 месяцев: результаты исследования по снижению антенатальной астмы с участием различных этнических групп (VDAART).J Allergy Clin Immunol. 2017; 139: 482–91 e14.
Артикул Google Scholar
- 44.
Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулле С.Л. и др. Микробиом влагалища женщин репродуктивного возраста. Proc Natl Acad Sci U S. A. 2011; 108: 4680–7.
CAS Статья Google Scholar
- 45.
Каннингтон А.Дж., Сим К., Дайерл А., Кролл Дж., Брэнниган Э., Дарби Дж. «Вагинальный посев» младенцев, рожденных с помощью кесарева сечения.BMJ. 2016; 352: i227.
Артикул Google Scholar
- 46.
Björkstén B, Sepp E, Julge K, Voor T., Mikelsaar M. Развитие аллергии и кишечная микрофлора в течение первого года жизни. J Allergy Clin Immunol. 2001; 108: 516–20.
Артикул Google Scholar
- 47.
Kalliomäki M, Kirjavainen P, Eerola E, Kero P, Salminen S, Isolauri E. Отчетливые образцы микрофлоры кишечника новорожденных у младенцев, у которых атопия развивалась и не развивалась.J Allergy Clin Immunol. 2001; 107: 129–34.
Артикул Google Scholar
- 48.
Li N, Russell WM, Douglas-esobar M, Hauser N, Lopez M, Neu J. Живые и убитые нагреванием Lactobacillus rhamnosus GG: эффекты на провоспалительные и противовоспалительные цитокины / хемокины у грудных детей, вскармливаемых гастростомией крысы. Pediatr Res. 2009; 66: 203–7.
CAS Статья Google Scholar
- 49.
Jeon SG, Kayama H, Ueda Y, Takahashi T, Asahara T., Tsuji H, et al. Пробиотик Bifidobacterium breve индуцирует продуцирующие IL-10 клетки Tr1 в толстой кишке. PLoS Pathog. 2012; 8: e1002714.
CAS Статья Google Scholar
- 50.
Pohjavuori E, Viljanen M, Korpela R, Kuitunen M, Tiittanen M, Vaarala O, et al. Эффект Lactobacillus GG в увеличении продукции IFN-γ у младенцев с аллергией на коровье молоко. J Allergy Clin Immunol. 2004. 114: 131–6.
CAS Статья Google Scholar
- 51.
Вильянен М., Савилахти Э, Хахтела Т., Юнтунен-Бакман К., Корпела Р., Пусса Т. и др. Пробиотики в лечении синдрома атопической экземы / дерматита у младенцев: двойное слепое плацебо-контролируемое исследование. Аллергия. 2005; 60: 494–500.
CAS Статья Google Scholar
- 52.
He F, Ouwehand A, Isolauri E, Hashimoto H, Benno Y, Salminen S.Сравнение адгезии слизистой оболочки и видовая идентификация бифидобактерий, выделенных от здоровых и аллергических младенцев. FEMS Immunol Med Microbiol. 2001; 30: 43–7.
CAS Статья Google Scholar
- 53.
Korpela K, Salonen A, Virta L, Kumpu M, Kekkonen R, de Vos W. Прием Lactobacillus rhamnosus GG изменяет микробиоту кишечника детей дошкольного возраста, смягчает изменения, связанные с пенициллином, и снижает использование антибиотиков.PLoS One. 2016; 11: e0154012.
Артикул Google Scholar
- 54.
Пламмер С.Ф., Гараиова И., Сарвотэм Т., Коттролл С.Л., Ле Скуиллер, Уивер М.А. и др. Влияние пробиотиков на состав кишечной микробиоты после антибактериальной терапии. Int J Antimicrob Agents. 2005; 26: 69–74.
CAS Статья Google Scholar
- 55.
Myllyluoma E, Ahlroos T, Veijola L, Rautelin H, Tynkkynen S, Korpela R.Влияние лечения против Helicobacter pylori и добавок пробиотиков на кишечную микробиоту. Int J Antimicrob Agents. 2007; 29: 66–72.
CAS Статья Google Scholar
- 56.
Энгельбрексон А., Корзеник Дж. Р., Питтлер А., Сандерс М. Е., Клаенхаммер Т. Р., Лейер Г. и др. Пробиотики для сведения к минимуму нарушения фекальной микробиоты у здоровых людей, получающих антибактериальную терапию. J Med Microbiol. 2009; 58: 663–70.
CAS Статья Google Scholar
- 57.
Myllyluoma E, Veijola L, Ahlroos T, Tynkkynen S, Kankuri E, Vapaatalo H, et al. Добавление пробиотиков улучшает переносимость эрадикационной терапии Helicobacter pylori — плацебо-контролируемое двойное слепое рандомизированное пилотное исследование. Алимент. Pharmacol. Ther. 2005; 21: 1263–72.
CAS Статья Google Scholar
- 58.
Brunser O, Gotteland M, Cruchet S, Figueroa G, Garrido D, Steenhout P. Влияние молочной смеси с пребиотиками на кишечную микробиоту младенцев после лечения антибиотиками.Pediatr Res. 2006; 59: 451–6.
Артикул Google Scholar
- 59.
Salonen A, Nikkilä J, Jalanka-Tuovinen J, Immonen O, Rajilić-Stojanović M, Kekkonen RA, et al. Сравнительный анализ методов выделения фекальной ДНК с филогенетическим микрочипом: эффективное восстановление бактериальной и архейной ДНК с помощью механического лизиса клеток. J Microbiol Methods. 2010. 81: 127–34.
CAS Статья Google Scholar
- 60.
Kolmeder CA, de Been M, Nikkilä J, Ritamo I, Mättö J, Valmu L, et al. Сравнительный анализ метапротеомики и разнообразия кишечной микробиоты человека свидетельствует о ее временной стабильности и выражении основных функций. PLoS One. 2010; 7: e29913.
Артикул Google Scholar
- 61.
Kolmeder CA, Salojärvi J, Ritari J, de Been M, Raes J, Falony G, et al. Фекальный метапротеомный анализ показывает персонализированный и стабильный функциональный микробиом и ограниченные эффекты пробиотического вмешательства у взрослых.PLoS One. 2016; 11: e0153294.
Артикул Google Scholar
- 62.
Корпела, К. Маре: Анализ микробиоты в R легко. Пакет R версии 1.0. 2016.
- 63.
Эдгар Р.С. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика. 2010; 26: 2460–1.
CAS Статья Google Scholar
- 64.
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T., Yarza P, et al.Проект базы данных генов рибосомных РНК SILVA: улучшенная обработка данных и веб-инструменты. Nucleic Acids Res. 2012; 41: D590–6.
Артикул Google Scholar
- 65.
Truong DT, Franzosa EA, Tickle TL, Scholz M, Weingart G, Pasolli E, et al. MetaPhlAn2 для расширенного метагеномного таксономического профилирования. Нат методы. 2015; 12: 902–3.
CAS Статья Google Scholar
- 66.
Оксанен, Дж. и др. . веганский: Пакет «Экология сообщества». Пакет R версии 2.0-6. 2013.
- 67.
Венейблс В., Рипли Б. Современная прикладная статистика с С. Нью-Йорк: Спрингер; 2002.
Google Scholar
- 68.
Пинейро, Дж., Бейтс, Д., Деброй, С., Саркар, Д. и основная группа разработчиков R. nlme: линейные и нелинейные модели смешанных эффектов. Пакет R версии 3.1-108. 2013.
- 69.
Korpela K, Blakstad EW, Moltu S, Strommen K, Nakstad B, Ronnestad и др. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный отчет 2018; 8: 2453.
Артикул Google Scholar
- В исследованиях есть несоответствия в отношении количества пробиотических бактерий, необходимых для восстановления микрофлоры кишечника, и того, какой пробиотик лучше всего.
- Пробиотики считаются пищевыми добавками и не регулируются FDA. Нет никакой гарантии, что в продукте будет указанная доза или количество.
- Многие производители пробиотиков спонсируют исследование, которое может привести к конфликту интересов.
- Фрукты и овощи
- Зерновые и бобовые
- Ферментированные продукты, такие как йогурт, кефир и квашеная капуста
- удаления продуктов, питающих вредные бактерии и вызывающих воспаление
- введения большого количества пребиотических продуктов, которые питают полезные бактерии упражнения и поддержание водного баланса
- западная диета или стандартная американская диета (SAD)
- безглютеновые диеты
- вынимая из шкафа или холодильника продукты, которых он пытается избежать
- планирование приема пищи на следующие 3 дня
- составление списка продуктов и покупка ингредиентов заранее
- приготовление или замораживание блюд заранее
- обеспечение ежедневного времени для приготовления домашней еды, физических упражнений и отдыха
- добавленных сахаров, таких как столовый сахар, кукурузный сироп или ингредиенты, оканчивающиеся на «-оза» (например, фруктоза)
- рафинированные углеводы, такие как макаронные изделия, тесто для пиццы, торты и выпечка
- продукты с высоким содержанием насыщенных жиров, таких как обработанное мясо
- листовых зеленых овощей, таких как шпинат или капуста
- ярко окрашенных овощей, таких как перец, морковь или баклажан
- фрукты с низким содержанием сахара, такие как ягоды, яблоки или авокадо
- оливки и оливковое масло
- орехи и семена
- жирная рыба и нежирный белок
- сырые овощи и салаты
- зеленые соки или смузи
- молотые семена льна
- бобы и чечевица
- ходьба
- йога
- пилатес
- тай-чи
- квашеную капусту
- кимчи
- мисо
- темпе
- кефир
- влиять на скорость пищеварения
- повышать чувствительность кишечника
- повышать проницаемость кишечника
- отрицательно влиять на флору кишечника
- медитацию или практику осознанности
- принятие теплой ванны
- получение массажа или самомассаж
- кокосовый йогурт с черникой и миндальными хлопьями
- смузи с кокосовой водой, листьями шпината, яблоком, горстью черники и столовой ложкой молотых семян льна
- овсяных хлопьев с корицей и тертой тертой яблоко
- салат с рукколой, кресс-салатом, помидорами, огурцом и перцем, покрытый хумусом и зелеными оливками
- обертка из нутовой муки, фаршированная салатом, квашеной капустой и нарезанным тофу
- овощной суп
- нежирную куриную грудку и овощи, обжаренные в кокосовом масле, свежий имбирь, чеснок и тамари
- лосось и тушеные зеленые овощи, такие как капуста, капуста и т. Д. или pak choi
- лапша из цукини и чечевичный соус болоньезе
.5b. [PubMed] [CrossRef] [Google Scholar] 60.Азад М.Б., Велинг Л., Чан Д., Клопп А., Никель Н.С., МакГэвок Дж.М., Беккер А.Б., Мандхан П.Дж., Терви С.Э., Мораес Т.Дж. и др. Кормление грудных детей и увеличение веса: отделение грудного молока от грудного вскармливания и смеси от пищи. Педиатрия. 2018; 142 DOI: 10.1542 / peds.2018-1092. [PubMed] [CrossRef] [Google Scholar] 61. Гарднер А.С., Рахман И.А., Лай К.Т., Хепворт А., Тренгов Н., Хартманн П.Е., Геддес Д.Т. Изменения в составе жирных кислот человеческого молока в ответ на симптомы простуды у кормящих матерей и младенцев.Питательные вещества. 2017; 9: 1034. DOI: 10.3390 / nu
34. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 62. Брейки А.А., Хайнде К., Валеджия С.Р., Синофски А., Эллисон П.Т. Заболевание у грудных детей связано с концентрацией лактоферрина и секреторного иммуноглобулина А в материнском молоке. Evol. Med. Здравоохранение. 2015; 2015: 21–31. DOI: 10.1093 / emph / eov002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Куигли М., Эмблтон Н.Д., Макгуайр В. Формула против донорского грудного молока для кормления недоношенных детей или детей с низкой массой тела при рождении.Кокрановская база данных Syst. Ред.2018; 6: CD002971. DOI: 10.1002 / 14651858.CD002971.pub4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64. Шанлер Р.Дж., Лау К., Херст Н.М., Смит Э.О. Рандомизированное испытание донорского грудного молока по сравнению с молоком для недоношенных детей в качестве заменителя материнского молока при кормлении крайне недоношенных детей. Педиатрия. 2005. 116: 400–406. DOI: 10.1542 / peds.2004-1974. [PubMed] [CrossRef] [Google Scholar] 65. Мартинес К.Б., Леоне В., Чанг Э.Б. Западные диеты, дисбактериоз кишечника и нарушения обмена веществ: связаны ли они? Кишечные микробы.2017; 8: 130–142. DOI: 10.1080 / 194
.2016.1270811. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67. Ву Г.Д., Чен Дж., Хоффманн К., Биттингер К., Чен Ю.Ю., Кейлбо С.А., Бьютра М., Найтс Д., Уолтерс В.А., Найт Р. и др. Связывание долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука. 2011; 334: 105–108. DOI: 10.1126 / science.1208344. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Wu G.D., Compher C., Chen E.Z., Smith S.A., Shah R.D., Bittinger K., Chehoud C., Альбенберг Л.Г., Нессель Л., Гилрой Э. и др. Сравнительная метаболомика у веганов и всеядных животных выявляет ограничения на производство метаболитов кишечной микробиоты, зависящее от диеты. Кишечник. 2016; 65: 63–72. DOI: 10.1136 / gutjnl-2014-308209. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69. Циммер Дж., Ланге Б., Фрик Дж .-С., Зауэр Х., Циммерманн К., Швирц А., Руш К., Клостерхалфен С., Энк П. Вегетарианская или вегетарианская диета существенно изменяет фекальную микробиоту толстой кишки человека. . Евро. J. Clin. Nutr. 2012; 66: 53–60.DOI: 10.1038 / ejcn.2011.141. [PubMed] [CrossRef] [Google Scholar] 70. Смитс Л.П., Кутте Р.С., Левин Э., Продан А., Фуэнтес С., Зетендал Э.Г., Ван З., Левисон Б.С., Клеофас М.С.П., Кемпер Э.М. и др. Влияние веганской трансплантации фекальной микробиоты на продукцию триметиламин-N-оксида, производную карнитина и холина, и воспаление сосудов у пациентов с метаболическим синдромом. Варенье. Сердце доц. 2018; 7 DOI: 10.1161 / JAHA.117.008342. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Кабердосс Дж., Деви Р.С., Мэри Р.Р., Рамакришна Б.С. Состав фекальной микробиоты вегетарианцев: сравнение с всеядными в группе молодых женщин на юге Индии. Br. J. Nutr. 2012; 108: 953–957. DOI: 10.1017 / S0007114511006362. [PubMed] [CrossRef] [Google Scholar] 72. Кисусе Дж., Ла-Онгкхам О., Накпайчит М., Тердтата П., Момода Р., Танака М., Фукуда С., Поплючай С., Кеспечара К., Сономото К. и др. Городские диеты, связанные с изменениями кишечного микробиома и метаболома у детей: сравнительное кросс-секционное исследование в Таиланде.Фронт. Microbiol. 2018; 9: 1345. DOI: 10.3389 / fmicb.2018.01345. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Фурусава Ю., Обата Ю., Фукуда С., Эндо Т.А., Накато Г., Такахаши Д., Наканиши Ю., Уэтаке К., Като К., Като Т. и др. Бутират, полученный из комменсальных микробов, индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа. 2013; 504: 446–450. DOI: 10,1038 / природа12721. [PubMed] [CrossRef] [Google Scholar] 74. Рагглс К.В., Ван Дж., Волкова А., Контрерас М., Ноя-Аларкон О., Лендер О., Кабальеро Х., Домингес-Белло М. Изменения кишечной микробиоты городских жителей во время погружения в традиционную диету и образ жизни в деревне тропических лесов. мСфера. 2018; 3 DOI: 10.1128 / mSphere.00193-18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Jantchou P., Morois S., Clavel-Chapelon F., Boutron-Ruault M.-C., Carbonnel F. Потребление животного белка и риск воспалительного заболевания кишечника: проспективное исследование E3N. Являюсь. J. Gastroenterol. 2010; 105: 2195–2201. DOI: 10.1038 / ajg.2010.192. [PubMed] [CrossRef] [Google Scholar] 76. Свилтека Д., Доминика Э., Нарбад А., Арьян Н., Риджуэй К.П., Карин Р.П., Костыра Х., Хенрик К. Исследование влияния гликированных белков гороха на кишечные бактерии человека. Int. J. Food Microbiol. 2011; 145: 267–272. DOI: 10.1016 / j.ijfoodmicro.2011.01.002. [PubMed] [CrossRef] [Google Scholar] 77. Romond M.B., Ais A., Guillemot F., Bounouader R., Cortot A., Romond C. Бесклеточная сыворотка из молока, ферментированного Bifidobacterium breve C50, используемого для модификации микрофлоры толстой кишки здоровых субъектов.J. Dairy Sci. 1998. 81: 1229–1235. DOI: 10.3168 / jds.S0022-0302 (98) 75683-8. [PubMed] [CrossRef] [Google Scholar] 78. Де Филиппис Ф., Пеллегрини Н., Ваннини Л., Джеффри И. Б., Ла Сториа А., Лаги Л., Серразанетти Д. И., Ди Каньо Р., Феррочино И., Лацци К. и др. Приверженность средиземноморской диете на высоком уровне благотворно влияет на микробиоту кишечника и связанный с ней метаболом. Кишечник. 2016; 65: 1812–1821. DOI: 10.1136 / gutjnl-2015-309957. [PubMed] [CrossRef] [Google Scholar] 79. Левин М.Е., Суарес Дж. А., Брандхорст С., Balasubramanian P., Cheng C.-W., Madia F., Fontana L., Mirisola M.G., Guevara-Aguirre J., Wan J., et al. Низкое потребление белка связано со значительным снижением IGF-1, рака и общей смертности у людей старше 65 лет, но не у пожилых. Cell Metab. 2014; 19: 407–417. DOI: 10.1016 / j.cmet.2014.02.006. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 80. Фава Ф., Гитау Р., Гриффин Б.А., Гибсон Г.Р., Туохи К.М., Лавгроув Дж. Тип и количество пищевых жиров и углеводов изменяют фекальный микробиом и экскрецию короткоцепочечных жирных кислот в популяции группы риска с метаболическим синдромом.Int. J. Obes. (Лондон) 2013; 37: 216–223. DOI: 10.1038 / ijo.2012.33. [PubMed] [CrossRef] [Google Scholar] 81. Цезарь Р., Тремароли В., Ковачева-Датчари П., Кани П.Д., Бэкхед Ф. Перекрестные помехи между кишечной микробиотой и диетическими липидами усугубляют воспаление WAT посредством передачи сигналов TLR. Cell Metab. 2015; 22: 658–668. DOI: 10.1016 / j.cmet.2015.07.026. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 82. Фойгт Р.М., Форсайт С.Б., Грин С.Дж., Мутлу Э., Энген П., Витерна М.Х., Турек Ф.В., Кешаварзян А.Циркадная дезорганизация изменяет микробиоту кишечника. PLoS ONE. 2014; 9: e97500. DOI: 10.1371 / journal.pone.0097500. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 83. Зонненбург Е.Д., Зонненбург Дж.Л. голодание нашего микробного «я»: пагубные последствия диеты с дефицитом доступных для микробиоты углеводов. Cell Metab. 2014; 20: 779–786. DOI: 10.1016 / j.cmet.2014.07.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 84. Фэн Ю., Ван Ю., Ван П., Хуанг Ю., Ван Ф. Короткоцепочечные жирные кислоты проявляют стимулирующее и защитное действие на барьерную функцию кишечника посредством ингибирования инфламмасомы NLRP3 и аутофагии.Клетка. Physiol. Биохим. 2018; 49: 190–205. DOI: 10,1159 / 000492853. [PubMed] [CrossRef] [Google Scholar] 85. Шлей П.Д., Филд С.Дж. Иммуностимулирующие эффекты пищевых волокон и пребиотиков. Br. J. Nutr. 2002; 87 (Приложение 2): S221 – S230. DOI: 10,1079 / BJN / 2002541. [PubMed] [CrossRef] [Google Scholar] 86. Смит П.М., Ховитт М.Р., Паников Н., Мишо М., Галлини К.А., Бохлули-Й. М., Гликман Дж. Н., Гарретт В.С. Микробные метаболиты, короткоцепочечные жирные кислоты, регулируют гомеостаз Treg-клеток толстой кишки. Наука.2013; 341: 569–573. DOI: 10.1126 / science.1241165. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 87. Cani P.D., Bibiloni R., Knauf C., Waget A., Neyrinck A.M., Delzenne N.M., Burcelin R.Изменения в кишечной микробиоте контролируют метаболическое воспаление, вызванное эндотоксемией, при ожирении, вызванном диетой с высоким содержанием жиров, и диабете у мышей. Сахарный диабет. 2008; 57: 1470–1481. DOI: 10.2337 / db07-1403. [PubMed] [CrossRef] [Google Scholar] 88. Халмос Е.П., Кристоферсен К.Т., Берд А.Р., Шеперд С.Дж., Гибсон П.Р., Мьюир Дж.Рационы, которые различаются по содержанию FODMAP, изменяют микросреду просвета толстой кишки. Кишечник. 2015; 64: 93–100. DOI: 10.1136 / gutjnl-2014-307264. [PubMed] [CrossRef] [Google Scholar] 89. Котийяр А., Кеннеди С.П., Конг Л.С., Прифти Э., Понс Н., Ле Шателье Э., Алмейда М., Квинкис Б., Левенес Ф., Галлерон Н. и др. Диетическое вмешательство влияет на богатство кишечных микробов. Природа. 2013; 500: 585–588. DOI: 10,1038 / природа12480. [PubMed] [CrossRef] [Google Scholar] 90. Ким М.-С., Хван С.-С., Пак Э.-Дж., Бэ Ж.-В. Строгая вегетарианская диета улучшает факторы риска, связанные с метаболическими заболеваниями, регулируя микробиоту кишечника и уменьшая воспаление кишечника. Environ. Microbiol. Отчет 2013; 5: 765–775. DOI: 10.1111 / 1758-2229.12079. [PubMed] [CrossRef] [Google Scholar] 91. Gamage H.K.A.H., Tetu S.G., Chong R.W.W., Ashton J., Packer N.H., Paulsen I.T. Зерновые продукты, полученные из пшеницы, сорго, риса и овса, изменяют микробиоту кишечника младенцев in vitro. Sci. Отчет 2017; 7: 14312. DOI: 10.1038 / s41598-017-14707-z.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 92. Мендес-Салазар Э.О., Ортис-Лопес М.Г., Гранадос-Сильвестр М.Д.Л., Паласиос-Гонсалес Б., Мендживар М. Измененная микробиота кишечника и изменения состава у фирмикутов и протеобактерий у мексиканских детей с недостаточным питанием и ожирением. Фронт. Microbiol. 2018; 9: 2494. DOI: 10.3389 / fmicb.2018.02494. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 93. Санс Ю. Влияние безглютеновой диеты на микробиоту кишечника и иммунную функцию у здоровых взрослых людей.Кишечные микробы. 2010; 1: 135–137. DOI: 10.4161 / gmic.1.3.11868. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 94. Bonder M.J., Tigchelaar E.F., Cai X., Trynka G., Cenit M.C., Hrdlickova B., Zhong H., Vatanen T., Gevers D., Wijmenga C. и др. Влияние краткосрочной безглютеновой диеты на микробиом кишечника человека. Genome Med. 2016; 8:45. DOI: 10.1186 / s13073-016-0295-у. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 95. Ван К.-П., Бровман Д., Херцог Х., Нили Г.Г. Непитательные подсластители обладают бактериостатическим действием и изменяют микробиоту кишечника мышей.PLoS ONE. 2018; 13: e0199080. DOI: 10.1371 / journal.pone.0199080. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 96. Суэц Дж., Корем Т., Зееви Д., Зильберман-Шапира Г., Таисс К.А., Маза О., Исраэль Д., Змора Н., Гилад С., Вайнбергер А. и др. Искусственные подсластители вызывают непереносимость глюкозы, изменяя микробиоту кишечника. Природа. 2014; 514: 181–186. DOI: 10,1038 / природа13793. [PubMed] [CrossRef] [Google Scholar] 97. Куэрво А., Вальдес Л., Салазар Н., де лос Рейес-Гавилан К.Г., Руас-Мадьедо П., Геймонде М., Гонсалес С. Экспериментальное исследование диеты и микробиоты: интерактивные ассоциации волокон и полифенолов с кишечными бактериями человека. J. Agric. Food Chem. 2014; 62: 5330–5336. DOI: 10.1021 / jf501546a. [PubMed] [CrossRef] [Google Scholar] 98. Паркар С.Г., Стивенсон Д.Э., Скиннер М.А.Потенциальное влияние фруктовых полифенолов на микрофлору толстой кишки и здоровье кишечника человека. Int. J. Food Microbiol. 2008. 124: 295–298. DOI: 10.1016 / j.ijfoodmicro.2008.03.017. [PubMed] [CrossRef] [Google Scholar] 99.Цунис X., Родригес-Матеос А., Вулевич Дж., Гибсон Г. Р., Квик-Урибе К., Спенсер Дж. П. Э. Пребиотическая оценка флаванолов, полученных из какао, у здоровых людей с помощью рандомизированного контролируемого двойного слепого перекрестного исследования. Являюсь. J. Clin. Nutr. 2011; 93: 62–72. DOI: 10.3945 / ajcn.110.000075. [PubMed] [CrossRef] [Google Scholar] 100. Мацумото К., Такада Т., Симидзу К., Морияма К., Каваками К., Хирано К., Каджимото О., Номото К. Влияние пробиотического кисломолочного напитка, содержащего штамм Lactobacillus casei Shirota, на частоту дефекации, микробиоту кишечника, и кишечная среда здоровых людей с мягким стулом.J. Biosci. Bioeng. 2010; 110: 547–552. DOI: 10.1016 / j.jbiosc.2010.05.016. [PubMed] [CrossRef] [Google Scholar] 101. Ян Ю.-Дж., Шеу Б.-С. Йогурты, содержащие пробиотики, подавляют нагрузку Helicobacter pylori и изменяют иммунный ответ и кишечную микробиоту у детей, инфицированных Helicobacter pylori. Helicobacter. 2012; 17: 297–304. DOI: 10.1111 / j.1523-5378.2012.00941.x. [PubMed] [CrossRef] [Google Scholar] 102. Забат М.А., Сано В.Х., Вурстер Дж. И., Кабрал Д. Дж., Беленький П. Анализ микробного сообщества при брожении квашеной капусты показывает стабильное и быстро установившееся сообщество.Еда. 2018; 7: 77. DOI: 10.3390 / foods7050077. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 103. Марко М.Л., Хини Д., Бинда С., Чифелли К.Д., Коттер П.Д., Фолинье Б., Гензле М., Корт Р., Пасин Г., Пихланто А. и др. Польза для здоровья ферментированных продуктов: микробиота и не только. Curr. Opin. Biotechnol. 2017; 44: 94–102. DOI: 10.1016 / j.copbio.2016.11.010. [PubMed] [CrossRef] [Google Scholar] 104. Хэ Т., Прибе М.Г., Чжун Ю., Хуанг К., Хармсен Х.Дж.М., Раангс Г.К., Антуан Ж.-М., Веллинг Г.В., Вонк Р.Дж. Влияние добавок йогурта и бифидобактерий на микробиоту толстой кишки у субъектов с непереносимостью лактозы. J. Appl. Microbiol. 2008. 104: 595–604. DOI: 10.1111 / j.1365-2672.2007.03579.x. [PubMed] [CrossRef] [Google Scholar] 105. Карлссон Видехульт Ф., Андерссон Ю., Элунд И., Стенлунд Х., Хернелл О., Западный С.Е. Влияние пробиотиков во время отлучения от груди на метаболический и воспалительный профиль: наблюдение в школьном возрасте. Int. J. Food Sci. Nutr. 2015; 66: 686–691. DOI: 10.3109 / 09637486.2015.1025717.[PubMed] [CrossRef] [Google Scholar] 106. Осборн Д. А., Синн Дж. К. Пробиотики у младенцев для профилактики аллергических заболеваний и пищевой гиперчувствительности. Кокрановская база данных Syst. Ред. 2007: CD006475. DOI: 10.1002 / 14651858.CD006475.pub2. [PubMed] [CrossRef] [Google Scholar] 107. Николини Г., Сперотто Ф., Эспозито С. Борьба с повышением устойчивости к антибиотикам у детей. Минерва Педиатр. 2014; 66: 31–39. [PubMed] [Google Scholar] 108. Азад М.Б., Моссави С., Овора А., Сепехри С. Воздействие антибиотиков в раннем возрасте, развитие кишечной микробиоты и предрасположенность к ожирению.Nestle Nutr. Inst. Мастерская Сер. 2017; 88: 67–79. DOI: 10,1159 / 000455216. [PubMed] [CrossRef] [Google Scholar] 110. Ямамото-Ханада К., Ян Л., Нарита М., Сайто Х., Охя Ю. Влияние использования антибиотиков в раннем детстве на астму и аллергические заболевания в возрасте 5 лет. Ann. Allergy Asthma Immunol. 2017; 119: 54–58. DOI: 10.1016 / j.anai.2017.05.013. [PubMed] [CrossRef] [Google Scholar] 111. Penders J., Thijs C., Vink C., Stelma F.F., Snijders B., Kummeling I., Brandt P.A. ван ден, Стобберинг Э.Э. Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве.Педиатрия. 2006; 118: 511–521. DOI: 10.1542 / peds.2005-2824. [PubMed] [CrossRef] [Google Scholar] 112. Ле Шателье Э., Нильсен Т., Цинь Дж., Прифти Э., Хильдебранд Ф., Фалони Г., Алмейда М., Арумугам М., Батто Дж. М., Кеннеди С. и др. Богатство микробиома кишечника человека коррелирует с метаболическими маркерами. Природа. 2013; 500: 541–546. DOI: 10,1038 / природа12506. [PubMed] [CrossRef] [Google Scholar] 113. Тернбо П.Дж., Лей Р.Э., Маховальд М.А., Магрини В., Мардис Э.Р., Гордон Дж.И. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию.Природа. 2006; 444: 1027–1031. DOI: 10,1038 / природа05414. [PubMed] [CrossRef] [Google Scholar] 115. Яллапрагада С.Г., Нэш С.Б., Робинсон Д.Т. Воздействие антибиотиков в раннем возрасте, изменения в кишечном микробиоме и риск метаболических заболеваний у детей и взрослых. Педиатр. Аня. 2015; 44: e265 – e269. DOI: 10.3928 / 00
Добавка с пробиотиками восстанавливает нормальный состав и функцию микробиоты у младенцев, получавших лечение антибиотиками, и у младенцев, родившихся после кесарева сечения | Микробиом
Антибиотики и здоровье кишечника — Здоровье детей
Антибиотики — это полезные лекарства, которые борются с бактериальными инфекциями и могут сохранить здоровье детей. Однако антибиотики также могут иметь общие побочные эффекты, многие из которых связаны с проблемами пищеварения, такими как диарея, запор и расстройство желудка.
Исследования показали, что от одной трети до половины детей, принимающих антибиотики, могут заболеть желудком. Бхаскар Гуррам, доктор медицины, детский гастроэнтеролог из Children’s Health℠ и доцент из UT Southwestern, рассказывает, почему антибиотики влияют на здоровье кишечника и как родители могут помочь облегчить пищеварительный расстройство ребенка, вызванное антибиотиками.
Почему антибиотики вызывают диарею?
Причина, по которой антибиотики могут вызывать диарею или расстройство желудка, заключается в том, что антибиотики разрушают экосистему кишечника.Наш желудочно-кишечный тракт является хозяином триллионов микроорганизмов, составляющих от 200 до 500 различных видов в каждом человеке. Эти кишечные бактерии, также известные как микробиом, представляют собой очень высокоорганизованную сеть, которая поддерживает функции нашего организма, включая пищеварение, защищает от определенных инфекций и регулирует нашу иммунную систему.
«Количество микроорганизмов в желудочно-кишечном тракте превышает количество наших человеческих клеток в 10 раз, и они несут в 150 раз больше генетического материала, чем наш человеческий геном», -Гуррам объясняет. «Это очень сложная и запутанная, но тонкая система».
Хотя у антибиотиков есть свои преимущества, проблема с антибиотиками заключается в том, что они не просто убивают «плохие» бактерии, вызывающие инфекцию, которую лечат. Они также убивают полезные бактерии, живущие в нашем кишечнике. Это может привести к дисбалансу микробиома, также называемому дисбактериозом, который может привести к симптомам со стороны ЖКТ.
Антибиотики редко вызывают запор, но могут вызывать диарею, спазмы и тошноту.Эти побочные эффекты — одна из причин, по которой важно избегать ненужного использования антибиотиков. Однако «антибиотики чрезвычайно важны и спасают жизнь», — утверждает д-р Гуррам. «Врачи понимают преимущества и риски антибиотиков и с осторожностью назначают антибиотики только тогда, когда они необходимы».
От чего помогают антибиотики от диареи?
Не все дети будут испытывать диарею или проблемы с желудочно-кишечным трактом при приеме антибиотиков. Чтобы предотвратить любые побочные эффекты, принимайте антибиотики только в соответствии с предписаниями и следуйте всем инструкциям, которые даются с лекарством.
Если ваш ребенок действительно испытывает диарею или другие проблемы с желудком во время приема антибиотика, самое важное, что нужно сделать, — это убедиться, что ваш ребенок пьет достаточно воды и остается гидратированным. Если симптомы со стороны желудочно-кишечного тракта не исчезнут в течение 7-10 дней, позвоните своему педиатру.
Следует ли детям принимать пробиотики во время приема антибиотиков?
Другой известный подход к предотвращению или облегчению диареи с помощью антибиотиков — это прием пробиотиков. Исследования показывают, что прием пробиотиков в начале приема антибиотиков может иметь некоторые профилактические преимущества.Однако доктор Гуррам предостерегает от всех исследований за чистую монету. Например:
«Пробиотик может помочь предотвратить один эпизод диареи, связанной с антибиотиками, примерно у 12-40 детей, которые его принимают», — объясняет доктор Гуррам. «Пробиотикам очень сложно восстановить микробиом организма, потому что в кишечнике очень много разных штаммов бактерий».
Что может восстановить флору кишечника после приема антибиотика?
Лучший способ восстановить микрофлору кишечника после приема антибиотиков — это выработать здоровые привычки в питании — еще до начала приема лекарств.Хорошо сбалансированная диета может помочь организму оправиться от нарушения микробиома — независимо от того, вызвано ли оно антибиотиком или инфекцией — и помочь облегчить побочные эффекты со стороны пищеварения.
Еще один подход, который следует рассмотреть, помимо здорового питания, — убедиться, что в ваш рацион входят пребиотики.
«Пребиотики создают благоприятную среду для жизни и роста пробиотиков», — объясняет доктор Гуррам. «Многие люди используют пребиотики и пробиотики вместе, чтобы создать благоприятную и устойчивую среду для жизни и процветания кишечной флоры — до, во время или после применения антибиотиков.«
Хорошие источники пребиотиков:
Узнайте больше о том, как здоровая диета может улучшить общее состояние кишечника, чтобы предотвратить проблемы с желудочно-кишечным трактом у вашего ребенка.
До половины всех детей могут испытывать расстройство желудка при приеме антибиотиков. Эксперт @Childrens объясняет, почему и помогут ли пробиотики.
Узнать больше
Высококвалифицированные педиатрические специалисты по желудочно-кишечному тракту в Children’s Health могут помочь выявить, диагностировать и лечить проблемы с пищеварением у детей.Узнайте больше о нашей гастроэнтерологической программе и услугах.
Зарегистрироваться
Следите за новостями о здоровье, которые важны для ваших детей. Подпишитесь на рассылку новостей здоровья детей и получайте больше советов прямо на ваш почтовый ящик.
Голодные дети часто не выздоравливают, даже если их достаточно кормить. Восстановление кишечных бактерий может помочь | Наука
Ребенка в Бангладеш проверяют на предмет недоедания.
МУНИР УЗ ЗАМАН / AFP / Getty ImagesАвтор Элизабет Пенниси
Даже после того, как голодные дети снова получают достаточно еды, они часто не могут расти. Их мозг не развивается должным образом, и они остаются восприимчивыми к болезням даже спустя много лет. Два исследования, проведенные на этой неделе в журнале Science , показывают, что выращивание правильных кишечных микробов может помочь этим детям выздороветь.Работа также определяет комбинации продуктов, которые питают полезные микробы.
Большинство экспериментов проводилось на животных, но небольшая группа истощенных детей, получавших эти продукты, также показала признаки улучшения. «Это выдающееся и чрезвычайно всестороннее исследование», — говорит Онорин Уорд, микробиолог и эксперт по глобальному здоровью из Медицинской школы Университета Тафтса в Бостоне. Адаптация продовольственной помощи к развитию микробиома «может стать ключом к новым стратегиям улучшения глобального общественного здоровья и человеческого потенциала», — добавляет Дэвид Релман, микробиолог из Стэнфордского университета в Пало-Альто, Калифорния.
Тахмид Ахмед, директор по исследованиям в области питания Международного центра исследований диарейных болезней, Бангладеш, в Дакке, уже 30 лет пытается помочь детям, страдающим от недоедания, лучше выздороветь. Около десяти лет назад он был заинтригован работой Джеффри Гордона из Вашингтонского университета в Сент-Луисе, штат Миссури, о связи определенных кишечных микробов с ожирением. Двое ученых задались вопросом, может ли микробиом — набор микробов, обитающих в человеческом теле и на нем, — также играть роль в противоположном числе ожирения — недоедании.
Вместе их команды сообщили в 2014 году, что микробиом кишечника обычно «созревает», когда младенец превращается в малыша. Они также заметили, что он остается незрелым у детей с тяжелым истощением, в котором преобладают бактерии, обнаруженные у здоровых детей младшего возраста. Два года спустя исследователи поместили зрелые и незрелые микробиомы детей в мышей, выращенных без микробов. Животные с незрелым микробиомом нарастали меньше мышц, имели более слабые кости и нарушали обмен веществ, что позволяет предположить, что для правильного развития может потребоваться зрелый микробиом.
Чтобы определить, какие из сотен штаммов микробиома связаны с созреванием, Арджун Раман, постдок из лаборатории Гордона, проанализировал данные из образцов фекалий, которые команда Ахмеда собирала ежемесячно у 50 здоровых младенцев в Бангладеш по мере их роста. Раман идентифицировал 15 типов бактерий, количество которых увеличивалось и уменьшалось одновременно по мере созревания микробиома. Он и его команда наблюдали ту же картину у здоровых детей из Перу и Индии и даже у стерильных поросят, которым давали бактерии и ели ту же пищу, что и младенцы и дети из Бангладеш, сообщают они в Science .
По мнению исследователей, стимулирование или подавление этих микробов может стать ключом к тому, чтобы помочь детям вылечиться от недоедания. Чтобы проверить эту идею, им нужен был способ контролировать восстановление. В поисках молекулярной сигнатуры здорового роста аспирантка лаборатории Гордона Джанет Гериг и ее коллеги проверили более 1000 белков и метаболитов, таких как жирные и аминокислоты, на предмет тех, которые меняются по мере роста здоровых детей и выздоровления истощенных.
Гериг и остальная команда затем протестировали влияние различных продуктов на мышей и поросят, микробиомы которых были пересажены от недоедающих младенцев.Они надеялись найти продукты, которые могли бы «стимулировать наверстывающий рост микробиоты», — говорит Гордон. Сухое молоко и рис, стандартные компоненты продовольственной помощи, мало способствовали созреванию, но нут, банан, соевая и арахисовая мука способствовали созреванию микробиомов.
Затем исследователи скармливали мышам и поросятам добавки, которые объединили все четыре корма, и увидели, что микробиомы животных созревают и их рост улучшается. «Это исследование указывает на важность и полезность тщательно отобранных питательных веществ для поддержки ключевых представителей микробиоты», — говорит Релман.
В качестве последнего доказательства принципа Ахмед, Гордон и их коллеги сравнили свои добавки со стандартным тарифом восстановления примерно у 60 детей Бангладеш, страдающих от недоедания, в течение 1 месяца. Это было слишком мало времени, чтобы оценить долгосрочное физическое восстановление, но достаточно, чтобы увидеть влияние на молекулярные сигнатуры в крови. Только комбинация из четырех продуктов питания резко улучшила эти сигнатуры, сообщается в Science . Он также улучшил работу 15 бактерий, связанных с созреванием группы Рамана.
Результаты предлагают способ улучшить питание даже у сытых детей, у которых неправильное питание может привести к повышенному риску ожирения, диабета и других заболеваний во взрослом возрасте. «Если воспитатели будут знать, какие продукты лучше всего кормить своих детей, чтобы поддержать развитие их кишечной микробиоты, мы могли бы потенциально предотвратить недоедание и незрелую микробиоту с самого начала», — говорит Гериг.
Релман и другие более осторожны, особенно потому, что неясно, сохранятся ли зрелые микробиомы у недоедающих младенцев, которые принимали добавки.Крис Дамман, старший сотрудник по программе Фонда Билла и Мелинды Гейтс в Сиэтле, штат Вашингтон, который финансировал работу, говорит: «Я бы не сказал, что это« будущее »или« панацея ». Но это все. безусловно, захватывающая идея, и мы думаем, что она многообещающая ».
Вернувшись в Бангладеш, Ахмед координирует усилия по обеспечению диеты, повышающей количество микробов, и других продуктов для большей группы недоедающих детей. Команда будет наблюдать за детьми в течение 3 месяцев, достаточно долго, чтобы увидеть, повлияет ли положительный эффект на здоровое развитие.По его словам, он надеется, что «это может изменить правила игры в лечении недоедания».
Может ли очищение помочь микробиому?
Некоторые люди утверждают, что соблюдение специальной диеты в течение короткого периода времени может значительно улучшить здоровье кишечника. Примером этого является трехдневная перезагрузка кишечника, цель которой — увеличить количество полезных бактерий в пищеварительном тракте человека.
Хотя изменение диеты и принятие мер по ведению здорового образа жизни действительно приносит пользу флоре кишечника, мало доказательств того, что трехдневная перезагрузка кишечника имеет длительную пользу для здоровья.
В этой статье рассказывается, что такое трехдневный сброс кишечника, что он может сделать и как его попробовать.
Трехдневная перезагрузка кишечника — это короткая диета, направленная на улучшение пищеварения за счет увеличения количества полезных бактерий в толстой кишке человека.
Бактерии и другие микроорганизмы в толстом кишечнике помогают расщеплять пищу. Это, в свою очередь, помогает организму усваивать питательные вещества и устранять отходы.
Однако исследования показали, что кишечные бактерии влияют на многие другие аспекты здоровья, такие как иммунитет и воспаление.Это влияние может быть положительным или отрицательным, в зависимости от вида микробов, обитающих в кишечнике человека.
Сброс кишечника направлен на восстановление баланса микробиома путем:
Часто трехдневная перезагрузка кишечника связана с принятием привычек, которые в целом полезны для здоровья человека.Соблюдение здоровой, сбалансированной диеты и отказ от потенциально вредных продуктов могут помочь людям почувствовать себя лучше по-разному.
Тем не менее, ученые не исследовали, может ли трехдневная перезагрузка кишечника навсегда изменить микробиом человека или обеспечить устойчивое улучшение здоровья.
Исследования показали, что краткосрочные диетические изменения действительно изменяют флору кишечника человека. В исследовании 2013 года исследователи обнаружили, что бактерии быстро реагируют на внезапное изменение растительной диеты.
Это говорит о том, что трехдневная перезагрузка кишечника может положительно повлиять на микробиом во время диеты.Однако для получения долгосрочных преимуществ может потребоваться внесение долгосрочных изменений в диету и образ жизни.
Согласно обзору 2017 года, средиземноморская диета может увеличить количество и разнообразие полезных бактерий в кишечнике, тогда как другие типы диеты могут уменьшить их. К последним относятся:
Средиземноморская диета включает в себя многие функции восстановления кишечника с упором на полезные жиры, овощи и другие источники. волокна.Трехдневная перезагрузка кишечника может помочь человеку перейти на диету, включающую больше этих продуктов.
Если человек хочет попробовать 3-дневную перезагрузку кишечника, лучше спланировать это заранее. Перезапуск кишечника часто требует внезапных и значительных изменений в диете, поэтому может помочь, если человек готовится следующим образом:
Ешьте противовоспалительные продукты
В первый раз В день перезагрузки кишечника основное внимание уделяется исключению из рациона воспалительных продуктов и напитков.К ним относятся:
Вместо этого человек должен есть много свежих продуктов и полезных жиров, в том числе:
Сложные углеводы могут обеспечить медленное сжигание энергии во всем день.Человек может попробовать умеренные порции таких продуктов, как коричневый рис, киноа, овес или сладкий картофель.
Сохраняйте водный баланс
Достаточное потребление воды необходимо для функционирования организма. Человек может определить, достаточно ли он пьет воды, по цвету мочи, которая должна быть бледно-соломенного цвета.
Во время перезагрузки кишечника лучше избегать употребления кофеина и алкоголя и заменить их водой или травяными чаями, такими как перечная мята, ромашка или фенхель.
Достаточно спите
Некоторые данные свидетельствуют о том, что сон может влиять на микробиом, а также на когнитивные функции.Человек может попытаться найти время, чтобы расслабиться вечером и установить регулярное время для сна и бодрствования.
Узнайте больше о том, почему сон важен для здоровья.
Добавляйте больше продуктов с высоким содержанием клетчатки
Добавление в рацион дополнительных продуктов с высоким содержанием клетчатки может обеспечить полезную флору кишечника и потреблять больше еды. Примеры продуктов с высоким содержанием клетчатки:
Внезапное увеличение потребления клетчатки может вызвать временное вздутие живота или газы.В этом случае лучше всего с первого дня придерживаться диеты.
Попробуйте регулярно заниматься спортом
Небольшое исследование, проведенное в 2014 году, показало, что упражнения могут положительно влиять на разнообразие микробиома. Регулярные упражнения также могут помочь людям снять стресс и поддерживать умеренный вес.
Легкие упражнения — хороший способ начать. Человек может попробовать:
Попробуйте ферментированные продукты
Ферментированные продукты содержат пробиотики, которые являются живыми бактериями.Человек может включать в свой рацион:
Как и продукты с высоким содержанием клетчатки, пробиотики могут вызывать побочные эффекты, такие как вздутие живота или газы. Это может исчезнуть само по себе через несколько дней. Если этого не произойдет, человек может захотеть уменьшить количество потребляемых ферментированных продуктов или вообще отказаться от них.
Попробуйте техники релаксации
Стресс влияет на кишечник по-разному.Согласно исследованию 2011 года, стресс может:
Трехдневная перезагрузка кишечника может быть возможностью для человек, который вводит расслабление в свой распорядок дня. Это может включать:
По истечении трех дней человек может рассмотреть возможность продолжения некоторых или всех этих практик надолго. -срочные льготы.
Завтрак
Варианты завтрака:
Обед
Некоторые варианты обеда включают:
Ужин
Варианты ужина включают:
Кратковременный сброс кишечника может не подходить для r люди, страдающие определенными заболеваниями, принимающие лекарства, беременные или кормящие грудью.Кроме того, поскольку перезагрузка кишечника связана с диетическими ограничениями, она может оказаться бесполезной для людей, выздоравливающих от расстройств пищевого поведения.
Важно проконсультироваться с врачом или диетологом, прежде чем делать какие-либо резкие изменения в питании. Также рекомендуется сообщить медицинскому работнику о любых стойких или тревожных симптомах, поскольку они могут указывать на основное состояние здоровья.
Трехдневная перезагрузка кишечника может быть полезна как способ перехода к более здоровой диете или образу жизни.Однако отсутствуют доказательства, подтверждающие мнение, что он может резко изменить микробиом или общее состояние здоровья человека в течение 3-дневного периода.
Более длительные изменения в диете могут иметь положительное влияние на здоровье кишечника человека и некоторые хронические заболевания. Врач или диетолог может посоветовать лучший способ для этого.
Использование пробиотиков для коррекции дисбактериоза нормальной микробиоты после болезни или разрушительных событий: систематический обзор
Введение
Популярность пробиотиков в последнее время выросла в геометрической прогрессии, но наряду с увеличением их использования ведутся споры о том, как следует регулировать пробиотики и следует ли рассматривать пробиотики в качестве лечебного питания, лекарства или пищевой добавки.В США пробиотики обычно доступны в виде пищевых добавок и, таким образом, ограничиваются заявлением о «структуре или функции» для здоровья и, в отличие от лекарств, отпускаемых по рецепту, не имеют права заявлять, что «лечат» или «излечивают» болезнь. В Европе и Великобритании пробиотики имеют право заявить о своей полезности или функциональности. Эти утверждения должны быть подтверждены хорошо проведенными испытаниями на людях в целевой популяции или на здоровых добровольцах, но Европейское управление по безопасности пищевых продуктов (EFSA) отклонило> 80% поданных им заявлений.1–3 Во многих случаях научное обоснование конкретного заявления о пользе для здоровья было сочтено недостаточным или основанным на косвенном эффекте4. Одно из таких функциональных заявлений, сделанных для пробиотических продуктов, заключается в том, что они устраняют дисбактериоз (или нарушение существования бактерий и грибов после применения антибиотиков или разрушительное воздействие) и, таким образом, может быть полезным для поддержания здоровья. Пробиотики активны в течение этого чувствительного окна с момента разрушительного события до момента восстановления нормальной микробиоты. Для пробиотиков задокументировано множество механизмов действия (от блокирования участков прикрепления патогенов, разрушения патогена бактериоцинами или протеазами, разлагающими токсины до регуляции иммунной системы) 5, 6, и хотя клинические данные подтверждают Эффективность некоторых пробиотических штаммов, доказательства, связывающие эти механизмы действия с определенными заявлениями о здоровье или функции, не так однозначны.
Классическим примером последствий дисбактериоза является диарея, связанная с антибиотиками (AAD) .7, 8 Хотя антибиотики могут быть эффективными в уничтожении патогенных организмов, общим непреднамеренным эффектом является уничтожение или подавление полезных микробов из-за общей восприимчивости к антибиотику. Одной из многих функций нормальной микробиоты является способность противостоять инфекции патогенными организмами, называемая «резистентностью к колонизации» 9, 10. Например, потеря субпопуляции нормальной микробиоты может привести к потере способности нарушать пуховые волокна и крахмалы в абсорбируемые короткоцепочечные жирные кислоты, что приводит к высокому уровню непереваренных углеводов, которые могут вызвать диарею.11 Было показано, что нарушение нормальной микробиоты приводит к более высокому уровню инфекций в других системах организма, помимо кишечного тракта, включая кожу, 12, 13 влагалище, 14, 15 дыхательные пути, 16, 17 и ротовую полость18. –20
Основной проблемой при установлении причин и следствий улучшения дисбактериоза пробиотиками является отсутствие стандартного определения «нормальной» микробиоты. Виды микробов, присутствующих в разных нишах тела, существенно различаются между индивидуумами, которые также зависят от возраста, географического района и состояния здоровья хозяина.Кроме того, полный учет микробиоты в настоящее время невозможен, поскольку нет анализов для обнаружения всех> 10 13 –10 14 организмов в кишечнике, а стандартные методы микробного культивирования пропускают 75–95% этих организмов. 21, 22 Развитие метагеномики (каталогизация профилей индивидуальных и специфичных для болезней бактериальных генов) и создание международного проекта «Микробиом человека» открыли новую эру в нашем понимании сложности этих взаимодействий в организме.23, 24 Этот сдвиг парадигмы от культивирования к метагеномному анализу расширил наши возможности документировать изменения микробных популяций до беспрецедентной степени, но интерпретация этих сдвигов продолжает оставаться предметом дискуссий.25-28 С появлением этих новых метагеномных инструментов, пересматривается роль пробиотиков в восстановлении нормальной микробиоты.29
В свете новых руководящих документов и рекомендаций цель этого систематического обзора состоит в том, чтобы определить, как требования по восстановлению нормальной микробиоты и коррекции дисбактериоза изучались с помощью хорошо спланированных испытаний и какие штаммы пробиотиков имеют доказательные данные. чтобы поддержать эти утверждения.
Методы
Цель исследования
Систематический обзор литературы для анализа доказательств того, что пробиотики могут исправить дисбактериоз нормальной микробиоты по результатам рандомизированных контролируемых испытаний.
Стратегия поиска
Поисковые запросы включали: пробиотики + заявления о здоровье, восстановление нормальной микробиоты, дисбиоз, нормальная микробиота, фармакокинетика, метагеномика, пробиотики, пищевые добавки, рандомизированные контролируемые исследования, AAD, Clostridium difficile, инфекция (CDI), воспалительное заболевание кишечника (IBD), синдром раздраженного кишечника (СРК), диарея путешественника (TD), ликвидация Heliobacter pylori, бактериального вагиноза (BV) или вагинита, лечение острой детской диареи и использование определенных пробиотических штаммов или продуктов.Первоначально стратегии поиска были широкими, а затем сузились до клинических испытаний пробиотиков.
Источники данных
PubMed (1985–2013), EMBASE (1985–2013), Кокрановская база данных систематических обзоров (1990–2013), CINAHL (1985–2013), AMED (1985–2013) и ISI Web of Science (2000–2013). Был проведен поиск по трем онлайновым регистрам клинических испытаний: Кокрановскому центральному регистру контролируемых испытаний (http://www.cochrane.org), метарегистру контролируемых испытаний (http://www.controlled-trials.com/mrct) и Национальным институтам здравоохранения. (http: // www.Clinicaltrials.gov).
Критерии отбора исследований и извлечения данных
Отрывки из всех цитат были рассмотрены одним автором и оценены для включения в рандомизированные контролируемые испытания пробиотических препаратов. Полные статьи были извлечены, если были упомянуты нормальные анализы микробиоты. Испытания на языках, отличных от английского, переводились и включались, когда это было возможно. Критерии исключения включали доклинические исследования (модели на животных или анализы in vitro), исследования безопасности или фазы 2, обзоры, испытания эффективности без анализов для нормальных видов микробиоты, только метагеномные методы, механизм действия нормальной микробиоты или пробиотика, перекрестные исследования, отчеты о случаях или серии случаев, повторяющиеся отчеты или исследования неуказанных типов пробиотиков.Были рассмотрены все фармакокинетические исследования на людях, поскольку в их рефератах часто не указывались данные нормального анализа микробиоты. Процесс извлечения данных и обзора осуществлялся в соответствии с руководящими принципами заявления о предпочтительных элементах отчетности для систематических обзоров и метаанализов (PRISMA) с использованием контрольного списка из 27 пунктов и блок-схемы.30 Для сбора данных о пробиотике (тип штамма) использовалась стандартизированная форма извлечения данных. , суточная доза, продолжительность), тип контроля (плацебо, активное лечение или отсутствие лечения), дизайн исследования (состояние микробиоты в исходное время и время последующего наблюдения), тип анализа микробиоты (микробное культивирование, молекулярные биомаркеры и т. д.), включенное исследование популяция (взрослые и дети, здоровые добровольцы, болезненное состояние), тип и время действия деструктивного агента (антибиотики, химиотерапия и т. д.), размер и отсев исследования, оценка результатов (эффективность и / или статус микробиоты в конце исследования, нежелательные явления) и вид заявления о состоянии здоровья.
Результаты и определения
Первичный результат — это степень коррекции или улучшения микробиоты с помощью определенного (ых) пробиотического штамма (ов). Вторичный результат — это связь между степенью коррекции дисбиоза и чистой эффективностью, обнаруженной в рандомизированных контролируемых испытаниях пробиотических вмешательств. Дисбиоз определяется как изменение или нарушение нормальной микробиоты (бактериальные или грибковые виды) из-за воздействия разрушающего фактора (например, антибиотиков, хронических заболеваний, стресса, медицинских процедур или лекарств и т. Д.).Поскольку в настоящее время не существует стандартного определения «нормальной» микробиоты, для этого обзора восстановление нормальной микробиоты определяется как возвращение к анализируемым видам или профилю микробов, полученным у здорового человека (до того, как произойдет разрушительное событие). Включенные исследования должны иметь по крайней мере анализ лечения препробиотиками и анализ лечения постпробиотиками. В течение периода поиска (1985–2013) было доступно множество микробных анализов, включая документирование микробиоты либо с помощью микробных культур, либо с помощью метагеномных методов (нацеленные на 16s рРНК зонды с использованием флуоресцентной гибридизации in situ (FISH) или другого метода ПЦР) 8, 21, 28, 31 или косвенными методами (по шкале Ньюджента).15 баллов по шкале Ньюджента (от 0 до 10) используются для диагностики бактериального вагиноза (баллы ≥7) или нормальной микробиоты влагалища (баллы 0–3) на основе количественных морфотипов малых грамотрицательных палочек ( Gardnerella vaginalis / bacteroides spp) и изогнутые грамотрицательные палочки ( Mobiluncus spp), полученные при окраске по Граму мазков из влагалищных выделений. Микробиологические анализы только штаммов, содержащихся в пробиотическом продукте, считаются фармакокинетическими исследованиями и не включаются в профили нормальной микробиоты.
Модели дисбактериоза
Для определения воздействия на нормальную микробиоту были включены только прямые свидетельства изменения микробиоты (виды, профили, индексы разнообразия или диагностические критерии), а косвенные эффекты были исключены (изменения кишечных ферментов, параметров иммунной системы или симптомов заболевания). Степень улучшения дисбактериоза подразделяется на три уровня: (1) восстановление нормальной микробиоты до исходного уровня; (2) изменение или улучшение нормальной микробиоты; и (3) отсутствие изменений нормальной микробиоты.
Литература содержала три модели дисбиоза: модель A (восстановление нормальной микробиоты), в которой анализировали пациентов, зарегистрированных со здоровой, ненарушенной микробиотой, а затем снова анализировали после разрушительного события (такого как воздействие антибиотиков) и терапии пробиотиками; модель B (изменение микробиоты) исследовала пациентов с уже существующей нарушенной микробиотой (например, уже существующее хроническое заболевание или активное заболевание), а затем после пробиотической терапии; Модель C (без дисбактериоза) тестировала добровольцев без разрушительного события (до или во время клинического испытания) как в препробиотическое, так и в постпробиотическое время, как показано на рисунке 1.«Восстановление» нормальной микробиоты определяется как восстановление микробиоты до нормального здорового исходного уровня. Восстановление может быть полным (все проанализированные уровни микробов вернулись к исходному уровню) или неполным восстановлением (частичное восстановление некоторых штаммов микробов, но не все вернулись к исходным уровням). В исследованиях, в которых участвовали участники с дисбактериозом на исходном уровне (обычно из-за хронических заболеваний), невозможно показать восстановление нормального уровня микробиоты, потому что нормальная, ненарушенная микробиота не присутствовала у этих типов участников исследования на момент включения в исследование.Таким образом, наиболее веские аргументы в пользу конструкции модели B — это «изменение или улучшение» микробиоты. В этой статье были проанализированы только данные участников, подвергшихся воздействию пробиотиков. Данные контрольных групп использовались для подтверждения дисбактериоза у участников с хроническими заболеваниями или после разрушительного воздействия, такого как антибиотики или химиотерапия, не затронутых воздействием пробиотиков.32–34
Рис. 1Временная последовательность событий и три модели дизайна исследования, определяющие три различные степени коррекции дисбактериоза пробиотиками.
Оценка методологической прочности и качества
Система GRADE (классификация рекомендаций, оценка, разработка и оценка) для оценки общего качества исследования будет использоваться для каждого пробиотического штамма или типа (отдельные штаммы и смеси штаммов) .35 Рекомендация в поддержку заявления о каждом пробиотическом штамме. или смесь могут быть оценены по общей силе доказательств («сильные», многие рандомизированные контролируемые испытания показывают значительное восстановление микробиоты, или «умеренные» — только одно рандомизированное контролируемое испытание; или «слабые», только серии случаев или отчеты, ограниченное количество малых испытаний и т. д.).
Качество доказательств основано на дизайне исследования и оценивается как «высокое качество» (четко определенный дизайн исследования для определения восстановления при нормальной микробиоте, модель A) или «среднее качество» (нарушение микробиоты на исходном уровне, модель B) или «низкое качество» (нарушение работы не произошло, модель C). Измерение систематической ошибки публикации в этом обзоре не оценивалось, поскольку объединенные оценки эффективности результатов не проводились, что типично для метаанализа, но все исследования с анализами микробиоты были включены для ограничения систематической ошибки.
Рейтинг чистой эффективности
Чтобы определить, связана ли способность корректировать дисбактериоз с клинической эффективностью, используйте опубликованную литературу для рандомизированных контролируемых исследований (РКИ) или мета-анализы пробиотиков для различных показаний заболевания, включая AAD, 5, 36, 37 CDI, 5, 38 IBD , 39 IBS, 40 TD, 41 эрадикация H. pylori , 36, 37 BV42 и лечение острой детской диареи были рассмотрены.43–45 Чистый рейтинг был рассчитан путем вычитания количества РКИ, показавших незначительную или эквивалентную эффективность из числа РКИ, показавших значительную эффективность.Ранги были разделены на следующие категории: ++, ≥2 чистых РКИ, показывающих значительную эффективность; +, чистых РКИ, показывающих значительную эффективность; 0, равное количество РКИ, показывающих значимые и незначимые результаты эффективности, и -, ≥1 чистое отрицательное или незначимое РКИ. Пробиотики, не прошедшие РКИ, не оценивались.
Результаты
Обзор литературы за 1985–2013 гг. Обнаружил 353 статьи, посвященные лечению пробиотиками и их потенциальному влиянию на нормальную микробиоту.
Исключенные исследования
Как показано на рисунке 2, в общей сложности 272 статьи были исключены по следующим причинам: обзоры (n = 116), исследования эффективности пробиотиков без данных о нормальных анализах микробиоты (n = 54), модели пробиотиков на животных и изменения микробиоты. (n = 38), только метагеномные методы или методы микробиоты (n = 17), исследования нормальной микробиоты, но без использования пробиотиков (n = 14), анализы микробиоты in vitro (n = 10), дублирующие отчеты (n = 2 ) или разные (n = 21), которые включали исследования механизма действия пробиотиков, исследования безопасности, дублирующие отчеты, перекрестные исследования и два с плохо описанными пробиотическими вмешательствами.46, 47 В общей сложности была рассмотрена 81 полная статья, в которой упоминались изменения в нормальной микробиоте или указывались на полезность пробиотиков и их влияние на нормальную микробиоту.
Рис. 2Блок-схема результатов обзора литературы (1985–2013) включенных и исключенных исследований по восстановлению или улучшению нормальной микробиоты с помощью пробиотиков. РКИ — рандомизированные контролируемые испытания; МОА, механизм действия; НМ, нормальная микробиота.
Фармакокинетические исследования пробиотиков (n = 18), в которых сообщалось о концентрациях пробиотических штаммов до и после лечения, но не анализировались на другие виды нормальной микробиоты, были исключены.Хотя в нескольких исследованиях, использующих этот дизайн исследования, утверждается, что пробиотики оказали влияние на нормальную микробиоту, тип полученных данных — это фармакокинетическое поведение самих пробиотиков, а не нормальная микробиота. Несколько исследований заявили, что нормальная микробиота была изменена, потому что после введения пробиотиков наблюдалось увеличение количества различных видов бактерий, но проанализированные виды были теми, которые содержались в пробиотическом продукте, поэтому это увеличение не является неожиданным. Фармакокинетические исследования документально подтвердили, что пробиотические штаммы, принимаемые перорально, могут выжить при прохождении через кишечный тракт с уровнем выделения с фекалиями от <1% до 22%.48, 49 Эти фармакокинетические исследования были исключены из этого анализа, поскольку они не тестировали другие типы нормальной микробиоты, не обнаруженные в пробиотическом продукте.
Включенные исследования
Из 63 включенных клинических испытаний пять испытаний включали несколько групп лечения, в результате чего в общей сложности было проанализировано 69 групп лечения. Engelbrektson и др. 50 протестировали смесь из пяти штаммов пробиотиков на добровольцах, подвергшихся воздействию антибиотиков, а также протестировали смесь из четырех штаммов пробиотиков на здоровых добровольцах, не подвергавшихся воздействию антибиотиков.Zoppi и др. 51 использовали восемь различных групп лечения в своем исследовании, и в наш анализ были включены группы пробиотиков (только Saccharomyces boulardii и только Lactobacillus rhamnosus GG ), смесь двух пробиотиков ( L. acidophilus и Bifido bifidum ) и смесь трех пробиотических штаммов ( L. acidophilus, L. rhamnosus и B. bifidum ). Orrhage et al., 52 использовали две группы лечения (только Bifido longum и смесь B.longum и L. acidophilus ). Ларсен и др. 53 тестировали два отдельных пробиотика ( B. lactis и L. acidophilus ) в разных группах лечения. Lidbeck и др. 54 давали либо эноксацин, либо клиндамицин и рандомизировали пациентов либо к L. acidophilus , либо к плацебо.
Нормальные методы анализа микробиоты
Из 69 лечебных групп, в которых проводились нормальные анализы микробиоты, для профилирования микробиоты использовались различные методы.Во многих исследованиях использовались только стандартные микробиологические анализы культур (37, 54%), в то время как в других (28, 40%) использовались методы обнаружения некультивируемых бактериальных штаммов, которые включали метагеномные анализы (FISH, TRFLP, секвенирование 16 s рРНК) или другие ПЦР. техники. В некоторых исследованиях (4,6%) использовалась косвенная оценка нормальной микробиоты с использованием шкалы Ньюджента для диагностики бактериального вагиноза, которая основывается на окрашивании по Граму вагинальных выделений, pH влагалища и симптомах для определения наличия или отсутствия нормальной микробиоты.15
Штаммы пробиотиков
В 69 группах лечения большинство (36, 52%) использовали один штамм пробиотика, в то время как 14 (20%) тестировали смесь двух пробиотических штаммов и 19 (28%) тестировали смесь трех или более пробиотических штаммов. Распределение пробиотиков с одним штаммом по сравнению с множественными пробиотиками незначительно варьировалось в зависимости от модели дизайна исследования (= 2,3, p = 0,32). Из 15 групп реставрационного исследования (модель A) 47% использовали один штамм пробиотика и 53% использовали несколько штаммов. Из 25 групп лечения с нарушенной микробиотой на исходном уровне (модель B) 44% использовали один штамм и 56% использовали несколько штаммов.Из 29 групп исследования с неповрежденной микробиотой (модель C) 62% использовали один штамм и 38% использовали несколько штаммов.
Модель восстановления нормальной микробиоты (модель A)
Было найдено только 10 исследований (с 15 группами лечения) с использованием модели А для определения восстановления микробиоты (таблица 1) .32, 34, 50–52, 54–58 Тип включенных участников варьировался от здоровых добровольцев до детей с нелеченными респираторные инфекции, педиатрическим онкологическим больным. Для участников с острыми инфекциями или раком базовые анализы проводились перед разрушающим агентом (антибиотиками или химиотерапией).Число участников, получавших пробиотики, составляло в среднем 20 на исследование и варьировалось от 5 до 83. В 93% разрушающим фактором было воздействие антибиотиков, а в одном исследовании химиотерапия вызвала нарушение микробиоты. Только 8 (53%) групп исследования выполнили анализ в течение периода наблюдения 1–8 недель после прекращения приема пробиотика.
Таблица 1Доказательные данные о восстановлении нормальной микробиоты (НМ) для 12 пробиотиков из 10 исследований (15 групп лечения; модель A)
Анализ пробиотических штаммов по отдельности выявил только два пробиотических продукта в более чем одном рандомизированном контролируемом исследовании.Пробиотическая смесь L. acidophilus и B. bifidum показала полное восстановление в одном исследовании и только частичное восстановление в другом (сила: сильная, качество: высокое). Пробиотическая смесь L. acidophilus (2 штамма) с B. bifidum и B. animalis показала полное восстановление в одном исследовании, но только частичное восстановление в другом (сила: сильная, качество: высокое). Пять других пробиотических продуктов только в одном подтверждающем клиническом исследовании показали восстановление микробиоты ( B.longum , Clost. butyricum , L. acidophilus , смесь L. acidophilus с L. paracasei и B. lactis и смесь L. acidophilus с L. paracasei и B. bifidum и два штамма B. lactis ; Прочность: умеренная, Качество: высокое). Три пробиотических продукта с одним подтверждающим клиническим испытанием показали частичное восстановление ( S. boulardii , L. rhamnosus GG, смесь L.rhamnosus с L. bifidus и L. acidophilus ; Прочность: умеренная, Качество: высокое). Только два пробиотических продукта с использованием модели A не показали изменений в микробиоте ( B. breve и смесь L. acidophilus и B. longum ; сила: умеренная, качество: высокое). Таким образом, 10 из 12 (83%) пробиотических продуктов показали полное или частичное восстановление нормальной микробиоты.
Из 11 пробиотических продуктов с заявлением о «восстановлении или улучшении нормальной микробиоты» 10 (91%) были поддержаны этим обзором, но только семь показали полное восстановление, а пять — частичное восстановление микробиоты (таблица 1).Смесь L. acidophilus и B. longum не показала никаких изменений в микробиоте. Wada и др. 32 заявили, что B. breve «усилены кишечными анаэробами», но это сравнивалось только с группой плацебо. Их данные показали, что химиотерапия является разрушительным событием, приводящим к увеличению количества энтеробактерий в кишечнике в группе плацебо, но к концу 8-недельного периода наблюдения в группе пробиотиков или плацебо не наблюдалось значительных различий по сравнению с исходной микробиотой. уровни.
Нарушение нормальной микробиоты при исходных исследованиях (модель B)
Двадцать четыре исследования (с 25 группами лечения) использовали модель B, в которую были включены участники с ранее существовавшей нарушенной микробиотой, связанной с текущим заболеванием или состояниями (таблица 2) .33, 53, 59–80 Среднее количество участников, получавших пробиотики, составляло 23 ± 16 / исследование и варьировались от 7 до 83 участников. Типы ранее существовавших факторов, нарушающих микробиоту, включали пациентов с атопическим дерматитом, аллергии, цирроз, бактериальный вагиноз, синдром раздраженного кишечника, воспалительные заболевания кишечника (язвенный колит и поучит), идиопатическую диарею, энтеральное питание, синдром короткой кишки и рак толстой кишки. .Только 10 (40%) групп исследования проводили анализ в течение периода последующего постпробиотического наблюдения.
Таблица 2Доказательные данные по улучшению или изменению нормальной микробиоты (NM) в 18 пробиотиках из 24 исследований (25 групп лечения) с нарушенной микробиотой на исходном уровне (модель B)
Три пробиотика прошли несколько клинических испытаний, чтобы подтвердить утверждение об улучшении микробиоты за счет пробиотика. S. boulardii использовался в двух испытаниях либо с пациентами с энтеральным питанием, либо с пациентами с активной диареей и обнаружил улучшение привычной микробиоты у пациентов с активной диареей, 66 но продемонстрировал только косвенные доказательства изменений короткоцепочечных жирных кислот в другое исследование65 (Сила: сильная, Качество: умеренное).Смесь из четырех пробиотических штаммов (2 штамма: L. rhamnosus , P. freudenreichii + B. breve ) показала улучшение микробиоты в двух клинических испытаниях74, 75 (сила: сильная, качество: умеренная). Из четырех клинических испытаний смеси семи пробиотических штаммов, два не показали значительных изменений в микробиоте, 77, 78 одно показало, что постпробиотическая обработка больше анаэробами79, а одно обнаружило уменьшение количества видов бактероидов80 (сила: сильная, качество: умеренная). В трех клинических испытаниях было установлено, что не было значительных изменений в связи с Lactobacillus plantarum 299v62–64 (сила: сильная, качество: умеренное).Из этих пробиотиков только одно подтверждающее клиническое испытание (сила: умеренная, качество: умеренное), два отдельных пробиотических штамма ( E. coli Nissle и L. casei rhamnosus ) и пять различных смесей пробиотических штаммов подтверждают утверждение о том, что пробиотик изменяет микробиоту (таблица 2). Таким образом, 10 из 18 (56%) пробиотических продуктов изменили или улучшили микробиоту у людей с ранее существовавшим заболеванием.
Из 25 лечебных групп утверждение статьи было подтверждено в 14 (56%) исследованиях.Не было значительных изменений микробиоты из-за пробиотика в девяти группах лечения и только изменение микробиоты в пяти других (таблица 2). Наш обзор не согласился с заявленными результатами в 11 (46%) других группах лечения. В семи группах лечения было заявлено, что тестируемый пробиотик «восстановил нормальную микробиоту», но неясно, как был сделан этот вывод, поскольку не было времени, когда нормальная неповрежденная микробиота присутствовала. Из семи исследований, в которых утверждалось, что их пробиотики «восстановили» нормальную микробиоту, наш анализ показал, что ни одно не способно документально подтвердить восстановление, но подтверждено, что пробиотики улучшили или изменили микробиоту в этих исследованиях.В четырех исследованиях утверждалось, что пробиотик «изменил или улучшил» нормальную микробиоту, но в этом обзоре не было обнаружено значительных различий при сравнении постпробиотических и исходных анализов для групп пробиотиков. Girard-Pipau и др. 65 пришли к выводу, что S. boulardii «изменил нормальную флору», потому что в группе пробиотиков было обнаружено больше грамположительных анаэробов по сравнению с контрольной группой, а в группе наблюдалось увеличение трех короткоцепочечных жирных кислот. S. boulardii группа.Однако, когда анализ ограничивается тенденциями, наблюдаемыми только в группе пробиотиков, не наблюдалось значительных различий в профилях микробиоты препробиотиков и постпробиотиков. Вентури и др. 77 пришли к выводу, что смесь из семи пробиотических штаммов увеличивает концентрацию некоторых полезных штаммов в кишечнике. Однако единственными штаммами, у которых наблюдалось значительное увеличение, были штаммы, содержащиеся в смеси пробиотиков, а не конкретно нормальная микробиота хозяина. Поскольку это исследование не имело исходного уровня микробиоты, увеличенное количество лактобацилл и бифидобактерий могло не отражать их нормальные уровни.Van der Aa и др. 59 утверждали, что B. breve «успешно модулирует кишечную флору», но при сравнении исходного уровня с уровнем постпробиотика не наблюдалось значительных изменений в группе пробиотиков. Odamaki и др. 33 действительно показали увеличение Faecalibacterium spp и Bacteroides fragilis spp в конце лечения B. longum BB536, но такое же увеличение наблюдалось и в группе плацебо.
Непрерывные исследования нормальной микробиоты (модель C)
В 29 испытаний были включены здоровые взрослые люди, у которых во время исследования не присутствовал деструктивный фактор (отсутствие антибиотиков, отсутствие лекарств или наличие острого или хронического заболевания), которые могли бы повлиять на нормальную микробиоту, как показано в таблице 3.14, 49, 50, 81–106. Среднее количество участников, получавших пробиотики, составляло 23 человека в исследовании и варьировалось от 7 до 160 в исследовании. Из 29 групп исследования анализы проводились в течение периода наблюдения только в 52%. Fujiwara и др. 84 культивировали семь здоровых добровольцев и обнаружили энтеробактерии и клостридиальных видов после B. longum , снизился на 10 1 / г по сравнению с исходным уровнем (p <0,03), но никаких других изменений в микробиоте не произошло. были обнаружены. Karlsson и др. 94 обнаружили значительное увеличение кишечного разнообразия у девяти добровольцев мужского пола с атеросклерозом, получавших L.plantarum 299v, но поскольку тесты полиморфизма длин концевых рестрикционных фрагментов использовались вместо культур для видов бактерий, специфические изменения в видах микробиоты не могли быть определены. Ян и Шеу культивировали 63 ребенка (55% с Helicobacter pylori ), получавших йогурт с L. acidophilus и B. lactis , но обнаружили только снижение количества E. coli в H.pylori отрицательных. в подгруппе детей, существенных изменений нормальной микробиоты у H.pylori -положительные дети.100 Кубота и др. 103 проанализировали 29 участников с аллергией на пыльцу японского кедра и обнаружили, что молоко, ферментированное с использованием L. rhamnosus GG и L. gasseri TMC0356, подавляло изменения микробиоты (меньше изменений кишечного профиля), но не удалось определить изменения конкретных видов бактерий из-за используемого типа анализа (FISH и TRFLP) .103 Таким образом, только 4 из 19 (21%) пробиотических продуктов изменили микробиоту у здоровых людей, у которых не было разрушительного события.
Таблица 3Модель C: Доказательные данные по улучшению или изменению нормальной микробиоты (NM) в 19 пробиотиках у здоровых добровольцев, включенных в 29 исследований (29 лечебных групп) в исследованиях без разрушительного воздействия
Из семи исследований, в которых утверждалось, что их пробиотики «восстанавливают или изменяют» нормальную микробиоту, только четыре утверждения были подтверждены. Сьерра и др. 96 заявили, что Lactobacillus salivarius дали 20 здоровым взрослым «улучшенная микробиота кишечника», но были обнаружены только повышенные уровни лактобацилл и никаких других изменений у нормальных видов микробиоты обнаружено не было.Единственное другое свидетельство было косвенным из наблюдаемых изменений иммунных параметров. He и др. 99 заявили о смеси B. longum и B. animalis «модифицированной» микробиоты, но изменения наблюдались только во время приема йогурта, а не после периода наблюдения в течение 1 недели. Витали и др. 14 утверждали, что смесь из четырех штаммов лактобактерий и трех штаммов бифидобактерий «модулировала вагинальную микробиоту», но единственные значительные изменения были связаны с увеличением количества видов бактерий, содержащихся в смеси пробиотиков.
из пробиотиков, подтвержденных многочисленными клиническими испытаниями ( B. animalis , B. longum , L. casei , L. plantarum 299v, смесь B. animalis и B. lactis ), 13 испытаний (87%) подтверждают отсутствие значительных изменений нормальной микробиоты, если микробиота не нарушена (сила: сильная, качество: низкое).
Ассоциация клинической эффективности и восстановления нормальной микробиоты
В нескольких исследованиях одновременно сравнивалась клиническая эффективность и способность восстанавливать или улучшать нормальную микробиоту после дисбактериоза.Был проведен синтез литературы по РКИ по восьми распространенным показаниям болезни, и была оценена общая сила сети. Эффективность пробиотиков, способных восстанавливать нормальную микробиоту, часто подтверждалась РКИ, как показано в таблице 4. Из 10 пробиотиков с доказательствами восстановления 7 (70%) также прошли по крайней мере одно РКИ по крайней мере для одного из восьми. болезней, в то время как 30% не имели поддерживающих РКИ по эффективности. Из семи пробиотиков, включенных в ассоциированные РКИ, только два пробиотика ( S.boulardii и L. acidophilus ) имеют убедительные доказательства эффективности при большинстве показаний к заболеваниям, тогда как пять пробиотиков, способных восстанавливать микробиоту, имели слабые доказательства эффективности или отсутствовали. Например, S. boulardii , у которого есть исследования, поддерживающие восстановление, имеет убедительные доказательства клинической эффективности для AAD (рейтинг ++: 11 РКИ имели значимые результаты, а 6 имели незначительные результаты), CDI (рейтинг ++: было два РКИ со значительными результатами. ), IBD (с рейтингом ++: было два РКИ со значительными результатами), IBS (с рейтингом 0: было одно РКИ со значительной эффективностью и одно РКИ с незначительными результатами), TD (рейтинг +: 3 РКИ со значительной эффективностью и 2 с незначительными результатами. эффективность), H.pylori (ранжирование -: 2 РКИ со значительными результатами и 4 с незначительными результатами) и отсутствие исследований на BV. L. acidophilus , который частично восстановил микробиоту в исследовании, связан с клинической эффективностью в отношении AAD, IBS и BV, но не в отношении TD или ликвидации H. pylori и лечения острой детской диареи (рейтинг ++: имел 19 РКИ со значительной защитой и пять с незначительными результатами). Напротив, L. rhamnosus GG, другой пробиотик, способный восстанавливать микробиоту, часто упоминается в метаанализе как имеющий значительную эффективность в отношении ААД.Наши результаты обновленного обзора литературы указывают на чистую слабую оценку клинической эффективности по всем показаниям болезни: AAD (оценено -: 3 РКИ имели значимые результаты, а 6 — незначительные результаты), CDI (ранжировано -: два РКИ с несущественные результаты), IBD (ранг -: одно РКИ с несущественными результатами), IBS (оценка 0: 2 РКИ со значительной эффективностью и два РКИ с незначительными результатами), TD (ранг 0: одно РКИ со значительной эффективностью и один с незначительной эффективностью), H.pylori (рейтинг -: 3 РКИ с незначительными результатами), отсутствие РКИ по БВ и лечению острой детской диареи (рейтинг ++: 10 РКИ со значительной эффективностью и одно с незначительными результатами).
Таблица 4Сравнение способности пробиотика восстанавливать или улучшать дисбактериоз с ранжированной клинической эффективностью при различных показаниях заболевания
Испытания эффективности не проводились так часто для пробиотиков, которые, как было показано, способны только изменять или улучшать, но не восстанавливать микробиоту после дисбактериоза.Из девяти пробиотиков, которые могут изменять микробиоту, 6 (67%) имели поддерживающие РКИ по крайней мере для одного заболевания, но разнообразие исследованных заболеваний было более ограниченным. L. casei имел умеренную сетчатую силу для AAD и бактериального вагиноза, но был нейтральным для способности уничтожить H. pylori. и другие показания к болезни не тестировались в РКИ с L. casei . Пробиотическая смесь L. reuteri и L. fermentum имеет убедительные доказательства бактериального вагиноза, но не имеет никаких других показаний, перечисленных в таблице 4.
Из восьми пробиотиков, не способных изменять или восстанавливать нормальную микробиоту, только L. plantarum 299v имели РКИ на ААД и СРК, оба с чистой отрицательной или слабой клинической эффективностью. B. lactis и смесь L. rhamnosus и L. reuteri имели чистую нейтральную оценку эффективности для лечения острой детской диареи. Для других четырех пробиотических продуктов, не влияющих на нормальную микробиоту, не было РКИ клинической эффективности.В исследованиях с использованием Bacillus clausii не проводился анализ на нормальную микробиоту, и были получены незначительные результаты испытаний по искоренению H. pylori и лечению детской диареи.
Из шести пробиотиков с данными только о фармакокинетике самого пробиотика и без других исследований других нормальных штаммов микробиоты, пять имели РКИ, показывающие различную чистую эффективность при различных показаниях, как показано в таблице 4.
Шесть популярных пробиотиков ( B.clausii , B. infantis , L. reuteri , L. acidophilus + L. helveticus , L. acidophilus + L. casei и L. acidophilus + B. animalis ) имеют только РКИ клинической эффективности, но не опубликовали исследования, посвященные их роли в восстановлении или улучшении нормальной микробиоты.
Обсуждение
Разработка и оценка заявлений о здоровье или функциональности пробиотиков — важный вопрос, который в настоящее время определен в качестве приоритетного для исследований несколькими международными организациями, включая Всемирную гастроэнтерологическую организацию107 и Американское общество питания.2 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США борется с обоснованными утверждениями о пользе для здоровья пробиотических продуктов и в настоящее время рекомендует использовать утверждения о структуре / функции, такие как «поддерживает регулярность кишечника», но утверждение о восстановлении нормальной микробиоты все еще обсуждается. 108 Европейское управление по безопасности пищевых продуктов (EFSA) предоставляет руководящие материалы, которые рекомендуют, чтобы заявления о здоровье или функциональности пробиотиков имели положительный физиологический эффект и имели соответствующие научные испытания для подтверждения заявлений о пользе для здоровья.3 Приемлемые утверждения о здоровье кишечника могут включать функциональные утверждения (улучшенное время прохождения, более мягкая консистенция стула, уменьшение желудочно-кишечного дискомфорта, защита от патогенов). Поскольку в настоящее время невозможно определить стандартный профиль нормальной микробиоты, EFSA рекомендует, чтобы функциональные заявления о восстановлении нормальной микробиоты документировали восстановление здоровой микробиоты и сопровождались благоприятным физиологическим или клиническим результатом. и механизмы зависят от штамма и могут варьироваться в зависимости от штамма пробиотика, доказательства должны анализироваться для каждого пробиотического продукта индивидуально.5, 6, 9, 109 — 112
Недооцененным открытием было влияние дизайна исследования и исследуемых групп на интерпретацию результатов исследования. В литературе обычно встречаются пять различных типов дизайна исследований, связанных с пробиотиками. Наиболее распространенным типом исследований является рандомизированное контролируемое испытание, в котором проверяются результаты эффективности и безопасности у пациентов, но эти испытания обычно не документируют влияние пробиотика на нормальную микробиоту. Вторым наиболее распространенным типом дизайна исследования являются фармакокинетические исследования (документирование восстановления пероральной дозы пробиотика или увеличения пробиотических штаммов после лечения по сравнению с предварительной обработкой или клиренсом пробиотика).Несмотря на то, что в этих кинетических исследованиях не проводился анализ на штаммы, не являющиеся пробиотиками, некоторые экстраполировали их результаты и пришли к выводу, что их пробиотики наблюдали некоторый эффект или улучшение нормальной микробиоты.19, 111 Эти два первых типа дизайна исследований не поддерживают доказательную базу выводы о восстановлении или изменении нормальной микробиоты и были исключены из этого обзора.
Для изучения дисбактериоза подходят три типа исследований. В первом типе исследования нормальная микробиота анализировалась как минимум дважды (на исходном уровне, то есть до воздействия разрушающего события или пробиотиков, а затем еще раз во время или после лечения пробиотиками), чтобы показать фактическое восстановление исследуемой нормальной микробиоты до здоровых исходных уровней.Второй тип дизайна исследования начался с неподходящих исходных условий (исходные образцы, взятые после того, как нормальная микробиота была нарушена хроническим заболеванием). Для пациентов с установленными хроническими заболеваниями не существует исходного уровня «нормальной микробиоты» ни в группе пробиотиков, ни в контрольной группе. Даже если исходные данные взяты во время ремиссии, на микробиоту все еще могут влиять хронические заболевания или острая диарея. Исследования пробиотиков при хронических или острых заболеваниях обычно сообщают о «пре-пробиотическом лечении» и «пост-пробиотическом лечении» и могут показывать значительные изменения в микробных видах, но неясно, отражает ли это истинное восстановление нормальных профилей микробиоты. .Третий тип дизайна исследования включал здоровых добровольцев, которым не вводили антибиотики (поэтому нормального нарушения микробиоты не происходило) и которые демонстрировали только влияние пробиотиков на здоровую микробиоту (как правило, слабые или нулевые эффекты). Контрольные группы не требовались для нашей оценки воздействия пробиотиков на микробиоту, но контрольные группы могут задокументировать степень нарушения нормальной микробиоты провоцирующими агентами (антибиотик, начало болезни и т. Д.).
Пять пробиотиков с одним штаммом ( B.longum , Clost. butyricum , L. acidophilus, L. rhamnosus и S. boulardii ) и пять пробиотических смесей (( L. acidophilus + B. bifidum) , ( L. rhamnosus + L. bifidus + L. acidophilus) , ( L. acidophilus + L. paracasei + B. lactis), (L. acidophilus , 2 штамма, B. bifidum, B. animalis) и (L . acidophilus + L. paracasei + B. bifidum + 2 штамма B.lactis )) задокументировано полное или частичное восстановление нормальной микробиоты (модель A). Только две смеси пробиотиков ((смесь 2 штаммов: L. acidophilus + B. bifidum ) и (смесь 4 штаммов: L. acidophilus , 2 штамма, B. bifidum, B. animalis )) были поддержаны подтверждающее исследование. Доказательства того, что пробиотики могут изменять или улучшать нормальную микробиоту (модель B), были обнаружены для трех пробиотиков одного штамма ( E. coli Nissle, S. boulardii и L.casei rhamnosus ) и семь смесей из 2-7 пробиотических штаммов. Из этих 10 пробиотиков, обнаруживших изменение микробиоты, только три прошли несколько испытаний: S. boulardii , смесь из четырех штаммов (2 штамма L. rhamnosus + P. Freudenreichii + B. breve ) и смесь из семи штаммов. (4 лактобациллы и 3 штамма бифидобактерий), но только у одного были стабильные результаты, свидетельствующие об улучшении микробиоты.74, 75 Очевидно, что для подтверждения воздействия пробиотика на нормальную микробиоту необходимо более одного исследования.Из 19 пробиотических штаммов (или смесей), изученных на здоровых добровольцах, которые не подвергались воздействию разрушающих факторов (модель C), никаких изменений нормальной микробиоты не наблюдалось для 79%, что указывает на устойчивость микробиоты.
Улучшение нормальной микробиоты за счет определенных штаммов пробиотиков, по-видимому, было связано с лучшими клиническими конечными точками. В рамках восьми распространенных заболеваний, обычно лечатся пробиотиками, большее количество испытаний со значительной эффективностью было связано с пробиотическими штаммами, восстанавливающими нормальную микробиоту, и только одно испытание со значительной эффективностью было обнаружено для пробиотиков, которые не влияли на микробиоту.Однако немногие пробиотики прошли испытания на эффективность при всех восьми заболеваниях, а многие не имели испытаний на эффективность.
Некоторые пробиотики, эффективность которых при различных заболеваниях опубликована, не имели исследований, изучающих влияние пробиотика на нормальную микробиоту: B. clausii , B. infantis , L. brevis , L. reuteri , смесь двух штаммов ( L. acidophilus + L. helveticus ), смесь двух штаммов ( L. acidophilus + L.casei ) или ( L. acidophilus + B. animalis ), смесь четырех штаммов ( L. rhamnosus (два штамма), P. freudenreichii + B. animalis )) и смесь семи штаммы ( L. sporogens, L. bifidum, L. bulgaricus, L. thermophilus, L. acidophilus, L. casei, L. rhamnosus) .
Сравнение результатов с другими исследованиями
Другие обзоры в литературе заявлений о пробиотиках, связанных с изменениями в нормальной микробиоте, были сосредоточены на широких вопросах нормативной стандартизации заявлений о здоровье или функциях, использовании надлежащего дизайна исследований и проблеме определения биомаркеров для «здоровой микробиоты». .3, 29, 112 Донован и др. 2 рекомендует, чтобы заявления о пользе пробиотиков для здоровья подтверждались хорошо проведенными испытаниями на людях в целевой группе населения. Эти обзоры также рекомендуют коррелировать биомаркеры кишечника с клиническими конечными точками, однако ни в одном из этих обзоров не предпринималось попыток сделать это.29, 112 В предыдущих обзорах не предпринимались попытки проанализировать связь между штаммами пробиотиков и их влиянием на нормальную микробиоту путем стратификации на качество дизайна исследования111. В этом обзоре эти проблемы были устранены путем анализа штаммов пробиотиков по качеству дизайна исследования и включения только испытаний, в которых оценивалась нормальная микробиота (либо с помощью микробного культивирования, либо с помощью биомаркеров молекулярных штаммов), а также оценивалась степень улучшения дисбактериоза с помощью клинических данных. результаты для каждого пробиотического штамма.
Возможности для будущих исследований
В большинстве исследований (80%) с использованием модели А для документирования восстановления нормальной микробиоты использовались только методы микробиологического культивирования, которые позволяют обнаруживать только те организмы, которые растут в культуре. Использование более совершенных молекулярных метагеномных методов показало, что одно культивирование пропускает до 95% этих организмов.21, 22 Использование метагеномных методов было более распространено в исследованиях с использованием модели B (48%) и модели C (45%). ) дизайн исследования, который касается только потенциального изменения микробиоты.Характеристика микробиоты — сложный вопрос, и всесторонний учет всех бактериальных и грибковых штаммов в организме выходит за рамки наших текущих возможностей. Следовательно, любые исследования изменений микробиоты в лучшем случае неполны, но общие тенденции в бактериальных филотипах могут быть задокументированы с помощью ДНК-зондов и метагеномных методов. Ошибка дифференциального обнаружения может присутствовать из-за разнообразия анализов, используемых в этих исследованиях, и должна быть учтена в будущих исследованиях.
Еще одно предложение для будущих исследований состоит в том, чтобы включить постпробиотический период в соответствующий период наблюдения.Менее половины рассмотренных исследований проводили анализы на нормальную микробиоту в течение соответствующего периода наблюдения. Как было показано, восстановление от разрушающего фактора может быть продлено (обычно 8 недель) 7, 8, и исследования, в которых не удалось обнаружить восстановление микробиоты, могли обнаружить возврат к нормальным исходным уровням, если для восстановления было уделено достаточно долгое время. произошло. Дальнейшие исследования должны быть направлены на то, чтобы дать время для восстановления нормальной микробиоты.
Поскольку действие пробиотиков зависит от штамма, и во многих исследованиях обычно указывается только род и вид тестируемого пробиотика, будущие отчеты должны включать полное описание пробиотика до уровня окрашивания.5, 112
Сильные и слабые стороны
Сильные стороны этого обзора включали полноту стратегии поиска, которая проверяла несколько баз данных цитирования, реестры испытаний и поиск авторов, использование установленных протоколов PRISMA для обзоров и использование схемы классификации результатов для различных степеней оценки микробного восстановления. Этот анализ контролировал смешанные эффекты различных исследуемых популяций и дизайнов исследований, представленных в литературе.Фармакокинетические исследования только самого пробиотического штамма (ов) были исключены, и были включены только испытания, в которых анализировали другие виды, обнаруженные в микробиоте. Применяя стандартное определение для «восстановления» и «улучшения» нормальной микробиоты, можно различать существенные различия по типу используемых дизайнов исследований и различным эффектам различных штаммов пробиотиков. Ограничения этого обзора включают: один автор проанализировал и извлек литературу, объединил испытания, проведенные в разных популяциях (взрослые и дети), а также использовались разные дозы и схемы пробиотиков.Неполный поиск всех исследований, оценивающих влияние пробиотиков на микробиоту человека, также является потенциальным ограничением любого поиска в литературе. Еще одним ограничением является то, что улучшение дисбактериоза и клиническая эффективность пробиотических штаммов также косвенно связаны, прямая причинно-следственная связь не была возможна с типами проведенных исследований. Еще одним ограничением является отсутствие в настоящее время стандартного определения того, что составляет «нормальную микробиоту». Состав микробиоты зависит от человека, возраста, географического положения и состояния здоровья хозяина.Современные микробиологические методы улучшаются, но не могут обнаружить все виды, присутствующие в организме хозяина.
.

 Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
Отвар настаивают в течение 20 минут и принимают по 100 мл три раза в день до еды.
