Организация вакцинопрофилактики в образовательных учреждениях — Бюджетное учреждение Ханты-Мансийского автономного округа — Югры
Одним из главных разделов деятельности школьных медицинских работников является прививочная работа, которая проводится согласно плану, предоставляемому прививочной картотекой ДП.
В работе медицинские работники руководствуются следующими приказами:
— Федеральный закон от 17 сентября 1998г. № 157-Ф «Об иммунопрофилактике инфекционных болезней»,
– Приказом МЗ РФ от 21 марта 2014 года № 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»;
— СП 3.3.2342-08 от 03.03.08г. «Обеспечение безопасности иммунизации»;
— СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов».
КАЛЕНДАРЬ ПРОФПРИВИВОК (приказ – 125 н)
|
ВОЗРАСТ
|
ПРИВИВКА |
ПРИМЕЧАНИЕ |
|
В ПЕРВЫЕ 24 Ч. ЖИЗНИ |
V1 — ВГВ |
|
|
3-7 ДЕНЬ |
V — БЦЖ |
|
|
1 МЕСЯЦ |
V2 — ВГВ |
|
|
2 МЕСЯЦА |
V 3 — ВГВ (ГРУППА РИСКА) V 1 – ПКИ |
(ГРУППА РИСКА) (ПНЕВМОКОККОВАЯ) |
|
3 МЕСЯЦА |
V1 —АКДС V1 — ПОЛИО — V1 — ГЕМОФИЛЬНАЯ |
(ИНАКТИВИРОВАННАЯ) (ГРУППА РИСКА) |
|
4,5 МЕСЯЦЕВ |
V2 — АКДС V2 V2 — ПОЛИО V2 — ПКИ |
(ИНАКТИВИРОВАННАЯ) |
|
6 МЕСЯЦЕВ |
V 3 — АКДС |
|
|
|
V 3 — ВГВ |
|
|
|
V 3 — ОПВ |
(ОРАЛЬНАЯ ВАКЦИНА) |
|
|
V 3 — ГЕМОФИЛЬНАЯ |
|
|
12 МЕСЯЦЕВ |
V — КПК (КОРЬ, Э/П, К/К) |
|
|
|
V 4 — ВГВ (ГРУППА РИСКА) |
(ГРУППА РИСКА)
|
|
15 МЕСЯЦЕВ (1 ГОД 3 МЕС. |
RV — ПКИ |
|
|
18 МЕСЯЦЕВ (1 ГОД 6 МЕС.) |
RV1 — ОПВ RV1 — АКДС RV — ГЕМОФИЛЬНАЯ |
|
|
20 МЕСЯЦЕВ (1 ГОД 8 МЕС.) |
RV2 — ОПВ |
|
|
6 ЛЕТ |
RV — КПК (КОРЬ, Э/П, К/К) |
|
|
6-7 ЛЕТ |
RV2 — АДСМ RV — БЦЖ |
|
|
14 ЛЕТ |
RV3 — АДСМ RV3 — ОПВ |
|
На каждую прививку родители (законные представители) несовершеннолетних в возрасте до 15 лет дают информированное согласие. С 15-ти летнего возраста информированное согласие подростки пишут сами.
В начале учебного года (сентябрь) в школе проводится массовая иммуннодиагностика туберкулёза детям с 1-го по 8-е классы, подросткам с 9-го по 11 классы иммуннодиагностика туберкулёза проводится весной (март-апрель).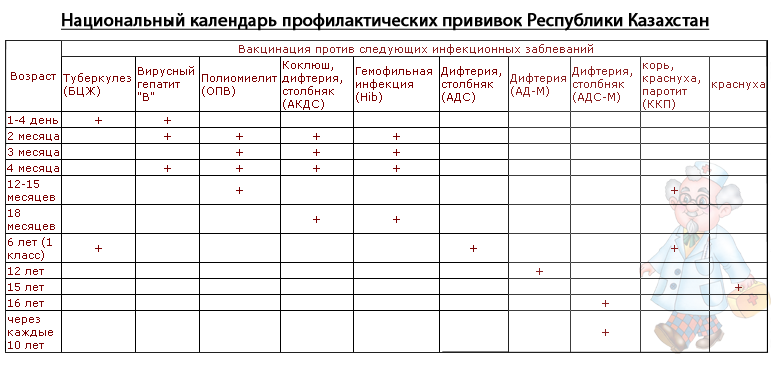
Все о вакцине против полиомиелита
Полиомиелит (детский спинномозговой паралич) — инфекционное заболевание, вызываемое вирусами полиомиелита 1,2 и 3 типов. В основном заболевание поражает детей в возрасте до 5 лет.
Полиомиелит — тяжелое заболевание, вызывающее параличи мышц, может стать причиной развития дыхательной и сердечно-сосудистой недостаточности из-за паралича межреберных и диафрагмальных мышц. Паралич дыхательных мышц нередко становится причиной летального исхода.
Передается полиомиелит фекально-оральным путем, реже – воздушно-капельным.
Профилактика полиомиелита заключается во введении вакцины.
В России прививки против полиомиелита обязательны и входят в Национальный календарь профилактических прививок, утвержденный приказом Министерства здравоохранения Российской Федерации от 21 марта 2014 г. № 125н., согласно которому всем детям первого года жизни необходимо сделать три прививки от полиомиелита. Детей начинают вакцинировать с 3х месяцев с интервалом в 6 недель (далее в 4.5 и 6 месяцев).
Существует 2 типа вакцин против полиомиелита:
Живая (ОПВ – оральная полиомиелитная вакцина) – содержит живые ослабленные вирусы 1,2,3 типов.
Инактивированная (ИПВ) – содержит убитые вирусы 1,2,3 типов.
Все дети первого года жизни вакцинируются инактивированной вакциной, которая вводится с помощью инъекции. Последующие прививки (ревакцинации) проводятся в 18, 20 месяцев и в 14 лет. Для ревакцинации используется живая вакцина, которая закапывается в рот.
Для ревакцинации используется живая вакцина, которая закапывается в рот.
Живая полиомиелитная вакцина имеет принципиальное отличие от инактивированной, которое заключается в том, что попадая в желудочно-кишечный тракт, видоизменяется, выделяясь с калом в течение 6 недель после вакцинации. Это может привести к вакциноассоциированному полиомиелиту (ВАП) как у самого привитого (в случае иммунодефицитного состояния), так среди не привитых контактных лиц.
Частота развития вакциноассоциированного полиомиелита невелика, по статистике около 10 случаев в год по стране. Приходится в основном на детей с выраженными нарушениями иммунитета и с тяжелыми хроническими заболеваниями.
В связи с тем, что дети, привитые живой полиомиелитной вакциной, выделяют вирус в окружающую среду, в организованных детских коллективах предусмотрено разобщение непривитых детей от привитых сроком на 60 дней.
Вирус, выделяясь из кишечника и носоглотки, попадает на руки, одежду, игрушки и другие предметы.
Живая полиомиелитная вакцина не применяется у детей из групп риска ( с иммунодефицитными состояниями, кишечными аномалиями), а также в случае, если в семье есть ребенок непривитый против полиомиелита.
Противопоказания к проведению вакцинации определяет только врач.
Если взрослый никогда не был привит против полиомиелита,то выезжая в страны, неблагополучные по полиомиелиту он может пройти трехкратную иммунизацию против полиомиелита. Всемирная организация здравоохранения (ВОЗ) рекомендует путешественникам в страны, эндемичные по полиомиелиту, иметь полную вакцинацию против полиомиелита.
Возможны ли побочные эффекты вакцинации?
Реакция на вакцинацию практически отсутствует. В крайне редких случаях возможно временное повышение температуры тела на 5-14 день после прививки.
Риск, связанный с побочным действием вакцины, в десятки тысяч раз меньше риска заболевания полиомиелитом.
Профилактические прививки
Когда можно делать прививки и когда нет?
Несколько важных правил вакцинации:
- Все члены семьи, человека получающего вакцину, должны быть здоровы
- При вакцинации детей, нельзя одновременно вводить новый прикорм.

- Нельзя делать прививки ребенку, у которого прорезываются зубки.
- Прививки делаются не раньше чем через месяц после выздоровления
- В случае, если у ребенка аллергия, за 3 дня до прививки начинайте принимать противоаллергические препараты (к примеру, Зиртек, Фенистил и т.д.)
- После прививки, не уходите сразу. Постарайтесь посидеть еще минут 30-40 рядом с кабинетом врача
- Не принимайте ванну в день прививк
- После прививок стоит избегать мест скопления народа, так как, вероятность заразиться выше.
КАЛЕНДАРЬ ПРИВИВОК
|
ВОЗРАСТ РЕБЕНКА |
НАИМЕНОВАНИЕ ПРИВИВКИ |
|
НОВОРОЖДЕННЫЕ В 1-ЫЕ 24 ЧАСА ЖИЗНИ |
ВАКЦИНАЦИЯ ПРОТИВ ГЕПАТИТА В ( V 1 ВГВ) |
|
НОВОРОЖДЕННЫЕ В 1-ЫЕ 3-7 ДНЕЙ ЖИЗНИ |
ВАКЦИНАЦИЯ ПРОТИВ ТУБЕРКУЛЕЗА (V БЦЖ) |
|
1 МЕСЯЦ |
ВАКЦИНАЦИЯ ПРОТИВ ГЕПАТИТА В ( V 2 ВГВ) |
|
2 МЕСЯЦА |
ВАКЦИНАЦИЯ ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ (V1) + V3 ВГВ (ГР. РИСКА) |
|
3 МЕСЯЦА |
ВАКЦИНАЦИЯ ПРОТИВ КОКЛЮША, ДИФТЕРИИ, СТОЛБНЯКА (V1 АКДС) + ПРОТИВ ПОЛИОМИЕЛИТА (V1 ИПВ) + ПРОТИВ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ (V1) |
|
4,5 МЕСЯЦА |
V2 АКДС + V2 ИПВ +V2 ПНЕВМОКОККОВОЙ ИНФЕКЦИИ + V2 ГЕМОФИЛЬНОЙ ИНФЕКЦИИ |
|
6 МЕСЯЦЕВ |
V3 АКДС + V3 ППВ +V3 ВГВ + V3 ГЕМОФИЛЬНОЙ ИНФЕКЦИИ |
|
12 МЕСЯЦЕВ |
Р. МАНТУ, ВАКЦИНАЦИЯ ПРОТВ КОРИ, ПАРОТИТА, КРАСНУХИ (V) +V4 ВГВ (ГР. РИСКА) |
|
15 МЕСЯЦЕВ |
РЕВАКЦИНАЦИЯ ПРОТИВ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ (RV) |
|
18 МЕСЯЦЕВ |
RV1 АКДС, RV1 ППВ, RV ГЕМОФИЛЬНОЙ ИНФЕКЦИИ |
|
20 МЕСЯЦЕВ |
RV2 ППВ |
|
6 ЛЕТ |
RV КОРЬ, ПАРОТИТ, КРАСНУХА |
|
6-7 ЛЕТ |
RV2 АДС-М, RV1 БЦЖ |
|
14 ЛЕТ |
RV3 АКДС, RV3 ППВ |
670042, Республика Бурятия, г. Улан-Удэ, ул. Тобольская, 155
Улан-Удэ, ул. Тобольская, 155
Адрес официального сайта: gp3uu.ru
Call-центр: 29-73-60
Детская поликлиника: 29-76-20
Женская консультация: 29-76-10
Пункт неотложной медицинской помощи с 08.00 до 20.00 (кроме воскресенья): 51-76-15 29-76-15
Зам.главного врача по оказанию медицинской помощи детскому населению: 55-60-48
Зам.главного врача по контролю качества и безопасности медицинской деятельности: 29-73-69
Горячая линия: 69-00-41
Одним из важнейших мероприятий, предпринимаемых для сохранения и укрепления здоровья детей, является организация и проведение профилактических прививок.
Вакцинация — это самое эффективное и экономически выгодное средство защиты против инфекционных болезней, известное современной медицине.
ИНФЕКЦИИ, ОТ КОТОРЫХ МОЖНО ЗАЩИТИТЬ ДЕТЕЙ ПУТЕМ ВАКЦИНАЦИИ
Полиомиелит — заболевание, поражающее ЦНС, в первую очередь спинной мозг, и приводит к развитию параличей, приводящих к инвалидизации.
Гепатит «В» -заболевание, характеризующееся воспалительным поражением печени. Перенесенный в раннем возрасте вирусный гепатит «В» в 50-90% случаев переходит в хроническую форму, приводящую в дальнейшем к циррозу печени и первичному раку печени.
Туберкулез — заболевание поражает легкие и бронхи, однако возможно поражение и др. органов. При туберкулезе возможно развитие генерализованных форм, в т.ч. и туберкулезного менингита, устойчивых к противотуберкулезным препаратам.
Коклюш — заболевание дыхательных путей. Серьезным осложнением является энцефалопатия, которая вследствие судорог, может привести к смерти или оставить после себя стойкие повреждения, глухоту или эпилептические приступы.
Дифтерия -заболевание, характеризующееся токсическим поражением организма, преимущественно сердечно-сосудистой и нервной систем, а также местным воспалительным процессом с образованием фибринного налета. Возможны такие осложнения как инфекционно-токсический шок, миокардиты, полиневриты, включая поражение черепных и периферических нервов, поражение надпочечников, токсический невроз.
Возможны такие осложнения как инфекционно-токсический шок, миокардиты, полиневриты, включая поражение черепных и периферических нервов, поражение надпочечников, токсический невроз.
Столбняк — поражает нервную систему и сопровождается высокой летальностью вследствие паралича дыхания и сердечной мышцы.
Корь — заболевание может вызвать развитие отита, пневмонии, не поддающей антибиотикотерапии, энцефалит. Риск тяжелых осложнений и смерти особенно велик у маленьких детей.
Эпидемический паротит — заболевание может осложниться серозным менингитом, в отдельных случаях воспалением поджелудочной железы. Свинка является одной из причин развития мужского и женского бесплодия.
Пневмококковая инфекция — причина большинства пневмоний (в том числе тяжелейших), части менингитов и септических состояний. Об актуальности свидетельствует хотя бы то, что вакцина присутствует в национальных календарях более чем 40 стран.
Гемофильная инфекция — это ряд острых инфекционных заболеваний, вызванных гемофильной палочкой. Гнойный менингит (воспаление оболочек головного или спинного мозга), отит (гнойное воспаление среднего уха), пневмония, септицемия (заражение крови.), гнойный артрит и проблемы с суставами.
ИНФЕКЦИИ И КАК ОТ НИХ ЗАЩИТИТЬСЯ
1. Туберкулез — БЦЖ, БЦЖ-M
2. Дифтерия — АДС, АДС-М, АД-М, АКДС, «Бубо-М», «Бубо-Кок», «Инфанрикс», «Пентаксим», «Тетраксим», «Инфанрикс Пента», «Инфанрикс Гекса»
3. Столбняк — столбнячный анатоксин, АКДС, АДС, АДС-М, «Пентаксим», «Бубо-Кок», «Бубо-М»,»Инфанрикс Гекса», «Тетраксим»,
4. Коклюш -АКДС, «Бубо-М», «Бубо-Кок», АКДС-ГепВ, «Пентаксим», «Инфанрикс Пента», «Инфанрикс Гекса», «Тетраксим», «Инфанрикс».
5. Корь — Вакцина коревая культуральная живая, вакцина паротитно-коревая культуральная живая,»Приорикс», М-М-Р II.
6. Грипп — «Ультравак», «Ультрикс», «Микрофлю», «Флюваксин», «Ваксигрип», «Флюарикс», «Бегривак», «Инфлювак», «Агриппал S1», «Гриппол плюс», «Гриппол», «Инфлексал V», «Совигрипп».
7. Гемофильная инфекция типа b — Хиб«Акт-ХИБ», «Хиберикс Пентаксим», гемофильная тип В конъюгированная, «Инфанрикс Гекса».
8. Краснуха — Вакцина против краснухи живая, вакцина против краснухи живая аттенуированная, «Приорикс», ММР-II.
9. Гепатит B — «Эувакс В», «Вакцина против гепатита В рекомбинантная», «Регевак В», «Энджерикс В», вакцина «Бубо-Кок», «Бубо-М», «Шанвак-В», «Инфанрикс Гекса», «АКДС-ГЕП В».
10. Гепатит А — «Аваксим», «Аваксим 80», «Вакта», «Хаврикс 720», «Хаврикс 1440».
11. Полиомиелит — «Инфанрикс Гекса», «Пентаксим», вакцина полиомиелитная пероральная 1, 3 типов, «Имовакс Полио», «Полиорикс», «Тетраксим».
12. Паротит — Паротитно-коревая культуральная (живая), паротитная культуральная (живая), «Приорикс», ММР-II.
13. Пневмококковая инфекция — «Пневмо-23», 13-валентная «Превенар 13», 10- валентная «Синфлорикс».
14. Вирус папилломы человека / РШМ«Гардасил», «Церварикс».
15. Ротавирусная инфекция — «РотаТек».
16. Менингококковая инфекция — Вакцина менингококковая группы А полисахаридная сухая, полисахаридная менингококковая вакцина А+С, «Менактра», «Менцевакс ACWY», «Менинго А+С»,
В настоящее время существуют вакцины от таких опасных инфекций как ВПЧ (вирус папилломы человека), ветрянная оспа и ротавирусная и менингококковая инфекции.
В нашей поликлинике имеется возможность альтернативной вакцинации, а именно платная вакцинация вакцинами импортного производства против ротавирусной инфекции, ветряной оспы и др. Подробную информацию Вы можете получить у своего участкового врача или медицинской сестры.
Автор: Тимофеева Е. Н., Жигжитова Е. В.
*Настоящий документ является интеллектуальной собственностью ГБУЗ «Городская поликлиника №3» и не может быть полностью или частично воспроизведен, тиражирован и использован иным образом без разрешения ГБУЗ «Городская поликлиника №3».
Дополнительную информацию Вы можете найти на Специалисты о прививках
Вакцинация на Планерной | Сделать прививку от гриппа в Москве: Сходненская, Тушино, Митино
Что такое вакцинация и когда её проводить?
По достижению определённого возраста все мы отправляемся в поликлинику для того, чтобы нам сделали вакцинацию. За исключением противников этой процедуры, конечно же.
Вакцинация позволяет создать иммунитет к различным инфекциям. Прохождение процедуры — отличная альтернатива выработке антител после тяжёлой болезни. Большинство инфекций, от которых вакцинируют, могут убить человека.
Вакцина, которая вводится в организм человека, сделана из очень ослабленных, а то и вовсе неживых патогенных организмов. Иногда для того, чтобы активировать выработку антител, достаточно просто внедрить в организм человека какие-то элементы возбудителя болезни.
Национальный календарь профилактических прививок РФ (приказ МЗРФ №125н от 21.03.2014 с поправками, внесенными приказом МЗРФ № 370н от 16.06.2016 и №175н от 13.04.2017)
Месяц | ||||||||||||||||||
0 | 1 | 2 | 3 | 4,5 | 6 | 12 | 15 | 18 | 20 | 6 лет | 7 лет | 14 лет | 15-17 лет | |||||
Туберкулез | 3-7 сут | RV | ||||||||||||||||
Гепатит В | V1 | V2 | V3 | |||||||||||||||
V1 | V2 | V3 | V4 | |||||||||||||||
Пневмококковая инфекция | V1 | V2 | RV | |||||||||||||||
Коклюш | V1 | V2 | V3 | RV1 | ||||||||||||||
Дифтерия | V1 | V2 | V3 | RV1 | RV2 | RV3 | ||||||||||||
Столбняк | V1 | V2 | V3 | RV1 | ||||||||||||||
Полиомиелит | V1 ИПВ | V2 ИПВ | V3 ОПВ | RV1 ОПВ | RV2 ОПВ | RV3 ОПВ | ||||||||||||
V3 ИПВ | RV1 ИПВ | RV2 ИПВ | RV3 ИПВ | |||||||||||||||
Гемофильная инфекция | V1 | V2 | V3 | RV | ||||||||||||||
Корь | V1 | V2 | ||||||||||||||||
Краснуха | V1 | V2 | ||||||||||||||||
Эпидемический паротит | V1 | V2 | ||||||||||||||||
Грипп | ежегодно | |||||||||||||||||
— Всем лицам данной группы
— Лицам из группы риска, по показаниям
— Ранее не привитым, не болевшим, не имеющим сведений
V1,2,3
— Порядковый номер вакцинации
RV1,2,3
— Порядковый номер ревакцинации
ИПВ
— Инактивированная полиомиелитная вакцина
ОПВ
— Оральная полиомиелитная вакцина
Когда и против чего вакцинируют?
Вакцинацию делают не в любое время года, а по специальным национальным календарям профилактических прививок. В России по нему проводят вакцинацию детей против 12 особо опасных инфекций. Речь идёт о возбудителях гепатита B, полиомелита, краснухи, паротита, гриппа, кори, пневмококковой инфекции, коклюша, туберкулёза, дифтерии, гемофильной инфекции типа B, столбняка. Вакцинация против гемофильной инфекции делаются только в том случае, если ребёнок состоит в группе риска.
В России по нему проводят вакцинацию детей против 12 особо опасных инфекций. Речь идёт о возбудителях гепатита B, полиомелита, краснухи, паротита, гриппа, кори, пневмококковой инфекции, коклюша, туберкулёза, дифтерии, гемофильной инфекции типа B, столбняка. Вакцинация против гемофильной инфекции делаются только в том случае, если ребёнок состоит в группе риска.
Начинать вакцинацию рекомендуется строго в указанные национальным календарём сроки. Любая вакцина, которая ставится детям, проходит испытания эффективности и безопасности в клинических условиях. Делается это для конкретных возрастных категорий. Если вы случайно пропустили вакцинацию, не стоит бросать это дело — посетите педиатра, он составит для вас новый график иммунизации. Некоторые родители пугаются прививок и не хотят прививать своих детей, у них возникают вопросы. Развеять все сомнения и получить полную информацию можно только при беседе со специалистом — педиатором.
Зачем нужна вакцинация?
С помощью вакцин человечество победило столбняк, который был бичом для прошлых поколений. Современному ребёнку вакцинация нужна не только для того, чтобы выжить в своей стране — если вы планируете поездки за границу, выезды за природу, вам понадобятся дополнительные прививки сверх обязательных. Кроме того, незащищённый ребёнок рискует подцепить заразу в любом месте, где присутствует большое скопление народа — в детском садике, школе, развивающей группе.
На настоящий момент в распоряжении врачей есть вакцины от менингококковой инфекции (детям от 9 месяцев), гепатита А (после 1 года), ветряной оспы (с 12 месяцев), ротавирусной инфеции (с 6 недель), клещевого энцефалита и других инфекций, которые могут погубить вашего ребёнка или сильно замедлить его в развитии.
Уважаемые родители, если вы планируете вакцинацию у нас в центре, возьмите с собой документ, содержащий сведения о предыдущей вакцинации
(прививочный сертификат или форму 063/у заполненные полностью или выписку о профилактических прививках из мед учреждения, где ребенок наблюдается и вакцинировался ранее). Помимо этого ребёнок должен быть совершенно здоров. Также нам понадобится анализ крови клинический и анализ мочи общий.
Помимо этого ребёнок должен быть совершенно здоров. Также нам понадобится анализ крови клинический и анализ мочи общий.
| Вакцинация | ||
|---|---|---|
| Процедура | Стоимость | |
| Адасель (коклюш, дифтерия, столбняк) Санофи Пастер | 2700,00 | руб |
| Прививка АДМ | 500,00 | руб |
| Альгавак М (гепатит А), Россия (с 3 лет) | 2450,00 | руб |
| Пневмовакс 23 (пневмококковая инфекция) Мерк Шарп И Доум | 3700,00 | руб |
| Гардасил (вирус папилломы человека), Нидерланды | 10000,00 | руб |
| АДС-М (Анатоксин-дифтерийно-столбнячный очищенный) (Россия) (дет, взр.) | 600,00 | руб |
| Вакцина дизентерии тип Зонне «Шигеллвак» (Россия) (взр) | 1200,00 | руб |
| Регевак (Россия) взр. (вакцина против гепатита В) | 600,00 | руб |
| Коревая вакцина живая сухая (Россия) | 600,00 | руб |
| Паротитно-коревая вакцина (Россия) | 650,00 | руб |
| Вакцина против краснухи живая (Россия) (дет, взр) | 750,00 | руб |
| Вакцина от ветрянки Варилрикс (Бельгия) | 4000,00 | руб |
| Гриппол плюс (Россия) | 600,00 | руб |
| Вакцина для профилактики менингококковой инфекции «Менактра», Франция (дет) | 6000,00 | руб |
| Вакцина клещевого энцефалита (для взрослых) | 1100,00 | руб |
| Вакцина для профилактики пневмонии Превенар-13 (Ирландия) | 3300,00 | руб |
| Прививка от гриппа вакциной «Ультрикс» | 800,00 | руб |
| Прививка от гриппа «Ультрикс Квадри» | 1000,00 | руб |
Новости
Российская газета.
 Какие болезни может показать анализ крови?
Какие болезни может показать анализ крови?
Лабораторная диагностика — один из лучших вариантов для первичного определения проблем. По анализу крови определяют целый спектр заболеваний. Об этом рассказал эксперт Центра молекулярной диагностики СМD ЦНИИЭ Михаил Лебедев.
KP.ru. Ошибка иммунитета
Именно она лежит в основе аллергических реакций. Как распознать и правильно лечить аллергию рассказала эксперт Центра молекулярной диагностики CMD ЦНИИЭ Марина Вершинина.
Открылась новая Медицинская клиника CMD Одинцово, Дачный поселок Лесной Городок
Открытие состоялось 11 апреля 2021 года
Parents.ru. Сезон клещей: встречаем во всеоружии
Эксперт Центра молекулярной диагностики CMD ЦНИИЭ Михаил Лебедев рассказал, как защититься от клещей взрослым и уберечь детей.
Итоги онлайн-семинара «Инфекции, передаваемые клещами: диагностика и разбор клинических случаев»
7 апреля 2021 г. состоялся онлайн-семинар
7ya.ru. Мода на D
Сейчас витамин D на «пике моды». О нем много говорят, пишут, связывают с его недостатком различные заболевания. Что же это за витамин, кому и как его принимать рассказывает Марина Савкина, эксперт Центра молекулярной диагностики CMD ЦНИИЭ.
Открылась новая Медицинская клиника CMD Аннино, Варшавское шоссе
Открытие состоялось 6 апреля 2021 года
Ученые ЦНИИЭ обсудили вопросы детской медицины
2-3 апреля 2021 года в Москве в онлайн-формате состоялся II Всероссийский Конгресс с международным участием
Известия.
 ru. Смейтесь на здоровье!
ru. Смейтесь на здоровье!
Эксперт центра молекулярной диагностики CMD ЦНИИЭ Кира Глинка рассказала, что смех помогает очищать бронхи и благотворно влияет на кровеносную систему
ЦНИИ Эпидемиологии принял участие в ЛАБРиН – 2021
31 марта – 2 апреля 2021 г. в Москве прошел III Национальный конгресс с международным участием
Пента | Прививки.уз — Предупредить. Защитить. Привить.
Новые инфо материалы по иммунизации во время пандемии COVID-19
для медицинский работников и родителей
Вакцинация во время пандемии COVID-19
Вопросы и ответы для РОДИТЕЛЕЙ
Вакцинация во время пандемии COVID-19
Вопросы и ответы для МЕДРАБОТНИКОВ
В ВОЗ отмечают 40-летие победы над оспой
и призывают проявить такую же солидарность в борьбе с COVID-19
Может ли БЦЖ вакцина помочь в борьбе с коронавирусом?
Международные исследования анализируют влияние БЦЖ вакцины на коронавирус
Совместное заявление ВОЗ и ЮНИСЕФ
Во время пандемии COVID-19 крайне важно сохранить услуги плановой иммунизации
В условиях пандемии COVID-19 вакцинацию необходимо продолжать, чтобы она сохраняла свою эффективность
Европейская неделя иммунизации — 2020
ГАВИ, ВОЗ, ЮНИСЕФ: успешное сотрудничество и новые планы
22-23 ноября 2019 года в конференц-зале гостиницы Hyatt Regency Tashkent при поддержке ВОЗ Министерство здравоохранения провело ежегодную национальную конференцию по иммунизации
Первый этап вакцинации против ВПЧ прошел успешно и эффективно
Минздрав провел конференцию по итогам первого этапа прививочной кампании против ВПЧ в Узбекистане.
Первые результаты вакцинации от ВПЧ!
Как вы знаете, с 21 октября 2019 года по всей республике проводится вакцинация против ВПЧ.
В Узбекистане дан старт вакцинации против вируса папилломы человека
В столице состоялась пресс-конференция, посвященная началу вакцинации против вируса папилломы человека.
Встреча с блогерами о ВПЧ
«Мероприятие полностью меня поглотило».
Профилактика рака шейки матки и внедрение ВПЧ вакцины в Узбекистане
Все о вакцинации от ВПЧ
Встреча с Ассоциацией частных школ Узбекистана по внедрению ВПЧ вакцины
Научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
20 августа 2019 года В Ташкенте под слоганом «Будущее без рака шейки матки» прошла научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
Рабочий визит делегации Республики Узбекистан по опыту внедрения внедрения вакцинации против ВПЧ в Молдове
«Это наши мамы, наши сестры, наши дочери, которых мы можем защитить от рака шейки матки уже сегодня благодаря вакцине от ВПЧ и программе скрининга», — неоднократно повторяли представители Молдовы.
Техническая поддержка Узбекистану в оценке температурных рисков в системе холодовой цепи для вакцин
В рамках оказания технической поддержки Узбекистану в достижении лучших стандартов качества и безопасности вакцин, с 13 по 24 августа 2019 года проходит миссия в составе консультантов ВОЗ г-жи Claire Frijs-Madsen и г-жи Erida Nelaj.
Прививки: абсолютно исчерпывающая инструкция для взрослых и детей Даже для тех, кто не верит в вакцинацию
Антипрививочное движение продолжает шириться, а вместе с ним растети частота вспышек инфекций
Совсем недавно в рамках Европейской недели иммунизации состоялась очень необычная и интересная встреча
Рязанский губернатор сделал прививку от коронавируса
22 января в ходе посещения пункта вакцинации в поликлиническом отделении «Городская поликлиника № 2» ГБУ РО «Областная клиническая больница им. Н.А. Семашко» Николай Любимов сделал прививку от коронавирусной инфекции.
Как сообщает сайт регионального правительства, губернатор ознакомился с тем, как в поликлинике организована вакцинация граждан против новой коронавирусной инфекции. После обязательной процедуры термометрии он посетил смотровой и прививочный кабинеты, а также кабинет наблюдения после вакцинации. Главный врач областной клинической больницы им. Семашко Людмила Сорокина проинформировала, что вакцинация проводится по предварительной записи. Пункт работает в ежедневном режиме. Уже привито более 150 человек. Каждого из пришедших на вакцинацию встречает медработник, затем осматривает врач и при отсутствии противопоказаний направляет в прививочный кабинет. После этого пациент находится под наблюдением медперсонала 30 минут, получает памятку с описанием возможных побочных действий, номером телефона для связи и датой 2-го этапа вакцинации.
Уже привито более 150 человек. Каждого из пришедших на вакцинацию встречает медработник, затем осматривает врач и при отсутствии противопоказаний направляет в прививочный кабинет. После этого пациент находится под наблюдением медперсонала 30 минут, получает памятку с описанием возможных побочных действий, номером телефона для связи и датой 2-го этапа вакцинации.
Губернатор пообщался с рязанцами, которые пришли в медучреждение для вакцинации и принял решение сделать прививку от коронавирусной инфекции. Его примеру последовал и министр здравоохранения региона Андрей Прилуцкий. «Призываю всех не откладывать вакцинацию. Это очень важно. Как видите, я и министр здравоохранения тоже сегодня сделали прививку. Многие люди уже прошли этот процесс или только собираются. Мы обязательно об этом будет говорить, чтобы рязанцы видели, что прививка – это не страшно, а очень важно и необходимо для того, чтобы защитить себя и своих близких, – сказал губернатор. – Статистически в регионе сейчас ежедневно прививают порядка 120 человек. Процесс организован понятно и логично. Думаю, что уже в понедельник, 25 января, мы должны выйти на количество 500 человек в день. А через неделю постараемся увеличить до тысячи. Понятно, что мы зависим от поставок вакцины Гам-КОВИД-Вак с федерального уровня. Сейчас у нас порядка 15 тысячи доз в наличии. В ближайшее время ждем поставку в размере 45 тысяч доз. Производство в стране увеличивается, и, соответственно, поставки к нам будут в полном объеме осуществляться. Надеюсь, что люди среагирует позитивно, потому что прививка – это сейчас единственное, что может избавить нас от пандемии». Губернатор добавил, что в настоящее время в регионе открыто 11 пунктов вакцинации, с 25 января их число увеличат до 33. Будут запущены и мобильные пункты, которые отправятся в населенные пункты, где нет поликлиник и больниц».
Фото Александра Королева
Мне нравитсяНе нравитсяВакцинация против ротавируса: что каждый должен знать
Одна из рекомендуемых вакцин
Краткий обзор
Ротавирус легко распространяется среди младенцев и детей младшего возраста. Вирус может вызывать сильную водянистую диарею, рвоту, лихорадку и боль в животе. Дети, заболевшие ротавирусной болезнью, могут обезвоживаться, и им может потребоваться госпитализация.
CDC рекомендует младенцам делать ротавирусную вакцину для защиты от ротавирусной болезни.Две ротавирусные вакцины в настоящее время лицензированы для младенцев в Соединенных Штатах. Начиная с 2 месяцев младенцы должны получать две или три дозы в зависимости от марки ротавирусной вакцины.
Кому следует делать вакцину против ротавируса?
Младенцы должны получить ротавирусную вакцину для защиты от ротавирусной болезни.
В США есть две ротавирусные вакцины, лицензированные для использования у младенцев:
- RotaTeq® (RV5), который вводится тремя дозами в возрасте 2, 4 и 6 месяцев
- Rotarix® (RV1), который вводится двумя дозами в возрасте 2 и 4 месяцев
Первую дозу ротавирусной вакцины следует ввести до достижения ребенком 15-недельного возраста.Дети должны получить все дозы ротавирусной вакцины до достижения 8-месячного возраста. Обе вакцины вводятся путем закапывания капель в рот младенца.
Лечащий врач вашего ребенка может помочь вам выбрать вакцину против ротавируса.
Для получения дополнительной информации см. О вакцине.
Кому не следует делать ротавирусную вакцину?
Ваш лечащий врач — лучший источник информации о преимуществах и рисках вакцин. Перед тем, как вашему ребенку сделают какую-либо вакцину, обсудите с вашим лечащим врачом:
- Проблемы со здоровьем, которые могут быть у вашего ребенка
- лекарств, которые в настоящее время принимает ваш ребенок
- проблемы, которые могут возникнуть у вас по поводу вакцинации
Младенцы не должны получать вакцину против ротавируса, если у них есть одно из следующего:
- тяжелая (опасная для жизни) аллергическая реакция на более раннюю дозу ротавирусной вакцины
- тяжелая (опасная для жизни) аллергия на любой компонент ротавирусной вакцины.Сообщите своему врачу, если у вашего ребенка есть какие-либо серьезные аллергии, о которых вы знаете, включая тяжелую аллергию на латекс
- тяжелый комбинированный иммунодефицит (ТКИД), состояние, при котором иммунная система ребенка не может бороться с инфекциями
- предыдущий эпизод типа непроходимости кишечника, называемого инвагинацией.
Младенцы со средним или тяжелым заболеванием должны дождаться вакцинации до выздоровления. Сюда входят младенцы с умеренной или тяжелой диареей или рвотой.Легко больные младенцы могут получить вакцину.
Проконсультируйтесь с врачом перед вакцинацией, если иммунная система вашего ребенка ослаблена из-за:
- ВИЧ / СПИД или любое другое заболевание, поражающее иммунную систему
- Лечение препаратами, например стероидами
- Рак или лечение рака с помощью рентгеновских лучей или лекарств
Насколько хорошо работает вакцина против ротавируса?
Обе ротавирусные вакцины (Rotarix® и RotaTeq®) были протестированы в крупных клинических испытаниях, в которых участвовали тысячи младенцев, и были признаны безопасными и эффективными.Около 9 из 10 детей, получивших вакцину, будут защищены от тяжелых ротавирусных заболеваний (лихорадка, рвота, диарея и изменения в поведении), а примерно 7-8 из 10 детей будут полностью защищены от ротавирусной болезни.
До появления вакцины многие дети, заболевшие ротавирусом, были госпитализированы. В настоящее время очень мало вакцинированных детей госпитализируются из-за ротавирусной болезни (от 94% до 96% защищены от госпитализации).
Каковы возможные побочные эффекты ротавирусной вакцины?
У большинства младенцев, которым вводят ротавирусную вакцину, нет побочных эффектов.Однако у некоторых детей могут быть побочные эффекты, которые обычно незначительны и проходят сами по себе. Серьезные побочные эффекты возможны, но редко.
Побочные эффекты или проблемы, связанные с ротавирусной вакциной, включают:
Легкие проблемы
Это может включать раздражительность или легкую временную диарею или рвоту после введения дозы ротавирусной вакцины.
Серьезные проблемы
Существует небольшой риск инвагинации кишечника, типа непроходимости кишечника, которую лечат в больнице, при которой может потребоваться операция.Инвагинация у некоторых детей случается ежегодно в Соединенных Штатах, и, как правило, причина этого неизвестна. Инвагинация от ротавирусной вакцинации обычно происходит в течение недели после введения дозы вакцины. Риск инвагинации кишечника в результате вакцинации против ротавирусной инфекции оценивается в диапазоне от 1 на 20 000 до 1 на 100 000 младенцев в США, которым вводят ротавирусную вакцину. Ваш лечащий врач может предоставить вам дополнительную информацию.
Проблемы, которые могут возникнуть после вакцинации
Любое лекарство может вызвать сильную аллергическую реакцию.Такие реакции от вакцины очень редки, оцениваются менее чем в 1 на миллион доз, и обычно происходят в течение от нескольких минут до нескольких часов после вакцинации. Как и в случае с любым лекарством, существует очень малая вероятность того, что вакцина станет причиной серьезных травм или смерти.
Безопасность вакцин постоянно контролируется. Для получения дополнительной информации посетите веб-страницу CDC по безопасности ротавирусных вакцин.
Для получения дополнительной информации о инвагинации кишечника посетите страницу «Вопросы и ответы о инвагинации и ротавирусной вакцине».
Можно ли вводить вакцину вместе с другими вакцинами?
Ротавирусную вакцину можно безопасно вводить во время одного визита к врачу вместе с вакциной DTaP, вакциной Hib, вакциной против полиомиелита, вакциной против гепатита B и пневмококковой конъюгированной вакциной.
Как родители могут платить за вакцину против ротавируса?
Большинство планов медицинского страхования покрывают стоимость вакцин. Тем не менее, вы можете проконсультироваться со своей страховой компанией, прежде чем идти к врачу. Если у вас нет медицинской страховки или ваша страховка не покрывает вакцины для вашего ребенка, программа «Вакцины для детей» (VFC) может вам помочь.Эта программа помогает семьям детей, имеющих право на вакцинацию, которые иначе не имели бы доступа к вакцинам. Чтобы узнать, имеет ли ваш ребенок право на участие в программе, посетите веб-сайт VFC или проконсультируйтесь с лечащим врачом вашего ребенка. Вы также можете связаться с координатором VFC в вашем штате.
Учебные материалы
Начало страницы
Будет ли в стоянках для автофургонов требовать доказательства вакцинации?
RVers пользуются сайтом RV. Потребуется ли карта вакцинации, чтобы получить сайт в ближайшее время?
Будет ли в парках для автофургонов требовать подтверждение вакцинации?
По мере того, как COVID-19 продолжает расти, а вакцина с каждым днем становится все более распространенной, получатели вакцины COVID покидают центры вакцинации с карточкой с напоминанием о приеме второй дозы и платой за . Повесьте эту карточку. вакцинация ».
Healthline.com отмечает несколько причин, по которым ваша карта вакцинации важна, и уже обсуждается мобильное приложение или «цифровые паспорта». Как сообщает WebMD.com,
«Американцам, которые сделали прививку от COVID-19 и используют цифровой« паспорт »здоровья, чтобы доказать это, в этом году может быть легче путешествовать и принимать участие в таких мероприятиях, как концерты, спортивные мероприятия и музеи».
Владельцев домов на колесах часто требовали предъявить доказательства вакцинации… для своих домашних животных.Хранить копию записей о вакцинации вашей собаки под рукой — не новость для 58% путешественников, путешествующих с другом-собакой. Но как насчет доказательства, цифрового или иного, о вакцинации COVID для вас и ваших партнеров по путешествию? Готово ли сообщество автодомов принять это требование, чтобы попасть в парк или курорт для автодомов? А как насчет государственного парка, национального леса или кемпинга в национальном парке?
Туристические сайты, такие как Travel Pulse, уже обсуждают, потребуются ли вакцины от COVID-19 для полетов в 2021 году.Кемпинги для автофургонов последуют этому примеру? Будут ли владельцы автопарков рассматривать это как ответственность? Будет ли им предъявлен иск, если турист докажет, что он заразился COVID на своей собственности? Будет ли страх перед судебным разбирательством подтолкнуть их к требованию доказательства прохождения вакцинации?
Как будет работать доказательство вакцинации в парке автодомов?
Вакцина от COVID-19 — это горячая тема сама по себе. Многие в целом выступают против вакцины и их часто называют Anti-Vaxxers. Вопрос для RVers заключается в том, готовы ли вы предоставить доказательство вакцинации против вируса COVID-19, чтобы войти в парк для автодомов, курорт для автодомов или кемпинг?
Если да, то как это будет работать? Нужно ли вакцинировать каждого человека в вашей группе? Если одного человека нет, будут ли они ограничены определенными местами в кемпинге или им всем будет отказано во въезде? А как насчет кемпингов с поздним заездом или безлюдных офисов? Будет ли подтверждение вакцинации, электронное или иное, которое вы должны заполнить на месте или через Интернет? Или же RVers просто украсят переднюю часть своего фургона большим крестом, как во дни Чумы, если они не вакцинированы?
Не могли бы вы предоставить подтверждение вакцинации владельцу автопарка, чтобы получить участок?
Вы откажетесь от вакцинации, даже если вам уже сделали прививку?
Для многих это может быть вовсе не вакцинация.До тех пор, пока вакцина не станет чипом для отслеживания или татуировкой на вашем лбу, большинство из них выбирают вакцину COVID и прилагаемое к ней доказательство вакцинации. Вопрос в том, согласитесь ли вы с требованием просто получить кемпинг, или вы расцените это как нарушение ваших личных прав? Опять же, это горячая тема.
В детстве все наши родители должны были предоставить в школу записи о выстреле, чтобы мы могли пойти в детский сад, третий класс и т. Д. Разве это сильно отличается? Были ли у наших родителей те же чувства и вопросы, когда были изложены требования к вакцинации?
Возможно, что сопротивление предоставлению доказательств вакцинации в значительной степени коренится в нынешнем недоверии к правительственному истеблишменту по обе стороны прохода.Правительство просто проявляет осторожность или закладывает основу, чтобы вырвать дальнейший контроль у своих избирателей? Это общие и изменчивые вопросы, которые относятся к другим вопросам, но служат фоном для нашего вопроса: Разрешат ли автодомные парковки требовать подтверждение вакцинации, чтобы разбить лагерь?
Будет ли RVers предоставлять доказательства вакцинации или нет?
В конце концов, RVers нуждаются в месте для разбивки лагеря. Будь то уединение или отдых на роскошных курортах для автодомов, RVing позволяет нам уйти от всего этого.Если единственный способ уйти и использовать этот дорогой дом на колесах — это предъявить доказательство вакцинации, скажут ли жители дома да? Скорее всего, будет, но, конечно, некоторые — нет.
Некоторые владельцы парков автодомов будут хвалить за требование доказательств, в то время как другие будут наказаны или заблокированы. Некоторые получат и то, и другое, поскольку разные стороны мнений учитываются при подаче отзывов о кемпинге.
Заключение
RVing и сообщество автодомов находятся в своей особой нише туристического пузыря. Хотя по-прежнему считается путешествием , его уникальная форма изоляции сделала его основным методом путешествий в 2020 году во время пандемии и не показывает никаких признаков замедления.
Тем не менее, когда мы думаем о путешествиях, мы склонны думать о таких терминах, как авиалинии, круизные лайнеры, такси и отели. В рамках этого жанра CNN предсказывает, что Если вы хотите поехать в следующем году, вам может понадобиться паспорт вакцины . Будут ли эти мандаты включать поездки на автофургонах и на колесах?
Мы могли бы ожидать, что отдельные кемпинги будут принимать эти решения независимо, но с таким количеством конгломератов и сетевых приобретений за последние пару лет можно ожидать, что корпоративные решения придется принимать и доводить до их палаточных лагерей по всем направлениям.
Лучше всего спланировать поездку на автофургоне заранее, зарезервировать места и спросить каждый кемпинг, потребуют ли им доказательства вакцинации. Поделитесь с нами своими мыслями в комментариях ниже, на нашей странице в Facebook или в сообществе на форумах iRV2.
Энтузиаст автофургонов, который путешествует уже 7 лет и любит путешествовать со своей женой и маленькими собаками на их 43-футовом дизельном толкаче.
Ротавирусная вакцина — обзор
4.6 Влияние вакцинации на распределение генотипов
С 2006 года доступны две ротавирусные вакцины, включая моновалентную вакцину Rotarix ® (GlaxoSmithKline Biologicals, Rixensart и Belgium) и пентавалентную RotaT. вакцина (Merck and Co., Уайтстейшн, штат Нью-Джерси и США). Эти вакцины различаются подходом к выработке иммунитета (Ward, 2009). Вакцина Rotarix состоит из аттенуированного Wa-подобного штамма G1P [8], тогда как RotaTeq содержит смесь 5 штаммов монореассортантного RVA крупного рогатого скота и человека, где каждый штамм содержит либо человеческий VP7 (G1, G2, G3 и G4), либо VP4. (P1A [8]), введенный путем реассортации in vitro в генетический фон штамма ротавируса WC3 (G6P7 [5]) крупного рогатого скота. (См. Главу 2.11.)
Хотя существует широкий научный консенсус в отношении того, что обе вакцины эффективны в снижении бремени тяжелого РВГЭ, все еще существуют разногласия относительно долгосрочного воздействия вакцинации на распределение циркулирующих генотипов РВ (Matthijnssens et al. ., 2012а). Было обнаружено, что эффективность вакцины одинаково высока в отношении как гомотипных, так и гетеротипных штаммов (Leshem et al., 2014). Тем не менее, временные изменения в распределении генотипов наблюдались после крупномасштабной вакцинации Rotarix и / или RotaTeq.
За введением RotaTeq последовало увеличение распространенности генотипа G3P [8] в некоторых местах, включая США и некоторые штаты Австралии (Hull et al., 2011; Kirkwood et al., 2011), что повысило опасения, что это может быть связано с более низкими показателями сероконверсии к компоненту G3 пентавалентной вакцины (Matthijnssens et al., 2012а). Однако подобные наблюдения не сохранились. Другие генотипы, включая G9P [8], G12P [8] и G2P [4], преобладали в течение года или двух в определенных местах, но в целом G1P [8] оставался преобладающим генотипом в странах, использующих RotaTeq.
Для Rotarix после широкомасштабной вакцинации наблюдалось последовательное и более продолжительное увеличение относительной распространенности полностью гетеротипного генотипа G2P [4] (Dóró et al., 2014), особенно в Бразилии, Бельгии и некоторых австралийских странах. состояния.Однако величина и продолжительность этого увеличения варьировались в зависимости от местоположения. В Австралии увеличение G2P [4] наблюдалось в течение двух сезонов после внедрения вакцины (2007–09) и снова в 2012 году, но G1P [8] и G3P [8] были наиболее распространенными генотипами в 2009–11 и 2013 годах, соответственно. , в штатах, использующих Rotarix. Явное увеличение G2P [4] после внедрения вакцины также было отмечено в Бельгии и сохранялось, по крайней мере, в течение семи сезонов 2006–2013 годов (Zeller et al., 2010; Pitzer et al., 2015). В Бразилии G2P [4] был преобладающим генотипом в течение как минимум шести лет с момента внедрения вакцины (2006–11), с распространенностью ≥50% во все годы, кроме 2009 года (Gómez et al., 2014). Кроме того, G1P [8] был относительно редким, его обнаруживали в ≤20% образцов во все сезоны с момента введения вакцины в Бразилии (Carvalho-Costa et al., 2011), в то время как другой полностью гетеротипный генотип (G8P [4]) появился на северо-востоке Бразилии в 2012 г. (Gurgel et al., 2014). Высокая распространенность штаммов G2P [4] RVA в Бразилии после введения универсальной вакцинации против RV с помощью Rotarix не была уникальной, но также была зафиксирована в других странах Южной Америки, где не была создана программа вакцинации RV (Matthijnssens et al., 2009).
Наконец, ряд реассортантных штаммов вакцинного происхождения также был выделен от лиц как с вакцинацией, так и без нее. В частности, реассортантные штаммы G1P [8] вакцинного происхождения были описаны у пациентов из США, Австралии и Финляндии после вакцинации RotaTeq. Также произошла перегруппировка между G1P дикого типа [8] и вакцинным штаммом Rotarix (Dóró et al., 2014). Это имеет важные последствия для эпиднадзора, поскольку могут потребоваться более совершенные лабораторные методы для дифференциации штаммов дикого типа и штаммов вакцинного происхождения.
Ротавирусная вакцина: что нужно знать (VIS)
Зачем делать прививки?
Вакцина против ротавируса может предотвратить ротавирус болезнь .
Ротавирус вызывает диарею, в основном у младенцев и детей младшего возраста. Диарея может быть тяжелой и приводить к обезвоживанию. У детей с ротавирусной инфекцией также часто наблюдаются рвота и жар.
Ротавирусная вакцина
Ротавирусная вакцина вводится путем закапывания капель в рот ребенка.Младенцы должны получить 2 или 3 дозы ротавирусной вакцины, в зависимости от марки вакцины.
Почти все дети, которым вводят ротавирусную вакцину, будут защищены от тяжелой ротавирусной диареи.
Другой вирус, называемый цирковирусом свиней (или его части), содержится в ротавирусной вакцине. Этот вирус не заражает людей, и угроза безопасности неизвестна. Для получения дополнительной информации см.
Обновленная информация о рекомендациях по использованию ротавирусных вакцин.
Ротавирусную вакцину можно вводить одновременно с другими вакцинами.
До появления вакцины
До появления ротавирусной вакцины ротавирусная болезнь была распространенной и серьезной проблемой для здоровья детей в Соединенных Штатах. Почти все дети в Соединенных Штатах перенесли хотя бы одну ротавирусную инфекцию до своего пятилетнего возраста. Ежегодно десятки тысяч пациентов госпитализировались, некоторые из них умирали.
Поговорите со своим лечащим врачом
Сообщите своему поставщику вакцины, если человек, получающий вакцину:
Имел аллергическая реакция после предыдущей дозы ротавирусной вакцины или тяжелая, опасная для жизни аллергия .
Имеет ослабленная иммунная система .
Имеет тяжелый комбинированный иммунодефицит (ТКИД).
Имеет тип непроходимости кишечника, называемый Инвагинация .
В некоторых случаях лечащий врач вашего ребенка может решить отложить вакцинацию против ротавируса до следующего визита.
Младенцы с легкими заболеваниями, такими как простуда, могут быть вакцинированы.Младенцы со средним или тяжелым заболеванием обычно должны дождаться выздоровления, прежде чем делать ротавирусную вакцину.
Лечащий врач вашего ребенка может предоставить вам дополнительную информацию.
Риски реакции на вакцину
Раздражительность или легкая временная диарея или рвота могут возникнуть после вакцинации против ротавируса.
Существует также небольшой риск инвагинации кишечника в результате вакцинации против ротавирусной инфекции, обычно в течение недели после первой или второй дозы вакцины.Инвагинация — это разновидность непроходимости кишечника, которая лечится в больнице и может потребовать хирургического вмешательства. Это происходит у некоторых младенцев каждый год в Соединенных Штатах, и обычно причина этого неизвестна. Этот дополнительный риск оценивается в диапазоне от 1 из 20 000 младенцев в США до 1 из 100 000 младенцев в США, которые получают вакцину против ротавируса. Ваш лечащий врач может предоставить вам дополнительную информацию.
Как и в случае с любым другим лекарством, существует очень малая вероятность того, что вакцина вызовет тяжелую аллергическую реакцию, другие серьезные травмы или смерть.
Что делать, если возникла серьезная проблема?
При инвагинации поищите признаки боли в животе и сильного плача. Вначале эти эпизоды могли длиться всего несколько минут и приходить и уходить несколько раз в час. Младенцы могут подтягивать ноги к груди. У вашего ребенка может быть несколько раз рвота или кровь в стуле, или он может казаться слабым или очень раздражительным. Эти признаки обычно появляются в течение первой недели после первой или второй дозы ротавирусной вакцины, но ищите их в любое время после вакцинации.Если вы считаете, что у вашего ребенка инвагинация, немедленно обратитесь к врачу. Если вы не можете связаться со своим врачом, отвезите ребенка в больницу. Сообщите им, когда вашему ребенку сделали ротавирусную вакцину.
Аллергическая реакция может возникнуть после того, как вакцинированный покинет клинику. Если вы заметили признаки тяжелой аллергической реакции (крапивница, отек лица и горла, затрудненное дыхание, учащенное сердцебиение, головокружение или слабость), позвоните. 9-1-1 и доставьте человека в ближайшую больницу.По поводу других симптомов, которые вас беспокоят, позвоните своему врачу.
О побочных реакциях следует сообщать в Систему сообщений о побочных эффектах вакцин (VAERS). Этот отчет обычно подает ваш лечащий врач, или вы можете сделать это самостоятельно. Посетить
Веб-сайт VAERS или позвоните 1-800-822-7967 . VAERS предназначен только для сообщения о реакциях, и персонал VAERS не дает медицинских рекомендаций.
Национальная программа компенсации травм от вакцин
Национальная программа компенсации за травмы от вакцин (VICP) — это федеральная программа, созданная для выплаты компенсации людям, которые могли быть травмированы определенными вакцинами.Посетить Веб-сайт внешнего значка VICP или позвоните 1-800-338-2382 , чтобы узнать о программе и о подаче иска. Срок подачи иска о компенсации ограничен.
Как я могу узнать больше?
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Мониторинг выделения пяти генотипов вакцинных вирусов RotaTeq с помощью генотип-специфичных ПЦР-тестов с обратной транскрипцией в реальном времени
РЕЗЮМЕ
RotaTeq (RV5) — широко используемая живая аттенуированная пятивалентная ротавирусная вакцина (RV). Хотя фекальное выделение штаммов вакцины против RV сохраняется в течение длительного времени, неясно, как каждый штамм вакцины реплицируется в ткани кишечника и выводится с калом. Чтобы изучить эту проблему, мы разработали методы ПЦР с обратной транскрипцией (ОТ-ПЦР), специфичные для генотипа RV5.Пять анализов ОТ-ПЦР в реальном времени были разработаны для гена VP7 в генотипах G1, G2, G3, G4 и G6. Все анализы продемонстрировали превосходную линейность, а предел обнаружения составлял 1 инфекционную единицу (МЕ) / реакцию для G2, G4 и G6 и 10 МЕ / реакцию для G1 и G3. Между генотипами G не наблюдалось перекрестной реактивности. Коэффициенты вариации между и внутри анализа были менее 3%. Анализы были использованы для изучения 129 образцов стула, взятых у восьми младенцев, получивших RV5. В случаях 1 и 2, получивших три раунда вакцинации, выделение RV постепенно уменьшалось с увеличением количества вакцинаций.Шеддинг G1 и G6 оказался преобладающим по сравнению с шеддингом других генотипов. Паттерны фекального выделения пяти генотипов вакцинных вирусов у восьми реципиентов вакцины различались. Специфичные для генотипа RV5 анализы ОТ-ПЦР в реальном времени будут полезны для изучения молекулярной биологии репликации RV5 у младенцев и экспериментальных животных.
ВВЕДЕНИЕ
Ротавирус (RV), который принадлежит к семейству Reoviridae, состоит из 11 сегментов двухцепочечной РНК, окруженных трехслойным капсидом, состоящим из ядра, внутреннего и внешнего капсида.Основываясь на антигенных и генетических особенностях внутреннего капсидного белка VP6, RV был разделен на восемь признанных групп (от A до H) (1), и недавно были идентифицированы два вида (I и J) (2, 3). ПЖ группы А являются основной причиной гастроэнтерита у детей и вызывают значительную заболеваемость и смертность во всем мире (4). Для большинства RV группы A человека (RVA) были установлены три геногруппы: две основные геногруппы, представленные эталонными штаммами Wa (гены геногруппы 1) и DS-1 (гены геногруппы 2), и одна минорная геногруппа, представленная эталонным штаммом AU. -1 (гены 1 геногруппы) (5, 6).Генотип RV определяется на основе последовательностей генов VP7 и VP4, которые определяют вирусные генотипы G и P соответственно (7). Четыре штамма, G1P [8], G2P [4], G3P [8] и G4P [8], преобладают во всем мире, в том числе в Латинской Америке. Таким образом, четыре распространенных типа G (G1, G2, G3 и G4) в сочетании с P [8] или P [4] составляют более 88% проанализированных штаммов во всем мире. Кроме того, было показано, что вирусы генотипа G9, связанные с P [8] или P [6], возникли как пятый глобально важный G-тип с относительной частотой 4.1% (8, 9). Поскольку несколько комбинаций GP, таких как G1P [8], G2P [4], G3P [8], G4P [8] и G9P [8], широко распространены во всем мире (10, 11), считается, что Иммунный ответ хозяина против этих пяти генотипов играет важную роль в предотвращении тяжелого гастроэнтерита правого желудочка (RVGE).
В настоящее время существует две коммерчески доступных живых аттенуированных вакцины против РВ: Rotarix (RV1; GlaxoSmithKline, Rixensart, Бельгия) и RotaTeq (RV5; Merck and Co., Whitehouse Station, NJ, США) (12). RV1 — это моновалентная вакцина, полученная из наиболее распространенного генотипа RV человека (G1P [8]), ослабленная серийным пассажем в культуре клеток (13).Ожидалось, что иммунный ответ хозяина на введение RV1 может обеспечивать перекрестную защиту против других общих генотипов RV. С другой стороны, RV5 — это пятивалентная реассортантная вакцина против РВ человека и крупного рогатого скота, которая содержит пять наиболее распространенных генотипов (G1, G2, G3, G4 и P [8], который обозначается как G6P [8]) и была разработана для индуцируют типоспецифический защитный иммунитет против этих распространенных штаммов у детей (14). Хотя концептуальный механизм предотвращения тяжелого РВГЭ у двух вакцин против РВ различается, предыдущие исследования показали, что обе вакцины в целом безопасны и одинаково эффективны в клинических испытаниях (13, 15, 16).Обе вакцины являются живыми аттенуированными вакцинами, и вакцинные вирусы выделяются с калом после вакцинации (13, 16–24). Кроме того, у здоровых детей наблюдалась передача штаммов вакцинного вируса от реципиентов вакцины (15). Хотя выделение вакцины против RV5 было исследовано Vesikari et al. (16), кинетика выделения кала каждого генотипа остается неясной.
Молекулярные методы генотипирования RV были разработаны с использованием гибридизации микроматрицы (25), полиморфизма длины рестрикционных фрагментов (26), одно- или двухэтапной стандартной ПЦР с обратной транскрипцией (ОТ-ПЦР) с последующим генотипированием на основе геля ПЦР-амплификации (27–29) и нуклеотидное секвенирование (30).Анализы ОТ-ПЦР в реальном времени имеют несколько преимуществ, включая большую чувствительность, чем обычная вложенная ПЦР (31), более высокая пропускная способность, меньшее время обработки и возможность количественного определения вирусной РНК. В этом исследовании мы разработали анализы ОТ-ПЦР в реальном времени, специфичные для генотипа RV5, чтобы различить пять различных генотипов VP7 RV5, и исследовали кинетику фекального выделения этих пяти генотипов у вакцинированных младенцев.
МАТЕРИАЛЫ И МЕТОДЫ
Вирусы и экстракция РНК. В качестве вакцинного штамма использовали коммерчески доступный RV5.Штаммы RVA человека KU G1P [8], DS-1 G2P [4], YO G3P [8] и ST3 G4P [6] и штамм RVA крупного рогатого скота WC3 G6P [5] были использованы в качестве репрезентативных вирусов дикого типа для соответствующего RV. генотипы. Эти штаммы RVA размножали, как описано ранее (32). Вкратце, штаммы RVA предварительно обрабатывали трипсином (тип IX, из поджелудочной железы свиньи) (10 мкг / мл; Sigma-Aldrich, Сент-Луис, Миссури, США) в течение 30 минут при 37 ° C и размножали в клетках MA104 в минимально необходимых условиях Игла. среда (Nissui, Tokyo, Japan) без фетальной телячьей сыворотки, но содержащая трипсин (1 мкг / мл).
Супернатант вирусных культур использовали для выделения РНК. РНК экстрагировали из 140 мкл суспензии вакцины RV5, каждого штамма дикого типа и образцов стула с использованием мининабора вирусной РНК QIAamp (Qiagen, Валенсия, Калифорния, США). После экстракции РНК хранили при -80 ° C.
Праймеры, зонды и условия для генотип-специфичных анализов ОТ-ПЦР в реальном времени. Расположение и последовательности праймеров и зондов для генотип-специфичных анализов ОТ-ПЦР в реальном времени показаны в таблице S1 в дополнительном материале.Праймеры и зонды были разработаны для различения G1, G2, G3, G4 и G6 с использованием PrimerQuest (Integrated DNA Technologies, Коралвилл, Айова, США) на основе эталонных последовательностей вакцинных штаммов (номера доступа GenBank GU565057.1 для G1, GU565068.1 для G2, GU565079.1 для G3, GU565090.1 для G4 и GU565046.1 для G6). Для повышения чувствительности анализов использовали зонды с двойным гашением ZEN (Integrated DNA Technologies).
Генотип-специфичные анализы ОТ-ПЦР в реальном времени проводили с использованием одностадийного набора TaqMan RNA-to- C T (Applied Biosystems, Foster City, CA, USA).Денатурацию в одной лунке, обратную транскрипцию и амплификацию выполняли в системе ПЦР в реальном времени StepOne (Thermo Fisher Scientific, Уолтем, Массачусетс, США) в стандартном режиме. Условия ПЦР были следующими: стадия RT в течение 15 минут при 48 ° C, активация ДНК-полимеразы и инактивация RT в течение 10 минут при 95 ° C и 45 циклов денатурации в течение 15 секунд при 95 ° C, отжиг праймеров в течение 30 секунд (G1 , при 56 ° C; G2, без ступени; G3, при 51 ° C; G4, при 50 ° C; G6, при 62 ° C), и удлинение / испускание флуоресценции в течение 60 с при 60 ° C.Смесь RT-PCR в реальном времени (общий объем 25 мкл) содержала 12,5 мкл смеси 2 × RT-PCR, 5 мкл матричной РНК, смесь ферментов TaqMan RT 40 x, зонд 200 нМ, праймер 400 нМ, 100 × 6 эталонный краситель -карбокси-X-родамин (ROX) и вода, не содержащая нуклеаз. Все образцы подвергались тепловой денатурации при 95 ° C в течение 5 мин.
Стандартные кривые и положительный контроль. РНК, выделенную из RV5, использовали для получения стандартных кривых для каждого генотип-специфичного анализа RT-PCR в реальном времени.
Согласно предписаниям, RV5 содержит ≥2.2 × 10 6 инфекционных единиц (МЕ) G1, ≥2,8 × 10 6 МЕ G2, ≥2,2 × 10 6 МЕ G3, ≥2 × 10 6 МЕ G4 и ≥2,3 × 10 6 МЕ P1A [8] в 2 мл раствора вакцины. Серийные разведения каждого генотипа использовали для построения каждой стандартной кривой для анализов ОТ-ПЦР в реальном времени. РНК, экстрагированную из RV5, использовали в качестве положительного контроля для всех генотип-специфичных анализов ОТ-ПЦР в реальном времени.
Воспроизводимость и повторяемость генотип-специфичных анализов ОТ-ПЦР в реальном времени.Для оценки воспроизводимости (вариации внутри анализа) и повторяемости (вариации между анализами) генотип-специфичных анализов ОТ-ПЦР в реальном времени, повторяющиеся эксперименты были выполнены с каждым штаммом дикого типа. Воспроизводимость определялась путем измерения образцов пять раз в разные дни в рамках одного и того же эксперимента (для оценки вариации внутри анализа) и между четырьмя разными анализами (вариация между анализами). Коэффициент вариации (CV) значения порогового цикла ( C T ) определяли как отношение стандартного отклонения к среднему значению.
Клинические образцы. Всего 129 сохраненных образцов стула, взятых поочередно у восьми младенцев (случаи 1-8), которые получали RV5 в предыдущем клиническом исследовании, одобренном нашим институциональным наблюдательным советом (разрешение № 14-140), были использованы в экспериментах, направленных на при оценке клинической надежности анализов. В случаях 1 и 2 образцы стула собирали в течение 14 дней после первой и второй вакцинации и в течение 11 дней (случай 1) или 8 дней (случай 2) после третьей вакцинации в приемной семье.Случаи 3-8 были пациентами, госпитализированными в отделение интенсивной терапии новорожденных (NICU), которые получили RV5 во время госпитализации. Образцы стула собирали в течение 9 дней только после первой вакцинации. До анализа образцы хранили при -20 ° C. Десятипроцентные суспензии (1 мл) каждого образца стула готовили в физиологическом растворе. В качестве альтернативы образцы мазков промывали в 200 мкл физиологического раствора. Каждую суспензию осветляли центрифугированием в течение 20 мин при 4000 × g , и 140 мкл супернатанта использовали для экстракции РНК.
РЕЗУЛЬТАТЫ
Линейность и чувствительность анализов ОТ-ПЦР в реальном времени, специфичных для генотипа RV5. Линейность и чувствительность анализов ОТ-ПЦР в реальном времени, специфичных для генотипа RV5, оценивали с использованием серийных разведений РНК, экстрагированной из RV5. Была получена превосходная линейность (дата не показана), и была получена высокая корреляция между концентрацией разведенной РНК и значением C T каждого генотипа во всех генотип-специфичных анализах ОТ-ПЦР в реальном времени.Пределы обнаружения составляли 1 МЕ / реакцию для G2, G4 и G6 и 10 МЕ / реакцию для G1 и G3.
Специфичность анализов ОТ-ПЦР в реальном времени, специфичных для генотипа RV5. Хотя только штамм вакцины был амплифицирован с помощью анализов ОТ-ПЦР в реальном времени, специфичных для G2, генотипы вакцины и дикого типа были коамплифицированы другими четырьмя генотипами. -специфические анализы ОТ-ПЦР в реальном времени (рис. 1). В каждом G-специфическом анализе RT-PCR в реальном времени специфически амплифицировали только соответствующий штамм дикого типа. Таким образом, никакой перекрестной реакции между другими генотипами G не наблюдалось ни в одном из генотип-специфичных анализов ОТ-ПЦР в реальном времени.
Рис. 1.Специфичность одностадийного анализа RT-PCR в реальном времени для распознавания пяти конкретных G-генотипов RotaTeq. ■, РНК, извлеченная из RotaTeq; ▲, РНК, экстрагированная из штамма ротавируса дикого типа, специфичного к генотипу G, в соответствующей ОТ-ПЦР в реальном времени; ● РНК, экстрагированная из штамма ротавируса дикого типа другого генотипа G в соответствующей ОТ-ПЦР в реальном времени.
Вариабельность анализов ОТ-ПЦР в реальном времени, специфичных для генотипа RV5, и межисследований. Чтобы оценить воспроизводимость анализов ОТ-ПЦР в реальном времени, специфичных для генотипа RV5, мы оценили вариабельность между и внутри анализов.Для определения изменчивости внутри анализа значения C T стандартных кривых были измерены дважды, а средние значения C T и коэффициенты вариации были рассчитаны в течение пяти дней подряд (Таблица 1). Для оценки воспроизводимости методов коэффициент вариации был определен как отношение стандартного отклонения к среднему значению. Как показано в таблице 1, коэффициенты вариации экспериментов внутри анализа были менее 2.8% для пяти генотипов G. Чтобы оценить воспроизводимость между анализами, значения C T были измерены в четырех повторностях (таблица 2). Как показано в таблице 2, коэффициенты вариации межисследовательского экзамена были менее 2,9% для пяти генотипов G.
ТАБЛИЦА 1Внутрианалитическая вариабельность анализов ОТ-ПЦР в реальном времени для различения пяти конкретных генотипов G RotaTeq
ТАБЛИЦА 2Межисследовательская вариабельность анализа ОТ-ПЦР в реальном времени для различения пяти конкретных генотипов G RotaTeq
Надежность тестов для анализа клинических образцов.Чтобы изучить репликацию пяти различных генотипов после вакцинации, мы проанализировали образцы стула, собранные у реципиентов вакцины, с помощью анализов, специфичных для генотипа RV5. В случае 1 фекальное выделение G6 преобладало после первой вакцинации, тогда как выделение G1 преобладало после второй и третьей вакцинаций (рис. 2A). В случае 2 выделение как G1, так и G4 преобладало после первой вакцинации, а выделение G1 преобладало после второй вакцинации (рис. 2B). В обоих случаях 1 и 2 фекальное выделение вакцинных вирусов уменьшалось по мере увеличения числа вакцинаций.Как показано на рис. 3, преимущественно сброшенными генотипами были G3 в случае 3, G6 в случае 4, G1, G2 и G6 в случае 5, G1 и G4 в случае 6 и G1 и G6 в случае 8. Фекальное выделение все пять генотипов были низкими в случае 7.
FIG 2Выделение пяти различных штаммов ротавируса после вакцинации RotaTeq в случаях 1 и 2, которые завершили три раунда вакцинации. Преимущественное высыпание генотипов показано следующим образом: синий — G1; кирпично-красный, G2; зеленый, G3; фиолетовый, G4; бирюза, G6.
FIG 3Выделение пяти различных штаммов ротавируса после вакцинации RotaTeq в случаях от 3 до 8.Образцы из этих шести случаев были собраны только после первой вакцинации, и преобладающее выделение генотипов показано следующим образом: синий, G1; кирпично-красный, G2; зеленый, G3; фиолетовый, G4; бирюза, G6.
ОБСУЖДЕНИЕ
Выделение вакцинных вирусов с фекалиями может вызвать передачу вакцинного вируса (ов) от вакцинированных детей невакцинированным контактам, потенциально вызывая коллективный иммунитет. С другой стороны, такая передача создает риск вакцинного заболевания у лиц с ослабленным иммунитетом (22, 33).Реассортантные штаммы, полученные из RV5 или RV1, связаны с острым гастроэнтеритом у вакцинированных (34, 35) и невакцинированных детей (36). Более того, предыдущие исследования показали, что широкое использование вакцины RotaTeq привело к введению вакцинных генов в циркулирующие RV человека (37, 38). Следовательно, характеристика генотипа RV циркулирующих штаммов RVA важна также для того, чтобы различать штаммы дикого типа и вакцинные или реассортантные вакцины (37, 38). В этом исследовании мы разработали анализы ОТ-ПЦР в реальном времени, специфичные для генотипа RV5, которые могут различать и количественно определять каждый генотип, и оценивали их надежность для анализа клинических образцов.
Пределы обнаружения специфичных для генотипа RV5 анализов ОТ-ПЦР в реальном времени составляли 1 МЕ / реакцию для G2, G4 и G6 и 10 МЕ / реакцию для G1 и G3, что эквивалентно таковому для неспецифических реальных проб, о которых сообщалось ранее. Метод временной ОТ-ПЦР для обнаружения РВ (39), который считался достаточно чувствительным для мониторинга фекального выделения вакцинных вирусов с использованием клинических образцов.
За исключением G2-специфичного анализа ОТ-ПЦР в реальном времени, анализы амплифицировали как вакцины, так и штаммы дикого типа каждого G-генотипа (рис.1). Однако перекрестной реактивности среди протестированных генотипов обнаружено не было. Следовательно, эти методы могут надежно различать пять различных генотипов, содержащихся в вакцине против RV5, несмотря на перекрестную реакцию между штаммами дикого типа и вакцинами в G1-, G3-, G4- и G6-специфичных RT- ПЦР-анализы. Кроме того, на основе тестов вариабельности внутри и между анализами в первоначальном валидационном анализе эти анализы обладают высокой воспроизводимостью и подходят для исследования клинических образцов.
Как показано на рис. 2, все нагрузки RV генотипа G постепенно уменьшались с количеством вакцинаций. Антитела IgA к RV в ткани кишечника играют важную роль в защитном иммунитете против болезни RV. Более того, мы ранее сообщали, что нагрузка РНК РВ в фекалиях постепенно снижается по мере увеличения количества вакцинаций (15). Естественно приобретенная инфекция правого желудочка индуцирует иммунитет против правого желудочка и снижает тяжесть последующей инфекции правого желудочка (40). Большое когортное исследование естественного течения инфекции RV, проведенное в Мексике, показало, что впоследствии идентифицированные генотипы имеют тенденцию отличаться от ранее инфицированного генотипа (40).Интересно, что генотипы RV, преимущественно выделяемые в случаях 1 (G6) и 2 (G4) во время первой вакцинации, практически не обнаруживались в фекальных выделениях после второй вакцинации. Таким образом, наши данные подтверждают идею генотип-специфического защитного иммунитета, предложенную на основе предыдущего клинического исследования (40). Чтобы подтвердить эту гипотезу, будущие исследования должны проверить связь между выделением из фекалий генотипа RV и ответом нейтрализующих антител, специфичных для генотипа.
В этом исследовании среди 12 отдельных введений RV5 выделение генотипа G1 было преобладающим при семи вакцинациях, а выделение генотипа G6 было преобладающим при четырех.Таким образом, выделение генотипов G1 и G6P [8], по-видимому, преобладало над выделением других генотипов (рис. 2 и 3). Согласно предыдущим доклиническим испытаниям, направленным на оценку безопасности и эффективности RV5, ответы нейтрализующих антител против G1 и G6 превосходили таковые против G2, G3 и G4, а эффективность вакцины была почти одинаковой для пяти генотипов (16). Настоящие результаты вместе с данными предыдущих доклинических испытаний (41, 42) предполагают, что генотипы G1 и G6P [8] могут пролиферировать преимущественно in vivo и могут вызывать сильный иммунный ответ против G1, G6 и P [8 ] генотипы вакцинированных младенцев.В будущих исследованиях следует измерить титры нейтрализующих антител, специфичных для генотипа, и другие иммунологические факторы, чтобы определить, коррелирует ли уровень фекального выделения RV с иммунным ответом (43–46).
Хотя количество случаев в этом исследовании было ограниченным, образцы фекального выделения пяти различных генотипов вакцинных вирусов, по-видимому, различались среди реципиентов вакцины. Например, в случае 7 выделение всех пяти штаммов вакцины против РВ было ограничено. Различные факторы, такие как грудное вскармливание и материнские антитела, могут мешать иммунному ответу хозяина.Грудное молоко содержит специфические антитела к RV и другие нейтрализующие факторы (47–50), в том числе материнские антитела (51, 52), что может привести к подавлению пролиферации вакцины против RV в тканях кишечника. Эффективность вакцин в развивающихся странах ниже (53, 54), чем в развитых странах (55, 56). Следовательно, в будущем будет важно выяснить точные механизмы, контролирующие репликацию вакцинного вируса в ткани кишечника и иммунный ответ хозяина против RV.
Таким образом, мы разработали анализы ОТ-ПЦР в реальном времени, специфичные для генотипа RV5, способные измерять генотип-специфическое выделение вируса у новорожденных, вакцинированных RV5.Согласно нашему анализу клинических образцов, вероятно, что выделение G1 и G6 является преобладающим у вакцинированных младенцев. Кроме того, поскольку образцы фекального выделения пяти различных генотипов RV5, по-видимому, различались у реципиентов вакцины, некоторые индивидуальные факторы могут способствовать контролю репликации вакцинного вируса в тканях кишечника. Новые анализы RT-PCR в реальном времени, специфичные для генотипа RV5, должны быть полезны для высокопроизводительного молекулярного скрининга образцов кала. Кроме того, анализы могут быть ценным инструментом для изучения молекулярной биологии / репликации компонентов RV5 у вакцинированных младенцев, а также на подходящих моделях животных.
БЛАГОДАРНОСТИ
Мы благодарим Акико Йошикаву, Чиеко Мори и Йоко Осакабе за их помощь в лабораторных исследованиях.
Эта работа была поддержана грантами Общественного фонда Исследовательского центра вакцинации и Японского агентства медицинских исследований и разработок (грант № 27270201) и Исследовательской программы по возникающим и вновь возникающим инфекционным заболеваниям Японского агентства медицины. Исследования и разработки.
- Авторское право © 2018 Американское общество микробиологии.
Вмешательство материнских антител способствует снижению эффективности ротавирусной вакцины в развивающихся странах
Abstract
Эффективность вакцины против ротавируса (RV) значительно ниже в странах с низким и средним уровнем доходов (СНСД) по сравнению со странами с высоким уровнем доходов. В этом обзоре суммируются текущие исследования механизмов, лежащих в основе этого явления, с особым акцентом на доказательства того, что вмешательство материнских антител (matAb) является фактором, способствующим этому несоответствию.Все вакцины против РВ, используемые в настоящее время, представляют собой пероральные вакцины с живыми аттенуированными вирусами, которые реплицируются в кишечнике младенца, поэтому на их эффективность потенциально влияет как перенесенный через плаценту иммуноглобулин G (IgG), так и антитела IgA слизистой оболочки, передаваемые через грудное молоко. Наблюдательные исследования когорт в СНСУД продемонстрировали обратную корреляцию между титрами matAb, как в сыворотке крови, так и в грудном молоке, и реакцией младенцев на вакцинацию против RV. Однако причинно-следственная связь между материнским гуморальным иммунитетом и сниженной эффективностью вакцины против RV у младенцев еще предстоит окончательно установить, частично из-за ограничений в существующих моделях болезни RV на животных.Характеристики опосредованного Abs и задействованный механизм (ы) еще предстоит определить, и они могут отличаться от механизмов интерференции matAb для парентерально вводимых вакцин из-за вклада иммунитета слизистой оболочки, передаваемого через грудное молоко. Повышенные дозы вакцины и более поздний возраст введения вакцины были стратегиями, применяемыми для преодоления интерференции matAb, но эти подходы трудно безопасно реализовать в условиях вакцинации против RV в СНСУД. В конечном итоге, необходима разработка соответствующих животных моделей интерференции matAb, чтобы определить, какие альтернативные подходы или конструкции вакцины могут безопасно и эффективно преодолеть интерференцию matAb при вакцинации младенцев против РВ.
Образец цитирования: Otero CE, Langel SN, Blasi M, Permar SR (2020) Вмешательство материнских антител способствует снижению эффективности ротавирусной вакцины в развивающихся странах. PLoS Pathog 16 (11): e1009010. https://doi.org/10.1371/journal.ppat.1009010
Редактор: Эндрю Меле, Висконсинский университет в Мэдисоне, США
Опубликовано: 19 ноября 2020 г.
Авторские права: © 2020 Otero и другие.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Генеральный директор поддерживается Национальным институтом рака NIH (NCI: https://www.cancer.gov/) Рут Л. Киршштейн, Национальная исследовательская награда T32 CA009111. SNL поддерживается Национальным институтом аллергии и инфекционных заболеваний NIH (NIAID: https: // www.niaid.nih.gov) Премия Национальной исследовательской службы Рут Л. Киршштейн T32 AI007392 и награда Фонда Билла и Мелинды Гейтс (https://www.gatesfoundation.org/) OPP 1189362. MB и SRP поддерживаются Биллом и Мелиндой Гейтс Премия фонда OPP 1189362. Спонсоры не играли никакой роли в дизайне исследования, сборе данных, анализе, принятии решения о публикации или подготовке рукописи. Содержание является исключительно точкой зрения авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения или Фонда Билла и Мелинды Гейтс.
Конкурирующие интересы: Я прочитал политику журнала и имею следующие конфликты: Салли Р. Пермар работает консультантом по вакцинам Pfizer, Sanofi, Moderna и Merck и имеет спонсируемую программу разработки доклинической цитомегаловирусной вакцины с Merck и Moderna. Все остальные авторы заявляют об отсутствии конкурирующих интересов.
Эффективность ротавирусной вакцины снижается в странах с низким и средним уровнем дохода (СНСД)
Несмотря на разработку эффективных вакцин, которые снизили заболеваемость и смертность от ротавирусов (РВ) на 67% [1], РВ все еще остается одной из наиболее частые причины диарейных заболеваний в детском возрасте [1,2].В настоящее время Всемирная организация здравоохранения (ВОЗ) одобрила четыре вакцины для профилактики гастроэнтерита, вызванного RV: Rotarix, Rotateq, Rotavac и RotaSiil, но только Rotarix и Rotateq широко используются во всем мире [3]. Эти вакцины вводятся перорально в живых ослабленных составах, каждая из которых содержит различные серотипы RV человека и / или крупного рогатого скота (таблица 1). В странах первого мира вакцины против РВ очень эффективны (от 80% до 90%), но в странах с низким и средним уровнем дохода эффективность падает до 40–60% [4,5]. Из-за такого несоответствия в эффективности вакцин инфекции RV по-прежнему вызывают значительную заболеваемость и смертность в СНСД [2].
Было предложено несколько причин низкой эффективности вакцины против РВ в СНСУД, включая более высокую экспозицию РВ, большее разнообразие серотипов G и P РВ, недоедание, состав микробиома, стадию созревания иммунной системы, снижение репликации вакцины из-за других кишечных патогенов, совместное введение пероральной вакцины против полиомиелита, разная экспрессия антигенов гистокрови, искаженный баланс Т-хелперов 1 (Th2) / Т-хелперов 2 (Th3) и ответ антител на вакцинацию, а также более высокая частота интерференции материнских антител (matAb) [15– 18].Хотя вполне вероятно, что несколько факторов способствуют снижению эффективности вакцины против RV, наблюдаемому в СНСД, вмешательство matAb, вероятно, является основным фактором из-за большего воздействия RV, что ведет к усилению материнского иммунитета, а также к более высоким показателям и большей продолжительности грудного вскармливания в СНСД [19–19]. 21]. В этом обзоре основное внимание уделяется текущим данным, подтверждающим, что вмешательство matAb вносит свой вклад, оставшимся вопросам и предлагаемым модификациям для повышения эффективности текущих схем вакцинации.
Доказательства подтверждают вмешательство matAb как механизм снижения эффективности вакцины против РВ.
MatAb передаются младенцу двумя разными путями: (1) плацентарный перенос иммуноглобулина G (IgG) в кровообращение младенца; и (2) перенос грудного молока, в первую очередь, IgA в желудочно-кишечный тракт младенца [22,23].Большинство исследований, изучающих роль интерференции matAb, сосредоточены на IgG, перенесенном через плаценту [24]. Однако данные наблюдательных исследований на популяционном уровне и моделирования на животных показывают, что matAb, полученный из грудного молока, также влияет на эффективность вакцины против RV [10,25,26].
Rotavac — это недавно разработанная вакцина против RV, полученная из естественно аттенуированного и реассортированного неонатального штамма RV (116E). Клиническое испытание этой вакцины на индийских младенцах выявило значительную обратную связь между RV-специфическими материнскими IgG и реакциями на вакцину Rotavac для младенцев.Однако ингибирование matAb удалось преодолеть за счет увеличения дозы вакцины [10]. В то время как испытание Rotavac не исследовало Abs грудного молока как способствующего влиянию matAb, моделирование RV-инфекции с использованием мышиного штамма RV.Эпизоонозная диарея младенцев мышей (EDIM) показало, что серопозитивные самки BALB / c передают Abs своим детенышам, в основном через грудное вскармливание. , что нарушало иммунный ответ детенышей на прививку живого ПЖ [26]. Эти результаты согласуются с исследованиями человеческих когорт в развивающихся странах, таких как Замбия и Вьетнам, где дети матерей с более высокими титрами антител к РВ в грудном молоке, как правило, имеют пониженный ответ на вакцины против РВ [9,20].Эти обсервационные исследования демонстрируют устойчивую связь между материнским гуморальным иммунитетом, включая сывороточный IgG и IgA слизистой оболочки, и реакцией младенца на вакцины против RV.
Установление причинной связи между вмешательством matAb и низкой эффективностью вакцины против РВ в СНСУД и определение механизмов
В то время как обсервационные исследования на животных и людях установили связь между материнским иммунитетом и эффективностью вакцины для младенцев, механистические исследования, демонстрирующие, что вмешательство matAb вызывает снижение Эффективность вакцины против RV все еще необходима.Предыдущие исследования продемонстрировали обратную корреляцию между титрами matAb в сыворотке и грудном молоке и реакцией младенца [9,27], но эти исследования не выделяют этот эффект только на matAb. Кроме того, в обращении находится несколько серотипов G / P RV [28], и воздействие определенных серотипов на мать может влиять на наблюдаемую степень интерференции matAb, в зависимости от уровня перекрестной реактивности matAb между штаммами RV дикого типа и аттенуированной вакциной. вирусы. Есть много других потенциальных иммунных факторов, передаваемых от матери ребенку, которые могут подавлять реакцию младенцев на вакцины.Одно исследование замбийских детей показало, что лактадгерин, противовирусный гликопротеин, присутствующий в грудном молоке, отрицательно связан с сероконверсией младенцев после вакцинации Rotarix [29]. Кроме того, генетические факторы хозяина, такие как экспрессия антигенов группы гистокрови, клеточного рецептора для RV, также могут влиять на эффективность вакцины RV и восприимчивость к заболеванию [30–33]. Таким образом, необходимы исследования, в которых matAb можно выделить в качестве переменной, чтобы установить причинную связь со сниженной эффективностью вакцины против РВ.Основным препятствием для таких исследований является сложность моделирования инфекции RV человека на животных моделях из-за ограниченного круга хозяев RVs [34].
Было предложено несколько механизмов для IgG-опосредованной интерференции matAb против различных вирусов, включая нейтрализацию живых ослабленных вакцин, маскировку эпитопа, перекрестное связывание рецепторов B-клеток (BCR) и ингибиторного рецептора Fcγ IIB (FcγRIIB), удаление антигена вакцины с помощью опосредованный антителами фагоцитоз и подавление дифференцировки В-клеток в плазму или В-клетки памяти (рис. 1) [24,35].Исследование материнского IgG-опосредованного вмешательства в вакцинацию против кори живой аттенуированной вакциной на модели хлопковых крыс продемонстрировало, что ненейтрализующие моноклональные антитела опосредованы вмешательством, тогда как нейтрализующие моноклональные антитела — нет [36]. Это исследование также показало, что участок кристаллизующегося фрагмента (Fc) необходим для ингибирования ответов Ab на вакцинацию, и что это ингибирование обусловлено взаимодействием с FcγRIIB [36]. Однако исследования на мышах, использующих эритроциты барана в качестве модельного антигена, подтвердили, что маскировка эпитопа является механизмом, опосредующим это ингибирование В-клеточных ответов [37–39].Примечательно, что одно исследование продемонстрировало, что интерференция происходит у FcγR-дефицитных мышей, демонстрируя, что BCR-FcγRIIB не является единственным механизмом ингибирования В-клеток в присутствии уже существующих Ab [39]. Интересно, что антитела RV, нацеленные на средний слой капсида (VP6), которые традиционно считались не нейтрализующими, способны к внутриклеточной нейтрализации, предполагая, что влияние таких материнских Ab на эффективность вакцины новорожденных может не ограничиваться Fc-опосредованным «ненейтрализующим» эффектором функции [40].В другом недавнем исследовании с использованием гемагглютинина гриппа в качестве модельного антигена исследователи обнаружили, что matAb не влияют на формирование зародышевого центра, но модулируют, какие антигены нацелены на В-клетки младенца, и в зависимости от дозы ингибируют дифференцировку В-клеток плазмы и B-клеток памяти. клетки через неопределенный механизм [35]. В совокупности эти результаты предполагают, что множественные механизмы могут вносить вклад в опосредованное matAb ингибирование ответов младенцев на вакцины, возможно, антиген-зависимым образом.
Рис. 1. Вмешательство matAb в вакцины против РВ для младенцев [41].(A) Перенесенный через плаценту IgG (красная кривая) начинает достигать младенца уже на 8 неделе беременности и достигает пика в срок, примерно на 40 неделе [22,42]. Материнский IgG уменьшается у ребенка через 12 месяцев после рождения [24]. Младенцы, находящиеся на грудном вскармливании, получают через грудное молоко антитела, в первую очередь IgA, которые достигают пика в молозиве при концентрации примерно 12 мг / мл и поддерживают примерно 1 мг / мл в зрелом молоке (голубая кривая) [23].Однако из-за объема молока, потребляемого младенцем, абсолютное количество matAb, передаваемого с грудным молоком, увеличивается со временем, пока ребенок не начнет получать энергию из других видов пищи (темно-синяя кривая) [43]. Вакцинация против RV обычно проводится 2–3 дозами, когда ребенку от 2 до 6 месяцев, как показано черными стрелками [44]. У младенцев, находящихся на грудном вскармливании, оба типа matAb присутствуют во время вакцинации против RV. (B) Вакцины против RV представляют собой перорально вводимые живые аттенуированные вирусы, репликация которых в энтероцитах младенцев вызывает устойчивый иммунный ответ.Микроскладчатые (M) клетки отбирают антигены из просвета кишечника и представляют их антигенпрезентирующим клеткам, которые стимулируют адаптивный иммунный ответ в пятнах Пейера [45]. В присутствии matAb было предложено несколько механизмов снижения иммунных ответов младенцев на вакцинацию против RV, включая (1) ингибирование репликации вакцинного вируса в энтероцитах путем нейтрализации matAb; (2) удаление вакцинного антигена путем опосредованного антителами фагоцитоза; (3) ингибирование активации В-клеток младенца путем перекрестного связывания BCR с ингибирующим FcγRIIB; (4) маскирование эпитопов, которое ингибирует ответы младенцев Ab путем сокрытия распознаваемых антигенов от детских B-клеток, что также может сдвигать B-клеточные ответы на неиммунодоминантные эпитопы; и (5) влияние на дифференцировку нижестоящих В-клеток в плазматические клетки или В-клетки памяти [24,35].Ab, антитело; BCR, рецептор В-клеток; FcγRIIB, рецептор Fcγ IIB; IgA, иммуноглобулин А; IgG, иммуноглобулин G; matAb, материнское антитело; Р., ротавирус.
https://doi.org/10.1371/journal.ppat.1009010.g001
Вакцины против RV вводятся перорально, поэтому на них также могут влиять Abs слизистой оболочки кишечника, в первую очередь IgA, доставляемые младенцу с грудным молоком. Примечательно, что IgA-опосредованная интерференция может не следовать тем же механизмам, что и IgG-опосредованная интерференция, из-за различий в характеристиках Fc.Кроме того, следует отметить, что, хотя грудное молоко содержит в основном IgA-Ab, в грудном молоке присутствуют IgG-Abs, которые могут транспортироваться в собственную пластинку и в кровоток [46,47]. Однако исследования, проведенные в нескольких популяциях СНСД, показали, что воздержание от грудного вскармливания в течение периода до и после вакцинации против РВ не влияет на частоту сероконверсии [48–51]. Неэффективность выбора времени кормления грудью для вакцинации против RV может указывать на то, что материнский IgG в крови, а не в грудном молоке, является основным медиатором вмешательства.Дальнейшая и более глубокая оценка характеристик антител и относительного вклада сывороточных IgG и IgA грудного молока была бы полезной для разработки и оценки стратегий преодоления интерференции matAb.
Возможные решения по поводу вмешательства matAb в вакцины против РВ
Обойти вмешательство matAb можно несколькими способами, но каждый из них сопряжен со своими рисками. Вакцинация против RV связана с несколько повышенным риском инвагинации кишечника, что обычно перевешивается огромным преимуществом снижения заболеваемости и смертности, но должно учитываться при оценке альтернативных стратегий вакцинации [52].Например, хотя увеличение дозы вакцинного антигена может преодолеть интерференцию matAb [10], превышение дозы matAb может также привести к патологии из-за чрезмерной репликации вируса живой вакцины или неправильного иммунного ответа. Этот подход ранее был протестирован с использованием живой аттенуированной противокоревой вакцины, которая индуцировала некоторую защиту в присутствии материнского IgG, но также приводила к увеличению детской смертности, особенно у девочек, у которых, как правило, было меньше материнского IgG по сравнению с мальчиками [24,53– 55].Серологическое тестирование для количественного определения уже существующих Ab до вакцинации невозможно в СНСД, поэтому было бы невозможно скорректировать дозу антигена на основе уровня matAb, что было бы идеальным компромиссом для повышения безопасности этого подхода.
Другой альтернативной стратегией является изменение времени вакцинации, чтобы дождаться снижения уровня matAb у младенца. Вакцина против кори следует этой стратегии, поскольку введение в возрасте 9 месяцев продемонстрировало снижение интерференции matAb [56].Однако более поздняя вакцинация также может представлять значительный риск, поскольку она делает ребенка более уязвимым в период до вакцинации, когда уровни matAb низкие, что является важным фактором в СНСД с более высокой экспозицией ПЖ [19]. Однако пассивная иммунотерапия антителом, нацеленным на грудное молоко, которое доставляется матери, может поддерживать matAb слизистой оболочки на защитном уровне до вакцинации в более позднем возрасте. Таким образом, необходимы дополнительные исследования для определения возраста, когда RV-специфические matAbs уменьшились в достаточной степени для достижения успешной вакцинации без увеличения смертности из-за воздействия RV до вакцинации.Однако риск инвагинации кишечника после вакцинации против RV увеличивается с возрастом ребенка, поэтому вакцинация позже может оказаться нежизнеспособной стратегией [57,58]. Примечательно, что испытание в Индонезии вакцины против RV3-BB (G3P [7], в настоящее время не одобренной ВОЗ) продемонстрировало лучшую эффективность, когда серию из 3 доз вводили в более раннем возрасте, начиная с рождения (75%), а не при рождении. 8 недель (51%) [59]. Это говорит о том, что более высокая эффективность может быть достигнута путем вакцинации в более раннем возрасте и может обойти дополнительный риск инвагинации кишечника, связанный с вакцинацией от RV у младенцев старшего возраста.
Другой потенциальной альтернативой является состав вакцины, отличный от перорального воздействия живого ослабленного вируса. Например, рекомбинантный усеченный белок VP4 был более иммуногенным, чем живые ослабленные композиции, и не подавлялся в присутствии matAb на мышиной модели [26]. Однако эффективность нерепликативных вакцин против РВ требует дальнейшего подтверждения с помощью исследований контрольного заражения с использованием штаммов РВ человека. Кроме того, нерепликативный вакцинный состав не гарантирует лучшего ответа на вакцинацию младенцев.Например, в модели RV-болезни человека у гнотобиотических поросят усиление пероральной живой аттенуированной вакцины RV-подобными частицами привело к подавлению эффекторного ответа и ответа В-клеток памяти [60]. Кроме того, существует несколько белковых вакцин, эффективность которых зависит от интерференции matAb, включая вакцины против столбняка и гепатита B [24].
Другой потенциальной альтернативой пероральным живым аттенуированным вакцинам против РВ является вакцина с вирусным вектором, разработанная для долговременной экспрессии антигена. Непрерывная экспрессия антигена посредством векторной экспрессии, вводимая на раннем этапе для высвобождения антигена в течение более длительного периода, может стимулировать иммунную систему младенца после того, как matAbs упадет до не мешающего уровня [24,61].Однако подходы к генной терапии соответствуют более высоким стандартам безопасности из-за возможности интеграции вектора в геном [62], и необходимы дальнейшие исследования, чтобы определить, будет ли такой подход эффективным в контексте вакцинации против RV. Несмотря на то, что существует несколько возможных подходов, необходимо дальнейшее исследование, чтобы определить, перевешивает ли их способность преодолевать помехи matAb риски для младенца.
Перспективы преодоления вмешательства matAb в вакцинацию младенцев от RV
В настоящее время существуют эффективные вакцины от RV, но эффективность этих вакцин значительно снижена в СНСД.Хотя многие факторы, вероятно, способствуют такому снижению эффективности, интерференция matAb явно связана со снижением эффективности вакцины, но необходимы дальнейшие исследования, чтобы выделить интерференцию matAb как способствующий фактор и полностью установить причинную связь. Механизмы влияния matAb на пероральные вакцины против RV могут отличаться от механизмов, наблюдаемых в других вакцинах, из-за важности иммунитета слизистых оболочек и способности Abs грудного молока вносить вклад в эти помехи. Определение механизмов интерференции matAb в этом контексте во многом поможет альтернативным стратегиям вакцинации, чтобы избежать или преодолеть интерференцию matAb.Было предложено несколько альтернативных стратегий вакцинации для уменьшения интерференции matAb, но они требуют дальнейшего тестирования для определения относительной безопасности. Таким образом, необходимы дополнительные исследования механизмов вмешательства matAb вакцины против РВ, а также безопасности и эффективности альтернативных стратегий вакцинации, чтобы в конечном итоге добиться повышения эффективности вакцины против РВ в СНСД и дальнейшего снижения смертности от ведущих диарейных заболеваний во всем мире.
Ссылки
- 1. Бернетт Э., Джонестеллер К.Л., Тейт Дж.Э., Йен С., Парашар У.Д.Глобальное влияние ротавирусной вакцинации на детские госпитализации и смертность от диареи. J Infect Dis J Infect Dis [Интернет]. 2017 [цитируется 12 июня 2020 г.]; 215: 1666–72. Доступен по телефону: pmid: 28430997
- 2. Тейт Дж. Э., Бертон А. Х., Боски-Пинто С., Парашар Ю. Д., Агокс М., Серхан Ф. и др. Глобальные, региональные и национальные оценки смертности от ротавирусов у детей младше 5 лет, 2000–2013 гг. Clin Infect Dis [Интернет]. 2016 [цитируется 20 июня 2020 г.]; 62: S96–105. Доступно по адресу: https: // Academic.oup.com/cid/article-abstract/62/suppl_2/S96/2478843. pmid: 27059362
- 3. ВОЗ | Ротавирус [Интернет]. [цитируется 15 мая 2020 г.]. Доступно по адресу: https://www.who.int/immunization/diseases/rotavirus/en/.
- 4. Кларк А., ван Зандвоорт К., Флаше С., Сандерсон С., Бинес Дж., Тейт Дж. И др. Эффективность живых пероральных ротавирусных вакцин по продолжительности наблюдения: мета-регрессия рандомизированных контролируемых испытаний. Lancet Infect Dis. 1 июля 2019 г .; 19 (7): 717–727. pmid: 31178289
- 5.Соарес-Вайзер К., Бергман Х., Хеншке Н., Питан Ф., Канлифф Н. Вакцины для предотвращения ротавирусной диареи: используемые вакцины. Кокрановская база данных Syst Rev.2019 Октябрь; 28: 2019 (10).
- 6. Руис-Паласиос Г.М., Перес-Шаэль И., Веласкес Ф.Р., Абате Х., Брейер Т., Клеменс С.А.К. и др. Безопасность и эффективность аттенуированной вакцины против тяжелого ротавирусного гастроэнтерита. N Engl J Med. 2006 1 мая; 354 (1): 11–22. pmid: 16394298
- 7. Китинг GM. Ротавирусная вакцина (RotaTeq).Vol. 8, Педиатрические препараты. Springer; 2006. с. 197–202. https://doi.org/10.2165/00148581-200608030-00008 pmid: 16774301
- 8. Беккер-Дрепс С., Вилчез С., Веласкес Д., Мун С.-С., Хадженс М.Г., Замбрана Л.Е. и др. Ротавирус-специфические антитела IgG из материнской сыворотки могут ингибировать иммунный ответ младенцев на пятивалентную ротавирусную вакцину. Педиатр Infect Dis J [Интернет]. 2015 Янв [цитируется 20 июня 2020 г.]; 34 (1): 115–6. Доступно по адресу: http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00006454-201501000-00031.pmid: 25741808
- 9. Chilengi R, Simuyandi M, Beach L, Mwila K, Becker-Dreps S, Emperador DM и др. Ассоциация материнского иммунитета с иммуногенностью ротавирусной вакцины у младенцев из Замбии. Уивер Э.А., редактор. PLoS One [Интернет]. 2016 14 марта [цитируется 15 мая 2020 года]; 11 (3): e0150100. Доступен по телефону: pmid: 26974432
- 10. Аппаиагари М.Б., Гласс Р., Сингх С., Танежа С., Ронгсен-Чандола Т., Бхандари Н. и др. Трансплацентарный IgG к ротавирусу препятствует иммунному ответу на живую оральную ротавирусную вакцину ORV-116E у индийских младенцев.Вакцина. 2014 г. 3 февраля; 32 (6): 651–656. pmid: 24374502
- 11. Бхандари Н., Ронгсен-Чандола Т., Бавдекар А., Джон Дж., Энтони К., Танежа С. и др. Эффективность моновалентной ротавирусной вакцины человека и крупного рогатого скота (116E) у индийских младенцев: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет. 2014, 21 июня; 383 (9935): 2136–2143. pmid: 24629994
- 12. Кулкарни П.С., Десаи С., Тевари Т., Каваде А., Гоял Н., Гарг Б.С. и др. Рандомизированное клиническое испытание фазы III для оценки эффективности реассортантной пентавалентной ротавирусной вакцины крупного рогатого скота и человека у индийских младенцев.Вакцина. 2017 27 октября; 35 (45): 6228–6237. pmid: 28967523
- 13. Наик С.П., Заде Дж.К., Сабале Р.Н., Писал С.С., Менон Р., Банкар С.Г. и др. Стабильность термостабильной живой аттенуированной ротавирусной вакцины (ROTASIIL). Вакцина. 2017 г. 19 мая; 35 (22): 2962–2969. pmid: 28434688
- 14. Рати Н., Десаи С., Каваде А., Венкатраманан П., Кунду Р., Лалвани С.К. и др. Открытое, рандомизированное, активно контролируемое клиническое исследование фазы III для оценки безопасности, иммуногенности и стабильности реассортантной пятивалентной ротавирусной вакцины крупного рогатого скота и человека у индийских младенцев.Вакцина. 18 декабря 2018 г .; 36 (52): 7943–7949. pmid: 30420116
- 15. Веласкес Д.Е., Парашар У., Цзян Б. Снижение эффективности живых аттенуированных пероральных ротавирусных вакцин в странах с низким уровнем дохода: причины и способствующие факторы. Vol. 17, Экспертный обзор вакцин. Тейлор и Фрэнсис Лтд; 2018. с. 145–61. https://doi.org/10.1080/14760584.2018.1418665 pmid: 29252042
- 16. Лисиандро Дж. Г., Ван Ден Биггелаар AHJ. Иммунная функция новорожденных и воспалительные заболевания в более позднем возрасте: уроки, которые следует извлечь из развивающегося мира? [Интернет].Vol. 40, Клиническая и экспериментальная аллергия. Clin Exp Allergy; 2010 [цитируется 8 сентября 2020 года]. п. 1719–31. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/20964742/. pmid: 20964742
- 17. Ван Ри Р., Язданбахш М. Аллергические расстройства в африканских странах: связь иммунологии с точным фенотипом. Аллергия [Интернет]. 2007 8 февраля 8 [цитируется 9 сентября 2020]; 62 (3): 237–46. Доступно по адресу: http://doi.wiley.com/10.1111/j.1398-9995.2007.01336.x. pmid: 17298340
- 18. Клиффорд HD, Хайден С.М., Кху С.К., Наниче Д., Мандомандо И.М., Чжан Г. и др.Генетические варианты пути IL-4 / IL-13 влияют на реакцию против кори и неэффективность вакцины у детей из Мозамбика. Вирусный иммунол [Интернет]. 2017 1 сентября [цитируется 15 сентября 2020 г.]; 30 (7): 472–8. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/28594599/. pmid: 28594599
- 19. Юлиан TR. Передача возбудителей диарейных болезней в окружающей среде в странах с низким и средним уровнем доходов [Интернет]. Vol. 18, Наука об окружающей среде: процессы и воздействия Королевское химическое общество; 2016 [цитируется 16 июля 2020 г.].п. 944–55. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/27384220/.
- 20. Транг Н.В., Бракман Т., Лерноут Т., Хау ВТБ, Ань ЛТК, Луан Л.Т. и др. Распространенность ротавирусных антител в грудном молоке и ингибирующие эффекты ротавирусных вакцин. Hum Vaccines Immunother. 2014, 1 декабря; 10 (12): 3681–3687. pmid: 25668672
- 21. Араби М., Фронгилло Э.А., Авула Р., Мангасарян Н. Кормление детей грудного и раннего возраста в развивающихся странах. Child Dev [Интернет]. 2012, январь [цитировано 16 июля 2020 г.]; 83 (1): 32–45.Доступно по адресу: http://doi.wiley.com/10.1111/j.1467-8624.2011.01675.x.
- 22. Palmeira P, Quinello C, Silveira-Lessa AL, Zago CA, Carneiro-Sampaio M. Перенос IgG через плаценту при здоровой и патологической беременности. Vol. 2012. Clin Dev Immunol: 2012. pmid: 22235228
- 23. Ван Де Перре П. Передача антител с материнским молоком. В кн .: Вакцина. Elsevier BV; 2003. с. 3374–6. https://doi.org/10.1016/s0264-410x(03)00336-0 pmid: 12850343
- 24. Невеск С.Материнские антитела: клиническое значение, механизм вмешательства в иммунный ответ и возможные стратегии вакцинации. Vol. 5, Границы иммунологии. Frontiers Media S.A .; 2014. с. 446.
- 25. Чан Дж., Нирвати Х., Триасих Р., Богданович-Сакран Н., Соенарто Й., Хакими М. и др. Материнские антитела к ротавирусу: могут ли они помешать применению живых ротавирусных вакцин в развивающихся странах? Вакцина. 2011, 1 февраля; 29 (6): 1242–1247. pmid: 21147127
- 26. Ян Х, Ло Г, Цзэн Й, Ли Й, Ю С, Чжао Б и др.Отчетливое влияние материнских антител на иммуногенность живых и рекомбинантных ротавирусных вакцин. Вакцина. 2019 июля 9; 37 (30): 4061–4067. pmid: 31182323
- 27. Mwila K, Chilengi R, Simuyandi M, Permar SR, Becker-Dreps S. Вклад материнского иммунитета в снижение эффективности ротавирусной вакцины в странах с низким и средним уровнем доходов. Vol. 24, Клиническая и вакцинная иммунология. Американское общество микробиологии; 2017.
- 28. Эстес МК, Капикян АЗ.Ротавирусы. В: Книп Д.М., Хоули П.М., редакторы. Поля вирусологии, том 2. 5-е изд. Липпинкотт Уильямс и Уилкинс; 2007. с. 1917–74.
- 29. Мвила-Казимбая К., Гарсия М.П., Босомпра С., Лабан Н.М., Чисенга С.К., Пермар С.Р. и др. Влияние врожденных противовирусных гликопротеинов грудного молока на сероконверсию к ротавирусной вакцине (Rotarix) у детей в Лусаке, Замбия. Итурриза-Гомара М., редактор. PLoS One [Интернет]. 2017 28 декабря [цитируется 16 мая 2020 года]; 12 (12): e0189351. Доступно по адресу: https: // dx.plos.org/10.1371/journal.pone.0189351. pmid: 29284036
- 30. Рамани С., Гири С. Влияние экспрессии антигена гистологической группы крови на восприимчивость к кишечным вирусам и вакцинам. Vol. 32, Современное мнение об инфекционных заболеваниях. Липпинкотт Уильямс и Уилкинс; 2019. стр. 445–52. https://doi.org/10.1097/QCO.0000000000000571 pmid: 31335438
- 31.
Ли Б., Диксон Д.М., ДеКэмп А.С., Росс Колгейт Э., Дил С.А., Уддин М.И. и др. Фенотип антигена гисто-группы крови определяет восприимчивость к ротавирусным инфекциям, специфичным для генотипа, и влияет на показатели эффективности ротавирусной вакцины.В: Журнал инфекционных болезней [Интернет]. Издательство Оксфордского университета; 2018 [цитируется 18 октября 2020 г.]. п. 1399–407. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/293
/. https://doi.org/10.1093/infdis/jiy054 pmid: 293
- 32. Хуанг П., Ся М., Тан М., Чжун В., Вэй Ц., Ван Л. и др. Spike Protein VP8 * ротавируса человека распознает антигены гисто-группы крови типоспецифическим образом. J Virol. 2012 1 мая; 86 (9): 4833–4843. pmid: 22345472
- 33. Gozalbo-Rovira R, Ciges-Tomas JR, Vila-Vicent S, Buesa J, Santiso-Bellón C, Monedero V и др.Раскрытие роли секреторного антигена в прикреплении ротавируса человека к антигенам гистологической группы крови. Рей Ф.А., редактор. PLoS Pathog [Интернет]. 21 июня 2019 г. [цитируется 16 июня 2020 г.]; 15 (6): e1007865. Доступен по телефону: pmid: 31226167
- 34. Gray J, Desselberger U, Ciarlet M, Conner ME. Оценка ротавирусных вакцин на моделях мелких животных. В кн .: Ротавирусы. Humana Press; 2003. с. 147–87.
- 35. Vono M, Eberhardt CS, Auderset F, Andersen P, Lambert P-H, Correspondence C-AS.Материнские антитела подавляют реакцию новорожденных и младенцев на вакцинацию, формируя репертуар ранних В-клеток в зародышевых центрах. CellReports [Интернет]. 2019 [цитировано 14 июля 2020 г.]; 28: 1773–1784.e5. Доступен по телефону: pmid: 31412246
- 36. Ким Д., Хьюи Д., Оглсби М., Невиеск С. Понимание регуляторного механизма, контролирующего ингибирование индуцированной вакциной сероконверсии материнскими антителами. Кровь [Интернет]. 2011 9 июня [цитируется 1 июля 2020 г.]; 117 (23): 6143–51. Доступно по адресу: https: // ashpublications.org / blood / article-pdf / 117/23/6143/1340052 / zh802311006143.pdf. pmid: 21357766
- 37. Хейман Б., Вигзелл Х. Иммунорегуляция с помощью моноклональных антител IgG, специфичных к эритроцитам барана: подавление коррелирует с уровнем связывания антигена, а не с изотипом. J Immunol. 1984; 132 (3).
- 38. Гетахун А., Хейман Б. Исследования механизма, с помощью которого антиген-специфический IgG подавляет реакции первичных антител: доказательства маскировки эпитопа и снижения локализации антигена в селезенке.Scand J Immunol [Интернет]. 1 сентября 2009 г. [цитировано 1 июля 2020 г.]; 70 (3): 277–87. Доступен по телефону: pmid: 19703017
- 39. Карлссон MCI, Вернерссон С., Де Стол Т.Д., Густавссон С., Хейман Б. Эффективное IgG-опосредованное подавление первичных ответов антител у мышей с дефицитом рецептора Fcγ. Proc Natl Acad Sci U S A [Интернет]. 2 марта 1999 г. [цитируется 1 июля 2020 г.]; 96 (5): 2244–9. Доступно по адресу: www.pnas.org. pmid: 10051626
- 40. Кэдди С.Л., Вайсбурд М., Крыло М, Фосс С., Андерсен Дж. Т., О’Коннелл К. и др.Внутриклеточная нейтрализация ротавируса VP6-специфическим IgG. PLoS Pathog [Интернет]. 2020 1 августа [цитируется 10 сентября 2020 г.]; 16 (8): e1008732. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/32750093/.
- 41. Создано с Biorender.com.
- 42. Фуда Г.Г., Мартинес Д.Р., Свами Г.К., Пермар С.Р. Влияние трансплацентарной передачи IgG на иммунитет в раннем возрасте. Иммунохоризонты. 2018 1 января; 2 (1): 14–25. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/29457151/.
- 43.Всемирная организация здоровья. Модель кормления детей грудного и раннего возраста для учебников для студентов-медиков и смежных медицинских работников. 2009. Доступно по ссылке: https://www.who.int/nutrition/publications/infantfeeding/9789241597494/en/
- 44. График иммунизации от рождения до 18 лет | CDC [Интернет]. [цитируется 1 июля 2020 г.]. Доступно по адресу: https://www.cdc.gov/vaccines/schedules/hcp/imz/child-adolescent.html.
- 45. Ding S, Song Y, Brulois KF, Pan J, Co JY, Ren L и др.Передача сигналов ретиноевой кислоты и лимфотоксина способствует дифференцировке М-клеток кишечника человека. Гастроэнтерология [Интернет]. 1 июля 2020 г. [цитировано 10 сентября 2020 г.]; 159 (1): 214–226.e1. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/32247021/. pmid: 32247021
- 46. Туайон Э., Валя Д., Бекварт П., Аль Таба И., Меда Н., Боллор К. и др. B-клетки, полученные из молока человека: популяция высокоактивированных переключаемых клеток памяти, примированных к секретированию антител. J Immunol [Интернет]. 1 июня 2009 г. [цитировано 15 сентября 2020 г.]; 182 (11): 7155–62.Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/19454712/. pmid: 19454712
- 47. Пизик М., Рат Т., Ленсер В.И., Бейкер К., Блумберг Р.С. FcRn: архитектор иммунных и неиммунных функций IgG и альбумина. J Immunol [Интернет]. 2015 15 мая [цитируется 15 сентября 2020 г.]; 194 (10): 4595–603. Доступно по адресу: / pmc / articles / PMC4451002 /? Report = abstract. pmid: 25934922
- 48. Цзян Б., Джонс С., Грум М.Дж., Веласкес Д., Мун С.-С., Парашар Ю.Д. и др. Влияние грудного вскармливания на иммуногенность пероральной живой аттенуированной ротавирусной вакцины человека: рандомизированное испытание на младенцах, не инфицированных ВИЧ, в Соуэто, Южная Африка.Vol. 92, Бюллетень Всемирной организации здравоохранения. 2014. с. 238–45. pmid: 24700991
- 49. Moon SS, Wang Y, Shane AL, Nguyen T., Ray P, Dennehy P et al. Ингибирующее действие грудного молока на инфекционность живых оральных ротавирусных вакцин. Pediatr Infect Dis J. 2010; 29 (10): 919–923. pmid: 20442687
- 50. Ронгсен-Чандола Т., Странд Т.А., Гоял Н., Флем Э., Ратор С.С., Арья А. и др. Влияние отказа от грудного вскармливания на иммунный ответ на живую оральную ротавирусную вакцину у младенцев из Северной Индии.Вакцина. 2014; 32 (S1).
- 51. Грум М.Дж., Мун С.С., Веласкес Д., Джонс С., Коэн А., ван Никерк Н. и др. Влияние грудного вскармливания на иммуногенность пероральной живой аттенуированной ротавирусной вакцины человека: рандомизированное испытание на младенцах, не инфицированных ВИЧ, в Соуэто, Южная Африка. Bull World Health Organ [Интернет]. 2014 [цитировано 7 сентября 2020 г.]; 92 (4): 238–45. Доступно по адресу: / pmc / articles / PMC3967577 /? Report = abstract. pmid: 24700991
- 52. Yih WK, Lieu TA, Kulldorff M, Martin D, McMahill-Walraven CN, Platt R и др.Риск инвагинации после вакцинации против ротавируса у младенцев в США. N Engl J Med [Интернет]. 2014 6 февраля [цитируется 7 сентября 2020 г.]; 370 (6): 503–12. Доступно по адресу: http://www.nejm.org/doi/10.1056/NEJMoa1303164. pmid: 24422676
- 53. Мартинс С., Бейл С., Гарли М.Л., Родригес А., Лисс И.М., Андерсен А. и др. У девочек могут быть более низкие уровни материнских антител к кори и более высокий риск субклинической инфекции кори до достижения возраста вакцинации против кори. Вакцина. 20 августа 2009 г.; 27 (38): 5220–5225. pmid: 19596409
- 54.Уиттл Х., О’Нил К., Марш В., Оби П., Хэнлон П., Хэнлон Л. и др. Испытание высоких доз противокоревой вакцины Эдмонстона-Загреба в Гамбии: реакция антител и побочные эффекты. Ланцет. 8 октября 1988 г., 332 (8615): 811–814. pmid: 2
4 - 55. Garenne M, Leroy O, Beau JP, Sene I. Детская смертность после вакцинации от кори с высоким титром: проспективное исследование в Сенегале. Ланцет. 1991, 12 октября; 338 (8772): 903–907. pmid: 1681265
- 56. Borràs E, Urbiztondo L, Costa J, Batalla J, Torner N, Plasencia A et al.Антитела к кори и ответ на вакцинацию у детей в возрасте до 14 месяцев: влияние на возраст вакцинации. Epidemiol Infect. 2012 сентябрь; 140 (9): 1599–1606. pmid: 22074684
- 57. Кох Дж., Хардер Т., Фон Крис Р., Вичманн О. Инвагинации, связанные с Impfung gegen Rotaviren: Systematisches Review und Metaanalyse. Dtsch Arztebl Int [Интернет], 14 апреля 2017 г. [цитировано 22 июля 2020 г.]; 114 (15): 255–62. Доступно по ссылке: https://pubmed.ncbi.nlm.nih.gov/28468712/.
- 58. Юнг К.Ф., Чонг С.Й., Тхун К.С.Возраст при первой вакцинации против ротавируса и риск инвагинации у младенцев: анализ моделирования общественного здравоохранения. Drug Saf [Интернет]. 2016 1 августа [цитировано 22 июля 2020 г.]; 39 (8): 745–8. Доступно по адресу: https://pubmed.ncbi.nlm.nih.gov/27067440/.
- 59. Bines JE, At Thobari J, Satria CD, Handley A, Watts E, Cowley D и др. Неонатальная ротавирусная вакцина человека (RV3-BB) для воздействия на ротавирус с рождения. N Engl J Med [Интернет]. 2018 22 февраля [цитировано 10 сентября 2020 г.]; 378 (8): 719–30. Доступно по адресу: https: // pubmed.ncbi.nlm.nih.gov/29466164/. pmid: 29466164
- 60. Nguyen TV, Yuan L, Azevedo MSP, Jeong K. Il, Gonzalez AM, Iosef C., et al. Высокие титры циркулирующих материнских антител подавляют эффекторные реакции и В-клетки памяти, индуцированные ослабленным праймированием ротавируса и иммуностимулирующим комплексом ротавирусоподобных частиц, стимулирующим режим вакцинации. Clin Vaccine Immunol. 2006 Апрель; 13 (4): 475–485. pmid: 16603615
- 61. Zhou X, Wang D, Xiong J, Zhang P, Li Y, She R. Защита цыплят, с материнскими антителами или без них, от инфекции IBDV рекомбинантным белком IBDV-VP2.Вакцина. 2010 21 мая; 28 (23): 3990–3996. pmid: 20338216
- 62. Грунтман AM, Flotte TR. Быстро развивающееся состояние генной терапии. FASEB J [Интернет]. 2018 29 апреля [цитировано 16 июня 2020 г.]; 32 (4): 1733–40. Доступно по ссылке: https://onlinelibrary.wiley.com/doi/abs/10.1096/fj.201700982R. pmid: 31282760
Ротавирус | История вакцин
Ротавирус — самая частая причина тяжелой диареи у детей и младенцев во всем мире. До того, как вакцина была введена в Соединенных Штатах, болезнь вызывала более 400 000 посещений врача и 200 000 обращений в отделения неотложной помощи каждый год, что приводило к 60 смертельным исходам ежегодно среди детей младше пяти лет.Ежегодно во всем мире ротавирус убивает около 450 000 детей в возрасте до 5 лет, причем большая часть этих смертей приходится на развивающиеся страны.
Симптомы и возбудительРотавирус — это двухцепочечный РНК-вирус семейства реовирусов. Под электронным микроскопом вирус имеет форму колеса, отсюда и его название ( rota в переводе с латыни означает «колесо»). Несколько видов и подтипов ротавирусов вызывают заболевания у людей.
Самый частый симптом ротавирусной инфекции — водянистая диарея.Это также может вызвать жар, боль в животе и рвоту. Осложнения ротавирусной инфекции описаны ниже.
ТрансмиссияРотавирус распространяется фекально-оральным путем, то есть из отходов инфицированного человека в рот другого человека. Это может произойти через загрязнение рук или предметов, например игрушек. Вирус легко распространяется среди детей, а также может передаваться от детей тем, с кем они находятся в тесном контакте.
Первое заражение ротавирусом обычно вызывает острое заболевание, но более поздние инфекции вызывают более легкие симптомы и часто протекают бессимптомно (то есть не вызывают видимых симптомов).Однако бессимптомные инфекции у взрослых могут привести к передаче вируса близким контактам.
Лечение и уходСпециальных методов лечения ротавирусных инфекций не существует. Скорее, им лечат поддерживающую терапию, такую как пероральная регидратация, отдых и снятие температуры.
ОсложненияПримерно в 1 из 50 случаев ротавирусной болезни у детей развивается тяжелое обезвоживание в результате диареи и рвоты. В этих случаях обычно необходима госпитализация, и детям проводят регидратацию жидкости, вводимой через назогастральный зонд или внутривенно.Своевременная регидратационная терапия обычно приводит к положительному результату, но смерть от ротавируса все еще происходит в развитых странах и, чаще, в развивающихся странах. По оценкам Всемирной организации здравоохранения, в 2008 г. (последний год, по которому имеются данные) умерло около 450 000 случаев смерти от ротавирусной болезни.
Доступные вакцины и кампании вакцинацииПервая вакцина против ротавируса, RotaShield, была лицензирована и рекомендована для плановой иммунизации детей в 1998 году.Однако Wyeth Pharmaceuticals отозвала вакцину в 1999 году из соображений безопасности. Ученые связали вакцину с редкой кишечной проблемой, называемой инвагинацией, потенциально фатальным телескопированием части кишечника.
Никакая ротавирусная вакцина не была доступна до 2006 года, когда Консультативный комитет по практике иммунизации рекомендовал плановую иммунизацию младенцев тремя дозами недавно лицензированной вакцины RotaTeq, разработанной доктором философии Х. Фредом Кларком, доктором медицины Стэнли А. Плоткиным и Полом А.Оффит, МД. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов лицензировало другую ротавирусную вакцину, Ротарикс, для использования в Соединенных Штатах в 2008 году. Ротарикс вводят младенцам в двух дозах. Обе вакцины вводятся перорально в виде капель.
CDC тщательно отслеживает заболеваемость ротавирусной инфекцией в Соединенных Штатах с 2000 года. Их исследования показывают, что количество положительных результатов тестов на ротавирус было значительно ниже, чем в среднем за период 2000-2006 годов. Кроме того, похоже, что количество госпитализаций по поводу острого гастроэнтерита снизилось на 16% в 2007 году и на 45% в 2008 году по сравнению с предыдущим периодом.По оценкам исследователей, вакцинация против ротавируса предотвратила около 55 000 госпитализаций в 2008 году.
Во всем мире ротавирус продолжает наносить ущерб. Около 450 000 детей в возрасте до 5 лет умирают ежегодно от ротавирусной болезни. Предпринимаются усилия по обеспечению доступности ротавирусной вакцины во всем развивающемся мире, где смертность от ротавирусной болезни более распространена. Мексика была одной из первых стран, получивших ротавирусную вакцину в 2006 году; к сезону ротавируса 2009 г. смертность от диарейных заболеваний снизилась как среди целевой группы населения для вакцинации (дети младше 11 месяцев, где уровень смертности снизился на 40%), так и среди детей в возрасте от одного до двух лет (уровень смертности упала почти на 30%).Тот факт, что смертность снизилась даже в той части населения, на которую вакцина не нацелена, говорит о том, что коллективный иммунитет принес пользу невакцинированным лицам: с меньшим количеством инфекций вначале болезнь циркулировала в популяции меньше, оставляя меньше возможностей для заражения.
Ниже приведены общие рекомендации по вакцинации против ротавируса в США:
Вакцинация против ротавируса рекомендуется для всех детей, начиная с двухмесячного возраста серией из двух или трех доз в течение многих недель, и должна быть завершена к тому времени, когда ребенку исполнится четыре месяца (для серии из двух доз). или шести месяцев (для серии из трех доз).
ИсточникиЦентры по контролю и профилактике заболеваний.
 )
)