Детская вакцинация | Клиника Рассвет
Вакцинация — самый надежный и эффективный метод профилактики инфекционных заболеваний. Иммунопрофилактика обеспечивает защиту от инфекций для миллионов людей во всем мире.
Вакцинация детей в России проводится согласно национальному календарю профилактических прививок (НКПП) вакцинами российского и зарубежного производства. Однако, в идеале, лучше рассмотреть возможность иммунопрофилактики в соответствии с рекомендациями международных врачебных ассоциаций.
Вакцины бывают монокомпонентными и многокомпонентными (комбинированными). Монокомпонентные вакцины защищают от одной, какой-то конкретной инфекции, а многокомпонентные сразу от нескольких. При этом не возрастает антигенная нагрузка на организм и не увеличивается частота осложнений. Также с введением многокомпонентной вакцины связано снижение количества болезненных инъекций, что особенно важно для детей.
Важно знать: кроме БЦЖ, ни у одной вакцины нет противопоказаний для одновременного введения с другими вакцинами.Одновременное введение нескольких вакцин безопасно и не «нагружает иммунитет и организм».
Вакцинация согласно национальному календарю профилактических прививок:
Порядок проведения профилактических прививок согласно НКПП.
Защита ребенка от управляемых инфекций
Идеальный план защиты ребенка от управляемых инфекций составил педиатр клиники Рассвет Сергей Бутрий:
- Не менее чем за 3 месяца до беременности женщине необходимо ввести вакцины против кори и краснухи.
- Во время беременности женщине необходимо вакцинироваться против гриппа (Инфлювак или Ваксигрип) и коклюша (Адасель), однократно.
- Ребенку в роддоме должны ввести первую дозу (V1) против гепатита В и БЦЖм.
- В 1 месяц — вторую дозу (V2) против гепатита В.
- В 2 месяца — V1 Превенар 13 + V1 РотаТек.
- В 3 месяца — V1 Пентаксим (АаКДС + ИПВ + ХИБ) + V2 РотаТек.
- В 4,5 месяца — V2 Пентаксим (АаКДС + ИПВ + ХИБ) + V3 РотаТек + V2 Превенар 13.

- В 6 месяцев — V3 Инфанрикс Гекса (АаКДС + ИПВ + ВГВ + ХИБ) + V3 Превенар 13 (по российскому календарю третья вакцинирующая доза от пневмококка не нужна, в развитых странах вводится трехкратно).
- В 9 месяцев — V1 Менактра.
- В 12 месяцев проводится проба Манту, через 3 дня оценивается и вводится V2 Менактра + V Приорикс Тетра (или по отдельности дивакцина корь + паротит, вакцина против краснухи, вакцина против ветряной оспы Варилрикс).
- В 1 год 3 месяца вводится R Превенар 13 + V2 Варилрикс + V1 Аваксим 80 или Хаврикс 720.
- В 1 год и 6 месяцев — R Пентаксим (АаКДС + ИПВ + ХИБ).
- В 1 год и 9 месяцев — R2 БиВак Полио + V2 Аваксим 80 или Хаврикс 720.
- Далее — до 6 лет — проводятся только ежегодные пробы Манту, ребенка нужно прививать против гриппа осенью (оптимально в сентябре-октябре), с 6 месяцев жизни, в первую осень двукратно, затем каждый год однократно. Также необходимо подумать о прививке против клещевого энцефалита (Клещ-Э-Вак или ФСМЕ Иммун Джуниор) — вводятся две дозы вакцины с минимальным интервалом в месяц перед первым сезоном, одна перед вторым сезоном и далее раз в три года по одной.

- В 6 лет вводится R дивакцина корь + паротит + R вакцина против краснухи.
- В 6,5 лет — R2 Адасель или R2 АДС-м + R1 Менактра.
- В 9 лет — V1 Гардасил или Церварикс.
- В 9 лет 6 месяцев — V2 Гардасил или Церварикс.
- В 14 лет — R3 АДС-м + R3 БиВак Полио + R2 Менактра.
- До 18 лет проводятся ежегодные пробы Манту и вакцинация против гриппа.
С иммунопрофилактикой связано много мифов и суеверий, в основном они транслируют «непоправимый вред для организма». Конечно же, это не так. Благодаря вакцинации детей и взрослых значительно снижается уровень предотвратимых заболеваний, а распространенность некоторых из них (например, полиомиелита) уже удалось свести к минимуму.
Часто родителям, вакцинирующим своих детей, приходится сталкиваться с т. н. ложными медицинскими отводами. Многие врачи считают легкую простуду, проявления аллергии и пищевой непереносимости показателями для переноса сроков вакцинации. Доказательная медицинская практика показывает, что действительным противопоказанием для своевременной вакцинации можно считать только острое проявление заболеваний среднего и тяжелого течения. Истинными пожизненными или долгосрочными противопоказаниями являются сильная реакция на введение предыдущей вакцины (и другие, содержащие тот же самый аллерген) и иммунодефицитные состояния (справедливо только для живых вакцин). То же самое касается и недоношенных детей — ожидание подвергает их высокому риску заражения инфекциями.
Доказательная медицинская практика показывает, что действительным противопоказанием для своевременной вакцинации можно считать только острое проявление заболеваний среднего и тяжелого течения. Истинными пожизненными или долгосрочными противопоказаниями являются сильная реакция на введение предыдущей вакцины (и другие, содержащие тот же самый аллерген) и иммунодефицитные состояния (справедливо только для живых вакцин). То же самое касается и недоношенных детей — ожидание подвергает их высокому риску заражения инфекциями.
Лучше всего делать прививки вовремя, но в большинстве случаев существует возможность наверстать упущенное.
Если по каким-то причинам, вы не делали прививок ребенку или выбились из графика, для составления догоняющего графика вакцинации запишитесь на консультацию к педиатру или иммунологу Рассвета.
Вакцинация защитит вашего ребенка от множества инфекций, способствующих возникновению серьезных заболеваний, — некоторые из них плохо поддаются лечению и существенно снижают качество жизни.
Рутинная вакцинация помогает остановить глобальное распространение инфекционных заболеваний в общей популяции и косвенно (за счет коллективного иммунитета) защищает людей, которым по каким-то причинам противопоказано введение вакцин (ослабленный иммунитет из-за лечения, иммунодефицитные состояния и пр.).
Вакцины не являются причиной аутизма, не ослабляют иммунитет, в них не содержатся опасные для здоровья компоненты, перед выходом на рынок каждая вакцина проходит многоэтапную проверку.
После введения вакцины могут наблюдаться незначительные нежелательные явления: отек и покраснение кожи в месте инъекции, небольшое повышение температуры и легкая слабость в течение 1-2 суток. Критические осложнения возникают крайне редко, о них необходимо незамедлительно сообщить врачу.
Инфекционные заболевания можно легко предотвратить с помощью своевременной иммунопрофилактики. Преимущества вакцинации перевешивают ее риски, это доказано многочисленными исследованиями.
Прививка АДСМ
Проводим вакцинацию от столбняка и дифтерии. Безопасно, быстро, в 8 районах Санкт-Петербурга.
АДСМ (АДС) — это вакцина, используемая для прививки от столбняка и дифтерии – инфекционных заболеваний, опасных развитием осложнений и летальным исходом.
Дифтерия – острое бактериальное заболевание, проявляется тяжелой интоксикацией, воспалением рото- и носоглотки, поражением сердечно-сосудистой системы, почек, печени и др. Дифтерия преимущественно передается воздушно-капельным путем (в редких случаях контактно-бытовым). Риск заражения при контакте с больным очень высок.
Столбняк – крайне опасное бактериальное заболевание с высокой вероятностью смертельного исхода. Болезнь протекает стремительно, поражая нервную систему и вызывая сильные судороги, мышечный гипертонус и боль. Заражение столбняком чаще всего происходит через попадание возбудителя из почвы, воды, загрязненных предметов в рану, ожог или поврежденную слизистую.
Дифтерия и столбняк практически не поддаются лечению сверхсильными антибиотиками, и даже при успешном выздоровлении риск грозных осложнений очень велик. Обезопасить себя от заражения можно с помощью своевременной вакцинации АДСМ. Прививка во взрослом возрасте обеспечивает защиту на 10 лет.
Другие названия: вакцинация АДСМ, вакцинация АДС, прививка АДС, вакцинация от столбняка, вакцинация от дифтерии, прививка от столбняка, прививка от дифтерии
Кому и в каких случаях необходима прививка АДСМ?
Вакцинация АДСМ нужна всем, кто хочет обезопасить себя от столбняка и дифтерии. В детском возрасте прививка проводится планово дважды — в 7 и 14 лет. Взрослым людям с 18 лет необходимо самостоятельно повторять вакцинацию каждые 10 лет на протяжении всей жизни. Ограничений по возрасту нет.
Прививка АДСМ особенна необходима лицам с нарушенным режимом вакцинации — непривитым в детском возрасте, привитым однократно, а также в случаях, когда после последней вакцинации прошло более 20 лет.
Как проводится вакцинация от столбняка и дифтерии?
Прививка АДСМ ставится посредством инъекции строго внутримышечно. Подкожное введение вакцины чревато неэффективностью в связи с медленным попаданием препарата в кровь.
Чаще всего укол производится в верхнюю треть плеча. В некоторых случаях возможно введение вакцины в бедро или подлопаточную область.
Есть ли противопоказания к прививке?
Вакцина АДСМ хорошо переносится и крайне редко приводит к побочным реакциям. Тем не менее существуют общие и специфические противопоказания, о которых следует предварительно сообщить врачу.
К общим противопоказаниям относятся острые и хронические заболевания в стадии обострения, ВИЧ, туберкулез, беременность.
Противопоказаниями непосредственно к АДСМ будут являться тяжелые реакции на препарат и заболевания центральной нервной системы.
Какие документы понадобятся для проведения вакцинации от кори?
В центрах «Медкомиссии №1» для вакцинации понадобится только паспорт. При наличии возьмите с собой прививочный сертификат с информацией о проведенных прививках.
При наличии возьмите с собой прививочный сертификат с информацией о проведенных прививках.
Куда и когда можно обратиться?
Сделать прививку АДСМ можно в любом удобном центре «Медкомиссия №1». Мы работаем в 8 районах Санкт-Петербурга и имеем все необходимые лицензии. В наших клиниках используются только проверенные безопасные вакцины, предоставляется консультация врача.
Почему стоит обратиться к нам?
Надежно — наши центры имеют все необходимые лицензии на данный вид услуг. Вакцинация проводится сертифицированными специалистами с большим опытом работы. Используется только высококачественные препараты.
Быстро – запись на услугу доступна по телефону и в онлайн режиме на сайте, где вы можете выбрать удобное время и ближайший филиал. Процедура вакцинации и консультация терапевта займет несколько минут.
Удобно – наши медицинские центры расположены в 8 районах Санкт-Петербурга и работают без выходных.
Получить консультацию или записаться на прием можно по телефону +7 (812) 380-82-54
Записаться на прием >>>
Дифтерия — острое инфекционное заболевание бактериальной природы
Дифтерия — острое инфекционное заболевание, вызываемое дифтерийной палочкой (коринебактерия), характеризующееся воспалительным процессом с образованием фибринозной пленки на месте внедрения возбудителя, явлениями общей интоксикации в результате поступления в кровь экзотоксина, обусловливающее тяжелые осложнения по типу инфекционно-токсического шока, миокардита, полиневрита и нефроза.
Возбудитель дифтерии передается воздушно-капельным путем: при непосредственном контакте, реже через инфицированные предметы обихода (посуда, белье, игрушки, книги), возможна передача и через третьих лиц. Описаны пищевые вспышки (инфицированные молочные продукты).
Источник заражения дифтерией — только человек, больной или носитель дифтерийной палочки. Наиболее часто при дифтерии поражается ротоглотка, реже — дыхательные пути, нос, гортань, трахея. Встречается дифтерийное поражение глаза, уха, половых органов, кожи.
Наиболее часто при дифтерии поражается ротоглотка, реже — дыхательные пути, нос, гортань, трахея. Встречается дифтерийное поражение глаза, уха, половых органов, кожи.
Осложнения. Наиболее характерны осложнения со стороны сердечно-сосудистой системы (миокардит), периферической нервной системы (невриты и полиневриты) и почек (нефротический синдром).
Прививки от дифтерии
Прививка от дифтерии. В допрививочные времена наблюдались периодические подъемы заболеваемости каждые 5–8 лет; они продолжались 2–4 года. Подъем заболеваемости сопровождался увеличением числа тяжелых форм и повышением летальности. При охвате прививками не менее 95–97% детей декретированных возрастов прекращаются периодические и сезонные подъемы заболеваемости дифтерией.
Основное значение в профилактике дифтерии имеет вакцинация. С этой целью применяют анатоксин дифтерийный, представляющий собой дифтерийный токсин, лишенный токсических свойств, адсорбированный на гидроксиде алюминия.
Прививка от дифтерии детям. Для профилактики дифтерии у детей в России используются комбинированные вакцины:
- Вакцина АКДС (Россия),
- Пентаксим (Авентис),
- Инфарикс (Глаксо),
- Инфанрикс Гекса (Глаксо).
Вакцина АКДС состоит из смеси корпускулярной коклюшной вакцины, дифтерийного и столбнячного анатоксинов.
В одной вакцинирующей дозе такой вакцины (0,5 мл) содержится не менее 10 млрд убитых коклюшных микробных клеток, 15 антигенных (флоккулирующих) единиц (ЛФ) дифтерийного анатоксина и 5 антитоксинсвязывающих единиц (ЕС) столбнячного анатоксина. Вакцина содержит гидроокись алюминия в качестве адъюванта, могут обнаруживаться следовые количества формальдегида. В качестве консерванта используют мертиолят (1:10 000).
АДС-анатоксин представляет собой очищенные и адсорбированные дифтерийный и столбнячный анатоксины. В одной вакцинирующей дозе (0,5 мл) содержится 30 ЛФ дифтерийного анатоксина и 10 ЕС столбнячного анатоксина. Прочие компоненты такие же, как и в вакцине АКДС.
Прочие компоненты такие же, как и в вакцине АКДС.
АДС-М-анатоксин отличается от АДС уменьшенным содержанием антигенов — в одной прививочной дозе (0,5 мл) содержится 5 ЛФ дифтерийного анатоксина и 5 ЕС столбнячного анатоксина.
Курс Вакцинации
Курс первичной вакцинации проводят с 3-месячного возраста вакциной АКДС троекратно с интервалом 45 дней.
Первая ревакцинация проводится вакциной АКДС через 12 мес после 3-й вакцинации, вторая ревакцинация — с 7 лет АДС-М-анатоксином, третья — в 14 лет и далее каждые 10 лет АДС-М-анатоксином.
Если почему-либо первую вакцинацию проводят в возрасте от 4 до 6 лет, то в этом случае вводят АДС-анатоксин двукратно с интервалом 45 дней с ревакцинацией через 9–12 мес.
Если почему-либо первую вакцинацию проводят в возрасте от 6 лет и старше, а также взрослых, то в этом случае вводят АДС-М-анатоксин также двукратно с интервалом 45 дней, но с ревакцинацией через 6–9 мес после введения 2-й дозы.
По желанию вместо вакцины АКДС можно использовать вакцины:
Все вакцинные препараты, содержащие дифтерийный анатоксин, мало реактогенны.
Прививки от дифтерии взрослым. Прививки от дифтерии в России взрослым проводят однократно комбинированной вакциной АДС-М каждые 10 лет, начиная от последней прививки в возрасте 14-16 лет (далее в 24-26 лет, 34-36 лет и т.д.). Если взрослый не помнит, когда он прививался от дифтерии последний раз, ему необходимо получить прививку АДС-М двукратно с интервалом 45 дней и с однократной ревакцинацией через 6–9 мес после введения 2-й дозы.
Реакции на введение проявляются умеренным повышением температуры тела, легким недомоганием в течение суток после вакцинации. Возможны также покраснение, припухание, болезненность в месте инъекции, редко бывают быстропроходящие эфемерные высыпания.
Тяжелые осложнения маловероятны. Если они все же встречаются (судороги, анафилактический шок, неврологические реакции), нельзя исключить интеркуррентные заболевания или отнести их на счёт других компонентов комбинированных вакцин.
Противопоказания к прививке от дифтерии практически отсутствуют. У детей с легкими проявлениями ОРВИ вакцинацию можно начинать сразу после нормализации температуры тела, а при среднетяжелых и тяжелых острых инфекционных болезнях — через 2 нед после выздоровления. Всем остальным больным (с хроническими заболеваниями печени, почек, легких и т.д.; гемобластозами; иммунодефицитами) вакцинацию проводят в период ремиссии под контролем врача кабинета иммунопрофилактики по индивидуальным схемам.
У непривитых дифтерия протекает тяжело, с преобладанием токсических и комбинированных форм, присоединением осложнений и часто с летальным исходом. У привитых может быть носительство, преобладают локализованные формы, гладкое течение, благоприятный исход.
Дифтерия у привитых детей возможна при снижении уровня иммунитета. Причинами недостаточного иммунитета могут быть нарушения схемы вакцинации и ревакцинации. Возможно также снижение напряженности иммунитета после инфекционных заболеваний. У привитых детей нечасто наблюдают токсические формы болезни, не встречается дифтерия дыхательных путей, не бывает тяжелых комбинированных форм. Осложнения редки, летальных исходов не отмечено.
У привитых детей нечасто наблюдают токсические формы болезни, не встречается дифтерия дыхательных путей, не бывает тяжелых комбинированных форм. Осложнения редки, летальных исходов не отмечено.
Данная публикация подготовлена специалистами в области иммунопрофилактики, сотрудниками Кафедры инфекционных болезней у детей (Ассоциация педиатров-инфекционистов) ГБОУ ВПО РНИМУ имени Н.И. Пирогова Минздравсоцразвития России с использованием материалов Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Территориального управления Роспотребнадзора по городу Москве, данных и рекомендаций Всемирной организации здравоохранения, а также других международных организаций.
Прививка от дифтерии
Варианты вакцин
Вакцины против дифтерии производятся на основе дифтерийного анатоксина, являющегося модифицированным бактериальным токсином, который индуцирует защитный антитоксин.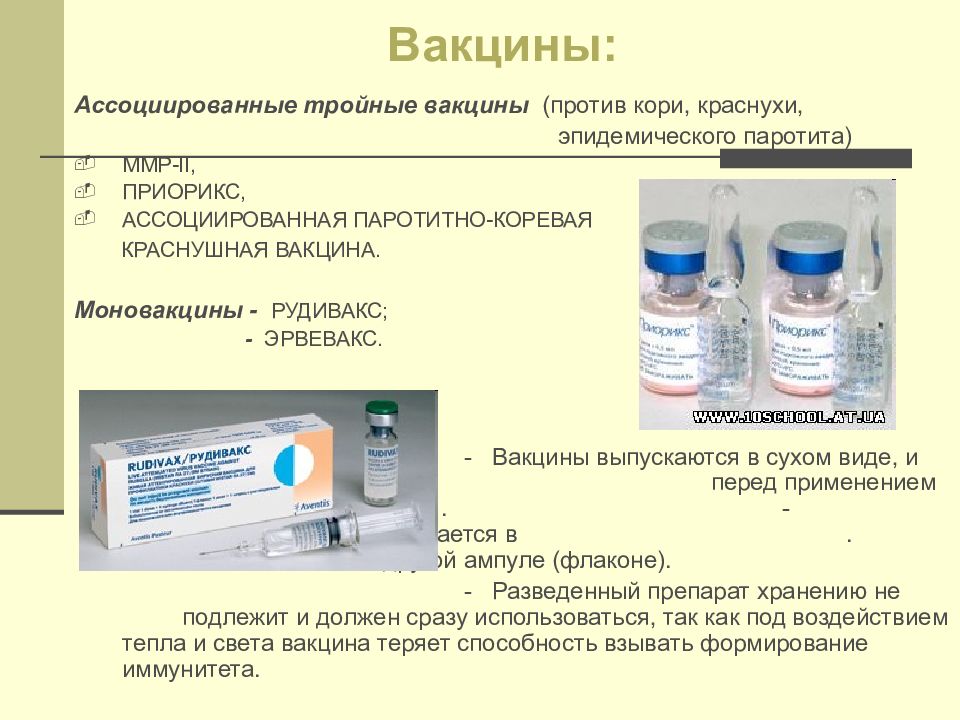 Прививка для профилактики дифтерии представляет собой анатоксин, адсорбированный на алюминия гидроксиде. Дифтерийный анатоксин выпускается также в комбинации со столбнячным анатоксином (прививки АДС, АДС-м) и коклюшной вакциной (цельноклеточной – АКДС, Бубо-М, Бубо-Кок; и бесклеточной, или ацеллюлярной – Инфанрикс, Пентаксим, Тетраксим, Инфанрикс Пента, ИнфанриксГекса). Профилактические прививки позволяют создать длительный и напряжённый антитоксический иммунитет от дифтерии.
Прививка для профилактики дифтерии представляет собой анатоксин, адсорбированный на алюминия гидроксиде. Дифтерийный анатоксин выпускается также в комбинации со столбнячным анатоксином (прививки АДС, АДС-м) и коклюшной вакциной (цельноклеточной – АКДС, Бубо-М, Бубо-Кок; и бесклеточной, или ацеллюлярной – Инфанрикс, Пентаксим, Тетраксим, Инфанрикс Пента, ИнфанриксГекса). Профилактические прививки позволяют создать длительный и напряжённый антитоксический иммунитет от дифтерии.
Прививка АКДС состоит из смеси корпускулярной коклюшной вакцины, дифтерийного и столбнячного анатоксинов. АДС-анатоксин представляет собой очищенные и адсорбированные дифтерийный и столбнячный анатоксины. АДС-М-анатоксин отличается от АДС уменьшенным содержанием антигенов — в одной прививочной дозе (0,5 мл) содержится 5 ЛФ (единица измерения активности компонентов) дифтерийного анатоксина и 5 ЕС (единица измерения активности компонентов) столбнячного анатоксина (для сравнения, в 0,5 мл прививки АДС содержится 30 ЛФ дифтерийного анатоксина и 20 ЕС столбнячного анатоксина).
Все вакцины для профилактики дифтерии, столбняка и коклюша являются инактивированными (убитыми), то есть они не содержат ничего живого. Известно, что отдельные антигены в чистом виде и инактивированные вакцины уступают по эффективности живым вакцинам. В этой связи в качестве усилителя (т.н. адъюванта) прививки против дифтерии, столбняка, коклюша (и ряда других инфекций) используется гидроокись алюминия. Смысл использования этого вещества заключается в усилении воспалительной реакции в месте введения вакцин и, как следствие, интенсификации иммунных реакций и увеличении эффективности прививки в целом.
Принципы и цели вакцинации
Дифтерия – крайне опасное своими осложнениями заболевание, для ее профилактики необходима вакцинация. Производство вакцин – сложный многоступенчатый процесс. Дифтерийный анатоксин получают из токсина, продуцируемого дифтерийным микробом. Микроорганизмы культивируют в жидкой питательной среде, в которую они выделяют токсин. Полученную среду тщательно освобождают от микробных клеток, а затем обрабатывают, чтобы полностью обезвредить токсин, сохранив только его иммунизирующую активность. Дифтерийный анатоксин контролируется по нескольким показателям (приняты ВОЗ в 1965 г.): прежде всего, на безопасность, то есть полноту обезвреживания токсина. Этот показатель проверяют на чувствительных животных, вводя им дозу, в 50-100 раз превышающую дозу для человека, что позволяет выявить следовые количества недообезвреженного токсина. После теста на безопасность его проверяют на возможность возврата токсических свойств. С этой целью очищенный анатоксин инкубируют в течение шести недель при разных температурных режимах, а затем опять проводят контрольный тест на животных.
Дозировка — у детей с 3-х месяцев до 4 лет — три прививки от дифтерии по 0,5 мл с интервалом 6 недель, с последующей ревакцинацией через 12 месяцев после третьей прививки; у детей старше 4 лет и взрослых – две прививки от дифтерии по 0,5 мл с интервалом 4-6 недель с последующей ревакцинацией через 9-12 месяцев.
После проведения серии первичной иммунизации средняя продолжительность защиты от дифтерии составляет около 10 лет. Далеко не все знают, что во взрослом возрасте показана ревакцинация ассоциированным дифтерийно-столбнячным анатоксином с уменьшенным содержанием антигена (АДС-м) каждые 10 лет.
Эффективность вакцин
Введение в 1994 г. массовой иммунизации населения страны против дифтерии с повторной ревакцинацией взрослых в 2003-2004 гг. позволило обеспечить достаточную специфическую защиту населения от этой инфекции. В совокупности с многолетним надзором это привело к снижению заболеваемости дифтерией в России с 26,8 в 1994 г. до 0,01 на 100 тыс. населения в 2009-2011 гг. В течение периода 1980-2000 гг. общее число зарегистрированных случаев дифтерии было снижено более чем на 90%.
Все компоненты АКДС-вакцин способны формировать иммунитет практически у 100% привитых.
Побочные реакции
После введения адсорбированных препаратов (внутримышечно или подкожно) на месте инъекции может некоторое время сохраняться небольшое уплотнение, которое не опасно для организма.
Прививки АКДС являются наиболее реактогенными, «тяжелыми» вакцинами детского возраста. В среднем побочные реакции встречаются у трети привитых, причем не на каждую прививку. Пик частоты реакций отмечается, как правило, на третье и четвертое введения вакцины, что совпадает с пиковыми показателями выработки иммунитета. Они проявляются умеренным повышением температуры тела, легким недомоганием в течение суток после вакцинации. Возможны также покраснение, припухание, болезненность в месте инъекции, редко бывают быстропроходящие эфемерные высыпания. Реакции в месте введения прививки от дифтерии в целом отмечаются у 15-25% привитых: покраснение (1-2%) и отечность (1-2%), вызванные иммунным воспалением в месте введения вакцины и действием адъюванта. Боль в месте укола (вероятность около 15%, проявляется тем, что при движениях ребенок «бережет» ножку и плачет) также является следствием воспалительной реакции.
Общие реакции на прививку от дифтерии в среднем отмечаются у 20% привитых: повышение температуры тела (до 30%), прочие (беспокойство или, наоборот, заторможенность, рвота, понос, нарушения аппетита). Как правило, все побочные реакции на АКДС-вакцины развиваются не позднее 24 (72) часов после прививки, длятся не более 24 (48) часов и не требуют лечения.
Риск поствакцинальных осложнений
Как и на введение любой другой вакцины, в редких случаях возможны аллергические реакции на компоненты АКДС-вакцины. Эти осложнения связаны не со свойствами прививки, а с количеством вспомогательных веществ в конкретных препаратах, наличием у ребенка аллергии к ним и, в части случаев, несоблюдением правил вакцинации. Показателен тот факт, что, согласно статистике поствакцинальных осложнений в США, даже тяжелые аллергические реакции на АКДС-вакцины не привели к тяжелым последствиям ни в одном случае с 1978 года, с учетом того, что за этот период было сделано около 80 млн прививок против дифтерии. К вероятным специфическим осложнениям на прививки АКДС можно отнести неврологические осложнения, которые крайне редки. Как предполагается, они могут быть вызваны тем, что токсины коклюшной палочки (даже инактивированной) в комбинированных вакцинах имеют свойство раздражать, у крайне небольшой части восприимчивых детей, мозговые оболочки.
Редкими проявлениями неврологических осложнений на прививку от дифтерии могут быть: судороги без повышения температуры – 0,3-90 на 100 тыс. прививок, осложнения в виде энцефалопатии – менее 1 случая на 300 тысяч привитых. В настоящее время в мире судороги без повышения температуры не считают осложнением на прививку. Исследования, проведённые в Великобритании в 1960-1970 гг. свидетельствуют об одинаковой частоте развития судорог у привитых и непривитых детей. При этом первые проявления таких заболеваний как эпилепсия, органическое поражение головного мозга могут проявляться в виде судорог в возрасте 3-4 месяцев, когда начинают проводить вакцинацию, и связаны с прививкой только временным фактором.
Противопоказания
Помимо общих противопоказаний к вакцинации против дифтерии, таких как острое заболевание, аллергия к компонентам прививок и тяжелый иммунодефицит (при котором формирование иммунитета невозможно), АКДС-вакцины временно или абсолютно противопоказаны в случае, если у ребенка имеется прогрессирующая патология нервной системы, либо отмечались судороги без повышения температуры (афебрильные). В этом случае дети прививаются вакциной от дифтерии без коклюшного компонента (прививка АДС). Временными и относительными противопоказаниями являются обострение хронических заболеваний (прививки можно проводить вне обострений), недавно перенесенная острая респираторная инфекция (ОРИ) (прививки против дифтерии можно проводить сразу после выздоровления). Следует заметить, что в США легкая ОРИ не является противопоказанием, и прививки могут быть проведены, в том числе, на фоне незначительного повышения температуры, кашля, насморка. Также противопоказанием является развитие сильных общих и местных реакций на предшествующее введение АКДС прививки (повышение температуры выше 40 С, отек и гиперемия в месте введения вакцины свыше 8 см в диаметре).
Когда прививать?
Курс первичной вакцинации против дифтерии проводят детям с 3-месячного возраста троекратно, с интервалом 45 дней. Первая ревакцинация проводится прививкой АКДС через 12 месяцев после 3-й вакцинации, вторая ревакцинация — с 7 лет АДС-М-анатоксином, третья — в 14 лет, и далее взрослым– каждые 10 лет АДС-М-анатоксином.
Прививка АДСМ
Что такое дифтерия и столбняк?
Дифтерия — это опасная инфекция, острое заболевание, передающееся в основном воздушно-капельным путем, однако вероятен и контактно-бытовой способ (больше характерно для теплого времени года). Возбудителем является бактерия Corynebacterium diphtheriae или, как говорят в народе, дифтерийная палочка. Болезнь проявляется в течение 2-5 дней и поражает ротоглотку, гортань, печень, почки, и даже сердечно-сосудистую систему.
Столбняк — это еще одна разновидность острого инфекционного заболевания. В данном случае в роли возбудителя выступают споры бактерии Clostridium tetani. Они могут присутствовать в почве, органах и фекалиях животных, на металлических инструментах и др. Наиболее распространенный способ заражения — когда возбудитель инфекции попадает в организм человека через рану. Симптоматика проявляется в течение двух недель. Болезнь очень опасна, и при отсутствии экстренной помощи грозит летальным исходом. Столбняк разрушает нервную систему, возможны судороги, спазмы челюсти, затрудненное глотание, конвульсии, мышечный гипертонус, температура и головная боль. Избежать риска заразиться можно благодаря своевременной вакцинации.
Против дифтерии и столбняка проводится вакцинация АДС (анатоксин дифтерийно-столбнячный) или АДСМ. Во втором случае речь идет о малой дозировке препарата. Он необходим для тех, кому противопоказан АКДС (препарат с компонентом коклюшного анатоксина).
Кому и когда нужна эта прививка?
Вакцинация необходима всем и в любом возрасте. Лучше всего начинать прививать ребенка еще в младенчестве- прививка существенно снизит угрозу заражения в дальнейшем. Далее ее делают в подростковом возрасте — в 14 лет, а начиная с совершеннолетия, вакцинацию необходимо проводит каждые 10 лет после предыдущей.
Как проводится процедура?
Препарат вводится однократно с помощью инъекции в плечо или под лопатку.
Существуют ли противопоказания?
Традиционно вакцина противопоказана тем, у кого имеется аллергия на компоненты препарата, а также при таких патологиях иммунитета как иммунная недостаточность, опухоли, иммунные инфекции. Кроме этого, не стоит делать прививку тем, у кого была отрицательная реакция на нее в предыдущий раз.
Запись на вакцинацию АДСМ доступна по телефону +7 (499) 922-88-19 или на нашем сайте.
Записаться на прием >>>
Вакцинация против дифтерии, столбняка и коклюша (АКДС) и против полиомиелита
В 3 месяца начинается вакцинация против коклюша, дифтерии, столбняка, полиомиелита. В Национальный календарь защита от данных инфекций введена в 1953 году, а против столбняка с 1966. Для вакцинации используются следующие вакцины:
— АКДС – это адсорбированная комбинированная вакцина, которая содержит убитую цельную коклюшную палочку (поэтому она еще называется цельноклеточная), анатоксин (обезвреженный токсин) дифтерийный и анатоксин столбнячный. Это российская вакцина (Микроген) и ее использование практически ликвидировало дифтерию и столбняк и заметно уменьшило число случаев коклюша.
Единственное, что не нравится многим родителям – это подъем температуры в первые сутки – это вариант нормальной реакции на вакцинацию, так как клетки иммунной системы начинают активно работать в ответ на контакт с обломками коклюшной палочки.
Но вакцинопрофилактика постоянно совершенствуется, и в настоящее время выпускаются вакцины бесклеточные (или ацеллюлярные). Данные вакцины содержат только 2 или 3 коклюшных антигена, в их составе нет целой коклюшной палочки (до 3000 коклюшных антигена). Но на сегодня подобные вакцины только зарубежного производства. В России зарегистрировано несколько подобных вакцин:
— первая вакцина, зарегистрированная в России в начале 2000 годов – Инфанрикс (ГлаксоСмитКляйн, Бельгия). Вакцина содержит 3 коклюшных антигена, дифтерийный и столбнячный анатоксины.
— несколько позже зарегистрирована вакцина Инфанрикс гекса (ГлаксоСмитКляйн. Бельгия). В дополнение к составу предыдущей вакцины здесь содержится еще инактивированная вакцина против полиомиелита, гепатита В и вакцина Хиберикс (против гемофильной палочки, которая является причиной осложнений при ОРВИ у детей раннего возраста).
— Пентаксим (Санофи, Франция), зарегистрирована и с успехом применяется в России с 2008 года. В своей комбинации данная вакцина содержит еще и инактивированную (убитую) вакцину против полиомиелита, вакцину против гемофильной палочки.
В редакции основного приказа по вакцинации в рамках Национального календаря N125н от 13.04.2017 есть следующие дополнения – определены дети из группы риска для вакцинации против гемофильной палочки и полного курса вакцинации инактивированной полиомиелитной вакциной:
- С иммунодефицитными состояниями;
- С анатомическими дефектами, приводящими к резко повышенной опасности заболевания гемофильной инфекцией;
- С аномалиями развития кишечника;
- С онкологическими заболеваниями и /или длительно получающим иммуносупрессивную терапию;
- Рожденные от матерей с ВИЧ инфекцией;
- Находящиеся в домах ребенка;
- Недоношенные и маловесные дети.
Вакцинация и ревакцинация детям, относящимся к группам риска, может осуществляться иммунобиологическими лекарственными препаратами для иммунопрофилактики инфекционных болезней, содержащими комбинации вакцин (например, Пентаксим), предназначенных для применения в соответствующие возрастные периоды (редакция приказа МЗ РФ N 175н от 13.04.2017г).
Дети, не входящие в группу риска, могут по желанию родителей привиться бесклеточными препаратами для вакцинации против коклюша, дифтерии и столбняка платно. Информацию в таком случае можно получить у участкового педиатра.
Могут быть и другие варианты вакцинации детей, что зависит от возможностей регионального бюджета.
В 2016 году в России зарегистрирована вакцина Адасель (Санофи, Франция), она также не содержит целую коклюшную палочку, а содержание дифтерийного и столбнячного анатоксинов в составе меньше, чем в других препаратах. Данная вакцина, в основном, предназначена для ревакцинации детей старше 4 лет и взрослых (после 14 лет можно каждые 10 лет), так как иммунитет против коклюша недлительный.
Для детей, кто не привит вовремя и имеет возраст старше 4 лет, по Национальному календарю прививаются только против дифтерии и столбняка (вакцинация АКДС препаратом проводится до 4 лет, препаратом Инфанрикс гекса до 36 мес), но по желанию родителей может быть выполнена вакцинация и препаратами Пентаксим и Инфанрикс, так как они не имеют возрастных ограничений.
Для вакцинации против полиомиелита также существуют изменения в Национальном календаре с 2014 года.
Если раньше для массовой вакцинации с 1958-59 годов использовали живую ослабленную вакцину Сэбина (она содержала 3 вакцинных штамма полиовируса), далее для предупреждения вакциноассоциированного полиомиелита у привитых и у контактных непривитых с 2014 года схема вакцинации изменилась:
-V1 и V2 все дети получают инактивированную вакцину в 3 мес. и в 4,5 мес.,
-V3 в 6 мес. и последующие ревакцинации в 1 г 6 мес., 1 г 8 мес. и в 14 лет получают оральной полиомиелитной вакциной ОПВ, причем с весны 2017 года ОПВ содержит только 2 штамма прививочных вирусов – I и III- БиВак полио (ФНЦИРИП им Чумакова, Россия).
Инактивированные вакцины, зарегистрированные в России:
- Имовакс Полио (Санофи, Франция) – применяется на сегодня в составе комбинированной вакцины Пентаксим,
- Полиорикс (ГлаксоСмитКляйн, Бельгия) – применяется на сегодня в составе комбинированной вакцины Инфанрикс гекса,
- Полимилекс (Нанолек, Россия) – применяется для проведения V1 и V2 против полиомиелита с весны 2017 г.
Дифтерия – это серьезная инфекция, которой болеют и взрослые, и дети. Причина инфекции – дифтерийная палочка, которая передается воздушно-капельным путем, иногда через общие игрушки, предметы быта. Дифтерия поражает нос, глотку, гортань, реже – кожу, глаза. У больного образуются пленки в зеве, которые могут распространиться в нос и гортань и перекрыть дыхание. У детей до года пленки сразу переходят на гортань, голосовые связки, появляется круп (отек гортани). В этих случаях требуются неотложные мероприятия, иначе человек задохнется. Кроме того, дифтерия чревата серьезными осложнениями – поражением сердца, почек, нервной системы. Избежать заболевания можно только при своевременной вакцинации. Вакцинация защищает от токсина, вырабатываемого бактерией дифтерии, который и вызывает все жизнеугрожающие состояния.
Привитые люди не болеют тяжелой опасной формой дифтерии. У них возможно развитие ангины, но жизни это не угрожает.
Столбняк (тетанус) – острая инфекция с поражением нервной системы, вызванное токсином, который выделяет столбнячная палочка, когда попадает в рану из земли. Столбняк протекает крайне тяжело и может развиться в любом возрасте. Токсин поражает нервную систему, при этом возникают мышечные спазмы и судороги. Смертность при столбняке достигает 90%. Иммунитет при вакцинации формируется против токсина, как и при дифтерии.
Коклюш – заболевание с особым поражением дыхательной системы, характеризуется приступообразным «спазматическим» кашлем. Ребенок «заходится» в кашле до рвоты, покраснения лица и появлением мелких кровоизлияний на лице, склерах глаз. Особенно приступы кашля беспокоят ночью и под утро Коклюш опасен осложнениями- воспалением легких, а у маленьких детей – смертью из-за апноэ – остановки дыхания, судорогами и поражением мозга из-за кислородного голодания
Полиомиелит – вызывается тремя типами полиомиелитных вирусов, передаётся с водой и пищей. От полиомиелита, как правило, не умирают, но может остаться паралич или парез, чаще одной ноги, при котором конечность постепенно худеет и укорачивается, а ребенок или тяжело хромает, или совсем не может двигаться без поддержки. Иногда развивается паралич дыхательных мышц и человек не может дышать без помощи специальных аппаратов.
Вакцины АКДС и инактивированная против полиомиелита вводятся внутримышечно в переднебоковую поверхность бедра.
План вакцинации.
Вакцинация АКДС и против полиомиелита начинается в 3 мес. После проведения вакцинации и ревакцинации АКДС (см ниже), согласно календарю прививок, проводятся ревакцинации взрослых каждые 10 лет (вакциной АДС-М).
Вакцинация детей согласно календарю прививок:
|
Возраст |
|
|
Первая вакцинация АКДС и Полимилекс |
3 месяца |
|
Вторая вакцинация АКДС и Полимилекс |
4,5 месяца |
|
Третья вакцинация АКДС и БиВак полио
Ревакцинация 2 Бивак полио
Ревакцинация 2 АДС-м
Ревакцинация 3 АДС-м и БиВак полио
|
6 месяцев
20 месяцев
7 лет
14 лет |
Побочные эффекты.
Вакцина АКДС вызывает умеренные побочные эффекты: небольшая лихорадка в первые сутки; умеренная болезненность, покраснение и припухание в месте инъекции может возникнуть при V 3 или R 1. Повышение температуры тела (как правило, не выше 37,5 С) и легкое недомогание также могут наблюдаться в течение 1-2 дней после прививки, редко (до 4 % может быть подъем t выше 38). При t выше 38,5 необходимо дать в домашних условиях жаропонижающие препараты по рекомендации врача парацетамол или ибупрофен. В случае повторного подъема t или недостаточного ответа на жаропонижающие препараты нужно вызвать педиатра или скорую помощь и объем необходимой терапии назначит врач. Обтирания водкой или спиртом не рекомендуется.
У детей, склонных к аллергическим реакциям, может быть сыпь, поэтому педиатр может назначить противоаллергические препараты до и после вакцинации.
Серьезные осложнения, вызванные АКДС – иммунизацией редки; они происходят меньше чем в одном проценте случаев. Это могут быть судороги на фоне высокой температуры, поэтому детей с возможной реакцией рекомендуется прививать на фоне жаропонижающих средств (парацетамол или ибупрофен).
Для того, чтобы уменьшить число побочных эффектов на цельноклеточную АКДС вакцину, её можно заменить комбинированным аналогом (вакцина Пентаксим, Инфанрикс), в которых цельноклеточный коклюшный компонент (до 3000 антигенов) заменен на бесклеточный вариант (2-3 антигена), который практически не вызывает побочных реакций. Кроме того, комбинированные вакцины значительно снижают инъекционную нагрузку, позволяют уменьшить суммарную дозу дополнительных веществ (стабилизаторы вакцин, консерванты).
После прививки коклюша иммунитет недолгосрочный и спустя 5-7 лет можно заболеть коклюшем. Для ревакцинации в 7 лет, 14 лет и далее ч/з 10 лет можно использовать вакцину Адасель. Единственное, привитые могут заболеть в более стертой форме – в диагнозе может звучать бронхит или пневмония, может не быть характерных приступов спазматического кашля, но для непривитых такой больной является источником инфекции.
10 ответов на вопросы о вакцинации от дифтерии
Комаровский: «Корь покажется сладкой ягодкой на тортике, а вот тортик — это дифтерия»Про вероятную дифтерию заговорили даже некоторые большие начальники. Общество с изумлением узнало, что прививаться от дифтерии надобно не только детям, но и взрослым. Поскольку начальники ничего конкретного не говорят, а у меня по сотне писем в день на тему «как мне быть» — отвечаю на основные вопросы и разъясняю основные непонятности. Вопросы «где что есть?» и «что почем?» — это, уж простите, не ко мне.
10 ОТВЕТОВ НА ВОПРОСЫ ПРО ВАКЦИНАЦИЮ ВЗРОСЛЫХ ОТ ДИФТЕРИИ
1. Вакцины для детей и взрослых — разные. Во «взрослых» вакцинах доза (количество вещества, что должно вызвать иммунитет) меньше — как правило, в два раза. Ими прививают не только взрослых, но и детей «не совсем раннего возраста» — некоторые вакцины, например АДС-М, применяют для иммунизации людей старше 7 лет, другие, например «Бустрикс», — старше 4 лет.
2. Буква «М» в названии вакцины АДС-М как раз и указывает на то, что в ней содержится уменьшенная доза. А еще возможны такие написания: «DT» — вакцина от дифтерии и столбняка, «Td» — маленькая буква «d» в названии означает в два раза уменьшенную дозу.
3. Вакцины для взрослых «только от дифтерии» на практике не применяются. Реально используются либо дифтерия+столбняк (DT), либо дифтерия+столбняк+коклюш (DTP).
4. Как надо прививать взрослых от дифтерии по правилам? Вот так: начинают в детстве — 3 дозы в первый год жизни, по 1 дозе в 1,5 года, 6 и 16 лет. Затем каждые 10 лет — в 26, 36, 46 и т. д.
5. Ученые всего мира продолжают спорить, и предмет спора выглядит так: «каждые 10 лет надо прививаться от дифтерии и столбняка или все-таки каждые 10 лет надо прививаться от дифтерии, столбняка и коклюша?». Вопрос о целесообразности вакцинации от дифтерии раз в 10 лет не стоит в принципе — надо, надо однозначно!
6. Совет: если у вас есть возможность купить вакцину для взрослых с коклюшным компонентом — настоятельно рекомендую привиться и от коклюша, особенно если в ближайшие годы вы планируете заводить детей. Вакцины для профилактики коклюша бывают цельноклеточные и дополнительно очищенные, т. н. «ацеллюлярные». После возраста 7 лет рекомендуется применять только ацеллюлярные вакцины. Про буквы: «DTР» — вакцина от дифтерии, столбняка и коклюша; «DTаР» — вакцина от дифтерии, столбняка и коклюша, но коклюш ацеллюлярный; «Tdap» — вакцина для взрослых от дифтерии, столбняка и коклюша, коклюш ацеллюлярный, уменьшенная доза коклюша и дифтерии — оптимальный вариант, рекомендуемый читателям старше 7 лет (из того, что есть на рынке, этому сочетанию букв соответствуют «Boostrix» и «Adacel»).
7. Вопрос: «Что делать, если правильно привиты в детстве, но пропустили необходимые вакцинации (в 26, 36, 46 и т.д.)?» Ответ: получить 1 дозу вакцины вне зависимости от того, 36 вам или 56 лет.
8. Вопрос: «Что делать, если в детстве не прививались, или привиты неправильно, или не знаем — привиты или нет?» Ответ: получить три дозы — сначала первая доза, через месяц — вторая, через 6 месяцев после второй — третья.
9. Дополнительная вакцинация от коклюша, дифтерии и столбняка обязательна для беременных. То есть вопрос не в том, «можно ли беременным»! Именно беременным нужно в первую очередь!
10. Комбинированная вакцина (дифтерия+столбняк+коклюш — Tdap) вводится однократно при каждой беременности во 2-м или 3-м триместре (оптимально — на сроке 26–37 недель). В любом случае вакцинацию следует завершить не менее чем за 2 недели до предполагаемой даты родов.
Ненейроинвазивная вакцина против ВПГ-1 R2 обеспечивает защиту от генитальных инфекций ВПГ-2 на модели морской свинки
Неудача субъединичной вакцины gD2 в недавнем клиническом испытании 14 продемонстрировала, что необходимы новые подходы к вакцинам против ВПГ, особенно те, которые представляют несколько антигенов HSV. R2 является привлекательным кандидатом, потому что он специфически удаляется для ретроградного транспорта аксонов и, следовательно, не может вторгаться в периферическую и центральную нервные системы, как первоначально было продемонстрировано на мышах и подтверждено здесь на морских свинках 17 .Потенциальная полезность не нейроинвазивного варианта ВПГ в качестве вакцины высоко ценится. Однако ранние мутантные вирусы, которые были аттенуированы по нейротропизму, обычно имели более широкие дефекты репликации in vivo, что ограничивало презентацию антигена 19 . Совсем недавно были созданы живые аттенуированные мутантные вирусы, которые уменьшают проникновение в нейроны и показывают обнадеживающие результаты в качестве кандидатов в вакцины 20,21,22,23 . Конструкция R2 предлагает другое решение проблемы производства вируса, который размножается на периферии, вызывая сильный иммунный ответ, не засевая нервную систему и не вызывая скрытой инфекции.Вместо того, чтобы регулировать тропизм ткани, R2 выборочно устраняет ретроградный аксональный транспорт, который является фундаментальным для нейроинвазии 17 . Дизайн оставляет все вирусные антигены нетронутыми для повышения эффективности вакцины 17,24,25 .
Таким образом, селективное устранение ретроградной доставки в нервную систему является привлекательным подходом для разработки вакцин против HSV 26,27 , потому что это снижает опасения, что живая ослабленная вакцина HSV может стать латентной, возможно, реверсивной или рекомбинирующей, или впоследствии вызвать осложнения, если иммунная система будет ослаблена или нарушена 3,26 .Аналогичным образом устранены опасения, что стойкий вирус вакцины HSV может способствовать нейродегенеративным заболеваниям, таким как болезнь Альцгеймера 9,10 .
Вакцина R2 кодирует мутантный ген UL37 17 Белок pUL37 содержит три эволюционно консервативных поверхностно-экспонированных области: R1, R2 и R3 28 . Мутация R2 продуцирует вирусы, которые обычно размножаются на периферических участках инокуляции, но не могут проникнуть в нервную систему за счет ретроградного транспорта аксонов, не могут установить латентную инфекцию и являются авирулентными 17 .Способность выборочно устранять нейроинвазивные свойства этих вирусов, не нарушая иным образом их репликацию и, следовательно, индукцию иммунитета, представляет собой интригующую парадигму иммунизации. Первоначальное использование вакцины HSV-1 R2 отражает важность HSV-1 при генитальных инфекциях HSV и важность перекрестной защиты, поскольку и HSV-1, и HSV-2 являются важными патогенами человека. Доказательства перекрестной защиты можно найти во многих экспериментах на животных. В недавнем клиническом испытании вакцина gD2 была более защищающей от ВПГ-1, чем ВПГ-2 14 .Тем не менее, производное R2 HSV-2 будет производиться для определения дальнейшего повышения эффективности вакцины.
В описанных здесь экспериментах мы сначала оценили ослабление вакцины R2 после вагинальной инокуляции морских свинок, полагая, что это чувствительная и хорошо описанная модель патогенеза HSV. Интересно, что хотя родительский штамм F был ослаблен по сравнению со штаммом 17syn + HSV-1 у морских свинок, как мы уже отмечали ранее 26 , производное R2 было дополнительно ослаблено, не нейроинвазивно и авирулентно.Таким образом, R2 также не обнаруживался в DRG ни на ранней стадии инфицирования, ни на 28-й день, когда можно было легко обнаружить родительский штамм F и штамм 17 syn + дикого типа.
Затем мы оценили защиту, обеспечиваемую вакциной R2 против вагинального заражения HSV-2. R2 вводили тремя путями (IM, ID и IVag), и его эффективность сравнивали с вакциной gD2 + MPL / Alum, аналогичной той, которая использовалась в клинических испытаниях 14 . Это сравнение было предназначено для определения того, был ли R2 по крайней мере таким же эффективным, как субъединичная вакцина, и был ли R2 более эффективным в важных исходах, касающихся рецидивов заболевания и рецидивирующего выделения вируса.Поэтому мы использовали генитальную модель морской свинки, потому что она однозначно позволяет оценить эти критические конечные точки. Более подробно о достоинствах этой модели можно прочитать в недавнем обзоре 29 .
Защита была обнаружена с помощью иммунизации R2 с использованием всех трех путей вакцинации, но путь ID был неизменно наиболее эффективным. Важно отметить, что ID-введение вакцины R2 индуцировало более высокие уровни нейтрализующих антител и обеспечивало большую защиту, чем вакцина с субъединицей gD2 по нескольким параметрам.Возможно, это было связано с улучшенной нейтрализующей реакцией против мальков и / или способностью живых аттенуированных вирусных вакцин вызывать опосредованный Т-клетками иммунитет, превышающий иммунитет субъединичных вакцин. Учитывая обнадеживающие результаты, полученные с помощью R2, необходим более подробный анализ коррелятов защиты, который будет изучен в рамках будущих исследований.
Оценка острого заболевания показала, что только у 1/12 животных, вакцинированных R2 методом ID, развились острые поражения по сравнению с 10/12 у животных, вакцинированных имитацией вакцины.Это выгодно по сравнению с 5/12 животными, получавшими вакцину gD2. Вакцинация IVag R2 также была эффективной (4/12), но в меньшей степени, чем путь ID. Повышенная защита после вакцинации ID также наблюдалась при сравнении острой вагинальной репликации, где log 10 среднего геометрического титра (GMT) вируса был самым низким в группе ID сразу после заражения ( P <0,05 по сравнению с вакциной gD2). Защита DRG, сайта латентного вируса, также была обнаружена наряду с уменьшением рецидивирующего заболевания и повторного выделения вируса в некоторых группах.Например, латентный контрольный вирус HSV-2 был обнаружен только у 1/12 животных, иммунизированных R2 путем ID или gD2 + MPL / Alum. Точно так же оценка рецидивов поражения снизилась с 5,3 до 1,3 и 1,4 в группах R2 ID и gD2 соответственно.
Возможно, наиболее важным является то, что рецидивирующее выделение вируса сократилось на 33–64% в каждой из групп, вакцинированных R2, тогда как группа gD2 + MPL / Alum не показала никаких преимуществ. Это особенно важно, потому что периодическое выделение вируса является основным средством передачи ВПГ.Следует отметить, что использованный здесь анализ кПЦР выявляет ДНК ВПГ, что не обязательно указывает на наличие инфекционного вируса 30 . Например, в предыдущем эксперименте, где 5–11% мазков из влагалища морских свинок были положительными на ДНК ВПГ, ни один из них не был положительным по культуре 31 . Таким образом, результаты, полученные с вакцинацией R2, могут недооценивать ее способность ограничивать распространение трансмиссивного вируса.
Поскольку ни одна вакцина против ВПГ еще не доказала свою эффективность клинически, неясно, какие конечные точки вагинальной модели морской свинки будут предсказывать защиту при оценке на людях.В описанных здесь экспериментах вакцинация R2 путем ID защищала большинство животных от острого заболевания и имела наибольшее снижение репликации острого вируса. Вакцинация R2 также снизила обнаружение латентного вируса в DRG, а также уменьшила рецидивирующее заболевание и периодическое выделение. Для сравнения, вакцина gD2 MPL / квасцы не приводила к значительному снижению количества животных с острым заболеванием, острым титром вагинального вируса или рецидивирующим выделением вагинального вируса. Только дальнейшие клинические оценки вакцин, которые были оценены на этой модели морской свинки, позволят лучше понять предсказуемость.
Есть несколько аномалий, на которые следует указать в наших данных. Наиболее важным является несоответствие между количеством животных с латентным вирусом, обнаруженным в DRG, и повторяющимся выделением. Это наиболее очевидно в группе gD2 MPL / квасцы, где вакцинация заметно снизила количество животных с обнаруживаемым латентным вирусом и количество рецидивов поражения, но не повлияла на количество рецидивирующих дней с выделением вируса. Следует отметить, что существует очень значимая корреляция между латентной вирусной нагрузкой и оценками рецидивов поражения ( P <0.001), но не повторяющиеся дни линьки ( P = 0,12), когда в анализ включены все животные. Кроме того, аналогичные результаты были отмечены при оценке другого живого ослабленного вируса, VC2 26 , где VC2 уменьшал количество животных с обнаруживаемым вирусом в DRG и повторяющиеся дни выделения, в то время как вакцина gD2 MPL / Alum только уменьшала количество животные с обнаруживаемым вирусом в DRG, но без дней выделения.
Хотя в настоящее время мы не можем согласовать эти находки, одно из возможных объяснений состоит в том, что gD2 MPL / Alum не защищен от инвазии и реактивации HSV-2 из другого латентного сайта, возможно, автономных нейронов 32 .Также возможно, что иммунный ответ, индуцированный субъединичными вакцинами, превращает то, что могло бы быть рецидивирующим поражением, в бессимптомные эпизоды выделения. Таким образом, в группе, иммунизированной gD2, было меньше рецидивов поражений, но больше эпизодов повторяющегося выделения. В любом случае это может быть важным ограничением для единичных вакцин. Неспособность внутримышечного пути обеспечить защиту также любопытна, поскольку внутримышечная вакцинация обеспечивала защиту с использованием другой живой ослабленной вакцины против ВПГ-2, VC2 26 . Однако в экспериментах, представленных здесь, ID-путь индуцировал значительно более высокие уровни нейтрализующих антител по сравнению с IM-вакцинацией.Также следует отметить, что ID-маршрут с использованием gD2 MPL / Alum здесь не оценивался и может обеспечить улучшенную защиту по сравнению с IM.
Хотя использование ID-вакцинации чаще ассоциируется с убитыми вакцинами, такими как грипп, оценка ID-введения модифицированной вакцины против осповакцины Анкара, вакцины против поксвируса, выявила сильный ранний местный и системный воспалительный ответ 33 . ID-путь также является мощным индуктором резидентных в ткани Т-клеток 34 , что может быть важным для защиты от инфекций HSV 35,36 .
Таким образом, живая вакцина R2 HSV-1 значительно ослаблена в вагинальной модели морской свинки и, что наиболее важно, не заражает нервную систему в пределах обнаружения. Вакцинация R2, особенно путем ID, обеспечивала защиту от острого заболевания, рецидивирующего заболевания и рецидивирующего выделения вируса, что было равно или превосходило вакцину gD2 + MPL / Alum. Мы считаем эти результаты весьма обнадеживающими, особенно учитывая, что R2 является вирусом HSV-1 и оценивался на предмет перекрестной защиты от заражения HSV-2.
Новое исследование демонстрирует способность кандидата генерировать антитела, ограничивать распространение вируса — ScienceDaily
Генетически отредактированная форма вируса простого герпеса, измененная таким образом, чтобы не дать ему укрыться в нервной системе и ускользнуть от иммунного ответа, превзошла результаты ведущий кандидат на вакцину в новом исследовании Университета Цинциннати, Северо-Западного университета и Университета Небраски-Линкольн.
Исследование, опубликованное 6 ноября в журнале Nature Vaccines , показало, что вакцинация морских свинок модифицированным живым вирусом значительно увеличивает выработку антител против вируса.При заражении вирулентным штаммом вируса простого герпеса у вакцинированных животных обнаруживалось меньше поражений половых органов, меньшая репликация вируса и меньшее выделение вируса, что с большей вероятностью распространяло инфекцию на других.
Модифицированный вирус на самом деле является формой вируса простого герпеса 1 типа, наиболее известного тем, что вызывает герпес вокруг губ. По словам исследователей, тот факт, что она продемонстрировала перекрестную защиту от ВПГ типа 2 — типа, передающегося половым путем, обычно ответственного за генитальный герпес — предполагает, что версия вакцины, специфичная для ВПГ-2, может оказаться еще более эффективной.
По оценкам Всемирной организации здравоохранения, более 500 миллионов человек болеют вирусом простого герпеса 2 типа, который сохраняется всю жизнь и часто обостряется в ответ на стресс. Помимо образования волдырей, ВПГ-2 увеличивает риск заражения ВИЧ и может способствовать развитию болезни Альцгеймера или других форм деменции.
Несмотря на широкое распространение вирусов, более четырех десятилетий исследований еще предстоит привести к утвержденной вакцине против ВПГ-1 или ВПГ-2. Отчасти сложность: альфа-герпесвирусы, в состав которых входит ВПГ, разработали особенно изощренный способ уклонения от иммунных реакций, направленных на их уничтожение.
После заражения слизистых оболочек рта или мочеполовых путей ВПГ проникает к кончикам сенсорных нервов, которые передают сигналы, ответственные за ощущение боли, прикосновения и т.п. Затем с помощью специализированного молекулярного переключателя вирус проникает в нервную клетку, путешествуя по молекулярному эквиваленту троллейбуса, который транспортирует его по нервному волокну в ядро сенсорного нейрона. В то время как инфекция слизистой оболочки вскоре устраняется иммунным ответом, инфицированные нейроны становятся убежищем от иммунной системы организма, а вирус простого герпеса уходит только при повышении уровня стероидов или других гормонов, вызывающих стресс.
Гэри Пикард и Патрисия Солларс из Небраски, наряду с Грегори Смитом из Северо-Западного университета и Екатериной Хельдвейн из Университета Тафтса, потратили годы на изучение того, как предотвратить попадание вируса простого герпеса в безопасную нервную систему. Хельдвейн продвинула эти усилия, когда она охарактеризовала архитектуру определенного белка альфа-герпеса, pUL37, который, по мнению группы, был неотъемлемой частью вируса, движущегося по нервным волокнам. Компьютерный анализ, основанный на этой архитектуре, показал, что три области белка могут оказаться важными для этого процесса.
ЗатемСмит осторожно извлек и заменил пять кодонов, основную кодирующую информацию в ДНК, из вирусного генома каждой области. Исследователи надеялись, что эти мутации могут помочь предотвратить проникновение вируса в нервную систему.
Их надежды оправдались, когда Пикард и Солларс ввели мышам вирус, модифицированный в области 2, или R2, белка. Вместо того чтобы проникать глубже в нервную систему, вирус застрял на нервном окончании. Но команда также знала, что изменение HSV может иметь непредвиденные последствия.
«Вы можете предотвратить попадание вируса в нервную систему», — сказал Пикард, профессор ветеринарной медицины и биомедицинских наук из Небраски. «Это не так сложно сделать, сделав широко изнуряющие мутации. Но когда вы подавляете вирус настолько, что он плохо размножается, вы не получаете надежного иммунного ответа, который может защитить вас от будущих воздействий».
Итак, исследователи были воодушевлены, когда дальнейшие исследования показали, что R2-мутировавший вирус эффективен в качестве вакцины для мышей.Более того, он позволил обойти некоторые упрямые проблемы, которые возникли при использовании других подходов к вакцинам. Некоторые подходы включают вызов иммунной системе только подмножеством компонентов ВПГ или антигенов, заставляя организм распознавать их, но потенциально упускать другие. Некоторые модифицировали вирус так, чтобы он мог реплицироваться только один раз, предотвращая длительное сохранение в нервной системе, но также уменьшая распространение в тканях слизистой оболочки и, как следствие, устойчивый иммунный ответ.
«Итак, одна и та же история повторяется снова и снова: либо ваша субъединичная вакцина не содержит достаточного количества антигенов, либо вы делаете живой вирус настолько больным, что он не очень хорошо работает, чтобы вызвать иммунный ответ», — сказал Пикард.«Вот почему мы с таким оптимизмом смотрим на нашу платформу R2, потому что она позволяет избежать всех этих проблем».
Дэвид Бернштейн, исследователь из Медицинского центра детской больницы Цинциннати, который оценивает кандидаты на вакцины от герпесвируса в рамках программы, поддерживаемой Национальными институтами здравоохранения, отметил успехи команды и обратился к Смиту из Northwestern в 2018 году. Вооруженный формой, модифицированной R2 В отношении HSV-1 Бернштейн решил проверить его эффективность против HSV-2 инфекции на морских свинках.Какими бы многообещающими ни были их предыдущие результаты, Пикард признал, что не был уверен, что вакцина против ВПГ-1 будет справляться с задачей создания иммунитета против ВПГ-2.
Но только у одной из дюжины инокулированных R2 морских свинок развились острые поражения после инъекции HSV-2, по сравнению с пятью из 12 животных, получивших другую многообещающую вакцину-кандидат, которая недавно не прошла клинические испытания на людях. В то время как последний кандидат на вакцину не оказал заметного влияния на количество дней, в течение которых морские свинки выделяли вирус, вакцина R2 сократила период выделения с 29 дней до примерно 13.И в отличие от морских свинок, не получавших вакцину, или других кандидатов, у тех, кто получал вакцину R2, не было никаких признаков ВПГ-2 в кластере клеток мозга, в котором он обычно находится. Между тем, количество нейтрализующих антител у морских свинок, инокулированных R2, было примерно в три раза выше, чем у тех, которым была инокулирована другая вакцина-кандидат.
«Тот факт, что выделение вируса было так сильно подавлено с помощью вакцины R2, действительно важен, потому что именно выделение вируса — даже если оно не вызывает поражений — может затем передать вирус», — сказал Пикард.«Если у вас генитальный герпес, вы можете передать его своей второй половинке, даже не зная, что вы это делаете. Это очень проблематично. Так что тот факт, что проливной герпес был так сильно сбит, — действительно хороший знак».
С версией вакцины R2 от HSV-1, демонстрирующей такую многообещающую перекрестную защиту от ее аналога, передающегося половым путем, в список дел исследователей теперь входит создание и тестирование вакцины HSV-2 против вируса HSV-2.
«Если вы создаете антитела против белков этого конкретного вируса, вполне естественно, что это будет работать лучше, чем если вы создаете антитело против чего-то, что немного отличается», — сказал он.«Так что это наши ожидания».
«ОЖИДАЕТСЯ ОГРОМНОЕ ВОЗДЕЙСТВИЕ»
Примерно в то время, когда Бернштейн и его программа NIH проявили интерес к дизайну вакцины R2, Пикард и Смит запустили стартап Thyreos LLC, нацеленный на дальнейшую разработку и, в конечном итоге, лицензирование своего дизайна вакцины R2.
Пригодно для пары исследователей из Небраски и Иллинойса, дуэт работает над вакцинами для домашнего скота — крупного рогатого скота и свиней, в частности, — которые борются с собственными альфа-герпесвирусами.У крупного рогатого скота вирус герпеса крупного рогатого скота может вызывать респираторные заболевания, снижать аппетит и даже способствовать абортированию телят, что ежегодно приводит к потере доходов в миллиарды долларов. Хотя модифицированная вакцина против живого вируса для крупного рогатого скота существует, она также попадает в нервную систему крупного рогатого скота. И это, как сказал Пикард, может вызвать проблемы у крупного рогатого скота так же легко, как и у людей.
«В таком случае, когда этих коров загружают в грузовик и отправляют на откормочную площадку, это создает стрессовую среду», — сказал он.«Вирус, скрывающийся в иммунной системе, снова активируется. Они начинают выделять вирус из выделений в носу, и затем они могут передать этот вирус другим животным на этом загоне, и у крупного рогатого скота может появиться респираторное заболевание.
«Так что тот факт, что наши модифицированные R2 вирусы не проникают в нервную систему, — это не просто академическая вещь. На самом деле, это имеет реальное практическое применение в животноводстве».
Готовясь приступить к новой серии исследований, которые, как они надеются, продемонстрируют превосходство конструкции R2 над существующей в отрасли вакциной, Пикард и Смит также начинают первоначальный раунд начального финансирования предприятия.
Учитывая, что команда первоначально разработала свой дизайн R2 на основе альфа-герпесвируса, поражающего свиней — так называемого вируса псевдобешенства, — Пикард также выразил уверенность в обещании этого дизайна защитить свиней. В конце 1990-х — начале 2000-х годов Соединенные Штаты провели успешную кампанию по искоренению псевдобешенства в стране, в основном с помощью вакцинации. Однако, как и в случае с крупным рогатым скотом, вакцина может проникать в нервную систему свиней и оказалась менее успешной в странах, которые менее бдительны в отношении вспышек.
«Опять же, мы вполне уверены, что наша вакцина против вируса псевдобешенства R2 будет более эффективной, чем то, что было раньше», — сказал Пикард. «Что касается защиты свиней, в какой-то момент это будет иметь большое значение.
«Эти патогены могут выжить при транспортировке через Тихоокеанский регион в кормовых ингредиентах или кормовых продуктах. Когда вы разговариваете с людьми, обеспокоенными биобезопасностью, они говорят, что все, что происходит в других частях мира с этими вирусами, в конечном итоге может показать здесь.Это просто вопрос времени ».
Интраназальная вакцинация телят химерным белком Mannheimia haemolytica, содержащим главный поверхностный эпитоп липопротеина внешней мембраны PlpE, нейтрализующий эпитоп лейкотоксина и субъединицу B холерного токсина
Это исследование было проведено для определения того, ковалентно ли связана интраназальная вакцинация телят-отъемышей говядины химерным белком, содержащим иммунодоминантный поверхностный эпитоп Mannheimia haemolytica PlpE (R2) и нейтрализующий эпитоп лейкотоксина (NLKT) с субъединицей B усеченного холерного токсина (CT) ( CTB) может стимулировать секреторные и системные антитела против M.haemolytica при повышении устойчивости крупного рогатого скота к внутрибронхиальному заражению M. haemolytica. Шестнадцать телят-отъемышей были интраназально вакцинированы химерным CTB-R2-NLKT (SAC102) или химерным белком R2-NLKT-R2-NLKT (SAC89) с нативным CT или без него в дни 0 и 14 и заражены внутрибронхиально на 28 день. vitro, SAC102 связывал молекулу рецептора СТ, GM (1) -ганглиозида. Средние антитела IgA к цельным клеткам (WC) M. haemolytica и к LKT были высокими в день 0. Небольшое, но значительное увеличение (p <0.05) был обнаружен в средних назальных антителах к M. haemolytica WC для вакцинированных SAC89 + CT и SAC102 после второй вакцинации. SAC102 стимулировал значимые (p <0,05) средние сывороточные ответы антител ко всем трем антигенам к 28 дню. После контрольного заражения средние антитела к WC и LKT значительно увеличились (p <0,05) для групп SAC102, SAC89 и SAC89 + CT со средним антителом. ответы на rPlpE, стимулированные вакцинацией SAC102, были значительно выше (p <0,05), чем для других вакцинированных и контрольных групп.На 1 день после заражения средний клинический балл для контрольной группы был значительно выше (p <0,05), чем для вакцинированных SAC102 и SAC89 + CT, а на 2 день после заражения клинический балл для контрольной группы был значительно выше (p < 0,05), чем для всех трех вакцинированных химерными вакцинами групп. Таким образом, интраназальная вакцинация химерными белками CTB-R2-NLKT (SAC102) и R2-NLKT-R2-NLKT (SAC89) повышала устойчивость к внутрибронхиальному заражению бактерией, а также стимулировала ответы антител на M.haemolytica антигены.
Вакцинация значительно снижает заболеваемость, инвалидность, смертность и неравенство во всем мире
FE Andre
a , R Booy b , HL Bock c , J Clemens d , SK Datta c , TJ John e , BW Lee f , S Lolekha g , H Peltola h , TA Ruff i , M Santosham j , HJ Schmitt kВведение
Вакцинация значительно снизила бремя инфекционных заболеваний.Только чистая вода, которая также считается одним из основных прав человека, работает лучше. 1 Парадоксально, но шумное лобби по борьбе с вакцинами сегодня процветает, несмотря на неоспоримый успех программ вакцинации против ранее внушающих страх болезней, которые сейчас редко встречаются в развитых странах. 2
Понятно, что безопасность вакцин привлекает больше внимания общественности, чем эффективность вакцинации, но независимые эксперты и ВОЗ показали, что вакцины намного безопаснее терапевтических лекарств. 2 , 3 Современные исследования стимулировали разработку менее реактогенных продуктов, таких как бесклеточные коклюшные вакцины и вакцины против бешенства, производимые на клеточной культуре. Сегодня вакцины имеют отличные показатели безопасности, и было доказано, что большинство «опасений по поводу вакцинации» являются ложными тревогами. 4 , 5 В некоторых странах ошибочные соображения безопасности привели к снижению охвата вакцинацией, что привело к повторному появлению коклюша и кори. 6
Обычно сообщается о предполагаемых проблемах безопасности вакцины, тогда как обзоров преимуществ вакцины мало.Поиск в Medline за последние пять лет с использованием ключевых слов «риски вакцины» дал примерно в пять раз больше результатов (2655 против 557), чем поиск в Medline с использованием «преимуществ вакцины» в качестве ключевых слов. 7 Это отражает тот факт, что отрицательные аспекты вакцинации получают гораздо больше внимания, чем положительные.
Как бороться с движением против вакцины, было проблемой со времен Дженнера. Лучший способ в долгосрочной перспективе — опровергнуть ошибочные утверждения при первой же возможности, предоставив научно достоверные данные.Это легче сказать, чем сделать, потому что противник в этой игре играет по правилам, которые обычно не соответствуют правилам науки. Этот вопрос не будет рассматриваться в данной статье, целью которой является показать, насколько вакцины ценны как для отдельных людей, так и для общества, представить подтвержденные факты и помочь исправить негативное восприятие. Без сомнения, вакцины являются одними из самых эффективных инструментов для укрепления здоровья человека и общества и заслуживают более широкой прессы. 8
Преимущества борьбы с болезнями
Искоренение
Если не существует резервуара в окружающей среде, искорененный патоген не может появиться повторно, если только он случайно или злонамеренно не будет повторно введен людьми, что позволит прекратить вакцинацию или другие профилактические меры.
Хотя ликвидация может быть идеальной целью для программы иммунизации, на сегодняшний день ликвидирована только оспа, что позволяет прекратить рутинную иммунизацию против оспы во всем мире. Потенциально, другие инфекционные заболевания, не имеющие внечеловеческого резервуара, могут быть искоренены при условии наличия эффективной вакцины и специальных диагностических тестов. Ликвидация требует высокого уровня популяционного иммунитета во всех регионах мира в течение длительного периода при надлежащем надзоре. 9 Следующей болезнью, которую необходимо искоренить, является полиомиелит, который по-прежнему представляет собой глобальную проблему. 10 Хотя высокий охват оральной полиовакциной (ОПВ) ликвидировал полиовирус типа 2 во всем мире, передача типов 1 и 3 продолжается в ограниченных районах в нескольких странах. Паралитическое заболевание, вызванное ОПВ, напрямую или в результате возврата к вирулентности, и стойкое выделение вакцины и вируса у лиц с иммунодефицитом — это проблемы, которые еще предстоит решить. В конечном итоге может потребоваться глобальное использование моновалентной ОПВ типа 1 и типа 3 и инактивированной полиовакцины (ИПВ). 10
Ликвидация
Заболевания можно ликвидировать локально без глобального уничтожения возбудителя. В четырех из шести регионов ВОЗ был достигнут значительный прогресс в элиминации кори; передача больше не происходит местным путем, и завоз не приводит к устойчивому распространению вируса. 11 Ключом к этому достижению является более 95% иммунитета населения благодаря схеме двухдозовой вакцинации. Комбинированная вакцина против кори, эпидемического паротита и краснухи (MMR) также может устранить и в конечном итоге искоренить краснуху и эпидемический паротит. 11 Повышение уровня иммунизации против кори в Африке, где охват в 2004 г. составлял в среднем лишь 67%, имеет важное значение для искоренения этой болезни. Уже достигнута элиминация кори в Северной и Южной Америке и кори, эпидемического паротита и краснухи в Финляндии, что в принципе доказывает возможность их окончательной глобальной ликвидации. 12 Также возможно ликвидировать Haemophilus influenzae типа b (Hib) болезнь с помощью хорошо реализованных национальных программ, как показал опыт на Западе. 13
Местная ликвидация не устраняет опасности повторного интродукции, например, в Ботсване, где полиомиелит отсутствует с 1991 г., с завозом полиовируса типа 1 из Нигерии в 2004 г. 14 и в Соединенных Штатах Америки (США), где корь повторно завезена в Индиану. в 2005 году путешественником из Румынии. 15
Устранение болезней с экологическим резервуаром, таких как столбняк, или животных-резервуаров, таких как японский энцефалит и бешенство, может оказаться невозможным, но глобальная ликвидация болезни является достижимой целью, если вакцинация людей (и животных от бешенства) будет поддерживаться на высоком уровне.
Контроль смертности, заболеваемости и осложнений
Для физических лиц
Эффективные вакцины защищают людей, если вводятся до заражения. Предэкспозиционная вакцинация младенцев несколькими антигенами является краеугольным камнем успешных программ иммунизации против группы детских болезней. Эффективность вакцины против инвазивной Hib-инфекции более 90% была продемонстрирована у детей из Европы, коренных американцев, чилийских и африканских детей в крупных клинических исследованиях в 1990-х годах. 13 В Соединенном Королевстве ни у одного младенца, получившего три дозы, не развилось заболевание Hib в краткосрочной перспективе (для долгосрочной защиты могут потребоваться бустеры), и недавние постмаркетинговые исследования подтвердили высокую эффективность вакцинации детей против Hib в Германии и коклюш в Швеции. 13 , 16 , 17
Многие вакцины также могут защитить при введении после контакта — примерами являются бешенство, гепатит B, гепатит A, корь и ветряная оспа. 18
Для общества
По оценкам Эрета, вакцины ежегодно предотвращают почти 6 миллионов смертей во всем мире. 19 В США произошло снижение на 99% заболеваемости девятью болезнями, вакцины против которых рекомендуются на протяжении десятилетий, 20 , что сопровождается аналогичным снижением смертности и последствий болезней.
Такие осложнения, как синдром врожденной краснухи, цирроз печени и рак, вызванные хронической инфекцией гепатита B, или неврологические поражения, вторичные по отношению к кори или эпидемическому паротиту, могут иметь более серьезные долгосрочные последствия, чем острое заболевание.До 40% детей, переживших менингит из-за Hib, могут иметь пожизненные неврологические дефекты. 13
В ходе полевых испытаний было отмечено снижение смертности и заболеваемости от пневмококковой инфекции в Африке к югу от Сахары и ротавируса в Латинской Америке. 21 , 22
Специальные вакцины также использовались для защиты тех, кто больше всего нуждается в защите от инфекционных заболеваний, таких как беременные женщины, больные раком и люди с ослабленным иммунитетом. 18
Смягчение тяжести заболевания
Заболевание может возникнуть у ранее вакцинированных лиц. Такие прорывы бывают первичными — из-за неэффективности вакцины — или вторичными. В таких случаях болезнь обычно протекает легче, чем у непривитых. В немецком исследовании эффективности бесклеточной коклюшной вакцины у вакцинированных лиц, у которых развился коклюш, продолжительность хронического кашля была значительно короче, чем в контрольной группе. 23 Такие выводы были подтверждены в Сенегале. 24 Прорыв при ветряной оспе проявляется слабым жаром, меньшим количеством повреждений кожи и меньшим количеством осложнений 25 , чем невакцинированные случаи. Сообщалось также о более легкой форме заболевания у вакцинированных от ротавирусной вакцины. 22
Профилактика инфекций
Многие вакцины в первую очередь предназначены для предотвращения болезней и не обязательно защищают от инфекции. Некоторые вакцины также защищают от инфекции. Доказано, что вакцина против гепатита А одинаково эффективна (защита более 90%) против симптоматических заболеваний и бессимптомных инфекций. 26 Полная профилактика стойкой инфекции вакцинного типа была продемонстрирована для вакцины против вируса папилломы человека (ВПЧ). 27 Такая защита называется «стерилизующий иммунитет». Стерилизующий иммунитет может ослабевать в долгосрочной перспективе, но защита от болезней обычно сохраняется, потому что иммунная память сводит к минимуму последствия инфекции. 28
Защита непривитого населения
Защита стада
Эффективные вакцины не только защищают иммунизированных, но также могут снизить заболеваемость среди неиммунизированных лиц в сообществе за счет «косвенных эффектов» или «защиты стада».Охват вакциной против Hib менее 70% в Гамбии был достаточным для ликвидации Hib-инфекции, аналогичные результаты наблюдались в популяциях навахо. 29 , 30 Еще одним примером защиты стада является вспышка кори среди детей дошкольного возраста в США, при которой уровень заболеваемости снижался быстрее, чем увеличивался охват. 31 Защита стада может также обеспечиваться вакцинами против диарейных заболеваний, как это было продемонстрировано в отношении оральных вакцин против холеры. 32
«Стадная защита» непривитых происходит, когда достаточная часть группы имеет иммунитет. 33 Снижение заболеваемости превышает долю иммунизированных лиц, потому что вакцинация снижает распространение инфекционного агента за счет уменьшения количества и / или продолжительности выделения патогенов вакцинированными, 34 замедляет передачу. Защита стада, наблюдаемая с помощью ОПВ, включает дополнительный механизм «контактной иммунизации» — вакцины вирусы заражают больше людей, чем те, которым вводили вакцину. 10
Степень охвата, необходимая для прекращения передачи, зависит от основного числа воспроизведений ( R 0), определяемого как среднее количество передач, ожидаемых от одного первичного случая, введенного в полностью восприимчивую популяцию. 34 Болезни с высоким значением R 0 (например, корь) требуют более высокого охвата для достижения защиты стада, чем болезнь с более низким R 0 (например, краснуха, полиомиелит и Hib).
Благодаря защите стада некоторые болезни можно устранить без 100% вакцинации.
Сушка источника
Сушка источника — это понятие, связанное с защитой стада. Если определенная подгруппа определена как резервуар инфекции, таргетированная вакцинация снизит заболеваемость среди всего населения.
В Северном Квинсленде, Австралия, среди коренного населения был высокий уровень заболеваемости гепатитом А. Вакцинация детей ясельного возраста из числа коренного населения в период до шестилетнего возраста оказала быстрое и драматическое воздействие на искоренение болезни среди коренного населения и среди гораздо более многочисленного некоренного населения (которое не было вакцинировано) по всему Квинсленду. 35 Подобные подходы были очень успешно применены в нескольких других крупных странах, включая Израиль и США. 36
Успех сушки источника оправдывает вакцинацию специальных профессиональных групп, таких как обработчики пищевых продуктов, для борьбы с брюшным тифом и гепатитом А. 37
Бустеры противококлюшной вакцины для близких людей (например, родителей, бабушек и дедушек, нянек, братьев и сестер и медсестер детского отделения), которые являются наиболее частыми источниками передачи инфекции младенцам, защищают тех, кто слишком мал для первичной вакцинации, окружая их «коконом без коклюша». ». 38
Профилактика сопутствующих заболеваний и рака
Защита от сопутствующих заболеваний
Вакцины также защитят от болезней, связанных с целевым заболеванием. Например, в Финляндии, США и других странах было установлено, что вакцинация против гриппа защищает детей от острого среднего отита с эффективностью вакцины более 30%. 39 Противокоревая вакцинация защищает от множественных осложнений, таких как дизентерия, бактериальная пневмония, кератомаляция и недоедание. 40 Энтеротоксическая вакцина Escherichia coli продемонстрировала защиту от диареи, вызванной Salmonella enterica . 41
Профилактика рака
Инфекционные агенты вызывают несколько видов рака. Хроническая инфекция гепатита B приводит к раку печени. Вакцинация против таких патогенов должна предотвратить ассоциированный рак, как это уже наблюдалось для гепатоцеллюлярной карциномы на Тайване, Китай. 42 Эти результаты могут быть воспроизведены в Африке. 43
Снижение заболеваемости раком шейки матки ожидается с использованием вакцин против ВПЧ против серотипов 16 и 18, на которые приходится более 70% глобального бремени рака шейки матки, поскольку у вакцинированных было продемонстрировано снижение предраковых поражений. 27
Социальные и прочие пособия
Здравоохранение и другие сбережения для общества
Программы иммунизации требуют финансирования инфраструктуры (например,грамм. обслуживание холодовой цепи), закупка вакцин и адекватное укомплектование персоналом. Однако предотвращенная смертность и заболеваемость означает долгосрочную экономию средств и потенциальный экономический рост. По оценкам Эрета в 2003 г., в глобальном масштабе экономия от вакцин составила порядка десятков миллиардов долларов США прямой экономии. 19 Малярия (против которой в настоящее время разрабатывается несколько многообещающих вакцин) обходится странам Африки к югу от Сахары в размере 100 миллиардов долларов США из-за потерянного годового валового внутреннего продукта (ВВП).
Экономия увеличивается, если в одной вакцине доставляется несколько антигенов. Комбинированные вакцины дают дополнительное преимущество в виде лучшего соблюдения режима лечения, охвата и безопасности инъекций. Введение нового антигена облегчается с помощью комбинированных вакцин, обеспечивая ранний высокий охват за счет сохранения предыдущих графиков иммунизации, без снижения (а иногда и улучшения) иммуногенности и реактогенности. 44 , 45
С учетом косвенных затрат экономия выше для общих болезней с более низкой смертностью и заболеваемостью (таких как ветряная оспа), чем для более тяжелых заболеваний (таких как полиомиелит). 46 Косвенные затраты, такие как потеря производительности (а также прямые медицинские затраты), были подчеркнуты выдающимися экономистами в области здравоохранения при оценке полной стоимости вакцинации. 47
Программы иммунизации по сравнению с другими распространенными мероприятиями общественного здравоохранения, такими как использование ремней безопасности и хлорирование питьевой воды, являются хорошим вложением и более рентабельны, чем, например, советы по отказу от курения. 48
Экономия средств будет достигнута за счет новых живых аттенуированных ротавирусных и конъюгированных пневмококковых вакцин, а также более широкого использования вакцин против гепатита B и Hib. 49
Профилактика развития устойчивости к антибиотикам
Уменьшая потребность в антибиотиках, вакцины могут снизить распространенность и препятствовать развитию устойчивых штаммов. Внедрение конъюгированной пневмококковой вакцины для детей грудного возраста в США в 2000 г. привело к снижению инвазивных заболеваний, вызываемых устойчивыми к пенициллину штаммами, на 57%, а к 2004 г. — на 59% в широком возрастном диапазоне: 81% среди детей. младше 2 лет и 49% среди лиц в возрасте 65 лет и старше. 50
Вакцины против брюшного тифа могут предотвратить первичную инфекцию и распространение чувствительных к антибиотикам, а также штаммов с множественной лекарственной устойчивостью. 51 Разработка новых вакцин против инфекционных патогенов, для которых устойчивость к антибиотикам является глобальной угрозой (например, Staphylococcus aureus ), рассматривается как лучший долгосрочный вариант решения проблемы повышения устойчивости. 52
Увеличение продолжительности жизни
Вакцины могут увеличить продолжительность жизни, защищая от болезней, от которых нельзя ожидать пользы.У пожилых людей, получивших вакцину от гриппа в США, вероятность возникновения сердечно-сосудистых и цереброваскулярных заболеваний была примерно на 20% меньше, а риск смерти от всех причин был на 50% ниже, чем у их невакцинированных сверстников. 53
В Швеции введение полисахаридной пневмококковой вакцины и инактивированной вакцины против гриппа значительно снизило риск госпитальной смертности от пневмонии и сердечной недостаточности среди пожилых людей с дополнительным эффектом при введении обеих вакцин. 54
Безопасное путешествие и мобильность
С ростом количества авиаперевозок во всем мире возрастает риск заражения инфекционными заболеваниями за границей. Путешественники передают и распространяют болезнь, как это наблюдалось в случае полиомиелита и распространения штаммов менингококка вернувшимися паломниками из Саудовской Аравии. 55 В случае мусульманского хаджа (крупнейшего ежегодного собрания людей в мире) местные власти требуют вакцинации против менингококковой инфекции ACWY и рекомендуют различные другие вакцинации, такие как грипп и гепатит B, для паломников. 56
Наиболее распространенными среди путешественников болезнями, которые можно предотвратить с помощью вакцин, являются грипп и гепатит А. 57 Другие вакцины, которые следует учитывать при поездках, включают бешенство, гепатит В, брюшной тиф, холеру, желтую лихорадку, японский энцефалит и корь. 57 Многие вакцины можно вводить по гибкому ускоренному графику для обеспечения ранней защиты. 58 Таким образом, путешественник, обратившийся за консультацией по вопросам здоровья, даже в течение нескольких недель до отъезда, может путешествовать за границу, не опасаясь предотвратимых с помощью вакцин рисков для здоровья себя и других.
Прочие пособия для общественного здравоохранения
В развивающихся странах программы вакцинации являются краеугольным камнем служб первичной медико-санитарной помощи. Инфраструктура и персонал, необходимые для эффективной и устойчивой программы иммунизации, открывают возможности для улучшения служб первичной медико-санитарной помощи, особенно в критический перинатальный период и в ранний младенческий период. 59 — 61
Расширение прав и возможностей женщин
С улучшением показателей младенческой и детской смертности женщины, как правило, выбирают меньшее количество детей, поскольку уменьшается необходимость иметь много детей, чтобы некоторые из них достигли совершеннолетия.Это имеет значительные преимущества для здоровья, образования, социальной и экономической жизни. 59
Защита от биотерроризма
Текущее беспокойство по поводу потенциального использования вируса оспы в биотерроре связано с прекращением вакцинации (и производства вакцины) после грандиозных достижений в ликвидации оспы. Потенциал вакцин для защиты населения от угроз биотерроризма, таких как оспа и сибирская язва, побудил многие правительства обеспечить адекватные поставки необходимых вакцин для подготовки к такой атаке. 62 Системы эпиднадзора и ответных мер в отношении болезней, предупреждаемых с помощью вакцин, и других болезней играют решающую роль в идентификации, характеристике биологического оружия и принятии ответных мер.
Содействие экономическому росту
Было показано, что плохое здоровье тормозит экономический рост, в то время как хорошее здоровье может способствовать социальному развитию и экономическому росту. Здоровье имеет фундаментальное значение для экономического роста развивающихся стран, и вакцинация составляет основу их программ общественного здравоохранения. 47 , 59 , 60 Годовая окупаемость инвестиций в вакцинацию, по расчетам, находится в диапазоне от 12% до 18%, но экономические выгоды от улучшения здоровья по-прежнему в значительной степени недооцениваются. 47 , 63 , 64
Увеличение капитала
Бремя инфекционных, в том числе предотвратимых с помощью вакцин, болезней непропорционально ложится на обездоленные слои населения.Вакцины имеют очевидные преимущества для обездоленных. Программы пневмококковой иммунизации в США по крайней мере временно устранили расовые и социально-экономические различия в заболеваемости инвазивными пневмококковыми инфекциями, в то время как в Бангладеш вакцинация против кори повысила равенство между группами с высоким и низким социально-экономическим статусом. 65 , 66
Содействие миру
Во время гражданских конфликтов при содействии Детского фонда Организации Объединенных Наций (ЮНИСЕФ) было зафиксировано как минимум семь прекращений огня с помощью вакцин. 67 Эти конфликты происходили в разных частях мира, от Либерии до Афганистана, где даже враждующие группировки видят выгоду от программ иммунизации.
Во время затяжного конфликта можно обеспечить высокий уровень охвата вакцинацией. Это наблюдается в Шри-Ланке, где, несмотря на волнения последних двух десятилетий, охват в 2005 г. тремя дозами вакцины против дифтерии, столбняка и коклюша и одной дозой вакцины против кори составил 99%. 68
Высокая рентабельность и многочисленные преимущества относительно скромных вложений ресурсов в иммунизацию резко контрастируют с расточительными глобальными военными расходами, которые в настоящее время превышают 1 триллион долларов США в год. 69
Выводы
Преимущества вакцинации выходят за рамки профилактики конкретных заболеваний у людей. Они дают богатый, многогранный урожай для обществ и наций. Вакцинация имеет хороший экономический смысл и удовлетворяет потребность в заботе о самых слабых членах общества. Снижение детской смертности во всем мире за счет обеспечения всеобщего доступа к безопасным вакцинам с доказанной эффективностью является моральным обязательством международного сообщества, поскольку право каждого человека иметь возможность жить более здоровой и полноценной жизнью.Достижение цели 4 в области развития, сформулированной в Декларации тысячелетия (сокращение на две трети детской смертности в возрасте до 5 лет в 1990 году к 2015 году), будет значительно ускорено за счет расширения и своевременного глобального доступа к ключевым жизненно важным иммунизациям, таким как противокоревой, и вряд ли будет достигнуто без него. Вакцины против Hib, ротавируса и пневмококка.
Мы пришли к выводу, что комплексная программа вакцинации является краеугольным камнем хорошего общественного здоровья и уменьшит неравенство и бедность. ■
Список литературы
- Плоткин С.Л., Плоткин С.А.Краткий анамнез вакцинации. В: Плоткин С.А., Оренштейн В.А., ред. Вакцины , 4-е изд. Филадельфия: У. Б. Сондерс; 2004: 1-15.
- Глобальный консультативный комитет по безопасности вакцин. 3–4 декабря 2003 г. Wkly Epidemiol Rec 2004; 79: 16-20.
- Чжоу В., Пул V, Искандер Дж. К., Инглиш-Буллард Р., Болл Р., Мудрый Р. П. и др. Надзор за безопасностью после иммунизации: Система сообщений о побочных эффектах вакцин (VAERS) — США, 1991–2001 гг. MMWR Surveill Summ 2003; 52: 1-24.
- MacIntyre CR, Leask J. Мифы и реалии иммунизации: отвечая на аргументы против иммунизации. J Paediatr Child Health 2003; 39: 487-91.
- Фольб П.И., Бернастовска Э., Чен Р., Клеменс Дж., Доду А.Н., Элленберг С.С. и др. Глобальный взгляд на безопасность вакцин и общественное здоровье: Глобальный консультативный комитет по безопасности вакцин. Am J Public Health 2004; 94: 1926-31.
- Аткинсон П., Куллинан С., Джонс Дж., Фрейзер Дж., Магуайр Х. Крупная вспышка кори в Лондоне: изменение неравенства в отношении здоровья. Arch Dis Child 2005; 90: 424-5.
- Сайт Medline. Доступно по адресу: http://www.pubmed.gov
- Андре FE. Что можно сделать, чтобы вакцины стали более модными? Expert Rev Vaccines 2005; 4: 23-5.
- Хендерсон Д.А. Уроки кампаний по искоренению. Vaccine 1999; 17: S53-5.
- Fine PE, Griffiths UK. Глобальная ликвидация полиомиелита: состояние и последствия. Lancet 2007; 369: 1321-2.
- Muller CP, Kremer JR, Best JM, Dourado I, Triki H, Reef S.Руководящий комитет ВОЗ по кори и краснухе. Снижение глобального бремени кори и краснухи: отчет Руководящего комитета ВОЗ об исследованиях, связанных с вакцинами и вакцинацией против кори и краснухи, 2005 г. Вакцина 2007; 25: 1-9.
- Peltola H, Davidkin I, Paunio M, Valle M, Leinikki P, Heinonen OP. Свинка и краснуха ликвидированы в Финляндии. JAMA 2000; 284: 2643-7.
- Документ с изложением позиции ВОЗ по конъюгированным вакцинам Haemophilus influenzae типа b. Wkly Epidemiol Rec 2006; 81: 445-52.
- В Ботсване зарегистрирован полиомиелит . Женева: ВОЗ; 2004 г. Доступно по адресу: http://www.who.int/mediacentre/notes/2004/np11/en
- Parker AA, Staggs W., Dayan GH, Ortega-Sanchez IR, Rota PA, Lowe L, et al. Влияние вспышки кори в Индиане в 2005 г. на устойчивую элиминацию кори в США. N Engl J Med 2006; 355: 447-55.
- Schmitt HJ, von Kries R, Hassenpflug B, Hermann M, Siedler A, Niessing W. и др. Haemophilus influenzae болезнь типа b: влияние и эффективность дифтерийно-столбнячных токсоидов — бесклеточный коклюш (-инактивированный полиовирус) / Комбинированные вакцины против H. influenzae типа b. Pediatr Infect Dis J 2001; 20: 767-74.
- Олин П., Густафссон Л., Баррето Л., Хессель Л., Mast TC, Rie AR и др. Снижение заболеваемости коклюшем в Швеции после внедрения бесклеточной коклюшной вакцины. Vaccine 2003; 21: 2015-21.
- Succi RC, Фархат СК.Вакцинация в особых случаях. J Pediatr (Rio J) 2006; 82: S91-100.
- Эрет Дж. Глобальное значение вакцинации. Vaccine 2003; 21: 596-600.
- Anon. Воздействие вакцины, универсально рекомендованной для детей. 1900–1998. Mortal Morb Wkly Rep 1999; 48: 243-8.
- Cutts FT, Zaman SM, Enwere G, Jaffar S, Levine OS, Okobo JB и др. Гамбийская группа по испытанию пневмококковой вакцины. Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое исследование. Lancet 2005; 365: 1139-46.
- Ruiz-Palacios GM, Perez-Schael I, Velazquez FR, Abate H, Breuer T., Clemens SC, et al. Безопасность и эффективность аттенуированной вакцины против тяжелого ротавирусного гастроэнтерита. N Engl J Med 2006; 354: 11-22.
- Schmitt HJ, von Konig CH, Neiss A, Bogaerts H, Bock HL, Schulte-Wissermann H, et al. Эффективность бесклеточной коклюшной вакцины в раннем детстве после заражения в домашних условиях. JAMA 1996; 275: 37-41.
- Preziosi M-P, Halloran ME.Влияние вакцинации против коклюша на заболевание: эффективность вакцины в снижении клинической тяжести. Clin Infect Dis 2003; 37: 772-9.
- Vazquez M, LaRussa PS, Gershon AA, Niccolai LM, Muehlenbein CE, Steinberg SP, et al. Эффективность вакцины против ветряной оспы с течением времени. JAMA 2004; 291: 851-5.
- Innis BL, Snitbhan R, Kunasol P, Laorakpongse T, Poopatanakol W, Kozik CA, et al. Защита от гепатита А инактивированной вакциной. JAMA 1994; 271: 1328-34.29.
- Harper DM, Franco EL, Wheeler CM, Moscicki AB, Romanowski B, Roteli-Martins CM, et al. Группа по изучению вакцины против ВПЧ. Устойчивая эффективность до 4,5 лет вакцины с бивалентными вирусоподобными частицами L1 против вируса папилломы человека типов 16 и 18: результаты рандомизированного контрольного исследования. Lancet 2006; 367: 1247-55.
- Banatvala J, Van Damme P, Oehen S. Пожизненная защита от гепатита B: роль иммуногенности вакцины в иммунной памяти. Вакцина 2000; 19: 877-85.
- Адегбола Р., Сека О, Лахай Г., Ллойд-Эванс Н., Нджие А., Усен С. и др. Ликвидация Haemophilus influenzae типа b (Hib) болезни из Гамбии после введения конъюгированной вакцины Hib: проспективное исследование. Lancet 2005; 366: 144-50.
- Moulton LH, Chung S, Croll J, Reid R, Weatherholtz RC, Santosham M. Оценка косвенного эффекта конъюгированной вакцины Haemophilus influenzae типа b в популяции американских индейцев. Int J Epidemiol 2000; 29: 753-6.
- Schlenker TL, Bain C, Baughman AL, Hadler SC. Коллективный иммунитет против кори: связь показателей заболеваемости с показателями иммунизации детей дошкольного возраста. JAMA 1992; 267: 823-6.
- Али М., Эмч М., фон Зайдляйн Л., Юнус М., Сак Д., Рао М. и др. Коллективный иммунитет обеспечивается убитыми оральными вакцинами против холеры в Бангладеш. Lancet 2005; 366: 44-9.
- Джон Т.Дж., Сэмюэл Р. Коллективный иммунитет и эффект стада: новые идеи и определения. Eur J Epidemiol 2000; 16: 601-6.
- Андерсон РМ, Май РМ. Инфекционные болезни человека: динамика и контроль . Оксфорд: издательство Оксфордского университета; 1991.
- Ханна Дж. Н., Холмы С. Л., Хамфрис Дж. Л. Влияние вакцинации детей коренных народов на гепатит А на уведомления о гепатите А в северном Квинсленде. Med J Aust 2004; 181: 482-5.
- Андре FE. Универсальная массовая вакцинация против гепатита А. // Плоткин С.А., изд. Массовая вакцинация: глобальные аспекты — успехи и препятствия.Актуальные темы микробиологии 2006; 304: 95-114.
- Fiore AE. Гепатит А передается с пищей. Clin Infect Dis 2004; 38: 705-15.
- Кроукрофт Н.С., Буй Р., Харрисон Т., Спайсер Л., Бритто Дж., Мок К. и др. Тяжелая и нераспознанная форма: коклюш у младенцев в Великобритании. Arch Dis Child 2003; 88: 802-6.
- Manzoli L, Schioppa F, Boccia A, Villari P. Эффективность вакцины против гриппа для здоровых детей: метаанализ, оценивающий потенциальные источники вариаций в оценках эффективности, включая качество исследования. Pediatr Infect Dis J 2007; 26: 97-106.
- Strebel PM, Папания MJ, Halsey NA. Вакцина против кори. В: Плоткин С.А., Оренштейн В.А., ред. Вакцины , 4-е изд. Филадельфия: У. Б. Сондерс; 2004; 389-440.
- Peltola H, Siitonen A, Kyronseppa K, Simula I, Mattila L, Oksanen P, et al. Профилактика диареи путешественников с помощью пероральной B — субъединичной / цельноклеточной вакцины против холеры. Lancet 1991; 338: 1285-9.
- Чанг MH. Снижение заболеваемости гепатоцеллюлярной карциномой среди детей после всеобщей иммунизации против гепатита В. Liver Int 2003; 23: 309-24.
- Кирк Г.Д., Лези О.А., Менди М., Акано А.О., Сэм О., Годерт Дж. Дж. И др. Исследование рака печени в Гамбии: инфекция гепатитом B и C и риск гепатоцеллюлярной карциномы в Западной Африке. Гепатология 2004; 39: 211-9.
- Aristegui J, Usonis V, Coovadia H, Riedemann S, Win KM, Gatchalian S, et al. Содействие расширенной программе иммунизации ВОЗ: клинический профиль комбинированной вакцины против дифтерии, столбняка, коклюша, гепатита B и Haemophilus influenzae типа b. Int J Infect Dis 2003; 7: 143-51.
- Decker MD. Принципы педиатрических комбинированных вакцин и практические вопросы, связанные с использованием в клинической практике. Pediatr Infect Dis J 2001; 20: S10-8.
- Lieu TA, Cochi SL, Black SB, Halloran ME, Shinefield HR, Holmes SJ, et al. Экономическая эффективность рутинной программы лечения ветряной оспы для детей в США. JAMA 1994; 271: 375-81.
- Блум Д.Е., Каннинг Д., Уэсон М. Ценность вакцинации. World Econ 2005; 6: 15-39.
- Chabot I, Goetghebeur MM, Gregoire J-P. Социальная ценность всеобщей вакцинации детей. Vaccine 2004; 22: 1992-2005.
- Миллер М.А., Макканн Л. Анализ политики использования гепатита B, Haemophilus influenzae типа B, Streptococcus pneumoniae и ротавирусных вакцин в схемах иммунизации. Health Econ 2000; 9: 19-35.
- MH Kyaw, R Lynfield, W. Schaffner, Craig AS, Hadler J, Reingold A, et al.Активный бактериальный основной эпиднадзор в сети программы возникающих инфекций. Влияние введения пневмококковой конъюгированной вакцины на лекарственно-устойчивый Streptococcus pneumoniae. N Engl J Med 2006; 354: 1455-63.
- CM Parry. Брюшной тиф. Curr Infect Dis Rep 2004; 6: 27-33.
- Либерман JM. Надлежащее использование антибиотиков и почему это важно: проблемы устойчивости бактерий. Pediatr Infect Dis J 2003; 22: 1143-51.
- Никол К.Л., Нордин Дж., Маллули Дж., Ласк Р., Филлбрандт К., Иване М. Вакцинация против гриппа и сокращение госпитализаций по поводу сердечных заболеваний и инсульта среди пожилых людей. N Engl J Med 2003; 348: 1322-32.
- Christenson B, Hedlund J, Lundbergh P, Ortqvist A. Аддитивный профилактический эффект вакцин против гриппа и пневмококка у пожилых людей. Eur Respir J 2004; 23: 363-8.
- Клабер Р., Буй Р., Эль Башир Х., Мифсуд А., Тейлор С.Устойчивая вспышка менингококковой инфекции W135 в восточном Лондоне, Великобритания. Lancet 2002; 360: 644-.
- Ахмед К.А., Араби Ю.М., Мемиш З.А. Риски для здоровья во время хаджа. Lancet 2006; 367: 1008-15.
- Штеффен Р., Банос А., де Бернардис К. Приоритеты вакцинации. Int J Antimicrob Agents 2003; 21: 175-80.
- Nothdurft HD, Zuckerman J, Stoffel M, Dieussaert E, van Damme P. Ускоренные графики вакцинации обеспечивают защиту от гепатита A и B у лиц, совершающих поездки в последнюю минуту. J Travel Med 2004; 11: 260-1.
- Shearley AE. Социальная ценность вакцинации в развивающихся странах. Vaccine 1999; 17: S109-12.
- Ruff TA, Gertig DM, Otto BF, Gust ID, Sutanto A, Soewarso T.I, et al. Проект иммунизации против гепатита B на Ломбоке: на пути к всеобщей иммунизации младенцев против гепатита B в Индонезии. J Infect Dis 1995; 171: 290-6.
- Martines J, Paul VK, Bhutta ZA, Koblinsky M, Soucat A, Walker N, et al.Группа управления выживанием новорожденных Lancet. Выживание новорожденных: призыв к действию. Lancet 2005; 365: 1189-97.
- Hassani M, Patel MC, Pirofski LA. Вакцины для профилактики заболеваний, вызываемых потенциальным биологическим оружием. Clin Immunol 2004; 111: 1-15.
- Пресс-релиз, 8 июля 2004 г. Панамериканская организация здравоохранения. Доступно по ссылке: http://www.paho.org/English/DD/PIN/pr040708.htm
- Wagstaff A. Бедность и неравенство в секторе здравоохранения. Bull World Health Organ 2002; 80: 97-105.
- Фланнери Б., Шраг С., Беннетт Н.М., Линфилд Р., Харрисон Л.Х., Рейнгольд А. и др. Влияние детской вакцинации на расовые различия при инвазивных инфекциях Streptococcus pneumoniae . JAMA 2004; 291: 2197-203.
- Бишай Д., Кениг М., Али Хан М. Вакцинация от кори улучшает справедливость результатов для здоровья: данные из Бангладеш. Health Econ 2003; 12: 415-9.
- Hotez PJ. Вакцины как инструменты внешней политики. EMBO Rep 2001; 2: 862-8.
- Профиль иммунизации — Шри-Ланка . Женева: ВОЗ. Доступно по адресу: http://www.who.int/vaccines/globalsummary/immunization/countryprofileresult.cfm?C=
- Stalenheim P, Fruchart D, Omitoogun W, Perdomo C. Военные расходы. В: Стокгольмский международный институт исследования проблем мира (SIPRI). Ежегодник СИПРИ 2006 . Оксфорд: издательство Оксфордского университета; 2006: 295-386.
Принадлежности
- Rue du Moulin, 23, 1330 Rixensart, Бельгия.
- Национальный центр исследований и надзора за иммунизацией, Детская больница Вестмид, Сидней, Австралия.
- GlaxoSmithKline Biologicals, Риксенсарт, Бельгия.
- Международный институт вакцин, Сеул, Республика Корея.
- Кафедра клинической вирусологии и микробиологии, Христианский медицинский колледж, Веллор, Тамил Наду, Индия.
- Кафедра педиатрии, Национальный университет Сингапура, Сингапур.
- Госпиталь Раматибоди, Бангкок, Таиланд.
- Центральная больница Хельсинкского университета, Детская и подростковая больница, Хельсинки, Финляндия.
- Носальский институт глобального здоровья, Мельбурнский университет, Мельбурн, Австралия.
- Департамент международного здравоохранения и педиатрии и Центр программы здоровья американских индейцев и систем здравоохранения, Университет Джона Хопкинса, Балтимор, Мэриленд, Соединенные Штаты Америки.
- Кафедра педиатрии, Университет Йоханнеса Гутенберга, Майнц, Германия.
(PDF) Ненейроинвазивная вакцина R2 от HSV-1 обеспечивает защиту от генитальных инфекций HSV-2 у морской свинки модели
, затем добавляется к монослою Vero и инкубируется при 37 ° C в течение 1 часа с последующим добавлением
1,5% метилцеллюлозы наложение. Через 3 дня при 37 ° C верхний слой
удалили и подсчитали бляшки после окрашивания Crystal Violet
(Sigma-Aldrich, Сент-Луис, Миссури). Для каждого образца максимальное разведение
, дающее ≥50% уменьшение бляшек, считалось конечной точкой нейтрализации антител
.
Статистический анализ
Для сравнения средних значений для двух групп был проведен тест Стьюдента
с использованием двустороннего анализа. Для сравнения нескольких групп первоначально выполняли ANOVA
, и если были отмечены значимые различия между всеми группами
, использовали критерий Тьюки для корректировки множественных сравнений. Данные представлены в виде средних значений и стандартных отклонений. Данные по заболеваемости
сравнивались с помощью точного теста Фишерса.Значение Pvalue <0,05 считалось значительным
.
Сводка отчета
Дополнительная информация о дизайне исследования доступна в обзоре Nature Research
Отчетность, связанном с этой статьей.
НАЛИЧИЕ ДАННЫХ
Наборы данных, сгенерированные и / или проанализированные в ходе текущего исследования, доступны по телефону
у соответствующего автора.
Поступила: 02.03.2020 г .; Принята в печать: 6 октября 2020 г .;
ССЫЛКИ
1.Джонстон, К., Готтлиб, С. Л. и Уолд, А. Статус исследования и разработки вакцин —
вакцин против вируса простого герпеса. Vaccine 34, 2948–2952 (2016).
2. Дропулич Л. К. и Коэн Дж. И. Проблема разработки вакцины против вируса простого герпеса 2
. Эксперт Rev. Vaccines 11, 1429–1440 (2012).
3. Стэнфилд Б. и Кусулас К. Г. Вакцины от простого герпеса: перспективы создания живых аттенуированных вакцин против вируса простого герпеса
для борьбы с генитальными и глазными инфекциями.Curr. Clin.
Microbiol. 2015. Т. 2. С. 125–136.
4. Распространенность вируса простого герпеса 2 типа среди лиц в возрасте 14–49 лет.
лет — США, 2005–2008 гг. Mmwr 59, 456–459 (2010).
5. Freeman, E. E. et al. Инфекция, вызванная вирусом простого герпеса 2, увеличивает заражение ВИЧ у
мужчин и женщин: систематический обзор и метаанализ продольных исследований.
AIDS 20,73–83 (2006).
6. Looker, K. J. et al. Глобальные и региональные оценки вклада инфекции вируса простого герпеса
типа 2 в заболеваемость ВИЧ: анализ фракции
, приходящейся на популяцию, с использованием опубликованных эпидемиологических данных.Lancet Infect. Дис. Https://doi.org/
10.1016 / S1473-3099 (19) 30470-0 (2019).
7. Смит, Г. Транспорт вируса герпеса в нервную систему и обратно. Анну. Rev.
Microbiol. 2012. Т. 66. С. 153–176.
8. Гнанн, Дж. У. Мл. И Уитли, Р. Дж. Энцефалит, вызванный вирусом простого герпеса: обновленная информация. Curr.
Заражение. Дис. Отчет 19, 13 (2017).
9. Харрис, С. А. и Харрис, Е. А. Вирус простого герпеса типа 1 и другие патогены являются
ключевыми причинными факторами спорадической болезни Альцгеймера.J. Alzheimers Dis. 48,
319–353 (2015).
10. Ицхаки Р. Ф. и Лате Р. Вирусы герпеса и старческое слабоумие: первая популяция
доказательства причинной связи. J. Alzheimers Dis. 64, 363–366 (2018).
11. Looker, K. J. et al. Глобальные оценки распространенных и случаев инфицирования вирусом простого герпеса
типа 2 в 2012 г. PLoS ONE 10, e114989 (2015).
12. Томпсон, К. и Уитли, Р. Инфекции, вызванные вирусом простого герпеса новорожденных: где сейчас
? Adv.Exp. Med. Биол. 2011. Т. 697. С. 221–230.
13. Stanberry, L. R. et al. Гликопротеин-D-адъювантная вакцина для профилактики генитального герпеса.
N. Engl. J. Med. 347, 1652–1661 (2002).
14. Belshe, R. B. et al. Результаты испытаний вакцины простого герпеса. N. Engl. J.
Med. 366,34–43 (2012).
15. Weibel, R.E. et al. Живая аттенуированная вакцина против вируса ветряной оспы. Исследование эффективности у здоровых
детей. N. Engl. J. Med. 310, 1409–1415 (1984).
16.Гершон, А.А. Вакцины против ветряной оспы и их значение для разработки вакцин против вируса простого герпеса
. Вирусология 435,29–36 (2013).
17. Richards, A. L. et al. Белок тегумента pUL37 направляет альфа-герпесвирус ret-
, ускоряя аксональный транспорт, способствуя нейроинвазии. PLoS Pathog. 13, e1006741
(2017).
18. Пикард, Г. Е., Бродерсен, Б., Солларс, П. Дж. И Смит, Г. А. Ненейроинвазивная вакцина от вируса псевдобешенства R2
: экспериментальное исследование на свиньях.Вакцина. Https://doi.
org / 10.1016 / j.vaccine.2020.05.002 (2020).
19. Verpooten, D. et al. Дефосфорилирование eIF2alpha, опосредованное белком
gamma134.5 вируса простого герпеса 1, облегчает вирусную нейроинвазию. J.
Virol. 83, 12626–12630 (2009).
20. Bernstein, D. I. et al. Продолжительность защиты от живых аттенуированных вакцин по сравнению с субъединицей HSV-
2 в модели генитального герпеса на морских свинках: переоценка эффективности с использованием
конечных точек из клинических испытаний.PLoS ONE 14, e0213401 (2019).
21. Brittle, E. E., Wang, F., Lubinsk i, J. M., Bunte, R.M. & Friedman, H.M. Репликация —
, компетентная, нейрональная дефектная по распространению, живая аттенуированная вакцина вируса простого герпеса типа
1 1. J. Virol. 82, 8431–8441 (2008).
22. Стэнберри, Л. Р., Бернштейн, Д. И., Берк, Р. Л., Пахл, К. и Майерс, М. Г. Вакцинация
рекомбинантными гликопротеинами вируса простого герпеса: защита от первоначального
и рецидивирующего генитального герпеса.J. Infect. Дис. 155, 914–920 (1987).
23. Stanfield, B.A. et al. Однократная внутримышечная вакцинация мышей вирусом HSV-1
VC2 с мутациями гликопротеина K и мембранного белка UL20
обеспечивает полную защиту от летального интравагинального заражения вирулентными штаммами HSV-1
и HSV-2. PLoS ONE 9, e109890 (2014).
24. Ричардс, А. Л., Солларс, П. Дж. И Смит, Г. А. Новые инструменты для преобразования бактериальных искусственных хромосом
в самоизекающиеся хромосомы и их применение к инфекционному клону вируса простого герпеса
типа 1.BMC Biotechnol. 16, 64 (2016).
25. Танака, М., Кагава, Х., Яманаши, Ю., Сата, Т. и Кавагути, Ю. Конструирование вырезанной бактериальной искусственной хромосомы
, содержащей инфекционный клон
вируса простого герпеса во всю длину. тип 1: вирусы, восстановленные из клона, проявляют свойства типа wild-
in vitro и in vivo. J. Virol. 77, 1382–1391 (2003).
26. Bernstein, D. I. et al. Живая аттенуированная вакцина VC2 от HSV-1 обеспечивает защиту
от генитальной инфекции HSV-2 на модели генитального герпеса у морских свинок.Вакцина
37,61–68 (2019).
27. Wang, K. et al. Мутант gD вируса простого герпеса 2 (HSV-2), нарушенный по нейральному тропизму
, превосходит субъединичную вакцину gD HSV-2 для защиты животных от заражения вирусом
HSV-2. J. Virol. 90. С. 562–574 (2016).
28. Питтс, Дж. Д., Клабис, Дж., Ричардс, А. Л., Смит, Г. А. и Хельдвейн, Э. Е. Кристаллическая структура
белка внутренней тегумента вируса герпеса UL37 поддерживает его важную роль в контроле
вирусного трафика.J. Virol. 88, 5462–5473 (2014).
29. Бернштейн, Д. И. Использование модели генитального герпеса на морских свинках для оценки вакцин и противовирусных препаратов вак-
: обзор. Антивирь. Res. 180, 104821 (2020).
30. Wald, A., Huang, ML, Carrell, D., Selke, S. & Corey, L. Полимеразная цепная реакция
для обнаружения ДНК вируса простого герпеса (HSV) на поверхности слизистой оболочки: сравнение
с Выделение ВПГ в культуре клеток. J. Infect. Дис. 188. С. 1345–1351 (2003).
31.Bernstein, D. I. et al. Успешное применение стратегии первичного и вытягивающего действия для терапевтической вакцины против HSV
. NPJ Vaccines 4, 33 (2019).
32. Парр, М. Б. и Парр, Э. Л. Интравагинальное введение мышей вируса простого герпеса 2 типа
приводит к инфицированию нескольких нервных и экстраневральных участков. J. Neurovirol 9,
594–602 (2003).
33. Rosenbaum, P. et al. Молекулярная и клеточная динамика в коже,
лимфатических узлах и крови иммунного ответа на внутрикожную инъекцию
модифицированной вакцины против осповакцины Ankara.Фронт Иммунол. 9, 870 (2018).
34. Louis, L. et al. Внутрикожная вакцинация синтетической ДНК генерирует специфические Т-клетки лейшмании-
в коже и обеспечивает защиту от крупной лейшмании. Заразить. Иммун.
https://doi.org/10.1128/IAI.00227-19 (2019).
35. Шин, Х. и Ивасаки, А. Стратегия вакцинации, которая защищает от генитального герпеса путем создания
Т-клеток локальной памяти. Nature 491, 463–467 (2012).
36. Srivastava, R. et al. Хемокин-зависимая мобилизация CXCR8 (+) CD8
(+) эффекторных Т-клеток памяти и резидентных Т-клеток памяти в слизистой оболочке влагалища составляет
, что связано с защитой от генитального герпеса.J. Immunol. 200, 2915–2926
(2018).
37. Willis, S.H. et al. Исследование кинетики связывания гликопротеина
D вируса простого герпеса с медиатором проникновения вируса герпеса с использованием поверхностного плазмонного резонанса. J.
Virol. 72, 5937–5947 (1998).
38. Bernstein, D. I. et al. Адъювант CLDC увеличивает защиту вакцины гликопротеина D типа 2 от простого герпеса
у морских свинок. Vaccine 28, 3748–3753 (2010).
39. Bourne, N.и другие. Дендримеры, новый класс кандидатных микробицидов для местного применения с активностью
против инфекции вируса простого герпеса. Противомикробный. Агенты Chemother. 44,
2471–2474 (2000).
40. Стэнберри, Л. Р., Керн, Э. Р., Ричардс, Дж. Т., Эбботт, Т. М. и Дж. С. Младший. Генитальный герпес
у морских свинок: патогенез первичной инфекции и описание
рецидивирующего заболевания. J. Infect. Дис. 146. С. 397–404 (1982).
41. Бернштейн, Д.I. et al. Эффективность N-метанокарбатимидина против генитального герпеса
, выделение вируса симплексного типа 2 и инфицирование морских свинок. Антивирь. Chem. Че-
мать. 24,19–27 (2015).
42. Bernstein, D. I. et al. Эффекты гликопротеиновых вакцин
вируса простого герпеса типа 2 и адъюванта CLDC на генитальную герпетическую инфекцию у морских свинок. Vaccine 29,
2071–2078 (2011).
Д.И. Bernstein et al.
7
Опубликовано в партнерстве с Институтом вакцин Сили npj Vaccines (2020) 104
Кандидаты в вакцины от герпеса — точные вакцины
Вакцины от герпеса
Разработка защитных вакцин против вируса простого герпеса (ВПГ) является постоянной проблемой на протяжении десятилетий.Многие кандидаты в вакцины против герпеса основаны на технологиях вакцинации ДНК, модифицированной мРНК, белковой субъединицы, убитого вируса и ослабленного живого вируса.
Вирус простого герпеса существует в виде двух биологически различных серотипов, HSV-1 и HSV-2, которые различаются в основном способом передачи, сообщает CDC США.
Кандидаты в вакцину от герпеса
Вакцины против герпеса, проходящие клинические испытания, включают терапевтические (предназначенные для уменьшения выделения вируса у людей, которые уже инфицированы ВПГ) и профилактические вакцины-кандидаты.
Delta gD-2 (∆gD-2) представляет собой кандидатную вакцину на основе вируса HSV-2, генетически удаленного для гликопротеина D (gD-2).
HSV 529 (HSV15) — вакцина-кандидат, классифицированная как вирус с дефектом репликации, что означает, что вирус обладает всеми компонентами вируса HSV дикого типа, за исключением двух белков UL5 и UL29, участвующих в репликации вирусной ДНК. Последнее исследование фазы 1/2 было обновлено 13 января 2021 г. Санофи Пастер и Национальным институтом аллергии и инфекционных заболеваний.
EXD-12 — вакцина-кандидат, которая в настоящее время проходит доклинические испытания на безопасность и эффективность в качестве профилактической и терапевтической вакцины как против вируса простого герпеса-1, так и вируса простого герпеса-1 и вируса простого герпеса-2, ВПГ-2.
NanoVax — это адъювантная платформа, используемая для разработки вакцины-кандидата для защиты от двух вирусов, которые могут вызывать генитальный герпес.
GSK Simplirix HerpeVac участвовал в двойном слепом рандомизированном контролируемом клиническом исследовании фазы 3 для оценки профилактической эффективности и безопасности вакцины gD-Alum / MPL в профилактике генитального герпеса у молодых женщин, инфицированных вирусом простого герпеса (ВПГ). -1 и -2 серонегативные.Последнее обновление: август 2018 г.
Вакцина HSV (GSK4108771A) GSK впервые начала клиническое исследование фазы 1 на людях для оценки реактогенности, безопасности и иммуногенности четырех различных уровней доз экспериментальной вакцины против вируса простого герпеса 2 типа (HSV-2). при внутримышечном введении по схеме 0, 2 месяца здоровым участникам в возрасте 18-40 лет. Предполагаемая дата завершения первичного строительства — 9 августа 2022 г.
Вакцины от герпеса — доклиническая разработка
RVx-201 Вакцина-кандидат от HSV-2 разработана так, чтобы иметь определенную степень ослабления за счет специально разработанных мутаций в белке ICP0.
Вакцина-кандидат VC2 — это живая аттенуированная вакцина против лицевого, глазного и генитального герпеса, вызываемого HSV-1, и потенциально защищает от генитального герпеса, вызванного HSV-2.
Новости разработки вакцины против герпеса
29 апреля 2021 г. — Вакцина-кандидат UPenn против HSV2 включает технологию мРНК.
16 апреля 2021 г. — На виртуальной конференции Морган Линар из Университета Бордо, Франция, связала изменения тканей мозга и более высокую заболеваемость болезнью Альцгеймера (БА) с инфекцией ВПГ, у носителей ApoE4 дела обстоят хуже.Оливер Голдхардт из Мюнхенского технического университета на встрече связал биомаркеры АД в спинномозговой жидкости с герпетической инфекцией. Обе команды измерили инфекцию герпеса, обнаружив иммуноглобулин G против HSV в крови или спинномозговой жидкости участников.
10 апреля 2021 г. — NEJM опубликовал результаты ограниченного исследования опухоли головного мозга фазы 1, в котором изучается только внутриопухолевый G207 и с лучевой терапией. G207, спонсируемый Университетом Алабамы в Бирмингеме, представляет собой лечение онколитическим вирусом простого герпеса-1 (ВПГ), успешно разработанное для введения мутаций в вирус, которые позволяют ему реплицироваться и убивать раковые клетки выборочно, но не нормальные клетки.G207 преобразовал иммунологически «холодные» опухоли в «горячие».
5 апреля 2021 г. — Rational Vaccines объявила о лицензионном соглашении на работу вирусолога из Университета штата Луизиана доктора Константина «Гуса» Кусуласа из Школы ветеринарной медицины LSU в отделе биотехнологии и молекулярной медицины, что способствует основной миссии Rational по устранению вирус герпеса. Технология вакцины, известная как VC2, продемонстрировала большие перспективы в лечении вируса простого герпеса 1 и 2, а также лицевого и глазного герпеса в нескольких исследованиях на животных.В отличие от вакцин, в которых для вакцинации пациентов используются отдельные вирусные белки, VC2 является живой ослабленной, сконструированной версией HSV-1. Поскольку VC2 предотвращает попадание вируса простого герпеса в нейроны организма, Кусулас считает, что это безопасный и эффективный способ предотвращения и потенциального лечения герпеса.
5 апреля 2021 г. — Компания Maxwell Biosciences из Остина, штат Техас, объявила, что рецензируемый журнал с открытым доступом Pharmaceuticals опубликовал результаты научных исследований, в соавторстве с Джиллом Даймондом, доктором наук.D. (Университет Луисвилля) и одиннадцать других сотрудничающих академических исследователей. Результаты исследования, названные «Потенциальная противовирусная активность против HSV-1» и «SARS-CoV-2» с помощью антимикробных пептоидов, демонстрируют, что некоторые пептоиды проявляют мощную противовирусную активность in vitro в отношении как вируса простого герпеса-1 (HSV-1), так и SARS-CoV-2. Как указано в аннотации к статье, вирусные инфекции, например, вызванные HSV-1 и SARS-CoV-2, ежегодно поражают миллионы людей.
30 марта 2021 г. — Две новые вакцины-кандидаты для профилактики и лечения генитального герпеса показали свою безопасность в доклинических исследованиях на животных, согласно исследованию, опубликованному в журнале Vaccines.«Эти результаты обнадеживают и подтверждают необходимость продолжения разработки и тестирования этих живых аттенуированных вакцин-кандидатов, которые исторически являются недостаточно развитыми типами вакцин для лечения или профилактики генитального герпеса», — сказал Джонатан Джойс, ведущий автор исследования и доктор философии. .D. кандидат в группе доктора Андреа Бертке в Департаменте наук о здоровье населения, Технологический институт Вирджинии.
19 марта 2021 г. — Исследование кандидата на вирус простого герпеса Rational Vaccines, опубликованное в Journal of Virology, демонстрирует, что кандидат на вакцину, RVX10, обеспечивает надежную защиту от инфекции вирусом простого герпеса 1 (HSV-1) у вакцинированных мышей. .Основной вывод исследования «Живая аттенуированная вакцина против вируса простого герпеса 1 (HSV-1) 0ΔNLS защищает от глазной инфекции HSV-1 в отсутствие нейтрализующих антител у трансгенных мышей, специфичных к Т-клеточным рецепторам HSV-1» Было показано, что вакцина-кандидат RVX101 компании, используемая для иммунизации уникальной линии мышей (не генерирующая значительного количества нейтрализующих антител к вирусу), обеспечивает высокий защитный иммунитет и предотвращает вызванную герпесом неоваскуляризацию. Эта высокая эффективность коррелировала с CD8 + Т-клетками, поскольку истощение этих клеток после вакцинации, но до заражения HSV-1 устраняло любую эффективность, реализованную вакциной.
18 марта 2021 г. — GlaxoSmithKline запустила фазу I, одинарное слепое, рандомизированное, плацебо-контролируемое исследование повышения дозы для оценки реактогенности, безопасности и иммунного ответа вакцины gE / gI SAM (LNP) в (60) Healthy Возраст участников 18-40 лет.
13 марта 2021 г. — Журнал Vaccines опубликовал исследование: Оценка двух новых живых ослабленных вакцин-кандидатов против вируса простого герпеса 2 (HSV-2) у морских свинок. Два экспериментальных новых живых аттенуированных кандидата на вакцину против ВПГ-2 (RVx201 и RVx202) были протестированы доклинически на безопасность.Результаты этого исследования показывают, что эти новые вакцины-кандидаты безопасны для морских свинок и должны быть протестированы на эффективность в качестве профилактических и / или терапевтических вакцин против HSV-2.
5 марта 2021 г. — В исследовании BMJ была опубликована авторская статья «Понимание спектра мер по обеспечению эффективности вакцин». Эффективность против тяжелого заболевания, возможно, имеет наибольшее клиническое значение. Однако эффективность вакцины для предотвращения инфекции труднее надежно измерить. Очевидно, что профилактика инфекции также предотвращает передачу и симптомы, однако вакцины могут иметь клинические преимущества, поскольку они активируют иммунную систему для предотвращения симптомов, даже несмотря на инфекцию.Таким образом, эффективность вакцины против инфекции не может быть выше эффективности против болезни. Например, от другого заболевания в 2012 г. эффективность вакцины простого герпеса против генитального заболевания, вызванного вирусом простого герпеса 1, составила 58% (95% ДИ от 12 до 80%). Тем не менее эффективность против инфекции вируса простого герпеса 1 составила 35% (95% ДИ от 13 до 52%).
26 февраля 2021 г. — Компания Rational Vaccines из Массачусетса объявила, что вирусолог Константин «Гас» Кусулас присоединился к компании в качестве вице-президента по научным вопросам.Он будет выполнять свою основную миссию по искоренению в мире вируса простого герпеса.
14 февраля 2021 г. — НАУЧНАЯ СТАТЬЯ: Герпесвирусные инфекции, противовирусное лечение и риск деменции — когортное исследование на основе регистров в Швеции. Противовирусное лечение было связано со снижением долгосрочного риска деменции у лиц с явными признаками герпетической инфекции. Это согласуется с более ранними данными, указывающими на участие вирусов герпеса в патогенезе БА.
12 февраля 2021 г. — Исследование: гипервозбудимость нейронов является DLK-зависимым триггером реактивации вируса простого герпеса, которую может индуцировать IL-1. «HSV-1 кооптирует врожденный иммунный путь, возникающий в результате стимуляции нейронов IL-1, чтобы вызвать реактивацию».
12 февраля 2021 г. — Журнал Nature опубликовал исследование: «Временное редактирование привлекает внимание». Таким образом, одноразовый переходный подход к терапевтическому редактированию генов является выгодным предложением по многим направлениям.
10 февраля 2021 г. — Коммерческие фирмы на рынке тестирования маркеров герпеса делают успехи в области диагностических тестов на ВПГ1- и ВПГ-2. В 2014 году прямые молекулярные тесты Simplexa HSV 1 и HSV 2 от Quest Diagnostics были первыми, кто получил США. Одобрение FDA. Тест Simplexa — первый тест, одобренный FDA США, позволяющий качественно дифференцировать и обнаруживать ВПГ-1 и ВПГ-2 в спинномозговой жидкости.
9 февраля 2021 г. — Quercus Molecular Design (QMD) разрабатывает противовирусные препараты широкого спектра действия с показаниями от вирусов герпеса до SARS-CoV2.Сандра Веллер, главный специалист по биологии QMD и заслуженный профессор молекулярной биологии и биофизики Медицинской школы Университета штата Коннектикут, изучала механизм репликации вирусов герпеса человека более 40 лет. Веллер объединила свое глубокое понимание молекулярных механизмов репликации вирусов с опытом Денниса Райта, профессора медицинской химии в фармацевтической школе Калифорнии и главного химика QMD.
9 февраля 2021 г. — Согласно Google Trends, поисковые запросы по слову «ковидная черепица» достигли пика популярности в поисковой системе за последнюю неделю.«Нет никаких научных доказательств этой [ассоциации]», — говорит Аарон Глатт, доктор медицинских наук, начальник отдела инфекционных заболеваний на горе Синай Южный Нассау в Оушенсайде, штат Нью-Йорк, и представитель Американского общества инфекционных заболеваний, сообщает WebMD.
3 февраля 2021 г. — ИССЛЕДОВАТЕЛЬСКАЯ СТАТЬЯ, опубликованная PLOS: Безопасность, приемлемость и фармакокинетика вагинальной многоцелевой профилактической пленки на основе моноклональных антител (MB66): рандомизированное исследование фазы I. Однократные и многократные интравагинальные аппликации пленки MB66 были безопасными, хорошо переносимыми и приемлемыми.Концентрации и биоактивность ex vivo обоих mAb в вагинальном секрете были значительно повышены и могли обеспечивать защиту в течение по меньшей мере 24 часов после введения дозы. Однако необходимы дальнейшие исследования, чтобы оценить эффективность пленки MB66 у женщин из группы риска инфицирования ВИЧ и ВПГ. К этой платформе можно добавить дополнительные антитела для защиты от других инфекций, передаваемых половым путем, и противозачаточных средств.
1 февраля 2021 г. — Virios Therapeutics, Inc. (Nasdaq: VIRI), биотехнологическая компания, специализирующаяся на разработке новых противовирусных методов лечения заболеваний, связанных с аномальным иммунным ответом, вызванным вирусами, объявила сегодня, что она вступает в сотрудничество с доктором .Майкл Камиллери из клиники Майо, чтобы изучить роль противовирусной терапии в лечении синдрома раздраженного кишечника (СРК). Сверхактивный иммунный ответ, связанный с активацией резидентного в тканях вируса простого герпеса-1 (HSV-1), был постулирован как потенциальная первопричина хронических заболеваний, таких как FM, заболевание раздраженного кишечника, синдром хронической усталости и функциональные соматические заболевания. синдром, каждый из которых характеризуется нарастанием и ослаблением проявления болезни.
13 января 2021 г. — Обновление исследования безопасности конкретной вакцины от герпеса у взрослых с герпетической инфекцией или без нее.Фаза I Исследование безопасности вакцины против репликационно-дефектного вируса простого герпеса-2, HSV529, у взрослых в возрасте от 18 до 40 лет с инфекцией HSV или без нее. Дата начала исследования: 26 сентября 2013 г.
11 января 2021 г. — Пресс-релиз Rational Vaccines herpes, посвященный исследованию, опубликованному в Journal of Virology 23 ноября 2020 г., демонстрирует, что вакцина-кандидат RVX10 обеспечивает надежную защиту от вируса простого герпеса 1 (HSV). -1) у вакцинированных мышей обнаружили, что вакцина-кандидат RVX101 компании, используемая для иммунизации уникальной линии мышей (не генерирующая значительного количества нейтрализующих антител к вирусу), обеспечивает высокий защитный иммунитет и предотвращает неоваскуляризацию, связанную с герпесом.Эта высокая эффективность коррелировала с CD8 + Т-клетками, так как истощение этих клеток после вакцинации, но до заражения HSV-1 устраняло любую полезность, реализуемую вакциной.
30 ноября 2020 г. — В этом систематическом обзоре исследований Medline, EMBASE и PubMed были признаны актуальными 16 статей, включающих исследования как на животных, так и на людях (301 пациент) в отношении использования вакцины Bacillus Calmette-Guérin (BCG). нецелевые эффекты, которые могут повлиять на рецидив инфекций HSV.В нерандомизированных исследованиях на людях (в которых не удалось контролировать эффект плацебо) вакцинация БЦЖ оказалась полезной у 78 процентов взрослых с рецидивирующим генитальным или губным герпесом, при этом у 37 процентов рецидивы отсутствовали в течение длительного периода, а у 41 процента — реже. или тяжелые эпизоды, и только 22 процента сообщили об отсутствии изменений. Это клиническое преимущество согласуется с результатами иммунологических дополнительных исследований. В двух исследованиях, ограниченных рецидивирующим лабиальным герпесом, 94% пациентов получили пользу от БЦЖ.
23 ноября 2020 г. — Исследование, опубликованное Американским обществом микробиологии: в совокупности, исследование предполагает, что CD8 + Т-клетки значительно способствуют адаптивному иммунному ответу хозяина на заражение ВПГ-1 после вакцинации ослабленным вирусом, но в этом участвует множество факторов. патология роговицы в ответ на заражение глазным вирусом. Настоящее исследование показывает, что при почти полном отсутствии антител против HSV-1 вакцинированные мыши защищены от последующих заражений HSV-1 дикого типа, что измеряется по выживаемости.Эффективность теряется после истощения CD8 + Т-клеток. В то время как у вакцинированных мышей, зараженных ВПГ-1, наблюдались повышенная выживаемость и снижение репликации вируса, патология роговицы смешивалась с уменьшением неоваскуляризации, но без изменения помутнения.
6 ноября 2020 г. — Исследование, опубликованное Nature: не нейроинвазивная вакцина R2 от HSV-1 обеспечивает защиту от генитальных инфекций HSV-2 на модели морской свинки. Использование живых аттенуированных вакцин против вируса простого герпеса, которые надежно реплицируют ткани слизистой оболочки, но удаляются из-за нейроинвазии, предлагает многообещающий подход к вакцинам против вируса простого герпеса.Исследование показало, что вакцинация морских свинок модифицированным живым вирусом значительно увеличивает количество антител, борющихся с вирусом. При заражении вирулентным штаммом вируса простого герпеса у вакцинированных животных обнаруживалось меньше поражений половых органов, меньшая репликация вируса и меньшее выделение вируса, что с большей легкостью распространяло инфекцию на других.
3 ноября 2020 г. — Защита от инфекции вируса простого герпеса 2 типа в модели неонатальных мышей с использованием трехвалентной модифицированной нуклеозидом мРНК в вакцине из липидных наночастиц.Неонатальный герпес — опасное осложнение генитальной герпетической инфекции во время беременности. Недавно мы сравнили две платформы вакцин для предотвращения генитального герпеса у самок мышей и морских свинок. Мы определили, что гликопротеины C, D и E HSV-2, экспрессированные с использованием нуклеозид-модифицированной мРНК в липидных наночастицах, обеспечивали лучшую защиту, чем те же антигены, продуцируемые как белки бакуловируса и вводимые с CpG и квасцами.
25 сентября 2020 г. — Исследование: проникновение в клетки вирусов в оболочке требует наличия специализированных вирусных белков, которые опосредуют слияние с мембраной хозяина за счет существенных структурных перестроек от метастабильной конформации до стабильной после слияния.Эта метастабильность делает гликопротеин B (gB) слияния вируса простого герпеса 1 (HSV-1) очень нестабильным, так что он легко превращается в форму после слияния, тем самым препятствуя структурному выяснению фармакологически релевантной конформации до слияния.
24 сентября 2020 г. — Обзор исследования: вакцина БЦЖ является потенциальным, безопасным, доступным и легкодоступным вмешательством-кандидатом для снижения высокого бремени болезней, связанных с инфекцией ВПГ и рецидивами, но требуются должным образом контролируемые рандомизированные испытания.
24 сентября 2020 г. — Исследование: Таким образом, почти у половины пациентов с COVID-19 легкой и средней степени тяжести, госпитализированных в полевой госпиталь в течение 2-недельного периода, были обнаружены кожно-слизистые изменения. Ротовая полость часто поражалась и заслуживает специального обследования при соответствующих обстоятельствах, чтобы избежать риска заражения. Покраснение и отек кистей и стоп, тонкая десквамация ладонно-подошвенной поверхности и пятна от красновато-коричневого цвета могут помочь нам диагностировать инфекцию COVID-19 и регулярно проверяться.
18 августа 2020 г. — Недавнее исследование оценило редактирование гена ВПГ на хорошо зарекомендовавшей себя модели на мышах с использованием мегануклеаз, доставляемых аденоассоциированным вирусом (AAV), в качестве потенциально лечебного подхода к лечению латентной инфекции ВПГ. Здесь мы показываем, что мегануклеазы, доставляемые AAV, но не CRISPR / Cas9, опосредуют высокоэффективное редактирование гена HSV, устраняя более 90% латентного вируса из верхних шейных ганглиев. Уровни элиминации HSV, наблюдаемые в этих исследованиях, при трансляции на людей, вероятно, значительно снизили бы реактивацию HSV, выделение и поражения.
14 августа 2020 г. — Научное исследование: передача сигналов HVEM способствует защитным антителозависимым ответам вакцины на клеточную цитотоксичность на вирусы простого герпеса.
J uly 27, 2020 — НАУЧНАЯ СТАТЬЯ: Вакцина против генитального герпеса, модифицированная нуклеозидами HSV-2, содержащая гликопротеины gC, gD и gE, защищает мышей от поражений половых органов HSV-1 и скрытой инфекции.
27 июля 2020 г. — Вакцины против генитального герпеса: где мы? Из-за высокого бремени генитального герпеса были разработаны вакцины против ВПГ, но ни одна из них не оказалась успешной.В этом обзоре обсуждается текущее состояние разработки вакцины против генитального герпеса.
27 июля 2020 г. — В исследовании на мышах эти исследователи сравнили защиту мРНК-вакцины HSV-2 от генитальной инфекции HSV-1 и HSV-2. Мыши, инфицированные любым из этих вирусов, были полностью защищены от заболеваний половых органов. Примечательно, что в двух экспериментах мРНК-вакцина предотвращала инвазию вируса простого герпеса в ганглии задних корешков, место латентности вируса, у 39/40 (97,5%) мышей, инфицированных ВПГ-1 или ВПГ-2.Они пришли к выводу, что вакцина с трехвалентной мРНК HSV-2 обеспечивает мощную защиту от генитальной инфекции HSV-1 и HSV-2 и является многообещающей вакциной-кандидатом для испытаний на людях.
24 июля 2020 г. — Более 65% молодых людей впервые вступают в половую жизнь без заражения герпесом, но рискуют заразиться им во взрослом возрасте, говорится в новом исследовании. Это исследование показало, что в молодости меньше людей подвергаются воздействию ВПГ-1, также известного как оральный герпес.
23 июля 2020 г. — Исследование: Тетрамерный гликопротеиновый комплекс gH / gL / gQ1 / gQ2 является многообещающей вакциной-кандидатом от вируса герпеса человека 6B.HHV 6 — это группа различных вирусов, принадлежащих к семейству вирусов герпеса. HHV-6B вызывает заболевание, называемое exanthema subitum или roseola infantum, у детей и младенцев. Это одна из наиболее частых причин экстренной госпитализации детей до 3 лет. Тетрамер HHV6B или gH / GL / gQ1 / gQ2 представляет собой белок на поверхности вируса HHV6, который взаимодействует с человеческим CD134 (белок, присутствующий на Т-клетках), чтобы проникнуть в клетки-хозяева. Поскольку вирусы являются внутриклеточными паразитами, для выживания им нужна живая клетка.
21 июля 2020 г. — История разработки Rational Vaccines терапевтической вакцины от генитального герпеса может войти в историю как одна из самых странных и противоречивых глав в истории разработки лекарств или вакцин.
17 июля 2020 г. — Эта статья проливает свет на молекулярные и структурные взаимодействия между тетрамером HHV-6B и его рецептором-хозяином, а также на их нейтрализующие антитела и их сродство, конкуренцию и способы связывания на основе структуры тетрамера HHV-6B. описаны.Наши результаты обеспечивают молекулярную и структурную основу для всестороннего понимания этих взаимодействий и взаимосвязей.
16 июля 2020 г.- Вирус простого герпеса типа 1 в Европе: систематический обзор, метаанализы и мета-регрессии. Результаты показали, что более двух третей (67,4%) населения Европы дали положительный результат на ВПГ-1, что намного ниже, чем исторический уровень всеобщей инфекции в детстве в других частях мира, например в Африке. Около 32.В Европе инфицировано 5% детей и 74,4% взрослых. Результаты также показали, что половина случаев первого эпизода генитального герпеса в Европе уже была вызвана ВПГ-1, а не инфекцией ВПГ-2.
9 июля 2020 г. — Метааналитический подход к транскриптомному профилированию вируса простого герпеса типа 1.
13 июня 2020 г. — Исследование: «В этом обзоре я кратко описал некоторые из доступных моделей, а затем более подробно описал модель острых и рецидивирующих генитальных герпесных инфекций на морских свинках.Как уже говорилось, модель морской свинки наиболее точно имитирует болезнь человека и обеспечивает несколько важных конечных точек для оценки вакцин и противовирусных препаратов ».
3 марта 2020 г. — Резидентные в тканях Т-клеточные цитокины уничтожают клетки, инфицированные вирусом простого герпеса 2.
22 мая 2020 г. — Исследование: оценка свойств и эффективности вакцины R2, полученной из альфа-вируса герпеса, вируса псевдобешенства (PRV), на свиньях. Мы демонстрируем, что вакцина PRV R2 не поражает периферическую нервную систему свиней в пределах обнаружения.Кроме того, после однократной интраназальной вакцинации R2 обеспечивал защиту свиней, впоследствии зараженных вирулентным полевым штаммом PRV (NIA-3). Эти данные подтверждают, что конструкция вакцины R2 не является нейроинвазивной и является эффективной вакциной в контексте естественного хозяина.
19 мая 2020 г. — Genocea Biosciences, Inc. объявила, что заключила соглашение о передаче материалов и эксклюзивную лицензию с Shionogi & Co., Ltd. на разработку новой вакцины против HSV-2 с использованием патентованных Genocea антигенов HSV-2 от компании Genocea. программа GEN-003.
7 мая 2020 г. — Эта модель резюмирует клинические реакции на естественную инфекцию и результаты испытаний вакцины rgD-2 и предполагает, что ΔgD-2 может оказывать защитное действие на HSV-1-серопозитивных хозяевах.
6 мая 2020 г. — Недавно опубликованное исследование впервые продемонстрировало на лабораторной модели, что вирус простого герпеса HSV-1 может вызывать болезнь Альцгеймера. В ходе исследования ученые обнаружили, что на мини-3D-моделях человеческого мозга при заражении вирусом, вызывающим герпес, появляются признаки болезни Альцгеймера, включая образования, похожие на амилоидные бляшки, и нейровоспаление.
1 мая 2020 г. — ВОЗ опубликовала заявление, в котором говорится: «Около полумиллиарда человек во всем мире живут с генитальным герпесом. Новые оценки показывают, что несколько миллиардов человек инфицированы оральным герпесом, что подчеркивает необходимость повышения осведомленности и расширения услуг по профилактике и лечению герпеса ».
17 марта 2020 г. — Исследование: Обсуждаются уроки, извлеченные из предыдущих исследований вакцин, и избранные вакцины-кандидаты, включая трехвалентную вакцину с модифицированной нуклеозидом мРНК, которую разрабатывает наша лаборатория.
2 марта 2020 г. — Исследователи из WSU недавно опубликовали исследование в журнале mSphere Американского общества микробиологов, в котором впервые установлено, как один из белков вируса действует как критически важный сигнал, позволяющий вирусу успешно заразить клетку.
27 апреля 2020 г. — Исследование: Основываясь на нашей пересмотренной аннотации 201 вирусного транскрипта и 284 ORF, мы расширили существующую номенклатуру, включив в нее все наши новые продукты вирусных генов. Это не повлекло за собой переименование ранее описанных продуктов вирусных генов.Таким образом, наша терминология объясняет экспрессию генов большинства вирусных ORF в контексте различных изоформ транскриптов, uORF и uoORF. Это облегчит функциональные исследования продуктов вирусных генов и их регуляции транскрипции и трансляции.
11 февраля 2020 г. — Исследование: современные противовирусные препараты и новые ботанические молекулы, препятствующие инфицированию вирусом простого герпеса.
6 февраля 2020 г. — Исследование: Внутримышечная вакцинация мышей вакциной VC2 от вируса простого герпеса человека типа 1 (HSV-1), но не его родительским штаммом HSV-1 (F), обеспечивает полную защиту от летального глазного HSV -1 (McKrae) патогенез.
10 января 2020 г. — Санофи объявила о публикации исследований Этапа 1 и 2. Основные цели исследования: описать профиль безопасности различных экспериментальных схем вакцинации против вируса простого герпеса типа 2 (HSV-2). Оценить эффективность экспериментальных схем вакцинации в отношении частоты заражения дезоксирибонуклеиновой кислотой вируса простого герпеса (HSV) ( ДНК) обнаружение в области гениталий (скорость выделения) после схемы вакцинации 2 дозами; доля участников, у которых не было рецидива генитального вируса простого герпеса через 6 месяцев после введения двух доз вакцины.
8 января 2020 г. — Candel Therapeutics объявила, что приобретение объединяет платформу разработки лекарств от герпеса нового поколения и производственный опыт, который может адаптироваться к различным типам опухолей и показаниям.
17 декабря 2019 г. — Иммунные ответы на полинуклеотидную иммунотерапию ВПГ-2 COR-1 у субъектов, положительных по ВПГ-2: рандомизированное двойное слепое исследование фазы I / IIa. Это исследование подтверждает ранее продемонстрированную безопасность COR-1 для людей и указывает на возможность использования COR-1 в качестве терапии для уменьшения выделения вируса у субъектов, инфицированных HSV-2.
10 декабря 2019 г. — Недавнее исследование дает новое представление о ранних стадиях инфекции, вызванной вирусом простого герпеса 1 (ВПГ-1). Он служит общим планом для исследования гетерогенных состояний клеток при вирусной инфекции.
5 декабря 2019 г. — Недавнее исследование показало, что «значительное бремя вируса иммунодефицита человека (ВИЧ), вероятно, связано с инфекцией, вызванной вирусом простого герпеса 2 типа (ВПГ-2).
21 ноября 2019 г. — Исследователи Корнельского университета, надеющиеся узнать, что переключает этот пожизненный вирус между латентной и литической стадиями, возможно, нашли «скрытый» ответ на этот вопрос.
18 ноября 2019 г. — Глобальные и региональные оценки вклада инфекции вируса простого герпеса 2 типа в заболеваемость ВИЧ: фракционный анализ популяций с использованием опубликованных эпидемиологических данных. Существенное бремя ВИЧ, вероятно, связано с инфекцией ВПГ-2, даже если влияние инфекции ВПГ-2 на ВИЧ не было точно измерено в исследованиях, дающих скорректированные оценки ОР, возможно, из-за остаточного искажения. Этот вклад, вероятно, будет наиболее значительным в регионах, где широко распространен ВПГ-2, особенно в Африке.Новые профилактические меры против инфекции ВПГ-2 могут не только улучшить качество жизни миллионов людей за счет снижения распространенности герпетической генитальной язвы, но также могут иметь дополнительный косвенный эффект на передачу ВИЧ.
20 сентября 2019 г. — Новое исследование вакцины против вируса простого герпеса 2 на животных сообщило, что экспериментальная вакцина, разработанная в Университете Пенсильвании, предотвратила поражения половых органов у 98 процентов протестированных мышей и морских свинок.Фридман и его коллеги только что опубликовали статью в Science Immunology, в которой описывают разработанную ими трехвалентную вакцину от герпеса и ее эффективность на животных моделях. Эта трехвалентная вакцина защищает мышей и морских свинок от развития половых органов и снижает вирусное выделение. Нейтрализующие антитела и ответы CD4 + Т-клеток были обнаружены у иммунизированных мышей.
23 июля 2019 г. — 19 февраля 2019 г. был выдан патент, который защищает использование уникальной адъювантной платформы NanoVax компании BlueWillow Biologics для разработки вакцины, защищающей от ВПГ-1 и ВПГ-2.
23 июля 2019 г. — X-Vax Technology, Inc. объявила о привлечении 56 миллионов долларов в рамках увеличенного финансирования серии A с участием стратегических и институциональных инвесторов, включая Johnson & Johnson Innovation — JJDC, Inc. Поступления от финансирования будет использоваться для продвижения ведущей программы X-VAX, вакцины-кандидата от герпеса, называемой ∆gD-2 (дельта gD-2), для дальнейшей разработки и производства, включая клиническое исследование фазы 1.
15 июня 2019 г. — Новое исследование, опубликованное в журнале Nature 12 июня 2019 г., исследователи из Йельского университета предложили идеи, которые могут привести к созданию более эффективной вакцины против генитального герпеса.
2 мая 2019 г. — Многочисленные эпидемиологические, клинические и иммунологические исследования демонстрируют, что вакцинация БЦЖ влияет на иммунный ответ на последующие инфекции, что приводит к снижению заболеваемости и смертности. Важные доказательства того, что БЦЖ защищает от вирусных патогенов, получены из экспериментальных исследований на мышах, показывающих, что БЦЖ обеспечивает защиту от различных ДНК и РНК-вирусов, включая вирусы герпеса и гриппа. Недавно было продемонстрировано действие БЦЖ на экспериментальную вирусную инфекцию у людей.Считается, что эти эффекты опосредуются индукцией врожденной иммунной памяти и активацией гетерологичных лимфоцитов, что приводит к усилению продукции цитокинов, активности макрофагов, Т-клеточных ответов и титров антител.
17 апреля 2019 г. — Терапевтическая вакцинация слизистой оболочки морских свинок, инфицированных вирусом простого герпеса 2, белком рибонуклеотид редуктазы 2 (RR2) усиливает противовирусные нейтрализующие антитела и местные тканевые резидентные CD4 + и CD8 + TRM-клетки, связанные с защитой от рецидивов герпеса.
27 марта 2019 г. — Исследовательская статья: Продолжительность защиты от живых аттенуированных вакцин против вируса простого герпеса 2 типа в модели генитального герпеса на морских свинках: переоценка эффективности с использованием конечных точек клинических испытаний.
22 января 2019 г. — Исследование: индуцированные вакциной антитела нацелены на секвестрированные вирусные антигены для предотвращения патогенеза глазного ВПГ-1, сохранения зрения и предупреждения продуктивной нейрональной инфекции.
22 ноября 2018 г. — Исследование: живая аттенуированная профилактическая вакцина против ВПГ, VC2, оказалась эффективной на модели генитального ВПГ-2 у морских свинок.Его пониженная способность инфицировать нервные ткани дает преимущества перед другими живыми аттенуированными вакцинами. Живая аттенуированная профилактическая вакцина против ВПГ, VC2, была эффективной на модели генитального ВПГ-2 на морских свинках. Его пониженная способность инфицировать нервные ткани дает преимущества перед другими живыми аттенуированными вакцинами.
11 августа 2018 г. — Датчик динамики вируса простого герпеса 2 измеряет чрезвычайно быстрый и пространственно локализованный тканевый ответ Т-клеток.
28 октября 2015 г. — Глобальные и региональные оценки распространенности и инцидентов инфекций, вызванных вирусом простого герпеса 1 типа, в 2012 г.
6 октября 2015 г. — Оригинальное исследование: рентабельность вакцины против опоясывающего герпеса для лиц в возрасте 50 лет.
9 января 2014 г. — Обзор: проблема разработки вакцин против вируса простого герпеса 2.
5 января 2012 г. — NEJM опубликовал оригинальную статью: «Результаты исследования эффективности вакцины от простого герпеса». В исследуемой популяции, представляющей общую популяцию женщин с серонегативными вирусами HSV-1 и HSV-2, исследуемая вакцина эффективно предотвращала генитальное заболевание и инфекцию HSV-1, но не предотвращала заболевание или инфекцию HSV-2.
Российская вакцина против герпесаVitagerpavac — единственная в мире поливалентная вакцина для лечения хронической герпесвирусной инфекции (HSV) типов I и II. Вакцина разработана в НИИ вирусологии. DI. Ивановский РАМН используется в Российской Федерации более 15 лет.
Обзор вакцины против герпесаПо данным CDC США, распространение HSV-1 обычно происходит при прямом контакте, обычно с участием слюны, и чаще всего проявляется в виде герпеса во рту или вокруг него.И инфекции HSV-2 обычно возникают после полового контакта, что приводит к повторяющимся, часто болезненным, язвам на гениталиях примерно у трети инфицированных людей. И от герпеса нет лекарства.
В 2016 году две трети населения мира в возрасте до 50 лет — около 3,7 миллиарда человек — были инфицированы вирусом простого герпеса 1 типа, который, по данным ВОЗ, чаще всего проявляется в виде герпеса во рту или вокруг него.
Вакцины против герпеса и ВИЧ
У людей, инфицированных ВПГ-2, вероятность заражения ВИЧ в случае контакта как минимум в три раза выше.Вмешательства, нацеленные на ВПГ-2, такие как новые вакцины против ВПГ, обладают потенциалом дополнительных преимуществ против ВИЧ, что может быть особенно эффективным в регионах с высокой частотой сочетанной инфекции.
Источники контента : ВОЗ, CDC США, ВОЗ, NIH, исследовательские статьи, ClinicalTrials.gov и новостная сеть Precision Vaccinations. Контент проверяется поставщиками медицинских услуг, такими как доктор Роберт Карлсон.
вакцин против вируса папилломы человека (ВПЧ) — Национальный институт рака
Чатурведи А.К., Энгельс Э.А., Пфайфер Р.М. и др.Вирус папилломы человека и рост заболеваемости раком ротоглотки в США. Журнал клинической онкологии 2011; 29 (32): 4294–4301.
[Аннотация PubMed]Гиллисон М.Л., Чатурведи А.К., Лоуи Д.Р. Профилактические вакцины против ВПЧ и потенциальная профилактика нецервикального рака у мужчин и женщин. Cancer 2008; 113 (10 приложение): 3036-3046.
[Аннотация PubMed]Коутский Л.А., Олт К.А., Уиллер С.М. и др.Контролируемое испытание вакцины против вируса папилломы человека типа 16. Медицинский журнал Новой Англии 2002; 347 (21): 1645-1651.
[Аннотация PubMed]Meites E, Szilagyi PG, Chesson HW, et al. Вакцинация взрослых против вируса папилломы человека: обновленные рекомендации Консультативного комитета по практике иммунизации. Еженедельный отчет о заболеваемости и смертности MMWR 2019; 68 (32): 698–702.
[Аннотация PubMed]Meites E, Kempe A, Markowitz LE.Использование схемы из двух доз для вакцинации против вируса папилломы человека — Обновленные рекомендации Консультативного комитета по практике иммунизации. Еженедельный отчет о заболеваемости и смертности MMWR 2016; 65: 1405–1408.
[Аннотация PubMed]Чаттерджи А. Новое поколение вакцин против ВПЧ: ненавалентная вакцина V503 на горизонте. Экспертный обзор вакцин 2014; 13 (11): 1279-90.
[Аннотация PubMed]Всемирная организация здравоохранения.Вакцины против вируса папилломы человека: документ с изложением позиции ВОЗ, май 2017 г. — Рекомендации. Вакцина 2017; 35 (43): 5753-5755.
[Аннотация PubMed]Кавана К., Поллок К.Г., Кушьери К. и др. Изменения в распространенности вируса папилломы человека после национальной программы вакцинации против вируса папилломы человека в Шотландии: 7-летнее кросс-секционное исследование. Ланцет. Инфекционные болезни 2017; 17 (12): 1293-1302.
[Аннотация PubMed]Дроле М, Бенар Э, Перес Н, Бриссон М; Группа изучения воздействия вакцинации против ВПЧ.Влияние на популяцию и стадные эффекты после внедрения программ вакцинации против вируса папилломы человека: обновленный систематический обзор и метаанализ. Lancet 2019; 394 (10197): 497-509.
[Аннотация PubMed]Kjaer SK, Nygård M, Dillner J, et al. 12-летнее наблюдение за долгосрочной эффективностью четырехвалентной вакцины против вируса папилломы человека в 4 странах Северной Европы. Клинические инфекционные болезни 2018; 66 (3): 339-345.
[Аннотация PubMed]Науд П.С., Ротели-Мартинс С.М., Де Карвалью Н.С. и др. Устойчивая эффективность, иммуногенность и безопасность вакцины с адъювантом против ВПЧ-16/18 AS04: окончательный анализ долгосрочного последующего исследования в течение 9,4 лет после вакцинации. Вакцины и иммунотерапевтические средства для человека 2014; 10 (8): 2147-2162.
[Аннотация PubMed]Huh WK, Joura EA, Giuliano AR, et al.Окончательный анализ эффективности, иммуногенности и безопасности девятивалентной вакцины против вируса папилломы человека у женщин в возрасте 16-26 лет: рандомизированное двойное слепое исследование. Lancet 2017; 390 (10108): 2143-2159.
[Аннотация PubMed]Джулиано А.Р., Палефски Дж. М., Голдстоун С. и др. Эффективность четырехвалентной вакцины против ВПЧ против инфекции и болезней ВПЧ у мужчин. Медицинский журнал Новой Англии 2011; 364 (5): 401-411.
[Аннотация PubMed]Kreimer AR, Gonzalez P, Katki H, et al.Эффективность бивалентной вакцины против ВПЧ 16/18 против анальной инфекции ВПЧ 16/18 среди молодых женщин: вложенный анализ в рамках испытания вакцины в Коста-Рике. Ланцет онкологии 2011; 12 (9): 862–870.
[Аннотация PubMed]Эрреро Р., Квинт В., Хильдесхайм А. и др. Снижение распространенности орального папилломавируса человека (ВПЧ) через 4 года после двухвалентной вакцинации против ВПЧ в рандомизированном клиническом исследовании в Коста-Рике. PLoS One 2013; 8 (7): e68329.
[Аннотация PubMed]Али Х., Гай Р.Дж., Ванд Х и др. Снижение стационарного лечения остроконечных кондилом среди молодых австралийцев после национальной программы вакцинации против ВПЧ. BMC Infectious Diseases 2013; 13: 140.
[Аннотация PubMed]Стейнбрук Р. Возможности вакцин против вируса папилломы человека. Медицинский журнал Новой Англии 2006; 354 (11): 1109–1112.
[Аннотация PubMed]Джемал А., Симард Е.П., Дорелл С. и др. Ежегодный отчет для нации о статусе рака, 1975–2009 годы, в котором представлены данные о бремени и тенденциях в области рака, ассоциированного с вирусом папилломы человека (ВПЧ), и об уровнях охвата вакцинацией против ВПЧ. Журнал Национального института рака 2013; 105 (3): 175-201.
[Аннотация PubMed]Gee J, Naleway A, Shui I, et al. Мониторинг безопасности четырехвалентной вакцины против вируса папилломы человека: результаты исследования Vaccine Safety Datalink. Вакцина 2011; 29 (46): 8279-8284.
[Аннотация PubMed]Arnheim-Dahlström L, Pasternak B, Svanström H, Sparén P, Hviid A. Аутоиммунные, неврологические и венозные тромбоэмболические побочные эффекты после иммунизации девочек-подростков четырехвалентной вакциной против вируса папилломы человека в Дании и Швеции: когортное исследование. Британский медицинский журнал 2013; 347: f5906.
[Аннотация PubMed]Стокли С., Джейараджа Дж., Янки Д. и др.Охват вакцинацией против вируса папилломы человека среди подростков, 2007–2013 гг., И мониторинг безопасности вакцин после получения лицензии, 2006–2014 гг. — США. Еженедельный отчет о заболеваемости и смертности MMWR 2014; 63 (29): 620-624.
[Аннотация PubMed]Джи Дж., Вайнбаум К., Сукумаран Л., Марковиц Л. Обзор безопасности четырехвалентной вакцины против ВПЧ и планы мониторинга безопасности девятивалентной вакцины против ВПЧ в США. Вакцины и иммунотерапевтические средства для человека 2016; 12 (6): 1406-1417.
[Аннотация PubMed]Марковиц Л.Е., Данн Э.Ф., Сарайя М. и др. Вакцинация против вируса папилломы человека: рекомендации Консультативного комитета по практике иммунизации (ACIP). Еженедельный отчет о заболеваемости и смертности 2014; 63 (RR-05): 1-30.
[Аннотация PubMed]Hildesheim A, Herrero R, Wacholder S, et al. Эффект вакцины L1 с вирусоподобными частицами от вируса папилломы человека 16/18 среди молодых женщин с ранее существовавшей инфекцией: рандомизированное испытание. JAMA 2007; 298 (7): 743–753.
[Аннотация PubMed]Hildesheim A, Gonzalez P, Kreimer AR, et al. Влияние вакцинации против вируса папилломы человека (ВПЧ) 16 и 18 на распространенные инфекции и частоту поражений шейки матки после эксцизионного лечения. Американский журнал акушерства и гинекологии 2016; 215 (2): 212.e1-212.e15.
[Аннотация PubMed]Kreimer AR, Herrero R, Sampson JN, et al.Доказательства защиты от однократного введения двухвалентной вакцины против ВПЧ — Обзор испытаний вакцины против ВПЧ в Коста-Рике и будущих исследований. Вакцина 20 января 2018 г. pii: S0264-410X (18) 30018-5.
[Аннотация PubMed]Safaeian M, Sampson JN, Pan Y, et al. Долговечность защиты, обеспечиваемая меньшими дозами вакцины HPV16 / 18: испытание CVT. Журнал Национального института рака 2018; 110 (2). DOI: 10.1093 / jnci / djx158.
[Аннотация PubMed]Brotherton JM, Budd A, Rompotis C, et al. Одна доза вакцины против вируса папилломы человека так же эффективна, как три ?: национальный когортный анализ. Исследование папилломавируса 2019; 8: 100177.
[Аннотация PubMed]Креймер А.Р., Шерман М.Э., Сахасрабуддхе В.В., Сафаян М. Обоснование проведения рандомизированного клинического исследования для оценки эффективности однократной дозы профилактических вакцин против ВПЧ среди подростков. Журнал Национального института рака 2015; 107 (3). pii: dju436. DOI: 10.1093 / jnci / dju436
Sampson JN, Hildesheim A, Herrero R, et al. Дизайн и статистические соображения для исследований, оценивающих эффективность разовой дозы вакцины против вируса папилломы человека (ВПЧ). Современные клинические испытания 2018; 68: 35-44.
[Аннотация PubMed]Magnan S, Tota JE, El-Zein M и др.Эффективность геля каррагинана против передачи цервикального ВПЧ (CATCH): промежуточный анализ рандомизированного двойного слепого плацебо-контролируемого исследования фазы 2B. Клиническая микробиология и инфекция 2019; 25 (2): 210-216.
[Аннотация PubMed]Хэнкок Г., Хеллнер К., Доррелл Л. Терапевтические вакцины против ВПЧ. Лучшие практики и исследования. Клиническое акушерство и гинекология 2018; 47: 59-72.
[Аннотация PubMed]Ян А., Фермер Э, У ТК, Хунг С.Ф.Перспективы разработки терапевтической вакцины против ВПЧ. Журнал биомедицинских наук 2016; 23 (1): 75.
[Аннотация PubMed]Trimble CL, Морроу М.П., Крайняк К.А. и др. Безопасность, эффективность и иммуногенность VGX-3100, терапевтической синтетической ДНК-вакцины, нацеленной на белки E6 и E7 вируса папилломы человека 16 и 18 для цервикальной интраэпителиальной неоплазии 2/3: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 2b. Lancet 2015; 386 (10008): 2078-2088.


