определение, виды, сущность, выполняемые функции и их влияние на человека
Человек сталкивается с эмоциональными реакциями каждый день, но редко о них задумывается. Тем не менее они сильно облегчают ему жизнь. Что же дает эмоциональная разрядка человеку? Она помогает сохранять нервы в порядке. По этой причине те персоны, которые скрывают проявление своих эмоций, чаще страдают сердечными недостаточностями и нервными болезнями.
Определение
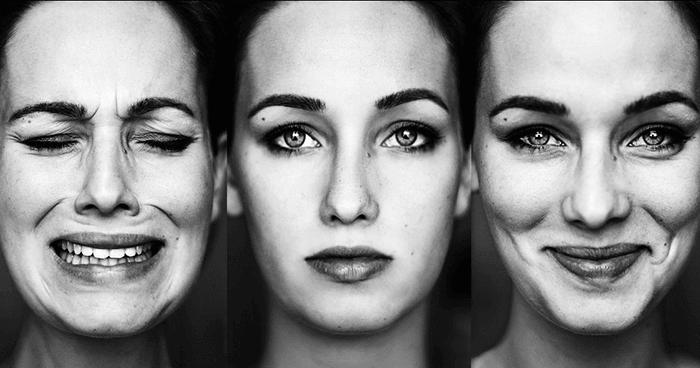
Что такое эмоциональная реакция? Это процесс, который выражается в действиях, словах или же состоянии. Он возникает в ответ на душевное или же внешнее раздражение. Например, вас кто-то напугал, и вы начинаете переживать. Или же вам кто-то сделал сюрприз, и вы обрадовались. Эмоциональная реакция на одну и ту же ситуацию у двух людей может быть разной. Все будет зависеть от того, как та или иная персона смотрит на сложившуюся ситуацию. Каждый человек является автором своих эмоций, по этой причине люди могут не только искренне чему-то радоваться, но и подделывать свои эмоции. А порой рамки приличия заставляют человека сдерживать свои чувства. Но все же от взгляда внимательного зрителя не ускользнет реальная эмоция и ее наигранный прототип.
Виды

Какие бывают виды эмоциональных реакций? Условно их можно разделить на две группы. В первой эмоции делятся по своей положительной окраске.
- Позитивные. Положительных эмоций у человека меньше, чем отрицательных. Это связано с тем, что в жизни не так много приятного? Не совсем. Исторически так сложилось, что человеку было хорошо там, где ему было спокойно. А спокойное течение жизни не вызывает никаких ярких эмоций.
- Негативные. Отрицательных эмоций у человека больше, чем положительных. Возможно, это связано с тем, что наши предки тратили много время на охоту и защиту себя и своей семьи. По этой причине у них было много эмоций, связанных со страхом и раздражением.
На какие еще виды могут делиться эмоциональные реакции?
- Врожденные. Человек не знает, что такое гнев, с рождения. Эта эмоция приобретенная. А вот о том, что такое страх, знает даже младенец.
- Выученные. Развиваясь, ребенок познает мир и учится выражать свои эмоции. Обучают свое чадо родители. Они следят за тем, чтобы ребенок мог в соответствии с общепринятыми нормами реагировать на ту или иную ситуацию.
Примеры

Какие вы знаете эмоциональные реакции? Ниже представлены 6 основных.
- Гнев. Эта реакция возникает в человеческой душе тогда, когда ожидание не совпадает с реальностью. Настроение у человека портится, и он начинает раздражаться. Чтобы нервы не сдали, он выплескивает все наружу, чаще всего на собеседника или на того, кто оказался ближе всего.
- Радость. Когда человек чем-то доволен, он улыбается и смеется. Такая реакция возникает на положительные события.
- Тоска. Грустное состояние время от времени присуще всем. Благодаря тоске человек может острее ощущать радость.
- Страх. Это врожденное чувство, которое человек непроизвольно испытывает всякий раз, когда находится в потенциальной опасности. Срабатывает инстинкт выживания, который предупреждает о грядущей беде.
- Удивление. Эта эмоциональная реакция может быть и положительной, и отрицательной. Все будет зависеть от обстоятельств, в которых человек столкнется с удивлением.
- Отвращение. Подобным образом человек реагирует на то, что ему неприятно. Эмоция эта приобретена и формируется под воздействием воспитания.
Степени

Эмоциональные реакции человека развиваются в трех направлениях. Условно их можно охарактеризовать тремя степенями.
- Быстрота. Каждая эмоциональная реакция наступает молниеносно, а вот сколько она будет длиться, человек не знает. Все зависит от того, насколько сильно заденет персону то или иное обстоятельство.
- Глубина. Даже если человека что-то вывело из себя, обида может быстро пройти, так же как и радость. А вот насколько сильно эмоция поразит человека, будет определяться глубиной чувств конкретной личности к персоне или объекту, который вызвал эмоциональную реакцию.
- Интенсивность. Одни эмоции запоминаются надолго, а другие быстро проходят. Это и называется интенсивностью реакции.
Типы

Эмоции бывают разными, и реакции человека на эти эмоции тоже. То, что персону не интересует, проходит тихо и не задевает тонких струн души. То, что для человека важно, оставляет сильный отпечаток. Какие же бывают типы эмоциональных реакций?
- Эмоциональный отклик. Такая реакция считается самой стандартной и ходовой. Вас что-то расстроило или обрадовало, вы смеетесь или плачете соответственно. Эмоциональные реакции ребенка должны развивать родители. Если они этого не делают, значит, их чадо вырастит бесчувственным эгоистом.
- Эмоциональная вспышка. То, что не попадает под определение ”отклик”, смело можно называть вспышкой. Это короткая сильная реакция, которая накладывает отпечаток на душу человека. Если вы неожиданно и сильно напугаете друга, то можете увидеть яркий пример эмоциональной вспышки.
- Эмоциональный взрыв. Такая реакция, в отличие от вспышки, не молниеносна. Она может произойти вследствие череды обстоятельств, которые поочередно вызывали сначала эмоциональный отклик, а затем вспышку.
Функции

Зачем нужны эмоциональные реакции и состояния человеку?
- Регуляторная. Чтобы нервная система могла нормально функционировать, ей время от времени нужно разряжаться. За счет выплеска эмоций снимается напряжение и нервы приходят в норму.
- Оценочная. Человеку необязательно что-то проверять на собственном опыте, чтобы понять, хорошо это или плохо. Персона может предположить эмоции и реакции на них, которые будет испытывать в той или иной ситуации.
- Побудительная. Некоторые эмоциональные реакции заставляют человека что-то делать. Если учесть правдивость поговорки, что движение – это жизнь, то именно благодаря получению конкретных эмоций человек может продолжать двигаться.
- Коммуникативная. С помощью языка тела человек может передать даже больше информации, чем он сможет это сделать вербально, обратившись к помощи слов.
Первая реакция
Человек может скрыть от посторонних многое, но не свои чувства. Сильные душевные волнения всегда передаются за счет эмоциональных реакций. Примером такого поведения могут быть искусственные улыбки, которые сегодня принято ”надевать” в обществе. Если ваш знакомый на подходе к вам держит мрачную мину, но его лицо преображается, когда человек подошел уже практически вплотную, это значит, что личность не очень добродушно настроена. Нарисовать эмоции на лице можно, но опытному глазу неискренность видна сразу. Так же как и явная радость, которая выдает симпатию одной личности к другой. Если при появлении человека в компании из трех персон одна из них начинает широко улыбаться, то это явный признак неравнодушного отношения. Так что если вы хотите знать, как к вам относится человек, посмотрите на то, как он себя ведет при вашем появлении.
Эмоциональная реакция — Психологос
Фильм «Операция Ы и другие приключения Шурика»
Эмоциональные реакции зависят от того, как мы увидели и поняли ситуацию.
скачать видео
Вас обрадовали — вы обрадовались. Вас испугали — вы боитесь…
Эмоциональные реакции отличаются от эмоциональных акций — состояний и движений, где человек был проактивен и был их автором. Вприкидку, соотношение эмоциональных акций и реакций у развитой личности — 50/50, у массовой личности — 20/80. У творческих детей и развитых взрослых значительнная часть эмоций — это эмоциональные акции. Эмоции у шаблонных взрослых — как правило, непроизвольная и не поддающаяся контролю эмоциональная реакция организма на происходящие вокруг события. Смотри Теория социального психоанализа эмоций
Виды эмоциональных реакций
Эмоциональные реакции могут быть и негативными, и позитивными, и врожденными, и выученными, могут быть как оперативными, так и реактивными.
Естественность эмоциональных реакций
Эмоциональные реакции обычно протекают как автоматизмы и ощущаются как естественные. При этом в реальности процесс, организующий эмоциональные реакции, бывает разной степени сложности. В частности, оперативные эмоциональные реакции сильно зависят от того, как мы увидели и поняли ситуацию. А восприятие — это уже поле субъективности…
Фильм «Храм судьбы»
Если вам не нравятся жуки на закуску или глазки в супе, то это не рефлекторные, а привитые или заякоренные эмоции. Ваши соседи хрумкают это с аппетитом.
скачать видео
Первая эмоциональная рекация
Первая эмоциональная реакция, как правило, показывает истинное отношение человека.
Если при встрече с вашим знакомым, в первые несколько мгновений у него возникло нахмуренное выражение лица, а потом он стал улыбаться, то есть большая вероятность, что он не так уж и рад этой встрече.
Фильм «Мир эмоций: искусство быть счастливее. Занятие проводит проф. Н.И. Козлов»
Первая эмоциональная реакция показывает истинное отношение.
скачать видео
Оперативные и реактивные эмоциональные реакции
Эмоциональные реакции имеют разную природу. Часть эмоциональных реакций — оперативные эмоции, приобретенные и используемые человеком в связи с реальной или условной выгодой. Оперативные эмоции — либо осознанные, либо привычные и уже неосознаваемые реакции человека на окружающий мир, которые когда-либо были освоены для решения тех или иных жизненных задач, в которых есть реальная или условная выгода. Другая часть — реактивные эмоции, возникающие всегда бессознательно, автоматически, без всякой цели и без какой-либо выгоды.
Вприкидку, соотношение оперативных и реактивных эмоций у развитой личности — 60/40, у массовой личности — 10/90.
В свою очередь, реактивные эмоции имеют три основные разновидности: рефлекторные эмоции, заякоренные эмоции и привитые эмоции.
Любовь как реактивное отношение
Любовь тоже бывает и акцией, и реакцией. Как реактивное отношение, любовь есть непроизвольный поведенческий и эмоциональный ответ человека на то, что на него в этом направлении воздействовало. Смотри Любовь как реактивное отношение

«Реакция» морфологический разбор слова — ассоциации, падежи и склонение слов
Гипо-гиперонимические отношения
реакция противодействие аэроупругостьПрилагательные к слову реакция
Какой бывает реакция? Предлагаем подбор прилагательных на основе литературных произведений и статей.
Глаголы к слову реакция
Что может реакция? Что можно сделать с реакцией? Подбор подходящих глаголов на основе русского языка.
Ассоциации к слову реакция
Подбор ассоциативного ряда. Слова, которые в той или иной степени ассоциируются с искомым.
Гипонимы
Какого рода реакция (морфологический разбор)
Разбор слова по части речи, роду, числу, одушевленности и падежу.
Часть речи:
существительное
Число:
единственное
Одушевленность:
неодушевленное
Падеж:
именительный
Склонение существительного реакция (какой падеж)
Склонение слова по падежу в единственном и множественном числах.
| Падеж | Вопрос | Ед.число | Мн. число |
|---|---|---|---|
| Именительный | (кто, что?) | реакция | реакции |
| Родительный | (кого, чего?) | реакции | реакций |
| Дательный | (кому, чему?) | реакции | реакциям |
| Винительный | (кого, что?) | реакцию | реакции |
| Творительный | (кем, чем?) | реакцией | реакциями |
| Предложный | (о ком, о чём?) | реакции | реакциях |
Сфера употребления
Химическое оружие Ядерное оружие Сейсмология Энергетика МедицинаПредложения со словом реакция
Наш робот составил несколько предложений в автоматическом режиме. Оцените его работу, тем самым Вы поможете ему стать более совершенным.
1. Реакция временно захватила из противной лужи
плохо 1
хорошо 0
2. Реакция немедленно навеяла на ульяну
плохо 1
хорошо 0
3. Реакция интуитивно позволила в настоящем ноябре
плохо 1
хорошо 0
4. Прибыльно реакция оставила в воздушной силе
плохо 1
хорошо 0
Напишите свои варианты ассоциаций
Химическая реакция — Википедия
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при котором ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов, так как ядра остаются прежними, а все изменения происходят в электронной оболочке.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По наличию границы раздела фаз[править | править код]
Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. В многостадийной химической реакции некоторые стадии могут быть гомогенными, а другие — гетерогенными. Такие реакции называются
В зависимости числа фаз, которые образуют исходные вещества и продукты реакции, химические процессы могут быть гомофазными (исходные вещества и продукты находятся в пределах одной фазы) и гетерофазными (исходные вещества и продукты образуют несколько фаз). Гомо- и гетерофазность реакции не связана с тем, является ли реакция гомо- или гетерогенной[2]. Поэтому можно выделить четыре типа процессов:
- Гомогенные реакции (гомофазные). В реакциях такого типа реакционная смесь является гомогенной, а реагенты и продукты принадлежат одной и той же фазе. Примером таких реакций могут служить реакции ионного обмена, например, нейтрализация раствора кислоты раствором щёлочи:
- NaOH+HCl→NaCl+h3O{\displaystyle \mathrm {NaOH+HCl\rightarrow NaCl+H_{2}O} }
- Гетерогенные гомофазные реакции . Компоненты находятся в пределах одной фазы, однако реакция протекает на границе раздела фаз, например, на поверхности катализатора. Примером может быть гидрирование этилена на никелевом катализаторе:
- C2h5+h3→C2H6{\displaystyle \mathrm {C_{2}H_{4}+H_{2}\rightarrow C_{2}H_{6}} }
- Гомогенные гетерофазные реакции. Реагенты и продукты в такой реакции существуют в пределах нескольких фаз, однако реакция протекает в одной фазе. Так может проходить окисление углеводородов в жидкой фазе газообразным кислородом.
- Гетерогенные гетерофазные реакции. В этом случае реагенты находятся в разном фазовом состоянии, продукты реакции также могут находиться в любом фазовом состоянии. Реакционный процесс протекает на границе раздела фаз. Примером может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
- MgCO3+2HCl→MgCl2+CO2↑+h3O{\displaystyle \mathrm {MgCO_{3}+2HCl\rightarrow MgCl_{2}+CO_{2}\uparrow +H_{2}O} }
По изменению степеней окисления реагентов[править | править код]
- Если в процессе реакции происходит изменение степеней окисления реагентов, то такие реакции называются окислительно-восстановительными реакциями: атомы одного элемента (окислителя) восстанавливаются, то есть присоединяют электроны и понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть отдают электроны и повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции конпропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
- 2h3+O2→2h3O{\displaystyle \mathrm {2H_{2}+O_{2}\rightarrow 2H_{2}O} }
Пример реакции конпропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
- Nh5NO3→N2O↑+2h3O(<250∘C){\displaystyle \mathrm {NH_{4}NO_{3}\rightarrow N_{2}O\uparrow +2H_{2}O\qquad (<250{}^{\circ }C)} }
- Не относятся к окислительно-восстановительным реакции, в которых не происходит изменения степеней окисления атомов, например:
- BaCl2+Na2SO4→BaSO4↓+2NaCl{\displaystyle \mathrm {BaCl_{2}+Na_{2}SO_{4}\rightarrow BaSO_{4}\downarrow +2NaCl} }
По тепловому эффекту реакции[править | править код]
Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение.
По типу превращений реагирующих частиц[править | править код]
Химические реакции всегда сопровождаются физическими эффектами: поглощением или выделением энергии, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
- Реакция соединения — химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое. В такие реакции могут вступать как простые, так и сложные вещества.
Пример: 2Cu+O2⟶2CuO{\displaystyle {\mathsf {2Cu+O_{2}\longrightarrow 2CuO}}}
- Реакция разложения — химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества.
Пример: 2HgO⟶2Hg+O2↑{\displaystyle {\mathsf {2HgO\longrightarrow 2Hg+O_{2}\uparrow }}}
- Реакция замещения — химическая реакция, в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным.
Пример: Fe+CuSO4⟶FeSO4+Cu{\displaystyle {\mathsf {Fe+CuSO_{4}\longrightarrow FeSO_{4}+Cu}}}
- Реакции обмена — реакция, в результате которой два сложных вещества обмениваются своими составными частями. К таким реакциям относится в том числе реакция нейтрализации.
Пример: NaOH+HCl⟶NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\longrightarrow NaCl+H_{2}O}}}
По направлению протекания[править | править код]
- Необратимыми называют химические реакции, протекающие лишь в одном направлении («слева направо»), в результате чего исходные вещества превращаются в продукты реакции. О таких химических процессах говорят, что они протекают «до конца». К ним относят реакции горения, а также реакции, сопровождающиеся образованием малорастворимых или газообразных веществ
- Обратимыми называются химические реакции, протекающие одновременно в двух противоположных направлениях («слева направо» и «справа налево»). В уравнениях таких реакций знак равенства заменяется двумя противоположно направленными стрелками. Среди двух одновременно протекающих реакций различают прямую (протекает «слева направо») и обратную (протекает «справа налево»). Поскольку в ходе обратимой реакции исходные вещества одновременно и расходуются, и образуются, они не полностью превращаются в продукты реакции. Поэтому об обратимых реакциях говорят, что они протекают «не до конца». В результате всегда образуется смесь исходных веществ и продуктов взаимодействия.
По признаку участия катализаторов[править | править код]
- Каталитическими называют реакции, протекающие в присутствии катализаторов. В уравнениях таких реакций химическую формулу катализатора указывают над знаком равенства или обратимости, иногда вместе с обозначением условий протекания (температура t, давление p). К реакциям данного типа относятся многие реакции разложения и соединения.
- Некаталитическими называются многие реакции, протекающие в отсутствие катализаторов. Это, например, реакции обмена и замещения.
По критерию самопроизвольности[править | править код]
Самопроизвольность показывает на способность протекания химических реакций как при нормальных условиях (T = 298 K, P = 101325 Па или 1 атм), так и при различных значениях температуры и давления. Критерием самопроизвольности протекания химических реакций служит свободная энергия Гиббса ΔG. Энергия Гиббса представляет собой разность двух разнонаправленных термодинамических критериев — энтальпийного ΔH (который стремится к уменьшению энтальпии) и энтропийного — TΔS (который стремится к увеличению энтропии):
- ΔG=ΔH−T⋅ΔS{\displaystyle \Delta G=\Delta H-T\cdot \Delta S}
Исходя из данного критерия, химические реакции делятся на:
- Самопроизвольные или экзергонические, когда величина энергии Гиббса отрицательна, то есть ΔG < 0
- Несамопроизвольные или эндергонические, когда величина энергии Гиббса положительна, то есть ΔG > 0
- Равновесные, когда величина энергии Гиббса равна нулю, то есть ΔG = 0
С помощью химических реакций можно получать практически любые вещества, которые в природе находятся в ограниченных количествах, например, азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
- Эмануэль Н. М., Кнорре Д. Г. Курс химической кинетики. — 4-е изд., переработанное и дополненное. — М.: Высшая школа, 1984. — 463 с.
- Химия: Справ. изд./ В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. — М.: Химия, 1989.
- Басоло Ф., Пирсон Р. Механизмы неорганических реакций. — М.: Мир, 1971. — 591 с.
- Воронин А. И., Ошеров В. И., Динамика молекулярных реакций. М.: Наука, 1990. — 421с.
- Воробьев А. Х., Лекции по теории элементарного акта химических реакций в конденсированной фазе. МГУ, 2000.
- Ганкин В. Ю., Ганкин Ю. В., Как образуется химическая связь и протекают химические реакции. М.: Граница, 2007.-319 с.
- Никитин Е. Е., Теория элементарных атомно-молекулярных процессов в газах. М., Химия, 1970.
- Салем Л. Электроны в химических реакциях. М.: Мир, 1985. 299 c.
- Тоуб М. Механизмы неорганических реакций. — М.: Мир, 1975. — 275 с.
- Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций. М.: ГИИЛ, 1948. — 584 с.
- Уманский С. Я. Теория элементарных химических реакций. Интеллект, 2009. — 408с.
- Степанов Н. Ф. «Сложный мир элементарных актов химических реакций» (недоступная ссылка) Соросовский образовательный журнал, 1996, № 11, с. 30-36.
- Степанов Н. Ф. «Потенциальные поверхности и химические реакции» (недоступная ссылка) Соросовский образовательный журнал, 1996, № 10, с. 33-41.\
Виды химических реакций
Мир химии увлекателен и интересен, если уловить суть и немного разобраться с особенностями. Начнем пожалуй с реакций и их подразделений.
Узнать свойства и возможности веществ, можно с помощью проведения разнообразных реакций. Его превращение, которое сопровождается переменой состава или строения и называется химической реакцией. Расшифровать понятие можно и по-другому, это получение из исходного материала, именуемого реагентом, конечного продукта. Записываются химические реакции в схемы, в которых указываются продукты реакций и количество вещества, уравнение реакции более привычный и удобный вид формул. Во втором случае, число атомов любого элемента идентично в правой и в левой частях, что показывает закон сохранения массы. В первой части химической формулы, слева, пишутся значения реагентов, исходных веществ, а во второй, справа, получаемых, в результате действия реакции. Связывает правую и левую часть знак равенства, тем самым показывая, что совокупное количество атомов компонентов задействованных в реакции, остается постоянным. Подобного рода уравнения могут включать в себя дополнительную информацию о влиянии внешних воздействий на реакцию. Это может быть температура, излучение, давление. Как правило, они обозначаются соответствующим символом над или под знаком равенства. Большое множество реакций может быть сгруппировано в несколько видов, которые объединяют определенные признаки. Один из первых, количество и состав исходных веществ. Число фаз в которых состоят участники, агрегатное состоянии исходного и полученного вещества. Возможность протекания реакции в обратную сторону и природа переносимых частиц. Также знак теплового эффекта делит реакции на: экзотермические реакции, протекающие с экзо-эффектом — выделение энергии в форме теплоты и эндотермические реакции, протекающие с эндо-эффектом — поглощением энергии в форме теплоты. Рассмотрим химические реакции подробнее.
Реакции соединения
В результате таковой, из нескольких взаимодействующих простых по составу веществ получается одно, более сложное. Обычно такие реакции образуют более устойчивые, но менее энергетические вещества, т.к. сопровождаются выделением тепла. Соединения простых веществ это окислительно-восстановительные реакции, степени окисления элементов в которых, равны нулю. Реакции которые протекают между сложными веществами могут происходить и без изменения валентности. Пример такого соединения можно привести используя свойства алюминия, атом алюминиясоединяясь с бромом образует новое вещество бромид алюминия: 2Al+3Вr2=2AlВr3.
Реакции разложения
Реакция разложения приводит к образованию из одного вещества нескольких, при этом получить можно как простое так и сложное конечное вещество. Во время взаимодействия веществ происходит перемещение электронов одних частиц к другим. Известно, что уметаллов, на внешнем энергетическом уровне (ВЭУ) имеется 1-3 валентных электрона. Поэтому они сравнительно легко отдают свои электроны неметаллам, у которых на ВЭУ 5-7 электронов. Таким образом свойства металлов, металлическая связь которых обусловлена взаимодействием положительных ионов элементов, помогают в протекании подобных реакций. Индикатором состояния вещества являются степени окисления элементов, окислитель, восстановитель в этом случае либо отдает либо забирает электроны. К реакциям разложения окислительно-восстановительного типа относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления.
Реакция замещения
При реакциях замещения простое вещество реагирует со сложным, образуя другое простое и другое сложное. Эти реакции в основном принадлежат к окислительно-восстановительным, используя реакцию замещения можно изменить жесткость воды,катионы солей жесткости (кальций и магний, железо и марганец), поглощаются ионообменной смолой, которая замещает их на ионы натрия и водорода. Это делает воду мягче.
Реакция обмена
Эта реакция происходит между соединениями, которые меняются между собой составными частями. Процесс всегда происходит без изменения валентности атом, в отличии от окислительно-восстановительных.
Реакция переноса
В результате реакции переноса, атом или группа атомов переходит от одной структурной единице к другой.
Реакция распада
Изучив свойства железа, температура плавления которого 1539 °C, можно рассматривать реакцию распада. Так называемая электролитическая диссоциация, химическая связь расплавленного металла с водой, в результате которой электролит диссоциирует, то есть распадается на ионы.
Электролиз
Следует отметить что в электрохимических процессах окислительная и восстановительная реакции разделяются, а электроны проходят от восстановителя к окислителю не по прямой, а по проводнику внешней цепи, образуя электрический ток, здесь наблюдается взаимное преобразование химической и электрической типов энергии. Ионы имеют электропроводность, электролиз — процесс превращения электрической энергии в химическую, происходит при погружении в раствор электролита или воды активного металла, его поверхностные ионы, находящиеся в узлах кристаллической решетки, вступают в различные взаимодействия с компонентами электролита.
Химия сложная, интересная наука и очень важная. Главное не забывайте, что все что происходит в нашей жизни это одна непрерывная химическая реакция.
реакция — это… Что такое реакция?
[изменение]
Морфология: (нет) чего? реа́кции, чему? реа́кции, (вижу) что? реа́кцию, чем? реа́кцией, о чём? о реа́кции; мн. что? реа́кции, (нет) чего? реа́кций, чему? реа́кциям, (вижу) что? реа́кции, чем? реа́кциями, о чём? о реа́кциях
1. Реакцией называются физиологические изменения в организме в ответ на внешнее раздражение.Биологическая, рефлекторная реакция. | Реакция вялая, живая. | Реакция организма на холод. | Реакция зрачков на свет. | Реакция на внешние раздражители утрачена полностью.
2. Реакцией называются чьи-либо действия в ответ на внезапные события, неожиданные действия какого-либо другого человека.Молниеносная реакция. | У кого-либо хорошая (плохая) реакция.
3. Реакцией называется чья-либо отзывчивость, способность к устойчивому восприятию и ответу на какую-либо информацию.Первая реакция зрителей, слушателей. | Реакция на жалобы, на отказ. | Реакция на публикацию. | Нормальная, странная реакция на что-либо. | Типичная реакция.
4. Защитной реакцией называется чьё-либо оптимальное поведение в сложной ситуации, заключающееся в том, что в организме, психике происходят процессы, которые защищают человека от нервной или физической перегрузки.
5. Реакцией называется процесс превращения веществ во что-либо или преобразования атомных ядер.Химическая, водородная, ядерная реакция. | Реакция гидролиза. | Реакция идёт, закончилась. | В плотном ядре звезды может идти реакция превращения гелия в углерод.
6. Цепной реакцией называется последовательность взаимосвязанных химических процессов, а также последовательность необратимых действий, при которой предыдущее действие вызывает последующее.Достаточно самоустранения одного крупного банка, чтобы пошла цепная реакция банкротств.
• реакцио́нный
[стремление к старому]
Реакцией называется стремление закрепить или восстановить в стране старые, отжившие порядки.Скрытая реакция. | Политическая реакция. | Николаевская реакция. | Эпоха реакции.
Химические реакции: типы, свойства, уравнения
Характеристика химических реакцийХарактеристика химических реакций
Химические реакции, их свойства, типы, условия протекания и прочая, являются одним из краеугольных столпов интересной науки под названием химия. Попробуем же разобрать что такое химическая реакция, и какова ее роль. Итак, химической реакцией в химии принято считать превращение одного либо нескольких веществ, в другие вещества. При этом ядра атомов у них не меняются (в отличие от реакций ядерных), зато происходит перераспределение электронов и ядер, и, разумеется, появляются новые химические элементы.
Химические реакции в природе и быту
Мы с вами окружены химическими реакциями, более того мы сами их регулярно осуществляем различными бытовыми действиями, когда например, зажигаем спичку. Особенно много химических реакций сами того не подозревая (а может и подозревая) делают повара, когда готовят еду.
Разумеется, и в природных условиях проходит множество химических реакций: извержение вулкана, фотосинтез листвы и деревьев, да что там говорить, практически любой биологический процесс можно отнести к примерам химических реакций.
Типы химических реакций
Все химические реакции можно условно разделить на простые и сложные. Простые химические реакции, в свою очередь, разделяются на:
- реакции соединения,
- реакции разложения,
- реакции замещения,
- реакции обмена.
Далее мы подробно остановимся на каждом из этих видов химических реакций, известных химии.
Химическая реакция соединения
По весьма меткому определению великого химика Д. И. Менделеева реакция соединения имеет место быть когда «их двух веществ происходит одно». Примером химической реакции соединения может быть нагревание порошков железа и серы, при которой из них образуется сульфид железа – Fe+S=FeS. Другим ярким примеров этой реакции является горение простых веществ, таких как сера или фосфор на воздухе (пожалуй, подобную реакцию можно также назвать тепловой химической реакцией).
Химическая реакция разложения
Тут все просто, реакция разложения является противоположностью реакции соединения. При ней из одного вещества получается два или более веществ. Простым примером химической реакции разложения может быть реакция разложение мела, в ходе которой из собственно мела образуется негашеная известь и углекислый газ.
Химическая реакция замещения
Реакция замещения осуществляется при взаимодействии простого вещества со сложным. Приведем пример химической реакции замещения: если опустить стальной гвоздь в раствор с медным купоросом, то в ходе этого простого химического опыта мы получим железный купорос (железо вытеснит медь из соли). Уравнение такой химической реакции будет выглядеть так:
Fe+CuSO4→ FeSO4+Cu
Химическая реакция обмена
Реакции обмена проходят исключительно между сложными химическими веществами, в ходе которых они меняются своими частями. Очень много таких реакций имеют место быть в различных растворах. Нейтрализация кислоты желчью – вот хороший пример химической реакции обмена.
NaOH+HCl→ NaCl+Н2О
Так выглядит химическое уравнение этой реакции, при ней ион водорода из соединения HCl обменивается ионом натрия из соединения NaOH. Следствием этой химической реакции является образование раствора поваренной соли.
Признаки химических реакций
По признакам протекания химических реакций можно судить прошла ли химическая реакция между реагентами или нет. Приведем примеры признаков химических реакций:
- Изменение цвета (светлое железо, к примеру, во влажном воздухе покрывается бурым налетом, как результат химической реакции взаимодействия железа и кислорода).
- Выпадение осадка (если вдруг через известковый раствор пропустить углекислый газ, то получим выпадение белого нерастворимого осадка карбоната кальция).
- Выделение газа (если Вы капнете на пищевую соду лимонной кислотой, то получите выделение углекислого газа).
- Образование слабодиссоциированных веществ (все реакции, в результате которых образуется вода).
- Свечение раствора (примером тут могут служить реакции, происходящие с раствором люминола, излучающего при химических реакциях свет).
В целом, трудно выделить какие признаки химических реакций являются основными, для разных веществ и разных реакций характерны свои признаки.
Как определить признак химической реакции
Определить признак химической реакции можно визуально (при изменении цвета, свечении), или по результатам этой самой реакции.
Скорость химической реакции
Под скоростью химической реакции обычно понимают изменение количества одного из реагирующих веществ за единицу времени. Притом, скорость химической реакции всегда положительная величина. В 1865 году химиком Н. Н. Бекетовым был сформулирован закон действия масс гласящий, что «скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам».
К факторам скорости химической реакции можно отнести:
- природу реагирующих веществ,
- наличие катализатора,
- температуру,
- давление,
- площадь поверхности реагирующих веществ.
Все они имеют самое прямое влияние на скорость протекания химической реакции.
Равновесие химической реакции
Химическим равновесием называют такое состояние химической системы, при котором протекает несколько химических реакций и скорости в каждой паре прямой и обратной реакции равны между собой. Таким образом, выделяется константа равновесия химической реакции – это та величина, которая определяет для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия. Зная константу равновесия можно определить направление протекания химической реакции.
Условия возникновения химических реакций
Чтобы положить начало химических реакций, необходимо для этого создать соответствующие условия:
- приведение веществ в тесное соприкосновение.
- нагревание веществ до определенной температуры (температура химической реакции должна быть подходящей).
Тепловой эффект химической реакции
Так называют изменение внутренней энергии системы как результат протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции при следующих условиях:
- единственно возможной работой при этом есть только лишь работа против внешнего давления.
- исходные вещества и продукты, полученные в результате химической реакции, имеют одинаковую температуру.
Химические реакции, видео
И в завершение интересно видео про самые удивительные химические реакции.
Эта статья доступна на английском языке – Chemical Reactions.