— фракции белков крови — Биохимия
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
Синтез белков плазмы крови осуществляют:
- печень – полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов,
- клетки ретикулоэндотелиальной системы (РЭС) костного мозга и лимфатических узлов – часть β-глобулинов и γ-глобулины (иммуноглобулины).
Существует довольно много различных методов разделения белков в зависимости от их некоторых качеств. Наиболее распространенным методом фракционирования белков крови является электрофорез..
Электрофорез белков
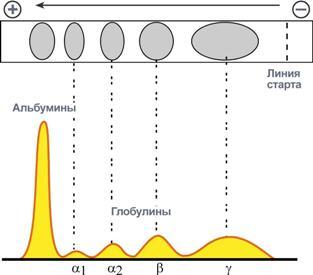
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови. Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных. Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
| Общий белок | взрослые | 65-85 г/л |
| дети 1-3 года | 55-85 г/л | |
| Белковые фракции | ||
| Альбумины | 50-70 % | 30-50 г/л |
| α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
| β-Глобулины | 8-18 % | 7-11 г/л |
| γ-Глобулины | 15-25 % | 8-16 г/л |
Нормальные величины фракций белков в ликворе и моче можно посмотреть здесь.
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы |
Альбумины |
Фракции глобулинов |
Примеры заболеваний |
|||
| α1 | α2 | β | γ | |||
| Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда |
| Хронические воспаления | ↓ | — | ↑↑ |
↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит | |
| Нарушения почечного фильтра |
↓↓ |
— | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии |
| Злокачественные опухоли |
↓↓ |
↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли |
| Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы |
| Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов |
| Механические желтухи | ↓ | — | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы | |
| α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы |
| β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема |
| γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы |
|
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока. Нормальные величины белковых фракций плазмы крови
Особенности содержания белков в крови у детей У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых. В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень. Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л). Типы протеинограмм В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Типы гиперлипидемий Классификация типов гиперлипидемий была разработана Дональдом Фредиксоном в 1965 году и была принята Всемирной организацией здравоохранения в качестве международного стандарта. Она используется до сих пор.
Согласно классификации Фредиксона, существует пять типов гиперлипидемий.
— Тип I. Это редкий тип гиперлипидемии, развивается при недостаточности липопротеинлипазы или дефекте в белке-активаторе липопротеинлипазы. При этом типе заболевания повышается уровень хиломикронов (липопротеины, которые переносят липиды из кишечника в печень). Гиперлипидемия усугубляется после приема жирной пищи и снижается после ограничения жиров, поэтому основное лечение — это назначение диеты.
— Тип II. Распространенный тип гиперлипидемии, при котором повышается уровень липопротеинов низкой плотности. Подразделяется на два подтипа в зависимости от наличия высоких триглицеридов, которые при лечении требуют дополнительного назначения гемфиброзила. Гиперлипидемия этого типа приводит к развитию атеросклероза после 20-30 лет и может стать причиной инфаркта в возрасте 40-50 дет у мужчин и 55-60 лет у женщин.
— Тип III. Тип гиперлипидемии, который еще называют дис-бета-липопротеиненией. Заболевание характеризуется наследственными причинами, и связан с дефектом Аполипопротеина E, а также характеризуется повышением уровня липопротеинов повышенной плотности. Носители гиперлипидемии склонны к ожирению, подагре, легкой форме сахарного диабета и входят в группу риска по атеросклерозу.
— Тип IV. Тип гиперлипидемии, для которого характерна повышенная концентрация триглицеридов. Их уровень повышается после приема углеводов и алкоголя. На фоне этого синдрома может развиться атеросклероз, ожирение, сахарный диабет и панкреатит. — — Тип V. Тип гиперлипидемии, похожий на первый, но в отличие от него повышается не только уровень хиломикронов, но и липопротеинов очень низкой плотности. Поэтому, как и в случае с первым типом, содержание жиров в крови подскакивает после приема жирной и углеводной пищи. Гиперлипидемия этого типа чревата развитием тяжелого панкреатита, который развивается на фоне приема слишком жирной пищи. Помимо этой классификации существуют еще два типа гиперлипидемии — гипо-альфа-липопротеинемия и гипо-бета-липопротеинемия. Читайте также: Рекомендуемые страницы: Поиск по сайту |
Поиск по сайту: |
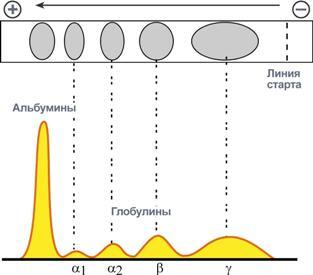
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
Общий белок | взрослые | 65-85 г/л |
дети 1-3 года | 55-85 г/л | |
Белковые фракции | ||
Альбумины | 50-70 % | 30-50 г/л |
α1-Глобулины | 3-6 % | 1-3 г/л |
α2-Глобулины | 9-15 % | 6-10 г/л |
β-Глобулины | 8-18 % | 7-11 г/л |
γ-Глобулины | 15-25 % | 8-16 г/л |
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы | Альбумины | Фракции глобулинов | Примеры заболеваний | ||||
α1 | α2 | β | γ | ||||
Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда | |
Хронические воспаления | ↓ | — | ↑↑ | — | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит | |
Нарушения почечного фильтра | ↓↓ | — | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии | |
Злокачественные опухоли | ↓↓ | ↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли | |
Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы | |
Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов | |
Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы | |
α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы | |
β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема | |
γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы | |
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
Общий белок | взрослые | 65-85 г/л |
дети 1-3 года | 55-85 г/л | |
Белковые фракции | ||
Альбумины | 50-70 % | 30-50 г/л |
α1-Глобулины | 3-6 % | 1-3 г/л |
α2-Глобулины | 9-15 % | 6-10 г/л |
β-Глобулины | 8-18 % | 7-11 г/л |
γ-Глобулины | 15-25 % | 8-16 г/л |
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
Тип протеинограммы | Альбумины | Фракции глобулинов | Примеры заболеваний | ||||
α1 | α2 | β | γ | ||||
Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда | |
Хронические воспаления | ↓ | — | ↑↑ | — | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит | |
Нарушения почечного фильтра | ↓↓ | — | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии | |
Злокачественные опухоли | ↓↓ | ↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли | |
Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы | |
Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов | |
Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы | |
α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы | |
β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема | |
γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы | |
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
⇐ ПредыдущаяСтр 72 из 89Следующая ⇒
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
| Общий белок | взрослые | 65-85 г/л |
| дети 1-3 года | 55-85 г/л | |
| Белковые фракции | ||
| Альбумины | 50-70 % | 30-50 г/л |
| α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
| β-Глобулины | 8-18 % | 7-11 г/л |
| γ-Глобулины | 15-25 % | 8-16 г/л |
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
| Тип протеинограммы | Альбумины | Фракции глобулинов | Примеры заболеваний | |||
| α1 | α2 | β | γ | |||
| Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда |
| Хронические воспаления | ↓ | — | ↑↑ | — | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит |
| Нарушения почечного фильтра | ↓↓ | — | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии |
| Злокачественные опухоли | ↓↓ | ↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли |
| Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы |
| Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов |
| Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы |
| α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы |
| β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема |
| γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы |
Белки крови выполняют серьезные задачи
Функции белков плазмы крови
Многообразие белков крови приводит к тому, что они обладают многочисленными функциями:
· поддерживают постоянство коллоидно-осмотического давления крови – в первую очередь, альбумины,;
· участвуют в регуляции кислотно-основного состояния – альбумины, гемоглобин,
· удерживают в связанном состоянии и транспортируют ионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой – альбумины и специфические транспортные белки,
· связываюти транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) – альбумины и другие белки,
· определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке, обеспечивают нормальный кровоток в капиллярах (реологические свойства крови) – белки свертывающей системы,
· специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.),
· обеспечивают иммунную защиту организма – иммуноглобулины, факторы системы комплемента, трансферрин и пропердин,
· обеспечивают неспецифическую защиту организма при повреждении тканей – белки острой фазы.
Общая биохимияБиохимия азотистых веществ кровиБелки острой фазы — быстро реагирующие белки
Белки острой фазы — быстро реагирующие белки
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое изначительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественныхновообразованиях. Смысл данного увеличения заключается в повышении резистентности клеток к окислению, в ограничении повреждения тканей, в подавлении скорости размножения бактерий.
Синтезбелков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды.
К белкам острой фазы относят С-реактивный белок, сывороточный амилоид А, гаптоглобин, α2-макроглобулин, церулоплазмин, α1-гликопротеин, α1-антитрипсин, орозомукоид, компоненты комплементаС1-С4, С9. Трансферринтакже относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативнымбелком острой фазы.
Увеличение концентрации белков острой фазы в крови является хорошим индикатором не только явного, но и скрытого воспаления (например, атеросклероз).
Альбумин — основной белок крови
Белок синтезируется почти исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в крови заключается:
1. В поддержании коллоидно-осмотического давления;
2. Он является богатым и быстро реализуемым резервом белка;
3. Транспортная– альбумин переносит
· длинноцепочечные жирные кислоты – основная физиологическая функция сывороточного альбумина.
· пигменты (билирубин),
· катионы(например, Ca2+ и Mg2+), анионы (Cl–),
· желчные кислоты,
· витамины,
· гормоны (альдостерон, прогестерон, гидрокортизон),
· органические красители,
· лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительныйхарактер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
Гиперальбуминемия
Истинноеповышение концентрации белка в крови обычно не наблюдается.
Относительная гиперальбуминемия вызывается потерями внутрисосудистой жидкости в результате профузных поносов (например, холере), усиленном потоотделении, неукротимой рвоте, несахарном диабете, при тяжелых и обширных ожогах и генерализованных перитонитах.
Гипоальбуминемия
Истинная (абсолютная) гипоальбуминемия связана:
· с недостаточным потреблением белка с пищей – заболевания желудочно-кишечного тракта, сужение пищевода при опухолях, частичное или полное голодание;
· со снижением синтеза белка в печени – несбалансированный аминокислотный состав пищи, хронические паренхиматозные гепатиты, интоксикации, злокачественные новообразования, лечение кортикостероидами;
· с усиленным распадом белка – кахексия, тяжелые инфекции, длительные воспалительные процессы, лихорадочные состояния, тиреотоксикозы;
· с потерей белка – нарушения проницаемости капиллярных стенок, кровоизлияния, ожоги, острые и хронические кровотечения, нефротический синдром.
Относительная гипоальбуминемия связана с нарушением водного баланса – гипергидратация при гиперальдостеронизме, при почечной недостаточности со снижением экскреции солей, при использовании для питья морской воды, при неадекватных инфузиях солевых растворов.
Рекомендуемые страницы:
Типы электрофореза — Наука и Техника — Каталог статей
Электрофорез — это способ разделения биологических молекул в электрическом поле, основанный на том факте, что разные молекулы имеют разные естественные электрические заряды, связанные с ними. Это заставляет различные компоненты вещества двигаться с разными скоростями под воздействием электрического поля. Представьте себе, что на подносе есть коллекция маленьких кусочков разных металлов, и на один конец подноса положили магнит. Различные куски металла (эквивалентные «молекулам») будут притягиваться к магниту в разной степени в зависимости от их удельных зарядов. По сути, это то, что происходит при электрофорезе, за исключением того, что молекулы изначально не разделены.
Различные виды электрофореза сегодня практикуются.
Принцип электрофореза
Причиной работы электрофореза является одно из фундаментальных уравнений физики электромагнетизма: сила равна электрическому заряду, умноженному на напряженность поля в этой точке. Это принимает форму:
F = qE
Где F = сила, q = электрический заряд и E = напряженность электрического поля.
Это уравнение подразумевает, что чем выше заряд на частице, тем сильнее сила, возникающая в результате приложения данного электрического поля. Это означает, что две частицы с одинаковой массой, но разными зарядами будут двигаться с разной скоростью через поле. Кроме того, скорость, с которой движется любая заряженная молекула, зависит от ее отношения заряда к массе. Вместе эти свойства и отношения позволяют ученым разделить компоненты критических биомолекул, таких как нуклеиновые кислоты, на их более мелкие компоненты.
Гель-электрофорез
Используются три основных типа гель-электрофореза. Электрофорез крахмального геля, который использует гранулы картофельного крахмала, является чем-то вроде реликвии. При электрофорезе в агарозном геле в качестве среды используется очищенный полисахарид с большой молекулярной массой; это обычно используется для больших молекул ДНК. Электрофорез в полиакриламидном геле является наиболее распространенным типом, потому что он чрезвычайно стабилен и работает в широком диапазоне концентраций молекул.
Менее распространенные виды электрофореза
Гель-электрофорез в некотором роде предпочтителен в большинстве экспериментальных ситуаций. Другие распространенные методы включают электрофорез высокого разрешения, капиллярный электрофорез, изоэлектрическое фокусирование, иммунохимический электрофорез, двумерный электрофорез и электрофорез в импульсном поле.
Типы установок электрофореза
Инструменты электрофореза имеют такое же большое значение, как и конкретная используемая среда. В старые времена пограничный электрофорез был стандартом. В этой экспериментальной установке измеряется скорость движения всей границы мигрирующих молекул. Сегодня зональный электрофорез является более распространенным явлением, когда молекулы мигрируют в разные области или зоны на небольшом участке бумаги. Это более целенаправленный подход, чем пограничный электрофорез. Наконец, бумажный электрофорез иногда используется для небольших молекул.
Альбумин
Спорт Альбуминпросмотров — 67
Индивидуальные белки плазмы крови
Типы электрофореграмм
В клинической практике для сыворотки выделяют 9 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
| Тип протеинограммы | Альбумины | Фракции глобулинов | Примеры заболеваний | ||||
| a1 | a2 | b | g | ||||
| Острые воспаления | ¯¯ | | | – | | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, обширный инфаркт миокарда | |
| Хронические воспаления | ¯ | – | | – | | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит | |
| Нарушения почечного фильтра | ¯¯ | – | | | ¯ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии | |
| Злокачественные опухоли | ¯¯ | | | | | Метастатические новообразования с различной локализацией первичной опухоли | |
| Гепатиты | ¯ | – | – | | | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата͵ некоторые формы полиартрита͵ дерматозы | |
| Некроз печени | ¯¯ | – | ¯ | | | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов | |
| Механические желтухи | ¯ | – | | | | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы | |
| a2-глобулиновые плазмоцитомы | ¯¯ | ¯ | | ¯ | ¯ | ||
| b-глобулиновые плазмоцитомы | ¯¯ | ¯ | ¯ | | ¯ | b1‑плазмоцитомы, b1‑плазмоклеточная лейкемия и макроглобулинемия Вальденштрема | |
| g-глобулиновые плазмоцитомы | ¯¯ | ¯ | ¯ | ¯ | | g‑Плазмоцитомы, макроглобулинемия и некоторые ретикулезы |
Белок синтезируется почти исключительно в печени. Отмечается микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в крови заключается:
1. В поддержании коллоидно-осмотического давления,
2. Он является богатым и быстро реализуемым резервом белка,
3. Транспортная – альбумин переносит
· длинноцепочечные жирные кислоты — основная физиологическая функция сывороточного альбумина.
· катионы (к примеру, Ca2+ и Mg2+), анионы (Cl–),
· желчные кислоты,
· витамины,
· пигменты (билирубин),
· гормоны (альдостерон, прогестерон, гидрокортизон),
· органические красители,
· лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота͵ сердечные гликозиды).
Гиперальбуминемия наблюдается при тех же состояниях, что и гиперпротеинемия.
Снижение концентрации альбумина наступает при больших потерях белка, связанных с кровотечением, при нарушении синтеза альбумина или увеличении скорости его распада.
a1‑глобулины
Во фракции a1‑глобулинов наиболее исследованными являются a1‑антитрипсин, a1‑липопротеин и a1‑гликопротеин, a1‑фетопротеин, a1‑антихимотрипсин.
1. a1‑антитрипсин (a1‑протеиназный ингибитор), гликопротеин, образуется в печени, белок острой фазы, является ингибитором протеиназ (трипсина, химотрипсина, калликреина, плазмина) и обуславливает 92‑94% от общей антипротеолитической функции крови.
Концентрация возрастает при воспалительных процессах, злокачественных образованиях, при действии гормонов (беременность, стероидная терапия), системной красной волчанке.
Аутосомно‑рецессивно наследуемый недостаток его в крови является одним из факторов патогенеза эмфиземы легких, бронхоэктазий и хронического бронхита͵ ранних циррозов печени. Очевидно, что отсутствие ингибитора приводит к неограниченному протеолизу клеток в зоне воспаления, что удлиняет и углубляет деструктивные процессы в тканях.
2. a1‑антихимотрипсин (ранее a1‑гликопротеин Шульца) является одним из реагирующих первыми белков острой фазы (уровень в сыворотке может удваиваться в течение нескольких часов), представляет собой слабый специфический ингибитор химотрипсина, вместе с тем отмечена его активность по отношению и к другим протеазам.
Увеличение концентрации белка обусловлено острофазовыми реакциями: воспаление, травма после хирургической операции, инфаркт миокарда, бактериальные инфекции.
3. a‑липопротеины (см «Липопротеины сыворотки крови»).
a2 ‑глобулины
Во фракции a2‑глобулинов наиболее важными для диагностики являются a2‑макроглобулин, гаптоглобин, церулоплазмин, Gc‑глобулин. Также к этой фракции относятся ангиотензиноген, a2‑гликопротеин, связанный с беременностью, a2‑HS‑гликопротеин, a2‑антиплазмин, белок A, связанный с беременностью.
1. a2‑макроглобулин — цинксодержащий белок, содержит 4 идентичных субъединицы и включает углеводный компонент. Белок синтезируется в печени и в иммунокомпетентых клетках. Является ингибитором протеиназ (как свертывающей системы крови, так и других) — плазмина, пепсина, трипсина, химотрипсина, эндопептидаз, катепсина D, тромбина, калликреина.
Дополнение
Механизм ингибирования состоит в захвате ферментативной молекулы a2‑макроглобулином, при этом энзим теряет способность гидролизовать крупные белки, однако сохраняет активность по отношению к низкомолекулярным субстратам. Комплексируясь с плазмином, белок снижает его протеолитическую активность до физиологических значений, оптимальных для активации системы фибринолиза.
Белок контролирует развитие инфекций и воспалительных процессов. Повышение его количества выявляется при циррозе печени, остром и хроническом гепатите, эндокринных заболеваниях (сахарный диабет, микседема), нефротическом синдроме. Снижение — при ревматическом полиартрите, потере белка или недостаточности его в питании, диссеминированном свертывании крови, фибринолитической терапии.
2. Гаптоглобин — типичный представитель белков острой фазы, синтезируется в печени и в низких концентрациях присутствует во многих жидкостях организма – ликворе, лимфе, синовиальной жидкости, желчи.
Белок обладает следующими функциями:
· связывает свободный гемоглобин плазмы и предохраняет организм от потери железа, данный комплекс разрушается в клетках РЭС и печени;
· выполняет неспецифическую защитную функцию, комплексируясь с белковыми и небелковыми веществами, появляющимися при распаде клеток;
· принимает участие в транспорте витамина В12.
Концентрация белка неспецифически повышается в ответ на повреждение ткани, воспаление, опухолевый процесс (особенно с метастазами). Высокие показатели наблюдаются при сахарном диабете, нефротическом синдроме, пиелонефрите, ожогах, острых и хронических воспалительных состояниях, некрозе тканей, инфаркте миокарда, активных аутоиммунных заболеваниях.
Снижение количества белка отмечено при поражении паренхимы печени, гемолитических анемиях. Уровень гаптоглобина считается чувствительным показателем гемолитических состояний: высвобождение гемоглобина вызывает снижение концентрации Hp.
3. Церулоплазмин (ферроксидаза), содержит 8 атомов меди. Это белок острой фазы, комплексирует 90% всей меди плазмы и транспортирует ионы меди из печени в другие органы. Церулоплазмин способствует насыщению апотрансферрина, принимает участие в обмене биогенных аминов (адреналина, норадреналина, серотонина) и аскорбиновой кислоты, регулирует уровень симпатических медиаторов мозга, как сывороточный антиоксидант ликвидирует супероксидные радикалы кислорода, восстанавливает О2 до воды и предотвращает окисление ненасыщенных жирных кислот.
Повышенные концентрации выявляются при ревматоидном артрите, системной красной волчанке, хронических воспалительных процессах, холестазе, гепатите, циррозе печени, инфаркте миокарда, острых инфекциях, злокачественных новообразованиях с метастазами.
Уменьшение показателя выявлено при снижении синтеза фермента (болезнь Вильсона‑Коновалова), повышенной потере (заболевания ЖКТ, нефротический синдром), уменьшении абсорбции в кишечнике (нарушения всасывания, недостаточность питания).
b ‑ глобулины
Фракция b‑глобулинов содержит трансферрин, гемопексин, компоненты комплемента и иммуноглобулины. В свежей сыворотке эта фракция часто разделена, меньшая b2‑фракция в основном обусловлена b‑липопротеинами.
1. Трансферрин – гликопротеин плазмы, имеет два центра связывания железа, присоединяет только трехвалентное железо вместе с анионом гидрокарбоната͵ синтезируется в печени и РЭС. Функции белка заключаются в связывании железа, превращении его в деионизированную форму и транспорте между тканями, в основном, между печенью и костным мозгом.
Дополнение
В отсутствие железа белок может связывать также Cr2+, Mn3+, Co3+, Cu2+.
Прочность связывания железа с трансферрином снижается при закислении среды, а также при восстановлении железа. В норме насыщено 1/3 общего количества трансферрина, при более чем половинном насыщении железо связывается с другими белками плазмы крови.
2. Гемопексин – гемсвязывающий гликопротеин, синтезируется в гепатоцитах, также связывает порфирин, гемсодержащие хромопротеиды (гемоглобин, миоглобин, каталазу), доставляя их в печень, где происходит распад гема и связывание железа с ферритином.
Уровень белка повышается при беременности, опухолях (особенно меланоме), сахарном диабете, мышечной дистрофии.
Снижение выявляется при гемолизе (более чувствительный тест по сравнению с гаптоглобином, так как гемопексин не является белком острой фазы), гемолитических анемиях, заболеваниях печени, недостаточности белка в пище.
3. b‑ и преb‑липопротеины (см «Липопротеины сыворотки крови»).
4. Стероид‑связывающий b‑глобулин связывает и транспортирует гормоны, такие как тестостерон (около 60% циркулирующего гормона), эстрадиол, другие 17‑b‑гидроксистероиды.
Увеличение выявляется при беременности, приеме контрацептивов.
Дополнение
Андрогены, тироксин, трийодтиронин, соматотропный гормон снижают количество этого белка.
Фракция g‑глобулинов
Содержит иммуноглобулины G, A, M, Е, D.
Иммуноглобулин G – основные иммуноглобулины сыворотки, осуществляют гуморальную защиту организма от бактерий и вирусов, и их растворимых токсинов (антигенов). Активно транспортируются через плаценту. У детей должная концентрация достигается только к 1,5‑2 годам.
Иммуноглобулины А осуществляют местный иммунитет на слизистых поверхностях дыхательных путей (носовой и бронхиальный секрет) и кишечного тракта. Οʜᴎ присутствуют в женском молозиве, слезе, слюне. После рождения количество секреторного IgA (на слизистых) достигает уровня взрослых уже на 2-3 неделе жизни, сывороточного IgA – только к 14-15 годам.
Иммуноглобулины М появляются в процессе формирования иммунного ответа͵ являясь первичными антителами. Вскоре после рождения их уровень нарастает, достигает максимума к 9 месяцу жизни, после чего снижается и восстанавливается только к 20-30 годам.
Иммуноглобулины Е вырабатываются плазматическими клетками и принимают участие в аллергических реакциях организма.
Иммуноглобулины D не имеют четкой сформированной функции. Предполагается, что они регулируют активность других иммуноглобулинов.
Читайте также
Сывороточные g-глобулины Сывороточный альбумин Сывороточный альбумин – самый крупный белок плазмы или сыворотки крови – может быть выделен различными методами, например высаливанием, дробным осаждением белков плазмы спиртом и… [читать подробенее]
Причины: 1) Снижение синтеза альбуминов в печени (при циррозе печени). 2) Белковое голодание (недостаток белка в пище или следствие нарушения переваривания и всасывания белка в кишечнике). 3)Нарушения кровообращения(болезни сердца, тромбозы, расширение вен).Усиливается… [читать подробенее]
Альбумины – небольшие белки, масса &… [читать подробенее]
Белки Органические кислотные радикалы — Лактат (молочная кислота). — Пируват (пировиноградная кислота). —бета-гидроксибутират (бета-гидроксимасляная кислота). — Ацетоацетат (ацетоуксусная кислота). — Сукцинат (янтарная кислота). — Цитрат (лимонная… [читать подробенее]
Иммунитета (Ig) Белки гумморального БОФ Транспортные Белки.системы гемостаза Белки БСК Главным органом, обеспечивающим обмен белков плазмы, является печень. Она ответственна за синтез альбуминов, большинства альфа- и бэта-глобулинов, фибриногена. Гамма-глобулины,… [читать подробенее]
Белки острой фазы — быстро реагирующие белки Белки острой фазы – большая группа белков сыворотки крови (в основном &… [читать подробенее]
Индивидуальные белки плазмы крови Типы электрофореграмм В клинической практике для сыворотки выделяют 9 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям. Тип протеинограммы Альбумины Фракции глобулинов … [читать подробенее]
Г. белка связывает 30-35 г. воды. Способность связывать воду изменяется с возрастом. Вода может проникать в молекулы и связываться с внутренними структурами белка, и образованием раствора воды в белке. Вода может связываться и с наружными структурами белка с образованием… [читать подробенее]
ПРОСТЫЕ БЕЛКИ КЛАССИФИКАЦИЯ БЕЛКОВ ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ Белки относятся к высокомолекулярным соединениям, их относительная молекулярная масса колеблется от 6000 до 1000000 а.е.м. и выше. Для определения молекулярной массы белков используют… [читать подробенее]
Около 20 видов аминокислот входят в состав белков. II. Свойства основания С основанием С оксидом металла С металлом I. Свойства кислоты 2Nh3Ch3COOH + 2Na = 2Nh3Ch3COONa + h32Nh3Ch3COOH + MgO = (Nh3Ch3COO)2Mg + h3ONh3Ch3COOH + NaOH = Nh3Ch3COONa + h3O :Nh3Ch3COOH + HСl ® [HOOC-Ch3 – -Nh4]+ Cl- III…. [читать подробенее]